2007
4
Autores:
Ornar Dueñas G.1, Hugo Rico O.1, Mario Rodríguez B.2
Instituciones:
1Médico Residente de Ginecología y Obstetricia, Instituto Nacional de Perinatología, Isidro Espinosa de los Reyes, México, 2Médico adscrito, Servicio de Obstetricia, Instituto Nacional de Perinatología, Isidro Espinosa de los Reyes, México.
Tipo de documento:
DocumentosActualidad en el diagnóstico y manejo del acretismo placentario
Contenido del documento:
INTRODUCCIÓN
El acretismo placentario es la inserción anormal de parte o de toda la placenta, con ausencia total o parcial de la decidua basal y anormalidad de la caduca verdadera con penetración de las vellosidades coriales al miometrio (1).
Es una de las principales causas de hemorragia obstétrica, principalmente del post parto inmediato, y que condiciona un importante riesgo de morbimortalidad materna, por la patología misma, como también por el tratamiento aplicado.
El principal tratamiento es la histerectomía obstétrica total, debido a su frecuente asociación con placenta previa y cicatrices de cesáreas previas. Este procedimiento es un desafío a las habilidades quirúrgicas del médico obstetra, por lo que es necesario conocer otras alternativas de tratamiento.
El objetivo de esta comunicación es revisar la etiopatogenia de esta complicación, los factores de riesgo, los métodos diagnósticos y las diferentes alternativas de tratamiento.
Clasificación
Existen tres variedades de adherencia anormal de la placenta:
– Placenta acreta: es la adherencia anormal de una parte o de la totalidad de la placenta a la pared uterina, sin que las vellosidades coriales penetren el miometrio.
– Placenta increta: las vellosidades coriales penetran el miometrio.
– Placenta percreta: es la penetración de los elementos coriales hasta sobrepasar la serosa del útero, pudiendo alcanzar órganos vecinos.
Por su extensión se reconocen tres tipos: a) Focal: solo involucra pequeñas áreas de la placenta; b) Parcial: uno o más cotiledones se involucran en el proceso; c) Total: la superficie completa de la placenta esta anormalmente adherida.
Incidencia y factores de riesgo
En un estudio realizado en México por Lira y cols (2), se encontró que en 210 casos de placenta previa, en 37 (17,6%) se presento acretismo pla-centario; de los casos de acretismo en 26 (70,2%) se tuvo el antecedente de cesárea: con una cesárea fue de 21,1% y con dos o más cesáreas el 50%. La edad media de las pacientes fue de 31 años, y el grupo de mayor riesgo fue el de 35 a 39 años con 26% de acretismo placentario.
En Estados Unidos la incidencia de acretismo placentario encontrada por Miller y cols (3), fue de 1 caso por cada 2510 pacientes. Sin embargo, esta estadística puede ser tan variable como hasta 1 en 533 pacientes como informa Wu y cols (4), en un estudio de 20 años realizado entre 1982 a 2002.
Los principales factores de riesgo identificados para acretismo placentario de acuerdo a los anteriores autores son (3,4):
– Edad (mayores de 30 años).
– Gestas (multíparas de 2 a 3).
– Placenta percreta: es la penetración de los elementos coriales hasta sobrepasar la serosa del útero, pudiendo alcanzar órganos vecinos.
– Placenta previa con antecedente de cesárea (35%).
– Placenta previa con antecedente de 3 o más cesáreas (67%).
– Historia de legrado uterino (18 a 60%).
– Antecedente de extracción manual placentaria.
– Historia de retención placentaria.
– Antecedente de infección intramniótica.
Importancia clínica del acretismo placentario
El acretismo placentario puede llevar a hemorragia obstétrica masiva, y como consecuencia alteraciones de la coagulación por pérdida, y por coagulación intravascular diseminada. La necesidad de realizar histerectomía total, especialmente cuando se asocia a placenta previa e inserta en cicatrices de cesáreas previas, puede condicionar riesgo de daño quirúrgico a los uréteres, vejiga y a otras estructuras pélvicas vecinas, así como también síndrome de dificultad respiratoria del adulto e incluso la muerte materna. La pérdida sanguínea durante el nacimiento oscila entre 3000 a 5000 mi. La incidencia de placenta acreta está aumentando, especialmente por la mayor incidencia de operación cesárea; el mayor riesgo de morbimortalidad materna disminuye con un adecuado diagnóstico prenatal y planificando la interrupción del embarazo con un equipo quirúrgico multidisciplinario, en una institución que disponga de banco de sangre (5).
Fisiopatología
Se piensa que el acretismo placentario es debido a una ausencia o deficiencia de la capa de Nitabuch, que es una capa de fibrina que se ubica entre la decidua basal y el corion frondoso. Be-nirschke y Kaufman (6), sugieren que esta situación es consecuencia de una falla en la reconstitución del endometrio/decidua basal, especialmente después de la reparación de una operación cesárea.
Diagnóstico
Básicamente el diagnóstico se limita al empleo de métodos como es el ultrasonido y la resonancia magnética. Sin embargo, el diagnóstico definitivo de acretismo placentario es por medio de histopatología, al comprobar la invasión de las vellosidades coriales en el miometrio.
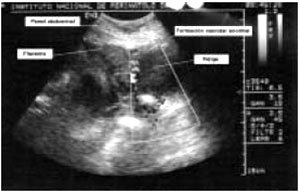
Ultrasonografía. El ultrasonido es una útil herramienta para el diagnóstico de acretismo placentario así como de sus distintas variantes en el segundo y tercer trimestre del embarazo (Figura 1). Su uso en embarazos más tempranos aún no es concluyente.
Finberb y Williams (7), establecieron en 1992, la utilidad de esta técnica de imagen; entre los criterios diagnósticos establecidos fueron: pérdida de la zona hipoecoica miometral retroplacentaria, adelgazamiento o disrupción de la serosa uterina hiperecoica y la interfaz con la vejiga, la presencia de masas exofíticas, presencia de una gran área de sonolucencias placentarias.
Chou y cols (8), emplearon el ultrasonido doppler usando como criterios diagnósticos el flujo lacunar placentario difuso en el parénquima, hipervascularidad en la interfase vejiga-serosa, y complejos venosos subplacentarios; con estos criterios se estimaron una sensibilidad de 82,4%, especificidad de 96,8%, valor predictivo positivo de 87,5% y valor predictivo negativo de 95,3%.
Shin y cols (9), describieron el uso del doppler poder (Power Doppler) para identificar las primeras evidencias de acretismo placentario en el primer trimestre de la gestación, a través de la detección de un reclutamiento anormal de los vasos subplacentarios que se encuentran por debajo del segmento uterino a las 8 semanas, ya las 15 semanas por la presencia de lagos placentarios con flujo que se extendían hacia el miometrio.
Chen y cols (10) también realizaron un estudio semejante pero con doppler color a las 9 semanas, demostrando también los lagos sanguíneos con flujo y la pérdida de la zona hipoecoica, dando un diagnóstico de acretismo placentario a las 10 semanas de edad gestacional, corroborado por la histopatología.
De los estudios descritos se puede concluir que el diagnóstico de acretismo placentario es básicamente por el flujo turbulento a través de los lagos placentarios. Sin embargo, esta modalidad en la mayor parte de los casos no mejora el diagnóstico obtenido por la escala de grises per se del ultrasonido normal. Es por eso que el doppler no debe ser empleado como método de diagnóstico primario para el diagnóstico de acretismo placentario. En cuanto al diagnóstico en el primer trimestre e inicios del segundo, se ha encontrado que los hallazgos de un saco gestacional localizado muy cerca de una cicatriz uterina previa en el segmento uterino son sospechosas de acretismo placentario pero no diagnósticas (5).
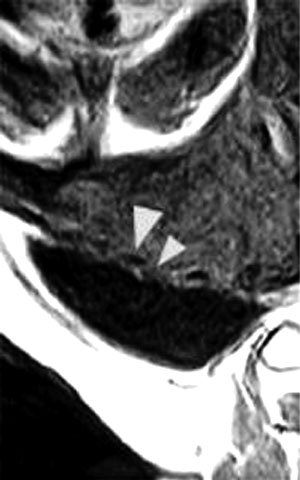
Resonancia magnética. Existen varios artículos que refieren el empleo de este método para el diagnóstico de acretismo placenterio, sin embargo, la mayor parte son casos retrospectivos los cuales carecen de correlación histopatológica. Los estudios serios mencionan que la resonancia magnética no es superior que la ultrasonografía y su costo es significativamente mayor, es por eso que el uso de ese procedimiento no parece tener valor como prueba de pesquisa y tal vez pueda en casos muy indicados emplearse como un medio de diagnóstico complementario (5,11). Palacios y cols (12), señalan el beneficio del procedimiento contrastado con gadolinio (gadopentate dimeglumine) inyectado en bolo, para el diagnóstico diferencial entre acretismo y percretismo placentario, cuando el ultrasonido no es concluyente (Figura 2).
Cistoscopia. El uso de cistoscopia como método diagnóstico para placenta percreta con invasión vesical no suele estar justificado, puesto que el ultrasonido tiene una mayor sensibilidad y especificidad. En el metanálisis realizado porWashecka y Behling (13), encontraron que en 54 pacientes con placenta percreta e invasión vesical solamente 12 pacientes (22,2%) presentaron hallazgos compatibles de invasión vesical para realizar el diagnóstico. Este porcentaje tan bajo parece estar asociado a que a la fecha no existe un consenso sobre cuales son los hallazgos patognomónicos de invasión vesical en placenta percreta. Actualmente la mayor utilidad del uso de la cistoscopia en una placenta previa con hallazgos ultrasonográficos sugerentes de invasión vesical es realizar la cateterización ureteral durante ese momento (13).
Alfa-feto proteína fetal sérica materna. Actualmente se ha propuesto que existe una anormalidad en la interfaz placeta-útero, lo cual promueve una fuga de alfa-feto proteína fetal hacia la circulación materna. Existen algunos estudios como el de Kupferminc y cols (14), donde revisaron 44 pacientes que se sometieron a cesárea histerectomía, 9 de 20 (45%) pacientes tenían acretismo placentario y elevación de la alfa-feto proteína. A pesar de que estos estudios son pequeños aún queda pendiente valorar la utilidad de la medición de esta proteína como predictor de acretismo placentario, en caso de que tengan elevaciones sin otra causa aparente.
Histología. Los criterios microscópicos para el diagnóstico de acretismo placentario es la ausencia de la decidua basal. Sin embargo su diagnóstico no resulta del todo fácil por la distorsión que ocurre en el momento del alumbramiento, salvo que se deje la pieza in situ y se realice una histerectomía y así se obtenga la muestra del tejido. En el caso de placenta increta o percreta el diagnóstico es más fácil y consiste en la presencia de tejido trofoblástico en el espesor uterino o en la estructura invadida.
Tratamiento
El tratamiento universalmente aceptado es la histerectomía total abdominal. A su vez ha surgido una corriente conservadora en cuanto a dejar la placenta in situ y en algunas ocasiones empleando medicamentos para su expulsión o reabsorción.
Vía y edad gestacional para la resolución. La vía de resolución es por medio de operación cesárea, la cual debe de ser de preferencia programada y con un enfoque multidisciplinario, que incluya al servicio de uroginecología u oncogine-cología, así como un cirujano general o vascular con conocimiento pélvico. Se prefiere el empleo de inductores de madurez pulmonar y una vez documentada la madurez pulmonar por amnio-centesis a las 36 o 37 semanas se interrumpe la gestación por cesárea. La resolución puede realizarse antes si existiese una urgencia como es el sangrado incoercible o si la paciente inicia trabajo de parto (1,15).
El Colegio Americano de Ginecología y Obstetricia (ACOG) (16), sugiere que si existen datos sugerentes de acretismo placentario, se deben tomar ciertas medidas para optimizar el nacimiento y el tratamiento, para así disminuir el riesgo de morbimortalidad materna. Estas medidas incluyen:
- El paciente debe de ser advertido de los riesgos de histerectomía y de transfusión sanguínea.
- Se debe de tener una reserva de hemocon-centrados disponibles.
- Disponer de un lugar adecuado para la resolución del embarazo, no solo en instalaciones sino también en personal.
- Evaluación previa por anestesiología.
- Si es necesario, se puede realizar embolización de las arterias pélvicas como alternativa a la histerectomía o para disminuir la pérdida sanguínea en la histerectomía.
En cuanto al tipo de incisión para la laparotomía, se prefiere en la mayor parte de los textos una media infraumbilical para mejor exposición de los vasos pélvicos. La histerotomía debe de ser realizada en base a los hallazgos ultrasonográficos de la localización placentaria, en casos de acretismo en cara anterior se prefiere una incisión corporal clásica, e inclusive fúndica para facilitar la extracción del feto (15).
Manejo conservador. Es una medida que consiste en evitar la histerectomía, al menos en ese momento, y tratar de preservar la fertilidad. Existen diversas modalidades de manejo conservador, que incluyen:
– Dejar la placenta en su lugar (totalmente o en fragmentos).
– Resección del lecho placentario y su reparación.
– Extracción y legrado obstétrico.
– Empleo de medicamentos asociados a cualquiera de los anteriores puntos.
– Empleo de algún medio que cause isquemia (embolización, ligadura de vasos, etc.) del lecho placentario.
a) Manejo expectante sin medicamentos. Dejar la placenta in situ y ligadura del cordón, con vigilancia periódica de la placenta mediante ultrasono-grafía, esperando que la placenta alumbre por su propia cuenta o extraerla por histerectomía en el momento que se diagnostique hemorragia profusa o infección (17). Otra medida consiste en la extracción manual placentaria, seguida de exteriori-zación uterina, suturar el lecho placentario, masaje uterino, uterotónicos e inclusive legrado, para evitar la hemorragia profusa. Cabe mencionar que el curetaje puede favorecer en un nuevo embarazo el acretismo placentario (5,17).
b) Manejo expectante con medicamentos. Golan y cols (18), describieron el empleo de oxi-tocina inyectada directamente en el cordón umbilical posterior al nacimiento del feto y esperar el alumbramiento. El uso de la oxitocina en estos estudios parece ser que ayuda al alumbramiento, sin embargo, la morbilidad no disminuye a comparación del uso de la extracción manual placentaria.
La embolización angiográfica de las arterias uterinas, ha sido empleada en algunos casos de acretismo placentario, con resultados ambiguos. Algunos autores la proponen de forma previa a la histerectomía para reducir la pérdida sanguínea, posterior al nacimiento del feto. Se realiza la embolización y posteriormente alumbramiento manual o continuar con manejo expectante para que ocurra el alumbramiento (19).
La resección del lecho placentario también ha sido descrita como método conservador del útero. Consiste en tomar ampliamente un segmento de útero que incluya el lecho placentario y posteriormente su reparación, empleando sutura con poli-glactina 910 del número 1, con puntos colchonero horizontal para los bordes uterinos, junto a pegamento de fibrina (Tissucoltm®, Baxter-lmmunotm®) en el lecho placentario. Este método presume preservar la fertilidad, sin embargo, los estudios a futuro sobre ruptura uterina y dehiscencia de histerorrafia quedan pendientes para valorar la utilidad de esta técnica (20).
El metotrexate es un medicamento quimiote-rápico el cual se encuentra catalogado dentro del grupo de los antagonistas de los folatos. Su empleo en el acretismo placentario tiene como fundamento la efectividad en contra del trofoblasto pro I iterativo. Sin embargo, de forma más reciente se ha argumentado que después del nacimiento del feto la placenta detiene su división y por lo tanto pierde su utilidad. Primero Arulkumaran y cols (21), en 1986 y posteriormente Mussalli y cols (22), reportaron 3 casos de acretismo placentario y uso de metotrexate. En cada uno de los estudios, en dos de los tres casos fue posible conservar el útero, sin embargo, el metotrexate no fue útil para detener la hemorragia. Otros casos han sido reportados donde el empleo de metotrexate no ha tenido utilidad, como los reportados por Butt y cols (23). Hasta el momento no existen estudios con una cohorte lo suficientemente amplia para valorar el empleo del metotrexate en el manejo conservador del acretismo placentario.
Invasión vesical. La vejiga es el órgano extrauterino que más se afecta en casos de placenta percreta. La invasión vesical representa un aumento significativo en la morbilidad materna, puesto que a pesar de los esfuerzos prenatales que se realizan en el diagnóstico y manejo de esta entidad, los resultados no son favorables. Washecka y Behling (13), en una revisión del tema a propósito de un caso, encontraron que la morbi-mortalidad era tan alta que en 39 de 54 casos reportados de invasión vesical, existió lesión urológica: lesión vesical 26%, fístula urinaria 13%, hematuria macroscópica 9%, lesión ureteral 6%, disminución de la capacitancia vesical 4%, cistectomía 44%, como también 3 muertes maternas (5,6%) y 14 muertes fetales (25,9%). Por lo anteriormente mencionado, cuando existan datos de invasión vesical, el manejo quirúrgico debe ser multidisciplinario (obstetra, urólogos, o gineco-oncólogos), para que mínimamente se efectúe cateterización ureteral previo a la operación cesárea y eventual histerectomía, y advertir a la paciente sobre la gravedad de su condición.
CONCLUSIONES
El acretismo placentario supone una entidad grave que debe manejarse de forma preferente en una institución de tercer nivel de atención y con equipo quirúrgico multidisciplinario. Hasta la fecha no existe un solo tratamiento que se pueda considerar como el óptimo, puesto que la histerectomía es curativa y la morbilidad materna asociada es elevada. El tratamiento quirúrgico es un desafío a las habilidades de los médicos, donde pareciera que el manejo conservador es un recurso útil en ausencia de hemorragia masiva y con intencionalidad de preservar la fertilidad, pero que requiere de mayores estudios en cuanto a su práctica.
BIBLIOGRAFÍA
- Instituto Nacional de Perinatología. Normas y procedimientos en Ginecología y Obstetricia del Instituto Nacional de Perinatología de México. Edición 2003. Marketing y Publicidad de México, 2003; 129-32.
- Lira J, Ibarbuengoitia F, Argueta M, Karchmer S. Placenta previa/acreta y cesárea previa. Experiencia de cinco años en el Instituto Nacional de Perinatología Ginec Obst Mex 1995; 63(8):337-40
- Miller DA, Chollet JA, Goodwin TM. Clinical risk factors for placenta previa-placenta accreta. Am J Obstet Gynecol 1997;177:210-4.
- Wu S, Kocherginsky M, Hibbard JU. Abnormal placentation: twenty-year analysis. Am J Obstet Gynecol 2005;192:1458-61.
- Oyelese Y, Smulian JO Placenta previa, placenta accreta, and vasa previa. Obstet Gynecol 2006; 107: 927-41.
- Bernischke K, Kaufmann P. Placental shape aberrations. In: Benirschke K, Kaufmann P (eds). Pathology of the human placenta. 4th ed. New York (NY): Springer; 2000;399-418.
- Finberg HJ, Williams JW. Placenta accreta: prospective sonographic diagnosis in patients with placenta previa and prior cesarean section. J Ultrasound Med 1992;11:333-43.
- Chou MM, Ho ES, Lee YH. Prenatal diagnosis of placenta previa accreta by transabdominal color doppler ultrasound. Ultrasound Obstet Gynecol 2000;15:28-35.
- Shih JC, Cheng WF, Shyu MK, Lee CN, Hsieh FJ. Power doppler evidence of placenta accreta appearing in the first trimester. Ultrasound Obstet Gynecol 2002;19:623-5.
- Chen YJ, Wang PH, Liu WM, Lai CR, Shu LP, Hung JH. Placenta accreta diagnosed at 9 weeks’ gestation. Ultrasound Obstet Gynecol 2002;19:620-2.
- Palacios Jaraquemada JM, Bruno CH. Magnetic resonance imaging in 300 cases of placenta accreta: surgical correlation of new findings. Acta Obstet Gynecol Scand 2005;84:716-24.
- Palacios J, Bruno C, Pesaresi M, Hermosid S, Gil A. Diagnóstico diferencial de los trastornos adherenciales de la placenta por resonancia magnética nuclear contrastada: acretismo y percretismo placentario. Rev Chil Obstet Ginecol 1999;64(1):34-40.
- Washecka R, Behiing A. Urologic complications of placenta percreta invading the urinary bladder: a case report and review of the literature. Hawaii Med J 2002; 61:66-9.
- Kupferminc MJ, Tamura RK, Wigton TR, Glassenberg R, Socol ML. Placenta accreta is associated with elevated maternal serum alpha-fetoprotein. Obstet Gynecol 1993;82:266-9.
- Hudon L, Belfort MA, Broome DR. Diagnosis and management of placenta percreta : a review. Obstet Gynecol Survey 1998;53(8):509-17.
- Breen JL, Neubecker RL. Placenta accreta. ACOG Committee Opinion No 266. Washington, DC: American College of Obstetricians and Gynecologists. Obstet Gynecol 2002; 99:169-70.
- Kayem G, Davy C, Goffinet F, Thomas C, Clement D, Cabrol D. Conservative versus extirpative management in cases of placenta accreta. Obstet Gynecol 2004;104:531-6.
- Golan A, Lidor AL, Wexler S, et al. A new method for the management of the retained placenta. Am J Obstet Gynecol 1983;146:708-9.
- Descargues G, Clavier E, Lemercier E, Sibert L. Placenta percreta with bladder invasion managed by arterial embolization and manual removal after cesarean. Obstet Gynecol 2000; 96(5 Pt 2):840.
- Palacios JM, Pesaresi M, Nassif JC, Hermosid S. Anterior placenta percreta: surgical approach, haemostasis and uterine repair. Acta Obstet Gynecol Scand 2004;83:738-44.
- Arulkumaran S, Ng Cs, Ingemarsson I, Ratnman SS. Medical treatment of placenta accreta with methotrexate. Acta Obstet Gynecol Scand 1986; 65(3):285-6.
- Mussalli GM, Shah J, Berck DJ, Elimian A, Tejani N, Manning FA. Placenta accreta and methotrexate therapy: three cases reports. J Perinatol 2000;20(5): 331-4.
- Butt K, Gagnon A, Delisle MF. Failure of methotrexate and internal iliac balloon catheterization to manage placenta percreta. Obstet Gynecol 2002; 99: 981-2.