2007
4
Autores:
Carlos Padilla E.1, a, Olga Lobos G.1, b, Ramiro Padilla E.2, Leoncio Fuentes V.2, Loreto Núñez F.3, c
Instituciones:
1Departamento de Microbiología, Facultad de Ciencias de la Salud, Universidad de Talca, 2Servicio de Obstetricia y Ginecología, Hospital Regional de Talca, 3Departamento de Salud Pública, Facultad de Ciencias de la Salud, Universidad de Talca, Chile.
aTecnólogo Médico (MSc), bBiólogo(a) (MSc), cOdontólogo(a).
Tipo de documento:
Trabajos OriginalesAislamiento de cepas de Escherichia Coli desde casos clínicos de infección vaginal. Asociación con otros microorganismos y susceptibilidad antibacteriana
Contenido del documento:
INTRODUCCIÓN
La vagina y su flora normal constituyen un ecosistema dinámico que puede alterarse con facilidad, debido a modificaciones por uso de antimicrobianos, nuevas prácticas sexuales e ingesta de hormonas, entre otros factores (1,2).
Los tres tipos más importantes de infecciones vaginales son la vaginitis candidiásica, la tricomoniásica y la vaginosis bacteriana (3). La vaginosis bacteriana es un tema controversial respecto de la responsabilidad de los agentes etiológicos (4).
La presencia de E. coli en secreciones vaginales, sola o acompañada de otros microorganismos, no ha tenido la importancia que se le asigna a esta bacteria cuando es aislada desde otras zonas anatómicas en el ser humano. En este contexto, existe discrepancia respecto de la conveniencia de instaurar una terapia antimicrobiana dirigida a erradicar este microorganismo. Actualmente, la vaginitis aeróbica se describe como la asociación entre cepas de E. coli y Streptococcus agalactiae, siendo esta la única instancia donde E. coli presenta responsabilidad etiológica (5). Un reciente estudio en vagina de mujeres sanas, demostró la presencia de una enorme variedad de géneros y especies bacterianas, sin detectar cepas de E. coli (6). En la literatura no se dispone de información respecto de los porcentajes de aislamiento de E. coli desde infecciones vaginales, ni tampoco de su asociación con agentes etiológicos conocidos.
En concordancia con lo anterior, los objetivos de este trabajo son determinar la presencia de cepas de E. coli a partir de muestras vaginales de mujeres en edad fértil, con diagnóstico clínico de infección vaginal y de mujeres sanas sin infección vaginal. En ambos casos se observará su asociación con otros agentes etiológicos y se determinará la susceptibilidad antimicrobiana de E. coli frente a diversos agentes antibacterianos.
MATERIALES Y MÉTODOS
Estudio caso-control: Los casos correspondieron a 425 mujeres en edad fértil no embarazadas, no fumadoras, sin historia de enfermedades de transmisión sexual que informaron de una sola pareja sexual en los últimos 6 meses. De estas mujeres, 160 presentaron diagnóstico clínico de vaginitis bacteriana y 265 presentaron diagnóstico clínico de vaginosis bacteriana. Las pacientes controles corresponden a 100 mujeres sanas con las mismas características generales mencionadas previamente y sin diagnóstico clínico de infección vaginal. La edad media de los casos varió entre 18 a 41 años y para los controles entre 17 a 39 años. Otros criterios de inclusión contemplaron que las participantes no hubiesen ingerido antimicrobianos 6 meses antes del estudio, ausencia de menstruación, diarrea e infección urinaria al momento de obtener la muestra. El diagnóstico diferencial inicial del laboratorio entre vaginitis y vaginosis fue realizado mediante la detección de tres o más criterios de Amsel y cois (7) y el registro microscópico de morfotipos bacterianos para determinar vaginosis bacteriana descrita por Nugent y cois (8).
Estudio microbiológico: Para casos y controles la muestra vaginal fue recolectada de los fondos de saco lateral y posterior con tres tórulas estériles. Para practicar el test de Nugent y Amsel, además de una observación directa, para detectar células micóticas y T. vaginalis, se irrigó la vagina directamente con 2 mi de buffer PBS pH 7.2 estéril. Se rescató aproximadamente 1 mi de buffer el cual fue distribuido en diferentes portaobjetos para posterior observación microscópica. Una tórula fue utilizada para siembra sobre placa de agar Brucella (Difco, Detroit, MI, USA), suplementada con sangre de cordero desfibrinada (5%), vitamina K (1 µg/ml), hemina (5 µg/ml) y kanamicina (50 µg/ml) con el propósito de obtener crecimiento de Bacteroides fragilis, Fusobacterium nucleatum, Porphyromonas glngivalis and Prevotella intermedia y las placas fueron incubadas en sistema anaeróbico (bio Mérieux, Lyon, France) por 12 días a 37°C. La misma tórula fue agitada al interior de un tubo con caldo Schaedler (BD, Franklin Lakes, NJ, USA) para cultivo de Mobiluncus sp. e incubado anaerobiamente a 37°C por 7 días. La segunda tórula fue usada para siembra en agar Mac Conkey (Merck, Darmstadt, Germany) y agar base para sangre (Merck, Darmstadt, Germany) adicionado de sangre al 5%, incubado en condiciones aeróbi-cas a 37°C; la misma tórula fue sembrada en agar Thayer-Martin (bio-Mérieux, Lyon, France) y finalmente esta tórula fue sembrada en agar Rogosa (Merck, Darmstadt, Germany) para permitir el crecimiento de Lactobacillus sp. Las placas fueron incubadas en presencia de C02 al 5% a 36°C por 48 horas para después evidenciar la presencia de N. gonorrhoeae. Finalmente, con esta tórula se sembró un tubo con agar Sabouraud (Merck, Darmstadt, Germany) para el crecimiento de Candida sp. y en medio base para T. vaginalis (Merck, Darmstadt, Germany). La tercera tórula fue agitada al interior de un frasco con buffer del kit commercial Mycoplasma IST-2 kit (bio-Mérieux, Lyon, France) y posteriormente sembrada en las correspondientes galerías para determinar desarrollo de Mycoplasma hominis o Ureaplasma urea-lyticum. Finalmente, esta misma suspensión fue usada para detectar Chlamydia trachomatis por medio del método enzima-inmunoensayo de Abbott TestPack Chlamydia (Abbot Park, IL, USA) y procesado de acuerdo al proveedor. La identificación de enterobacterias fue realizada con el API test 20-E (bio Mérieux, Lyon, France). La identificación de bacterias anaerobias estrictas fue realizada mediante métodos fenotípicos (9). C. albicans fue identificada mediante el uso del kit de bio-Mérieux ID 32C (Lyon, France).
Estudio de susceptibilidad antimicrobiana de cepas de Escherichia coil: Como control de calidad del procedimiento se utilizó la cepa de E. coli ATCC 25922. Para la determinación de la susceptibilidad antimicrobiana se utilizó la prueba de difusión en agar descrita por Kirby y Bauer (10). Se emplearon discos impregnados con los siguientes antimicrobianos: ampicilina 10 µg, cefuroxima 30 ug, cefotaxima 30 µg, clindamicina 2 µg, ciprofloxa-cino 5 µg, cloranfenicol 30 µg, gentamicina 10 µg, amikacina 30 µg, y sulfametoxazoltrimetoprim 25 ug. Para la interpretación, se aplicaron los puntos de corte y el esquema de clasificación en categorías (susceptible, resistencia intermedia y resistente) recomendados por la NCCLS (11).
RESULTADOS
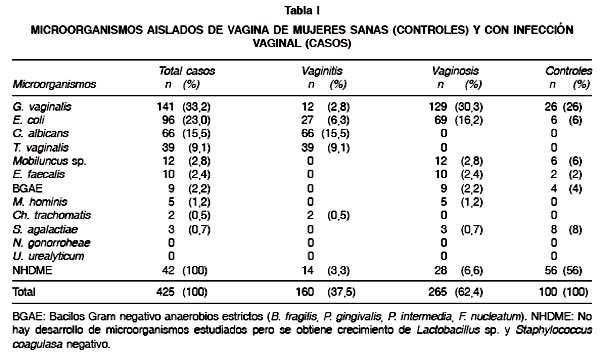
En la Tabla I se observa que G. vaginalis es el microorganismo más frecuentemente aislado de muestras de mujeres con diagnóstico clínico de infección vaginal (33,2%), seguido por E. coli(23,0%). Otros aislados frecuentes fueron C. albicans y T. vaginalis con un 15,5 y 9,1% respectivamente. Bacilos gram negativo anaerobios estrictos fueron pobremente aislados (2,2%). No se obtuvo desarrollo de N. gonorrhoeae ni de U. urealyticum. La mayoría de las cepas de E. coli aisladas corresponden a casos clínicos de vaginosis. En la misma Tabla, se observa que en 42 muestras de estas mujeres no se obtiene desarrollo de ningún tipo de los microorganismos estudiados, observándose crecimiento de Lactobacillus sp. y Staphylo-coccus coagulasa negativo. También en esta tabla se observa que en el grupo de mujeres sanas (controles), se presentó desarrollo de 6 diferentes especies, destacándose en 26 muestras la presencia de G. vaginalis y solamente en 6 de ellas desarrollo de E. coli.
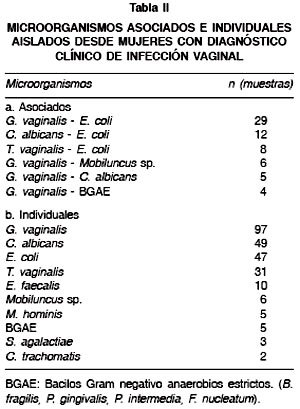
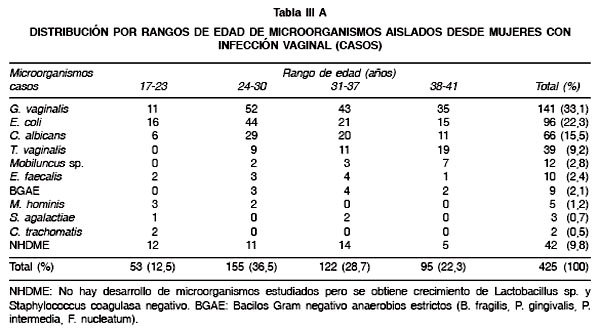
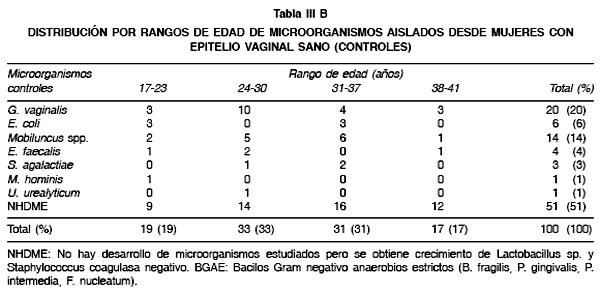
En la Tabla II se observa que en algunas mujeres con infección vaginal fue posible aislar más de un microorganismo. La asociación más común fue entre G. vaginalis y E. coli seguida de C. albicans y E. coli con un total de 29 y 12 asociaciones respectivamente. La mayoría de los aislados de flujos vaginales reveló la presencia de infecciones monomicrobianas donde G. vaginalis (97%), C. albicans (49%) y E. coli (47%) fueron los más frecuentes. No se determinó ningún tipo de asociación microbiana en los fluidos vaginales del grupo control. En las Tablas III Ay B se observa que el rango etario con la mayor tasa de microorganismos corresponde a los grupos de entre 24-30 y 31-37 años, lo cual es coincidente para casos y controles. Al centrar la atención en las cepas de E. coli se pudo observar que el resultado del estudio caso-control mostró un OR: 4,7 (95% IC: 1,91-12,27), de este modo la presencia de cepas de E. coli fue 4,7 veces más frecuente en los casos que en los controles.
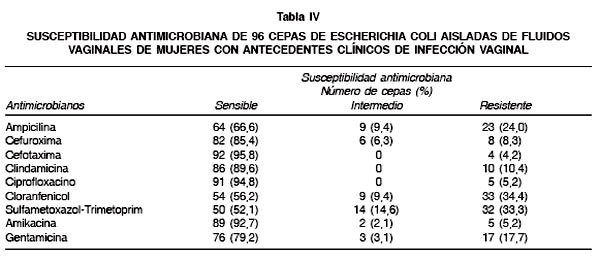
En la Tabla IV, se observa que las cepas de E. coli aisladas de infección vaginal presentan una interesante sensibilidad a la mayoría de los antibacterianos estudiados, destacándose cefotaxima, ciprofloxacino, amikacina, clindamicina y cefuroxima. La principal resistencia se evidencia frente a cloranfenicol, sulfametoxazoltrimetoprim y ampicilina.
DISCUSIÓN
En orden a estudiar la participación de cepas de E. coli en infecciones vaginales, 425 mujeres con diagnóstico clínico de infección vaginal y 100 mujeres sanas fueron analizadas. En ambos grupos de mujeres se descartaron las embarazadas para eliminar la influencia de cambios hormonales y otros factores que pudiesen explicar la presencia de E. coli . Mujeres con infección urinaria no fueron incorporadas al estudio, considerando la controversial relación detectada en algunos trabajos entre infección urinaria y vaginosis bacteriana (12,13). También se eliminó el posible rol de la nicotina descartándose a las mujeres fumadoras.
Fueron aceptadas mujeres con una sola pareja sexual en los últimos 6 meses, con el propósito de eliminar la recurrencia de la infección vaginal y además las infecciones de transmisión sexual.
Los resultados obtenidos permitieron observar a un mayor número de mujeres con vaginosis bacteriana respecto de vaginitis. Se observó que la mayoría de los microorganismos fueron aislados desde mujeres en los rangos etarios de 24-37 y 31-37 años, confirmándose que las infecciones vaginales son más prevalentes en mujeres en edad fértil (14). También se observó que T. vaginalis y C. albicans fueron aisladas exclusivamente desde mujeres con vaginitis y por otra parte G. vaginalis presentó un elevado aislamiento desde mujeres con vaginosis bacteriana, corroborándose las características etiológicas de estos microorganismos. Además fue interesante observar que un importante número de mujeres con infección vaginal presentan dos microorganismos diferentes, lo cual podría tener relevancia al momento de instaurar una terapia antimicrobiana. En este contexto, se observó que las cepas de E. coli se asocian comúnmente con G. vaginalis, C. albicans y T. vaginalis, pero la asociación más común fue con G. vaginalis.
El enfoque de E. coli como agente causal de infección vaginal ha sido controversial. En muchos casos su aislamiento desde esos cuadros clínicos no es tomado en cuenta ya que usualmente se le considera un contaminante ocasional de vagina, sin asignársele ningún rol en la patogenia de estas infecciones. E. coli es una bacteria fuertemente adaptada al ser humano, con el cual puede vivir en perfecta simbiosis o generarle severas enfermedades. Esta bacteria, habitante normal del intestino humano y de animales de sangre caliente, durante su evolución ha adquirido determinantes genéticos, cuya expresión fenotípica la transforman en patógeno para el ser humano y animales (15,16). La plasticidad genómica de esta bacteria, permite distinguir varios patotipos especializados en reconocer diferentes epitelios del hombre y que expresan numerosos factores de virulencia responsables de la infección. Esta capacidad genética obliga a pensar en una constante evolutiva de este microorganismo, que le otorga propiedades para reconocer y colonizar nuevos nichos ecológicos en mucosa y epitelios del ser humano (17). En el presente estudio llamó la atención que en los 47 aislados monomicrobianos de E. coli evidencian un masivo número de colonias, en comparación a su presencia asociada a otro microorganismos, donde su desarrollo fue significativamente menor. En este contexto, el aislamiento individual de esta bacteria y descartándose la presencia de otros reconocidos agentes etiológicos, permitiría argüir algún grado de responsabilidad en la infección vaginal, debiendo considerarse desde esta perspectiva la implementación de un tratamiento antimicrobiano. En relación a esto último, es importante considerar que algunos de los problemas ocasionados por infecciones vaginales que afectan a la mujer embarazada y que pueden dañar al feto o al recién nacido, sean provocados por cepas de E. coli en conjunto con los agentes etiológicos ya conocidos (18). Un interesante estudio determinó que mujeres embarazadas portadoras asintomáticas de E. coli en vagina, pueden transferírsela al feto o al recién nacido e inducirle meningitis (19).
Tomando en cuenta lo comentado anteriormente, es importante observar que el aislamiento de cepas de E. coli es 4,7 veces más frecuente en los casos respecto de los hallazgos en mujeres controles, lo cual implicaría algún grado de incidencia en las infecciones vaginales y sus posteriores consecuencias al no realizarse un diagnóstico pertinente y un tratamiento adecuado.
Hasta el momento no existían antecedentes con base científica que mostraran la participación de cepas de £ co//en la infección vaginal. Si bien los resultados obtenidos ofrecen solamente algún grado de sospecha en la participación de E. coli , se hace necesario investigar las reales propiedades virulentas y de adaptación ecológica que podrían presentar estas bacterias en el habitat vaginal.
Agradecimientos: Este trabajo fue ejecutado con fondos del proyecto DI. 280 de la Dirección de Investigación de la Universidad de Talca.
BIBLIOGRAFÍA
- Larsen B, Monif G. Understanding the bacterial flora of the female genital tract. Clin Infect Dis 2001;15: 69-77.
- Marrazzo J. Bacterial vaginosis. Curr Treat Opt Infect Dis 2003;5:63-8.
- Egan M, Lipsky M. Diagnosis of vaginitis. Am Fam Physician 2000;62:1095-104.
- Marrazzo J. A persistent(ly) enigmatic ecological mystery: bacterial vaginosis. J Infect Dis 2006; 193: 1475-7.
- Donder GG, Vereecken A, Bosmans E, et al. Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis. Br J Obstet Gynecol 2002;109:34-3.
- Hyman R, Fukushima M, Diamond L, et al. Microbes on the human vaginal epithelium. Proc Nati Acad Sci USA 2005;31:102:7952-7.
- Amsel R, Totten P, Spiegel CA, et al. Nonspecific vaginitis: diagnostic criteria and microbial and epidemiológica! associations. Am J Med 1983;74:14-22.
- Nugent RP, Krohn MA, Hillier SL Reliability of diagnosing bacterial vaginosis is improved by a standardized method of Gram stain interpretation. J Clin Microbiol 1991;29:297-301.
- Hannele R, Jousimies S, Sumanen P, et al. Anaerobic Gram negative rods and cocci. In: Murray P, Baron E, Pfaller M, Tenover F, Yolken R. eds. Manual of Clinical Microbiology 7th ed. Washington DC: ASM Press, 1999:690-711.
- Bauer AW, Kirby WM, Sherris JC, et al. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 1966;45:493-6.
- National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial disk susceptibility test. Villanova (PA): National Committee for Clinical Laboratory Standards, 1997. NCCLS document M2A6.
- Martinez JJ, Hultgren SJ. Requirement of Rho-family GTPases in the invasion of type 1-piliated uropatho-genic Escherichia coli. Cell Microbiol 2002;4:19-28.
- Harmanli OH, Cheng GY, Nyirjesy R et al. Urinary tract infection in women with bacterial vaginosis. Obstet Gynecol 2000;95:710-2.
- Hellberg D, Nilsson S, Mardh PA. The diagnosis of bacterial vaginosis and vaginal flora changes. Arch Gynecol Obstet 2001;265:11-5.
- Jores J, Rumer L, Wieler L. Impact of the locus of enterocyte effacement pathogenicity island on the evolution of pathogenic Escherichia coli. Int J Med Microbiol 2004;294:103-13.
- Muhldorfer L, Hacker J. Genetic aspects of Escherichia coli virulence. Microb Pathog 1994;16:171-81.
- Schmidt H, Hensel M. Pathogenicity islands in bacterial pathogenesis. Clin Microbiol Re. 2004;17:14-56.
- McGregor J, French J. Bacterial vaginosis in pregnancy. Obstet Gynecol Surv 2000;55:S1-S19.
- Watts S, Lanotte R Meneghetti L, et al. Escherichia coli strains from pregnant women and neonates: interspecies genetic distribution and prevalence of virulence factors. J Clin Microbiol 2003;41:1929-35.