2007
6
Autores:
Ricardo Cornejo U.1
Instituciones:
1Departamento de Ciencias Básicas, Facultad de Medicina, Universidad de La Frontera, Temuco. Biólogo Celular, PhD.
Tipo de documento:
Trabajos OriginalesApoptosis en células mamarias transfectadas con el oncogen ras
Contenido del documento:
INTRODUCCIÓN
HC11 corresponde al tipo celular de epitelio mamario normal en mitad de la preñez que cuando es mantenido en cultivo retiene características del desarrollo normal de la glándula sintetizando y secretando 6 caseína (1). Estas células son estimuladas a proliferar mediante el factor de crecimiento epidérmico (2).
La transfección de dichas células con el oncogen ras genera un fenotipo celular transformado Qe, el cual sufre profundas y numerosas modificaciones tanto en lo relativo a la cantidad y cualidad de sus componentes, como en lo referente a su función, destacando la inhibición en la síntesis y secreción de 6 caseína (3-5).
Los cambios generados por el potencial transformador del ras transfectado, fundamentalmente a nivel del DNA es tal, que Q6 adquiere propiedades de malignidad traducido finalmente en actividades mitóticas incontroladas, características de la célula neoplásica (6), y por ende incentiva vías de transducción de señales involucradas en etapas de transformación maligna (7).
Tanto en estas células mamarias como en otros tipos celulares la expresión del ras es capaz de introducirlas en el camino de la apoptosis (8-11), mecanismo activo dependiente de control génico a cargo del gen Bcl-2 (12) que desemboca en la muerte celular programada de células dañadas, superfluas o defectuosas que representen un eventual peligro para las demás células de un tejido (13,14).
El objetivo del presente trabajo es demostrar mediante micrografías ópticas, evidenciar células mamarias en curso normal de proliferación y desarrollo, comparadas con aquellas cuyo DNA ha sido dañado por expresión del oncogén, actuando como inductor a la opción celular del proceso apoptótico.
MATERIAL Y MÉTODO
Para el estudio con la microscopía óptica las células normales-proliferantes y transformadas con el oncogén fueron fijadas en paraformaldehido al 4% disuelto en PBS para enseguida proceder a la deshidratación en acetona 100% por dos días con un cambio diario. Luego las células fueron colocadas en una mezcla de resina Tecnovit y acetona en proporción 1:1 durante dos horas. Transcurrido este lapso la muestra se transfirió a impregnación con resina pura permaneciendo en agitación por 18 horas para finalmente adicionar el polimerizador Tecnovit en proporción 0,43 mi por mi de resina pura. Una vez incluidas las muestras fueron seccionadas con un espesor de 2 um con ayuda de un piramitomo 11800 LKB-BROMMA y teñidos con azul de toluidina. Las láminas se montaron con medio de adhesión Permount. Estas células fueron observadas y fotografiadas en un microscopio Cari Zeiss modelo Axioskop 40 acondicionado con cámara digital incorporada.
RESULTADOS
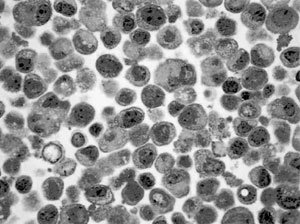
Del correspondiente análisis de las micrografías ópticas que contenían los tipos celulares descritos, queda en evidencia como puede apreciarse en la Figura 1 que el tipo HC11 GM se caracteriza por presentar un núcleo voluminoso, de ubicación central y de forma regular, característico de células indiferenciadas, en donde la mayor parte de su cromatina se encuentra en forma de eucromatina mientras que existe heterocromatina solamente en pequeños acúmulos pegados al envoltorio nuclear. Uno o más nucléolos son también característicos. Su citoplasma es escaso y presenta un granulado basótilo que corresponde a la representación de ribosomas libres presentes en gran cantidad.
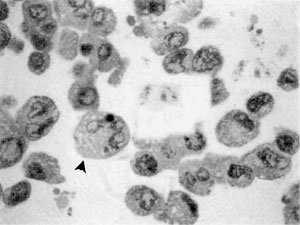
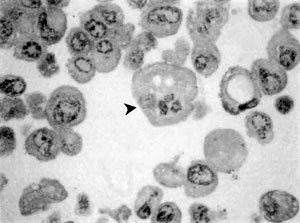
Por otra parte, en las Figuras 2 y 3, se observa claramente la morfología correspondiente a la célula transformada Q6 destacándose en ella la presencia de un núcleo igualmente voluminoso pero en donde existe mayor cantidad de heterocromatina. Es posible también evidenciar un único nucléolo. El citoplasma también basótilo debido a la presencia de cisternas de retículo endoplasmático rugoso. Sin embargo, algunas de estas células producto de la transformación con el oncogén ras, adquieren la morfología característica de la apoptosis (cabeza de flechas), tales como la fragmentación nuclear y una acentuada condensación de la cromatina, producto de la acción de endonucleasas que originan fragmentos definitivos de DNA mas cortos de 180 a 200 pares de nucleótidos, aún rodeados de envoltura nuclear persistente. La desintegración nucleolar es también observada corrientemente en el proceso apoptótico. A nivel de la membrana plasmática se observa una acentuada deformación a modo de evaginaciones, hecho que pudiese estar involucrado en una drástica pérdida de adhesión célula-célula, característica del mecanismo tumorigénico, debido básicamente a una disminución en la expresión de E-caderinas. Citoplasmáticamente es claramente observable un número importante de elementos vacuolizados que acompaña a una notable condensación del citosol resultado de una activa pérdida de agua. Finalmente se advierte con precisión un aumento considerable en lo relativo al volumen de las células en apoptosis comparadas con las transformadas.
DISCUSIÓN
A partir de las correspondientes observaciones de las micrografías ópticas, queda en evidencia que las características morfológicas descritas en estas células pertenecientes al epitelio mamario, ya sea aquellas en estadio de proliferación (HC11 GM), evidencian células manteniendo interacciones estrechas dispuestas a modo de epitelio simple, situación descrita ya en 1980 (15). De igual modo, la información disponible en lo relativo a las transfectadas con el oncogén ras que siguen la trayectoria de la neoplasiay sobre todo, aquellas en las que se centra este estudio, donde el mecanismo apoptótico se encuentra en desarrollo, es coincidente tanto con los eventos celulares como con los aspectos morfológicos característicos del proceso de muerte programada, producto de los hallazgos de investigaciones e investigadores relativos al tema apoptótico (16,17).
En este contexto, relacionado al rol del oncogén ras como gatillador y responsable de generar tanto los aspectos neoplásicos como modulando y/o regulando la entrada celular al proceso apoptótico, existen informaciones semejantes a las planteadas en el presente trabajo (18-20).
Mediante esta comunicación, entonces, quedaen evidencia el camino apoptótico que ciertas células, las drásticamente dañadas, pertenecientes al epitelio mamario de la estirpe HC11 transfectadas con el ras, y producto de las profundas e irreversibles modificaciones experimentadas por la expresión del oncogén, se introducen en el camino de la muerte celular programada.
BIBLIOGRAFÍA
- Marte BM, Jeschke M, Graus-Porta D, Taverna D, Hofer P, Groner B, et al. Neu differentiation factor/heregulin modulates growth and differentiation of HC11 mammary epithelial cells. Mol Endocrinol 1995;9(1):14-23.
- Normanno N, Ciardello F. EGF-related peptides in the pa-thophysiology of the mammary gland. J Mammary Gland Biol. Neoplasia 1997;2:143-51.
- Hynes NE, Taverna D, Harwerth IM, Ciardiello F, Salomon DS, Yamamoto T, Groner B. Epidermal growth factor receptor, but not c-erbB-2, activation prevents lactogenic hormone induction of the beta-casein gene in mouse mammary epithelial cells. Mol Cell Biol 1990;10:4027-34.
- Jehn B, Costello E, Marti A, Keon N, Deane R, Li F, et al. Overexpression of Mos, Ras, SRC, and Fos inhibits mouse mammary epithelial cell differentiation. Mol Cell Biol 1992;12(9):3890-902.
- Kampfer S, Hellbert K, Villunger W, Doppler W, Baier G, Grunicke HH, Uberall F. Transcriptional activation of c-fos by oncogenic Ha-Ras in mouse mammary epithelial cells requires the combined activities of PKC-lambda, epsilon and zeta. EMBO J 1998;17(14):4046-55.
- Schlatter B, Waghorne C. Persistence of Ha-ras-induced metastatic potential of SPI mamary tumors despite loss of the Ha-ras shuttle vector. Proc Nati Acad Sci USA 1992;89:9986-90.
- Reuther GW, Der CJ. The Ras branch of small GTPases: Ras family members don’t fall far from the tree. Curr Op Cell Biol 2000;12(2):157-65.
- Gulbins E, Bissonnette R, Mahboubi A, Martin S, Nishioka W, Brunner T, et al. FAS-induced apoptosis is mediated via a ceramide-initiated RAS signaling pathway. Immunity 1995;2(4):341-51.
- Trent JC, McConkey DJ, Loughlin SM, Harbison MT, Fernandez A. Ananthasm HN. Ras signaling in tumor necrosis factor-induced apoptosis. EMBO J 1996;15:4497-505.
- Kauffmann-Zeh A, Rodriguez-Viciana P, Ulrich E, Gilbert C, Coffer P, Downward J, Evan G. Suppression of c-Myc-induced apoptosis by Ras signalling through PI(3)K and PKB. Nature 1997;385:544-8.
- Fecteau K, Mei F, Wang H. Differential modulation of signaling pathways and apoptosis of ras-transformed 10T1/2 cells by the depsipeptide FR901228. Pharmacology 2002;300:890-9.
- Miyashita T, Reed JC. Tumor suppressor p53 is a direct transcriptional human bax gene. Cell 1995;80(2):293-9.
- Onishi Y, Kizaki H. Apoptosis and diseases. Hum Cell 1994;7:27-32.
- Downward J. Ras signalling and apoptosis. Curr Op Genet Deve 1998;8(1):49-54.
- Ball RK, Friis RR, Schoenenberger CA, Doppler W, Groner B. Prolactin regulation of beta-casein gene expression and of a cytosolic 120 kD protein in a cloned mouse mammary epithelial cell line. EMBO J 1988;7:2089-95.
- Cohen J. Apoptosis. Immunol Today 1993; 14:126-30.
- Arango M, Llanes L, Diaz T, Faxas M. La apoptosis: sus características y su papel en la transformación maligna de la célula. Rev Cubana Oncol 1997;13:126-34.
- Ichikawa T, Ichikawa Y, Isaacs JT. Genetic factors and suppression of metastatic ability of v-Ha-ras-transfec-ted rat mammary cancer cells. Proc Nati Acad Sci USA 1992;89:1607-10.
- Rodriguez-Viciana P, Warne PH, Khwaja A, Marte BM; Pappin D, Das P, et al. Role of phosphoinositide 3-OH kinase in cell transformation and control of the actin cytos-keleton by Ras. Cell 1997;89:457-67.
- Embade N, Valeron P, Aznar S, Lopez-Collazo E, Lacal J. Apoptosis induced by Rac GTPase correlates with indduction of FasL and ceramides production. Mol Biol Cell 2000;11:4347-58.