2018
2
Autores:
René Rivera Z.1, Raúl Barrero P.1, Bárbara Barrientos F.2, David Barrero V.a, Angélica Larraín H.b
Instituciones:
1Servicio de Ginecología y Obstetricia, Hospital Clínico Félix Bulnes, 2Servicio de Anatomía Patológica, Hospital Félix Bulnes C..
aAlumno(a) de Medicina, Universidad de Chile, bMatrona, Facultad de Ciencias Médicas, Escuela de Obstetricia, Universidad de Santiago de Chile.
Tipo de documento:
Casos ClínicosCarcinoma escamoso ovárico bilateral
Contenido del documento:
INTRODUCCIÓN
El carcinoma ovárico de estirpe escamosa o espinocelular es poco frecuente (1). Se puede clasificar como primario o secundario, siendo el primer grupo el más frecuente, en particular, aquellos derivados de un teratoma quístico maduro (2). La frecuencia de transformación maligna en este tipo de tumores ocurre en alrededor del 2% de los casos, correspondiendo la estirpe escamosa la línea germinal más frecuentemente afectada (3). Se presenta el caso clínico de una paciente que desarrolló un carcinoma escamoso bilateral de ovario, originado en un teratoma quístico maduro.
CASO CLÍNICO
Paciente de 41 años, consulta en urgencia maternal el día 05/04/2005 por dolor pélvico de dos meses de evolución. Entre sus antecedentes mórbidos destaca hipertensión arterial crónica en tratamiento con enalapril 20 mg/día. Antecedentes gíneco-obstétricos: Gesta 2, Para 1, Abortos 1. Cesárea por síndrome hipertensivo severo del embarazo. FUM: 29/03/2005. Ciclos menstruales regulares IV/30 días. PAP normal en 2004. Sin actividad sexual desde 2003. Al exámen ginecológico de ingreso se palpa útero en anteversoflexión de volumen normal, sensible a la palpación, anexos aumentados de tamaño y tumor de aproximadamente 10 x 8 cm que ocupa el fondo de saco posterior. Cérvix de aspecto macroscópico normal.
Se ingresa con diagnóstico de tumor pélvico en estudio. La ecografía transvaginal destaca un tumor bilobulado de 103 x 80 mm, heterogéneo, localizado en región anexial derecha, en estrecho contacto con cara posterior uterina. TAC abdominopélvico informa masa pélvica sólida de 10 cm de probable origen anexial derecho. Ascitis negativa. Sin evidencias de compromiso ganglionar linfático pélvico ni periaórtico. Radiografía de tórax normal. CA-125: 64,7 U/ml. Cistoscopía normal y colonoscopía negativa para neoplasia.
Por cuadro de abdomen agudo, la paciente es sometida a laparotomía exploradora, encontrándose ambos ovarios aumentados de tamaño, de aspecto neoplásico y gran tumor de aproximadamente 8 cm, necrótico, que ocupa fondo de saco posterior. Útero de aspecto normal. Se realizó estudio citológico de liquido peritoneal, histerectomía total más salpingooforectomía bilateral, omentectomía infracólica, apendicectomía y resección parcial del tumor por compromiso rectal. La biopsia intraoperatoria informa carcinoma ovárico bilateral. La paciente es dada de alta el 26/04/2005.
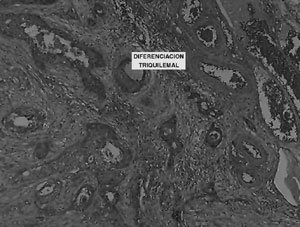
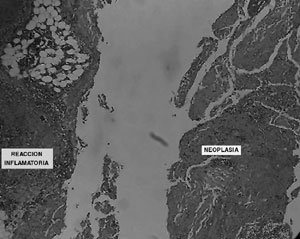
La biopsia diferida describe carcinoma escamoso bien diferenciado de ovario bilateral, originado en teratoma quístico maduro de ovario derecho, con extensión extracapsular bilateral (Figura 1 y 2). Muestra obtenida del tumor, está constituida en su totalidad por el carcinoma descrito (Figura 3). Cérvix (mucosa endo y exocervical) sin atipías, con infiltración de su pared posterior por carcinoma escamoso (Figura 4). Epiplón comprometido con implante carcinomatoso de 4 mm (Figura 5). Estudio citológico de líquido peritoneal positivo para células neoplásicas malignas. Apéndice sin compromiso tumoral.
La paciente fue derivada a centro oncológico para tratamiento complementario, sometiéndose a nueva cirugía en forma privada y a quimioterapia coadyuvante, fallece a los siete meses de la cirugía inicial.
DISCUSIÓN
El carcinoma escamoso de ovario es una entidad poco frecuente (1). Puede ser clasificado como primario o secundario (metastásico). El tipo primario se asocia con algunos tumores de ovario como el teratoma quístico maduro, tumor de Brenner, cistoadenoma mucinoso y con focos de endometriosis ovárica (2,4,5). La gran mayoría corresponden a carcinomas escamosos originados de un teratoma quístico maduro que ha presentado transformación maligna de la estirpe escamosa (3), proceso que es reportado en la literatura con una frecuencia de aproximadamente 2% (6). Si consideramos que un 0,46% de los cánceres primarios de ovario derivan de un teratoma quístico maduro, tenemos que un 0,37% representan al grupo de carcinomas escamosos, dado que la principal degeneración maligna se produce a partir de la línea escamosa del teratoma, con una frecuencia del 80% (2,7). El carcinoma escamoso primario puro (no derivado de otros tumores ováricos), es extremadamente raro, reportándose en la literatura mundial solo 11 casos a la fecha (1,8). En el grupo de carcinomas escamosos secundarios, que representan el 2,5% de las metástasis ováricas, el carcinoma escamoso de cérvix, representa la neoplasia de origen más frecuente con un 90% (9).
Diversos trabajos han mencionado probables factores de mayor o menor riesgo de transformación maligna en teratomas quísticos maduros, señalando que la edad menor de 40 años y el antígeno carcinoma de células escamosas menor a 2,5 ng/ml, representan condiciones de menor riesgo de transformación maligna. En cambio un tamaño tumoral mayor de 99 mm, medido por ecografía transvaginal y un antígeno carcinoembrionario mayor a 2,5 ng/ml, otorgan mayor riesgo de transformación maligna de un teratoma (10,11,12).
Respecto de las etapas, la literatura señale al estadío I con frecuencias de 46-51%, estadío II con 14% y el estadío III con 35-41% (6,11,13,14).
En relación al tratamiento, la cirugía de etapificación completa con un volumen tumoral residual menor a 1 cm, es la cirugía recomendada, permitiendo lograr un mejor pronóstico en este tipo de pacientes (6,13,15). Respecto del tratamiento complementario, no existe acuerdo en la literatura que defina la mejor terapia, ya sea quimioterapia, radioterapia o la combinación de ambas, fundamentalmente por el reducido número de casos publicados (6). Cisplatino ha sido utilizado con resultados variables, sugiriendo que la respuesta por etapas es menor que en carcinoma ovárico epitelial, otorgándole al carcinoma escamoso un peor pronóstico (13).
La sobrevida a 5 años publicada por diferentes autores, señala un 95% para la etapa I, 80% para la etapa II y 0% para las etapas III-IV, con un 92% de las muertes, en este último grupo, ocurrida durante los primeros 20 meses post tratamiento (6,13,15).
Diversos factores de mal pronóstico han sido descritos, entre los que destacan la etapa avanzada de la enfermedad, el grado tumoral 3, infiltración difusa del estroma y el compromiso vascular por la neoplasia (6,13).
En caso actual, la extensión de la enfermedad y el tipo histológico, determinaron el mal pronóstico de la paciente.
BIBLIOGRAFÍA
- Chien SC, Sheu BC, Chang WC, Wu MZ, Huang SC. Pure primary squamous cell carcinoma of the ovary: a case report and review of the literature. Acta Obstet Gynecol Scand 2005; 84: 706-8.
- Stamp GWH, McConnell EM. Malignancy arising in cystic ovarian teratomas. A report of 24 cases. Br J Obstet Gynaecol 1983; 90: 671-5.
- Powell JL, Stinson JA, Connor P, Shiro BS, Mattison M. Squamous cell carcinoma arising in a dermoid cyst of the ovary. Case report. Gynecol Oncol 2003; 89: 526-8.
- Ness RB. Endometriosis and ovarian cancer: Thoughts on shared pathophysiology. Am J Obstet Gynecol 2003; 189(1): 280-94.
- Naresh KN, Ahuja VK, Rao CM, Mukherjee G, Bhargava MK. Squamous cell carcinoma arising in endometriosis of the ovary. J Clin Pathol 1991; 44: 958-9.
- Lee YC, Abulafia O, Montalto N, Holcomb K, Matthews R, Golub RW. Malignant transformation of an ovarian mature cystic teratoma presenting as a rectal mass. Gynecol Oncol 1999; 75: 499-03.
- Chen RJ, Huang PT, Lin MC, Huang SC, Chow SN, Hsieh CY. Advanced stage squamous cell carcinoma arising from mature cystic teratoma of the ovary. Case report. Acta Obstet Gynecol Scand 2001; 80: 84-6.
- Radhi JM, Awad SM. Bilateral squamous cell carcinoma of the ovary. Case report. Br J Obstet Gynaecol 1990; 97: 855-6.
- Webb MJ, Decker DG, Mussey E. Cancer metastatic to the ovary. Factors influencing survival. Obstet Gynecol 1974; 45(4): 391-6.
- Peterson WF. Malignant degeneration of benign cystic teratomas of the ovary. A collective review of the literature. Obstet Gynecol Surv 1957; 12: 793-830.
- Mori Y, Nishii H, Takabe K, Shinozaki H, Matsumoto N, Suzuki K, et al. Preoperative diagnosis of malignant transformation arising from mature cystic teratoma of the ovary. Gynecol Oncol 2003; 90: 338-41.
- Kikkawa F, Nawa A, Tamakoshi K, Ishikawa H, Kuzuya K, Suganuma N, et al. Diagnosis of squamous cell carcinoma arising from mature cystic teratoma of the ovary. Cancer 1998; 82: 2249-55.
- Kikkawa F, Ishikawa H, Tamakoshi K, Nawa A, Suganuma N, Tomoda Y. Squamous cell carcinoma arising from mature cystic teratoma of the ovary: A clinicopathologic analysis. Obstet Gynecol 1997; 89(6): 1017-22.
- Curling OM, Potsides PN, Hudson CN. Malignant change in benign cystic teratoma of the ovary. Br J Obstet Gynaecol 1979; 86: 399-02.
- Tseng C, Chou H, Huang K, Chang T, Liang C, Lai C, et al. Squamous cell carcinoma arising in mature cystic teratoma of the ovary. Gynecol Oncol 1996; 63: 364-70.