2011
6
Autores:
Ernesto Perucca P., Moisés León V., Sylvia Márquez C., Danny Mendoza G., Eduardo Cuellar J., Nicolás Escorza L., Pilar Rivera A., Valentina Rojas R.
Tipo de documento:
Casos ClínicosEMBARAZO POSTRASPLANTE HEPÁTICO: REPORTE DE UN CASO Y REVISIÓN DE LA EVIDENCIA ACTUAL
Contenido del documento:
RESUMEN
Se estima que en Chile, hasta marzo de 2008 se han efectuado 637 trasplantes hepáticos ortotópicos (THO), siendo la principal causa la cirrosis hepática. Según estadísticas norteamericanas, en el año 2006 existían 3000 mujeres con THO en edad reproductiva. Presentamos el caso de una paciente de 25 años, trasplantada hepática hace 6 años, en terapia inmunosupresora, con buen resultado materno-perinatal.
PALABRAS CLAVE: Trasplante hepático ortotópico, terapia inmunosupresora, embarazo
SUMMARY
Until March 2008, Chile had 637 orthotopic liver transplantation (OLT), the main cause was liver cirrhosis. According to US statistics, in 2006 there were 3000 women of reproductive age with OLT. We report a 25-year-old, liver transplant six years ago in immunosuppressive therapy, with good maternal and perinatal outcome.
KEY WORDS: Orthotopic liver transplantation, immunosuppressive therapy, pregnancy
INTRODUCCIÓN
Los primeros trasplantes hepáticos ortotópicos (THO) se realizaron en EEUU en el año 1963 por el equipo de Thomas Starzl, con malos resultados iniciales (1). No fue hasta 1978 en que Walcott y cols (2), notifican el primer embarazo postrasplante hepático.
Desde 1983, año en que se consolida como una alternativa terapéutica (3), se han realizado aproximadamente 100.000 THO en el mundo, en más de 250 centros. La sobrevida actual de los pacientes al año y a los 5 años pos THO alcanza tasas de 90 y 80%, respectivamente (1).
Según nuestra estadística, cada año fallecen en Chile alrededor de 4.000 personas por enfermedades hepáticas, representando el 5% del total de las muertes. La cirrosis hepática es la principal causa.
El primer THO con sobrevida en Chile se realizó en 1985, contabilizándose hasta marzo de 2008 un total de 637 THO (1). La tasa de donante efectivo es de 10 por millón de habitantes, muy por debajo de países como España, que presenta una tasa de 33 por millón (1). No todos los pacientes que requieran THO son candidatos a realizar dicha intervención, existiendo varias contraindicaciones que se deben tener presente (Tabla I). Se debe considerar también el elevado costo que tiene en Chile un THO, alcanzando cifras por sobre los US$32.000, con estadías hospitalarias promedio entre 11 y 21 días (1).
Según estadísticas norteamericanas, en el año 2006 existían 3000 mujeres con THO en edad reproductiva (4), cifra importante si se considera que en este grupo etáreo se debe intervenir a la hora de planificar y controlar los futuros embarazos.
El objetivo de esta comunicación es presentar un caso de embarazo postrasplante hepático y revisión de la evidencia actual.
Caso clínico
Paciente de 25 años, multípara de 1 parto vaginal espontáneo en el año 2001, con antecedentes de trasplante hepático de donante cadáver el año 2002 por hepatitis fulminante, y retrasplantada en el 2003 por colangitis asociada a estenosis biliar y formación biliosa. En tratamiento imunosupresor con Micofenolato 500 mg cada 12 horas y Tacrolimus 4 mg cada 12 horas.
Cursando embarazo programado de 11 +5 semanas por amenorrea y acorde con ecografía precoz. Inicia controles multidiciplinario en la Unidad de Alto Riesgo Obstétrico y en el Servicio de Gastroenterología del Hospital Barros Luco Trudeau, Santiago, Chile.
El embarazo evoluciona favorablemente con buen incremento de peso y valores de presión arterial dentro de rangos normales. Los exámenes de control realizados periódicamente revelaron función renal, bilirrubinemia, glicemia y prueba de tolerancia a la glucosa oral (PTGO) en valores normales. Cursa con anemia leve durante todo el embarazo, tratada con hierro en dosis habituales.
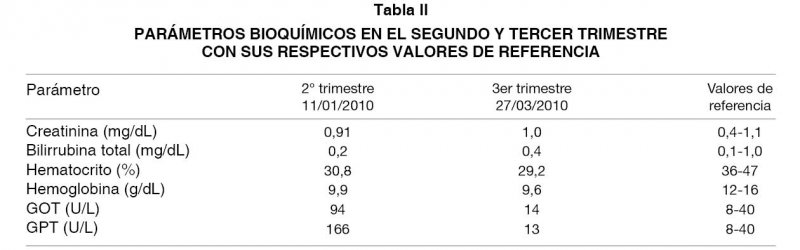
Presentó elevación de enzimas hepáticas en el segundo trimestre del embarazo, con valores de GOT 2,4 veces y GPT 4,2 veces por sobre los valores normales. Ante tal alza enzimática se decide aumentar la dosis de Tacrolimus a 5 mg cada 12 horas, manteniendo Micofenolato en igual dosificación. Evoluciona con buena respuesta y descenso de las pruebas hepáticas en exámenes de control (Tabla II).
Las ecografías seriadas del primer, segundo y tercer trimestre muestran feto único vivo, con anatomía, líquido amniótico y estimación de peso fetal normal, correspondiente con la edad gestacional respectiva. Doppler de arterias uterinas del segundo trimestre fue normal. El 23 de marzo de 2010 se decide vigilancia materno-fetal con perfil hepático y función renal semanal, y se decide la interrupción de la gestación a las 38 semanas, siendo susceptible a parto vaginal.
A las 34 semanas presenta el segundo episodio de infección del tracto urinario por Klebsiella pneumoniae, es tratada con Cefadroxilo en dosis habituales. A la semana siguiente se realiza cultivo de secreción vaginorectal, con resultado positivo para Streptococcus agalactiae grupo B (SGB).
En control a las 35 semanas por gastroenterología se reajustan los inmunosupresores, indicándose las dosis inicialmente expuestas. Se sugiere la suspensión durante parto por no más de 24 horas y la administración hidrocortisona en dosis habituales para su reemplazo.
Ingresa el 17de abril de 2010 a las 36+5 semanas, en trabajo de parto en fase latente, siendo manejada con esquema inmunosupresor intraparto sugerido, agregándose Ampicilina para tratar el SGB. El parto fue vaginal espontáneo con recién nacido vivo, femenino, peso 2.878 gramos, talla 47,5 cm, APGAR 8-9. Se indica suspensión de lactancia y antibióticos profilácticos por 3 días. Son dadas de alta en buenas condiciones.
DISCUSIÓN
Un número importante de las pacientes que adquieren o tienen enfermedad hepática, están en edad reproductiva (5), por lo que es imprescindible previo al trasplante realizar una adecuada consejería sobre embarazo y anticoncepción.
Anticoncepción. La mujer en falla hepática aguda se encuentra habitualmente en amenorrea por alteración del eje hipotálamo-hipófisis-ovario. Luego del trasplante, la fertilidad vuelve en general a las ocho semanas, pero puede demorar hasta un año (5,6). Dentro de los métodos anticonceptivos a utilizar, deben preferirse aquellos que no interfieren con los inmunosupresores. Los métodos de barrera son una buena opción, especialmente el condón por ofrecer adicionalmente protección contra las infecciones de transmisión sexual. El dispositivo intrauterino es considerado por muchos el método de elección y la esterilización quirúrgica es elegida por el 24% de las trasplantadas (6). Los anticonceptivos hormonales tienen las mismas contraindicaciones que en una mujer no trasplantada, utilizándose en pacientes con función estable del injerto en los últimos 6-8 meses y monitorización de enzimas hepáticas periódicas. Se tiene poca experiencia sobre anticonceptivos transdérmicos y anillo vaginal (6).
Momento del embarazo. El momento óptimo de embarazo es controversial. La mayoría de los centros recomienda diferir el embarazo en al menos un año postrasplante, pues la función del injerto es cercana a la óptima con bajas dosis de inmunosupresores, minimizando el riesgo de rechazo agudo e infecciones oportunistas (4). Ante un episodio de rechazo, se recomienda una espera de un año pos episodio antes de permitir un embarazo (5).
Inmunosupresión: embarazo y lactancia. Se ha descrito baja teratogenicidad y pérdida fetal, pero los estudios tienen limitaciones que impiden predecir resultados. Las drogas más comunes usadas pos transplante en EEUU y Europa son:
a. Ciclosporina A, fármaco clase C; se han reportado casos de parto prematuro, bajo peso al nacer, hiperkalemia neonatal y creatinina sérica aumentada (6).
b. Tacrolimus, clase C; se han reportado hasta un 60% de partos prematuros y un 4% de malformaciones congénitas en las usuarias (6).
c. Prednisona, clase B; el mayor riesgo es el paladar hendido, rotura prematura de membranas y la restricción del crecimiento fetal (6).
d. Micofenalato mofetil, clase C; ha ganado popularidad como alternativa a azatioprina y esteroides, pero tiene un efecto potencialmente teratogénico (6,7).
En cuanto a la lactancia, se sabe que los inmunosupresores se excretan en la leche materna, no existiendo información suficiente para recomendarla (6).
Complicaciones maternas, fetales y vía de parto. La complicación más temida frente a un trasplante es el rechazo, no existiendo diferencia significativa en las mujeres embarazadas respecto a las no embarazadas, salvo si concibieron en menos de 6 meses del trasplante. Existe un 7% de rechazo agudo durante el embarazo y 8% de pérdida del injerto a los 2 años posparto (8).
La presión arterial se ve afectada con el trasplante, registrándose un 34% de hipertensas en mujeres embarazadas trasplantadas versus un 10% en las no trasplantadas. Asimismo, la incidencia de preeclamsia llega a un 22% en mujeres trasplantadas. Se ha relacionado a los inmunosupresores con el desarrollo de la hipertensión arterial, siendo en orden decreciente la Ciclosporina, Tacrolimus y los esteroides (4). No se ha reportado incremento en la incidencia de diabetes gestacional (4).
Es común ver el aumento de las enzimas hepáticas sin ictericia, usualmente tratada con incremento en las dosis de inmunosupresores y/o bolos de esteroides (4).
Presentan dos veces más hemorragia posparto con necesidad de transfusión sanguínea, independiente de la vía del parto. Esto tendría relación con la inmunosupresión, que como efecto adverso produce anemia y/o trombocitopenia (9). La anemia fue la causa más común de hospitalización anteparto, por lo tanto se debe vigilar estrechamente este parámetro (9).
Las complicaciones fetales más comunes, al igual que en otro tipo de trasplantes son: pérdida fetal, prematurez y bajo peso al nacer (4). Se sabe que las causas más comunes de prematurez son la preeclampsia y la rotura prematura de membranas. No se ha reportado un aumento de las malformaciones fetales, siendo comparables con la población general, alcanzando un 2-3% (4).
Según las condiciones obstétricas se define la vía del parto, siendo susceptibles a parto vaginal. Sin embargo, la resolución por cesárea es mayor que en la población general con cifras cercanas al 35%, explicado por la mayor incidencia de complicaciones materno fetales (4).
Control prenatal y posnatal. Es necesario el diagnóstico precoz del embarazo, con control estricto clínico y de laboratorio de las funciones del órgano transplantado y de los niveles de inmunosupresores. Se hace imprescindible la vigilancia de infecciones virales o bacterianas, recomendándose en nuestro centro el cultivo de orina mensual. Se debe considerar la vigilancia del rechazo con biopsias si es necesario. Además, se requiere una estricta vigilancia fetal con ultrasonido después de las 32 semanas. Revisar periódicamente la presión arterial, pesquisar preeclampsia, nefropatía y diabetes gestacional.
En el posparto, se deben medir los niveles plasmáticos de inmunosupresores por lo menos durante el primer mes y ajustarlos si es necesario. Debemos considerar el uso de anticonceptivos como en cualquier puérpera.
CONCLUSIÓN
El trabajo metódico y multidiciplinario del equipo de salud, permitirá que casos de alto riesgo materno-perinatal, como el que presentamos, lleguen a buen término y se pueda lograr un embarazo exitoso.
BIBLIOGRAFÍA
1. Hepp J, Zapata R, Buckel E, Martínez J, Uribe M, Díaz JC, Ferrario M, Sanhueza E, Pérez RM, Hunter B, Ríos G, Humeres R, Poniachik J, Oksenberg D, Arrese M. Trasplante hepático en Chile: Aspectos generales, indicaciones y contraindicaciones (Documento de consenso). Rev Méd Chile. 2008;136:793-804
2. Walcott WO, Derick DE, Jolley JJ, Zinder DL. Successful pregnancy in a liver transplant patient. Am J Obstet Gynecol. 1978;132:340-1.
3. National Institutes of Health Consensus Development Conference Statement: Liver transplantation, June 20-23, 1983. Hepatology 1984;4(1 Suppl):107S-110S.
4. Surti B, Tan J, Saab S. Pregnancy and liver transplantation. Liver Int 2008;28:1200-6.
5. Bonanno C, Dove L. Pregnancy after liver transplantation. Semin Perinatol 2007;31:348-53.
6. Heneghan MA, Selzner M, Yoshida EM, Mullhaupt B. Pregnancy and sexual function in liver transplantation. J Hepatol 2008;49:507-19.
7. Mastrobattista JM, Gomez-Lobo V. Pregnancy after solid organ transplantation. Obstet Gynecol 2008;112:919-32.
8. Joshi D, James A, Quaglia A, Westbrook RH, Heneghan MA. Liver disease in pregnancy. Lancet 2010;375:594-605.
9. Coffin CS, Shaheen AA, Burak KW, Myers RP. Pregnancy outcomes among liver transplant recipients in the United States: A nationwide case-control analysis. Liver Transpl 2010;16:56-63.