2018
3
Autores:
Álbaro José Nieto MD, Juan Manuel Burgos MD, Lina Marcela Echeverry, María Fernanda Escobar MD, MSC
Tipo de documento:
Casos ClínicosENCEFALOPATÍA DE WERNICKE SECUNDARIO A HIPERÉMESIS GRAVÍDICA: LA IMPORTANCIA DEL DIAGNÓSTICO TEMPRANO
Contenido del documento:
RESUMEN
Introducción: La hiperémesis gravídica (HG) es una condición frecuente en el embarazo, que puede resultar en complicaciones potencialmente letales como la encefalopatía de Wernicke (EW), síndrome que al ser reconocido y tratado tardíamente puede traducirse en una alta morbi-mortalidad materna y fetal.
Objetivo: Describir el primer caso de EW secundario a HG en Colombia y realizar una revisión de la literatura publicada sobre su diagnóstico y tratamiento.
Materiales y métodos: Se describe un caso de EW secundario a HG en el que se brindó un manejo interdisciplinario. Se realizó una revisión de la literatura con los términos “encefalopatía de Wernicke”, “hiperémesis gravídica” y “embarazo” incluyendo reportes de casos, series de casos, artículos de revisión, investigaciones originales o cartas al editor en inglés, español y francés, en donde se analizaron el método y tiempo del diagnóstico, pauta de tratamiento y estado funcional final.
Resultados: Se incluyeron 69 publicaciones y se identificaron 89 casos. En 23 de ellos se presentó pérdida gestacional, sólo en el 12,4% de los casos se reportó el nivel de tiamina, de los cuales en el 90% se encontraba disminuido y de los casos en donde se reportó estado funcional final en el 5,9% la gestante falleció.
Conclusión: La EW secundaria a HG es una complicación potencialmente letal. Debe sospecharse ante cualquier alteración neurológica e historia de emesis persistente. El diagnóstico y tratamiento oportuno interdisciplinario son fundamentales para disminuir el riesgo de secuelas que limitan la capacidad funcional con alto impacto en la calidad de vida.
PALABRAS CLAVE: Encefalopatía de Wernicke; Hiperemesis gravídica; Tiamina; Embarazo.
SUMMARY
Introduction: Hyperemesis gravidarum (HG) is a frequent condition in pregnancy, which can result in potentially lethal complications such as Wernicke encephalopathy (WE), a syndrome that can be translated into a high maternal and fetal morbidity and mortality if it is recognized and treated late.
Objective: To describe the first case of WE due to HG in Colombia and to review the published literature about its diagnosis and treatment.
Materials and methods: We describe a case of WE due to HG with an interdisciplinary approach. A review of the literature was performed with the terms «Wernicke’s encephalopathy», «hyperemesis gravidarum» and «pregnancy» including case reports, case series, review articles, original investigations or letters to the editor in English, Spanish and French, where the method and time of the diagnosis, treatment regimen and sequelae were analyzed.
Results: Sixty-nine publications were included and 89 cases were identified. In 23 of them had a gestational loss, only in 12.4% of the cases the thiamine level was reported, in which 90% was diminished and in the cases where the final functional status was reported in 5.9% of the pregnant woman died.
Conclusion: WE due to HG is a potentially lethal complication. In any neurological disturbance and history of persistent emesis it should be suspected. Timely interdisciplinary diagnosis and treatment are essential to reduce the risk of sequelae that limit functional capacity with a high impact on quality of life.
KEY WORDS: Wernicke encephalopathy; Hyperemesis gravidarum; Thiamine; Pregnancy.
INTRODUCCIÓN
Al comienzo de la gestación hasta el 80 % de las mujeres experimentan algún grado de nauseas y/o vómito (1). Su frecuente presentación hace que éste síntoma sea minimizado y subtratado, facilitando en algunos casos su progresión a cuadros más severos como la hiperémesis gravídica (HG) que se caracteriza por vómito persistente, pérdida de peso mayor al 5%, deshidratación, alteraciones electrolíticas o requerimiento de hospitalización (2). En el espectro más severo de la HG se encuentran algunas complicaciones neurológicas como neuropatías periféricas por déficit de vitamina B6 y B12 y la encefalopatía de Wernicke (EW) (3).
La EW es un síndrome neuropsiquiátrico agudo relacionado en la mayoría de los casos con alcoholismo crónico (4) y es causado por otras condiciones como la HG (5). Esta asociación se describió por primera vez en 1914 (6), sin embargo, sigue siendo reconocida y tratada tardíamente, lo que puede traducirse en una alta morbi-mortalidad materna y fetal.
Dando énfasis al diagnóstico temprano y el manejo interdisciplinario con el fin de evitar secuelas neurológicas severas a largo plazo, reportamos el primer caso en Colombia de una gestante que, tras 9 semanas de emesis persistente, presenta deterioro neurológico asociado a hallazgos en resonancia magnética nuclear que sugieren EW, manejada por un grupo interdisciplinario en la Unidad de Alta Complejidad Obstétrica (UACO) de la Fundación Valle del Lili (FVL) en Cali, Colombia.
Presentación del caso
Paciente de 23 años, G2A1, con antecedente de gastritis crónica y trastorno depresivo previo a la gestación, desde las 7 semanas de gestación presenta vómito persistente manejada con metoclopramida oral. A las 14 semanas de gestación, consulta al servicio de salud donde hacen diagnóstico de HG, con transaminasas elevadas (alanino aminotransferasa (ALT): 86 U/L, aspartato aminotransferasa (AST): 33 U/L), hiperbilirrubinemia (bilirrubina total (BT): 1.74 mg/dl, bilirrubina directa (BD): 1.36 mg/gl), ecografía con barro biliar y dos episodios aislados de fiebre con cultivos negativos, se da manejo sintomático y egreso. Cinco días después regresa por persistencia de los síntomas, con mayor aumento de transaminasas (AST 60 U/L, ALT 120 U/L) y bilirrubinas (BT 1,8 mg/gl), es valorada por cirugía general quienes consideran colangitis como posible diagnóstico con colangioresonancia magnética que resulta normal y posteriormente laparoscopia diagnóstica sin hallazgos patológicos, para continuar manejo ambulatorio.
A las 16 semanas de gestación presenta desorientación en tiempo y lugar, pérdida del control del esfínter urinario, fiebre, afasia motora, deterioro estado de conciencia (Glasgow 7/15) y oftalmoplejia, requiriendo traslado a la unidad de cuidado intensivo e intubación orotraqueal durante 8 días. Ante sospecha de neuroinfección realizan tomografía cerebral y estudio de líquido cefalorraquídeo obteniendo resultados normales. A las 17 semanas de embarazo se documenta muerte fetal y se induce aborto con misoprostol y posterior legrado uterino.
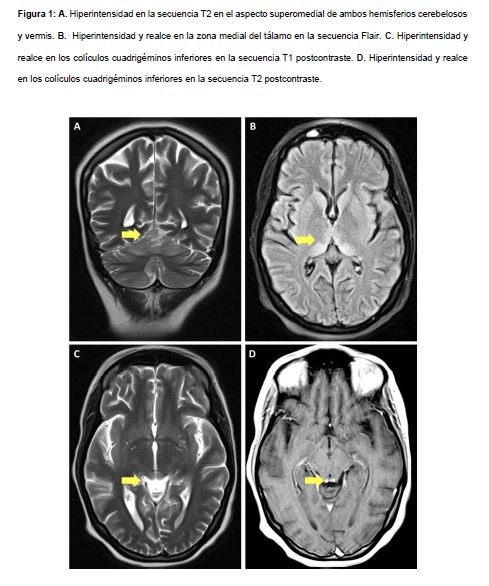
A las 17 semanas y 5 días, sin ninguna mejoría neurológica, es remitida a la UACO de la FVL, donde ingresa con Glasgow de 9/15, hipertensa (143/51 mmHg), taquicárdica (118 lpm), con pupilas reactivas, limitación para la supraversión de la mirada y para el seguimiento ocular a la derecha, nistagmus horizontal, cuadriparesia y arreflexia. Se documenta hiperbilirrubinemia directa (BT: 1.26 mg/dl y BD: 0.91 mg/dl), trombocitopenia (75000/mcL) y anemia de volúmenes normales (hemoglobina 10.4 gr/dl, volumen corpuscular medio 79.8 fL/célula y hemoglobina corpuscular media de 27.6 picogramos/célula), sodio y potasio sérico en valores de normalidad, cloro sérico de 108.6 mmol/L, sin leucocitosis, con urocultivo y hemocultivos negativos, por lo cual se descarta proceso infeccioso activo. Se realiza resonancia magnética que sugiere EW (Figura 1).
Se miden niveles de vitamina B1 y B6, muestras que son tomadas posterior a 10 minutos de infusión de dextrosa en agua destilada (DAD), y posteriormente se inicia reposición de tiamina 500 mg intravenoso (IV) cada 8 horas por 3 días, seguido de 250 mg IV diarios durante 5 días y finalmente 300 mg diarios vía oral (VO) durante toda la hospitalización. El manejo interdisciplinario incluyó terapia física, ocupacional y por fonoaudiología, ademas intervenciones de psicología y psiquiatría, con lo cual hay lenta mejoría, con persistencia de afasia, dismetría, debilidad en miembros inferiores y nistagmus posterior a 20 días de rehabilitación intensiva. Los niveles de vitamina B1 resultan en 2.2 μg/dL (normal 2.00-7.20μg/dL) y B6 en 13μg/L (normal 8.7-27.2μg/L).
Se realizó un estudio de neuroconducción compatible con polineuropatía axonal motora y sensitiva. Se traslada la paciente a un centro de menor nivel de complejidad para continuar con el proceso de rehabilitación, en donde se da egreso después de completar 4 meses de rehabilitación, con desaparición de afasia y control muscular del tronco y miembros superiores, pero persistencia de paraparesia y nistagmus que dificulta su participación en actividades de la vida diaria.
DISCUSIÓN
La HG es una condición presente en el 0,3 al 1% de los embarazos (2) y puede conducir a graves complicaciones perinatales como bajo peso al nacer, restricción del crecimiento intrauterino, nacimiento pretérmino y muerte fetal (5); por su parte, la madre puede presentar desde deshidratación severa, pérdida de masa muscular, desequilibrio electrolítico, cetonuria e hipovitaminosis (7,8), hasta la muerte. Una complicación neurológica infrecuente, secundaria al déficit de vitamina B1 (tiamina), es la EW.
La tiamina es una coenzima de aproximadamente 24 enzimas cruciales en la producción de energía, utilización de la glucosa en el ciclo de las pentosas fosfato, metabolismo de los lípidos, producción de aminoácidos de cadena ramificada y mantenimiento de la vaina de mielina. Cuando existe un déficit de tiamina se produce concomitantemente déficit de la actividad de enzimas como la transcetolasa, alfa glutarato deshidrogenasa y 2-oxoglutarato deshidrogenasa, que resultan en aumento del glutamato intracelular con muerte celular apoptótica secundaria a citotoxicidad (5), o incluso por sobreexpresión del oncogen Fos como lo muestran algunos modelos animales (9). Con periodos de deficiencia tan cortos como dos semanas, se ha descrito muerte de neuronas talámicas (10).
La asociación entre HG y EW se hizo por primera vez en 1914 (6). En 1997 Caine et. al (15) propusieron cuatro criterios diagnósticos con una sensibilidad del 85% cuando hay presencia de por lo menos dos de ellos: deficiencia en la dieta, anomalías oculomotoras (60.3%), disfunción cerebelosa (82.5%) y estado mental alterado (30.1%) o alteración de la memoria (52.3%) (12,17). Esta propuesta resalta la importancia de la sospecha diagnóstica que el obstetra debe tener ante cualquier paciente con HG y alteración neurológica. En el presente caso, se presentaron dos criterios clínicos para el diagnóstico, especialmente las alteraciones de la motilidad ocular u oftalmoplejia 12 días antes de la remisión a nuestra UACO. Las alteraciones en la neuroconducción, como la descrita en nuestra paciente, se presentan en muy pocos casos (12,17), pero se conoce que una deficiencia prolongada moderada puede conducir un daño a los nervios periféricos (16).
El requerimiento diario de tiamina durante la gestación es de 1.5 mg, lo que representa un 36% más que en la población general (18). De ésta forma, un individuo promedio tiene reservas para 18 días sin un consumo adecuado (5). Las manifestaciones clínicas de la EW por HG inician a las 14 ± 4 semanas de gestación (19), lo cual es compatible con lo observado en nuestra paciente, quien presentó alteraciones neurológicas a las 16 semanas de gestación y luego de 2 semanas de intolerancia a la ingesta.
Los niveles de tiamina normales no excluyen el diagnóstico de EW, ya que existe una relación con mutaciones en el gen del transportador de tiamina (20, 21) y adicionalmente, su medición es difícil en el contexto de los paises en vias de desarrollo. En nuestra institución es necesaria la remisión internacional de la muestra, con resultado disponible luego de 10 días de la toma, además son necesarias algunas condiciones técnicas difíciles de cumplir en pacientes sintomáticos (análisis de la muestra antes de 24 horas de la recolección, toma en ayuno mínimo de 8 horas y sin infusiones dextrosadas, entre otras).
Está comprobado que la adecuada respuesta a la administración de tiamina vía parenteral representa la mejor prueba diagnóstica (10). En el presente caso, la sintomatología, los hallazgos en la resonancia y la mejoría sintomática con la reposición de tiamina apoyaron el diagnóstico, incluso a pesar de niveles normales bajos de tiamina. En cuanto a las condiciones especiales de toma y manejo de la muestra de sangre para medición de tiamina, los resultados obtenidos en nuestra paciente pudieron verse afectados por la infusión de dextrosa endovenosa al momento de la toma.
Una opción diagnóstica recomendada en algunas guías es la medición de la actividad de la enzima transcetolasa eritrocitaria antes y después de la suplementación de tiamina, en donde se define un déficit de ésta última cuando se encuentra un aumento de la actividad de la enzima trancetolasa (22). Esta prueba no estuvo disponible en nuestro medio.
El tratamiento consiste en la reposición de tiamina. Aunque no existe un consenso acerca de la dosis y forma de preparación, es claro que el tratamiento se debe realizar vía parenteral ya que la tiamina se absorbe en el duodeno a una velocidad limitada y la cantidad máxima vía oral que puede absorberse en una dosis es de sólo 4.5 mg (21). La vida media de la tiamina es 96 minutos por lo que la administración en varias dosis (dos o tres) puede lograr una mejor penetración cerebral que con una sola dosis (12). Hay evidencia que dosis entre 100 – 250 mg no reestablecen el nivel óptimo de tiamina (23), no mejoran los signos clínicos (24) y no previenen la muerte (25). En nuestro caso se administró una dosis inicial de 500mg de tiamina IV en 100 cc de DAD al 5% en 30 minutos cada 8 horas por 3 días (21,26). Se continuó con 250 mg IV diarios por 5 días, obedeciendo la recomendación de 3 – 5 días hasta la mejoría clínica o hasta que el paciente tolere la vía oral (12); posteriormente se administró reposición vía oral con 300 mg una vez al día. Se recomienda continuar una dosis de 30 mg dos veces al día por mínimo tres meses (5,16). Con el anterior esquema la paciente presentó mejoría a los 20 días de tratamiento sumado a rehabilitación con terapia física, ocupacional y de deglución intensivas.
La mortalidad por EW es del 17% (27) y en casos de morbilidad severa, hay persistencia del déficit neurológico a pesar de la administración del tratamiento recomendado (28,29). Los síntomas residuales más frecuentes son el nistagmus y la ataxia en el 60% de los casos (5). Se ha descrito que el 80% de los pacientes que sobreviven presentan síndrome de Korsakoff (10) caracterizado por anomalías de la conducta, confabulaciones y deterioro de la memoria (amnesia anterógrada y retrógrada) de manera crónica como resultado de la deficiencia de tiamina (5,10). En el presente caso la remisión a un nivel de alta complejidad se realizó cuando los síntomas neurológicos tenían 12 días de evolución, posiblemente por desconocimiento de la relación entre HG y EW, y luego de un enfoque hacia el manejo de otras posibilidades diagnósticas. El diagnóstico y manejo tardío, explican la lenta evolución hacia la mejoría y la persistencia del déficit neurológico a pesar del manejo instaurado.
Se recomienda que cualquier paciente con un cuadro de HG debe recibir un manejo que implica corrección de los posibles desequilibrios electrolíticos, rehidratación, administración de antieméticos, apoyo nutricional y psicológico (30). Si hay un cuadro de más de 3 – 4 semanas de emesis persistente debe recibir profilaxis con tiamina 100 mg día vía IV (1) o 250 mg diarios vía intramuscular por 3 – 5 días (16,17). Cuando se asocie a síntomas neurológicos debe ser referida a un centro de alta complejidad en donde se puedan realizar estudios diagnósticos y tratamiento oportunos, por la posibilidad de EW u otras complicaciones potencialmente fatales.
CONCLUSIONES
La HG es una condición que puede llevar a complicaciones potencialmente letales como la EW. Esta asociacion, que describimos por primera vez en Colombia, debe ser sospechada en cualquier paciente con cuadro de alteración neurológica e historia de emesis persistente. El diagnóstico y tratamiento oportuno, con participación de un grupo interdisciplinario, son fundamentales para la disminución del riesgo de secuelas que pueden limitar de manera importante la capacidad funcional de estas pacientes, con alto impacto en su calidad de vida.
Declaración de conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Financiación
Ninguna.
BIBLIOGRAFÍA
1. Molina S, Vásquez D, Benavides JA, Aramendis JM, Vásquez GA, Buitrago M. Manejo de las naúseas y vómitos en el embarazo. Consenso de la Federación Colombiana de Asociaciones de Perinatología. Medicina. 2016;38 (113): 169-186.
2. Niebyl JR. Nausea and vomiting in pregnancy. N Engl J Med. 2010;363(21):1544-1550.
3. Gárdián G, Vörös E, Járdánházy T, Ungureán A, Vécsei L. Wernicke’s encephalopathy induced by hyperemesis gravidarum. Acta Neurol Scand. 1999;99:196-8
4. Harper C, Giles M, Finlay-Jones R. Clinical signs in the Wernicke-Korsakoff complex: a retrospective analysis of 131 cases diagnosed at necropsy. J Neurol Neurosurg Psychiatry. 1986;49(4):341–345.
5. Chiossi G, Neri I, Cavazzuti M. Hyperemesis gravidarum complicated by Wernicke encephalopathy: background, case report, and review of the literature. Obstet Gynecol Surv. 2006;61(4):255–268.
6. Henderson D. Korsakow’s psychosis occurring during pregnancy. Bull Johns Hopkins Hosp. 1914;25:261–270.
7. Jarvis S, Nelson-Piercy C. Management of nausea and vomiting in pregnancy. BMJ. 2011;324:d3606.
8. Sonkusare S. The clinical management of hyperemesis gravidarum. Arch Gynecol Obstet. 2011;283(6):1183–1192.
9. Matsushima K, MacManus J, Hakim A. Apoptosis is restricted to the thalamus in thiamine-deficient rats. Neuroreport. 1997;8(4):867–70.
10. Sechi G, Serra A. Wernicke’s encephalopathy : new clinical settings and recent advances in diagnosis and management. Lancet Neurol. 2007;6(5):442–455.
11. Zimitat C, Nixon PF. Glucose induced IEG expression in the thiamin-deficient rat brain. Brain Res. 2001;892(1):218–227.
12. Lehmann HC, Lindenberg R, Arendt G, Ploner M. Acute axonal neuropathy and Wernicke’s encephalopathy. J Neurol. 2006;253(11):1516–1517.
13. Chung TI, Kim JS, Park SK, Kim BS, Ahn KJ, Yang DW. Diffusion weighted MR imaging of acute Wernicke’s encephalopathy. Eur J Radiol [Internet]. 2003;45:256–8. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12595110
14. Antunez E, Estruch R, Cardenal C, Nicolas JM, Fernandez-Sola J, Urbano-Marquez A. Usefulness of CT and MR imaging in the diagnosis of acute Wernicke’s encephalopathy. AJR Am J Roentgenol. 1998;171(4):1131–7.
15. Caine D, Halliday GM, Kril JJ, Harper CG. Operational criteria for the classification of chronic alcoholics: identification of Wernicke’s encephalopathy. J Neurol Neurosurg Psychiatry. 1997;62(1):51–60.
16. Galvin R, Brathen G, Ivashynka A, Hillbom M, Tanasescu R, Leone MA. EFNS guidelines for diagnosis, therapy and prevention of Wernicke encephalopathy. Eur J Neurol. 2010;17(12):1408–18.
17. Cirignotta F, Manconi M, Mondini S, Buzzi G, Ambrosetto P. Wernicke-korsakoff encephalopathy and polyneuropathy after gastroplasty for morbid obesity: report of a case. JAMA Neurol. 2000;57(9):1356–9.
18. Spruill SC, Kuller JA. Hyperemesis gravidarum complicated by Wernicke’s encephalopathy. Obstetrics & Gynecology. 2002;99(5 SUPPL. 1):875–7.
19. Di Gangi S, Gizzo S, Patrelli TS, Saccardi C, D’Antona D, Nardelli GB. Wernicke’s encephalopathy complicating hyperemesis gravidarum: from the background to the present. J Matern Fetal Neonatal Med. 2012;25(8):1499–504.
20. Kono S, Miyajima H, Yoshida K, Togawa A, Shirakawa K, Suzuki H. Mutations in a Thiamine-Transporter Gene and Wernicke’s-like Encephalopathy. N Engl J Med. 2009;15–7.
21. Thomson AD, Cook CC, Touquet R, Henry JA. The Royal College of Physicians report on alcohol: guidelines for managing Wernicke’s encephalopathy in the accident and Emergency Department. Alcohol Alcohol. 2002;37(6):513–21.
22. Consejo de salubridad general. Gobierno Federal. Estados Unidos Mexicanos. Diagnóstico Y Tratamiento De Encefalopatía De Wernicke. Guía de Práctica Clínica. Catálogo maestro de guías de práctica clínica: IMSS-460-11. Fecha de consulta: 20 de febrero de 2017. Disponible en: https://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwjrqJ7k7tbUAhWBQSYKHQrVDbUQFggkMAA&url=http%3A%2F%2Fwww.cenetec.salud.gob.mx%2Fdescargas%2Fgpc%2FCatalogoMaestro%2F460-11_Encefalopatxa_Wernicke%2FGRR_Encefalopatxa_de_Wernicke.pdf&usg=AFQjCNGqKNLsaidgiPCmR4VjokvvcLRm6w.
23. Brown L, Rowe A, Ryle P, Majumdar S, Jones D, Thomson A. Efficacy of vitamin supplementation in chronic alcoholics undergoing detoxification. Alcohol Alcohol Suppl. 1983;18:157–66. Fecha de consulta: 20 de febrero de 2017. Disponible en: https://academic.oup.com/alcalc/article-abstract/18/2/157/148654/EFFICACY-OF-VITAMIN-SUPPLEMENTATION-IN-CHRONIC.
24. Tallaksen CME, Bell H, Bohmer T. Thiamin and Thiamin Phosphate Ester Deficiency Assessed by High Performance Liquid Chromatography in Four Clinical Cases of Wernicke Encephalopathy. Alcohol Clin Exp Res. 1993;17(3):712–6.
25. Cook C. Prevention and treatment of Wernicke-Korsakoff syndrome. Alcohol Alcohol. 2000;35(1):19–20.
26. Cook CCH, Hallwood PM, Thomson AD. Invited Review B Vitamin Deficiency and Neuropsychiatric Syndromes in Alcohol Misuse. Alcohol Alcohol. 1998;33(4):317–36.
27. Ropper A, Brown R. Diseases of the nervous system due to nutritional deficiency. Eigth edition. McGraw-Hill, editor. 2005. 984-988 p.
28. Reuler J, Girard D, Cooney T. Current concepts. Wernicke’s encephalopathy. N Engl J Med. 1985;312:1035–9.
29. Zubaran C, Ferandes J, Rodnight R. Wernicke – Korsakoff Syndrome. Postgrad Med J. 1997;73:27–31.
30. Ngene NC, Moodley J. Fatal encephalopathy complicating persistent vomiting in pregnancy: Importance of clinical awareness on the part of healthcare professionals. S Afr Med J. 2016;106(8):792–4.