2011
3
Autores:
Instituciones:
Laura Blasco G., Vanesa Nuñez M., Mireia Cruceyra B., Fernando Magdaleno D., Silvia García B.
Tipo de documento:
Trabajos OriginalesENFERMEDAD DE CHAGAS Y EMBARAZO
Contenido del documento:
RESUMEN
Objetivo: Analizar la situación actual de la Enfermedad de Chagas (EC) en relación con la gestación en el Hospital Universitario La Paz (HULP). Método: Estudio retrospectivo de gestantes diagnosticadas de EC en el HULP y seguimiento de sus hijos. Resultados: En el HULP hay descritos cinco casos de recién nacidos de madres con EC en seguimiento sin que se haya demostrado transmisión vertical. Discusión: El diagnóstico de la enfermedad en el neonato es complicado debido a la dificultad de detectar parásitos en sangre y a la presencia de anticuerpos maternos. El tratamiento únicamente tiene buenos resultados cuando se administra en los primeros meses de vida. Conclusiones: Debido al aumento de población inmigrante procedente de áreas endémicas, el tamizaje de EC en gestantes procedentes de dichas áreas y el seguimiento de los neonatos es fundamental para facilitar la detección de la infección congénita y su tratamiento.
PALABRAS CLAVE: Enfermedad de Chagas, inmigración, efectos perinatales, diagnóstico precoz, tratamiento.
SUMMARY
Objective: Analyze the current situation of Chagas’ disease in relation with gestation in The University Hospital La Paz (HULP). Methods: Retrospective study of pregnant women diagnosed of Chagas’ disease in HULP and the clinical tracking of their children. Results: In the HULP, five cases of new borns with mothers affected of Chagas’ disease have been reported without a vertical transmission being detected. Discussion: The diagnosis of Chagas’ disease in the new born is complicated because of the difficulty for detecting parasites in blood and the presence of maternal antibodies. Treatment is only effective if it is administered during the first months of life. Conclusions: Due to the increment of immigrant population from endemic areas, the screening of Chagas’ disease is really important to detect this congenital infection and its treatment.
KEY WORDS: Chagas’ disease, immigration, perinatal effects, screening, treatment.
INTRODUCCIÓN
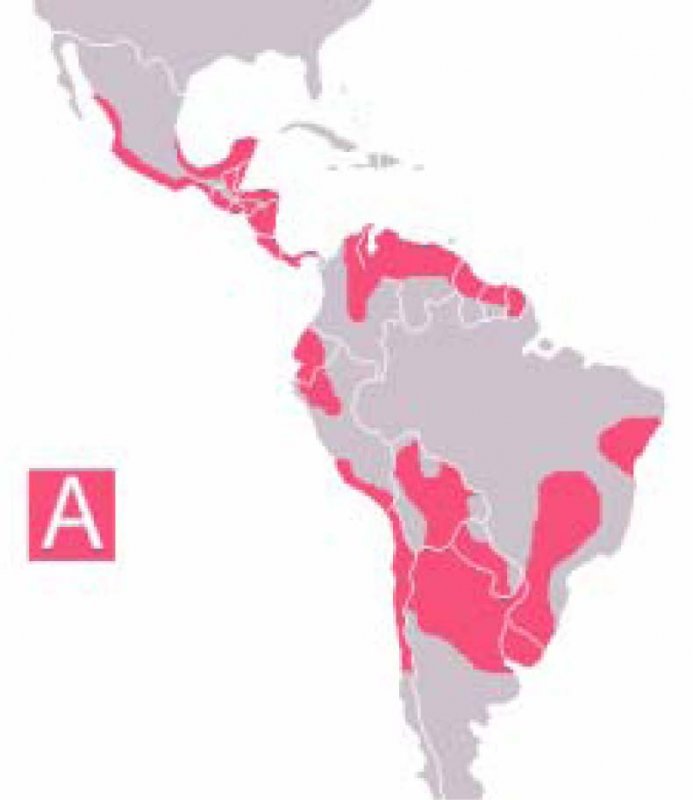
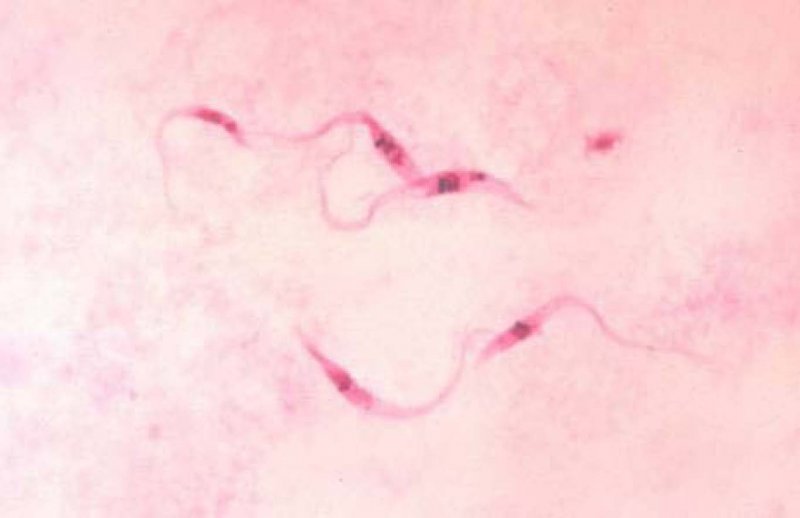
La enfermedad de Chagas (EC) es una infección parasitaria crónica y sistémica causada por el Trypanosoma Cruci (Figura 1), trasmitido por transfusiones sanguíneas o por un agente vector que es la Triatoma infestans, comúnmente denominada vinchuca (Figura 2). Es endémica en América, desde el sur de Estados Unidos hasta el norte de Chile y Sur de Argentina (1) (Figura 3).
Gracias a las medidas de control de la transmisión vectorial, transfusional y materno-fetal, se ha conseguido disminuir la incidencia de la enfermedad, pero en 2006 se calculaba que todavía existían 28 millones de personas en riesgo, 8 millones de infectados y que se podían producir unas 12.500 muertes al año por enfermedad de Chagas (2). La principal causa de muerte es la miocardiopatía chagásica crónica (3).
Como consecuencia del creciente volumen de población inmigrante procedente de zonas donde la enfermedad es endémica, en España se está produciendo un aumento de casos de enfermedad de Chagas congénita. El objetivo de esta comunicación es presentar un estudio retrospectivo de las pacientes asistidas en el Hospital Universitario La Paz de los casos de gestantes diagnosticadas de EC y el seguimiento de sus hijos.
PACIENTES Y MÉTODOS
Se realiza un estudio retrospectivo revisando los casos de gestantes diagnosticadas de EC en el Hospital Universitario La Paz (HULP) y el seguimiento de sus hijos. Los aspectos analizados han sido los siguientes: edad; nacionalidad; antecedentes familiares de enfermedad de Chagas; antecedentes personales sobre la enfermedad de Chagas; antecedentes gineco-obstétricos, alteraciones ecográficas en este embarazo, edad gestacional al parto, peso del neonato, seguimiento del hijo.
El protocolo de seguimiento que se realiza en el HULP para los recién nacidos de madres con enfermedad de Chagas está de acuerdo con el protocolo de actuación para la detección temprana de la infección congénita por Trypanosoma Cruzi propuesto por el Grupo de Trabajo de Chagas de la Comunidad Autónoma de Madrid (CAM)(3) (Figura 4).
Se debe obtener una muestra de sangre periférica en el recién nacido para realizar detección del parásito mediante técnica de microhematocrito y PCR. Si la detección es positiva, se administrará tratamiento inmediatamente. En caso de que la detección sea negativa se realizará nuevo control en un mes y, si es positivo, se instaurará tratamiento. En caso de que el segundo control sea negativo se repetirá a los nueve meses el estudio parasitológico y se realizará además un estudio serológico, procediéndose de la misma manera si es positivo. En caso de que el tercer control sea negativo, se confirma la ausencia de infección congénita.
RESULTADOS
En el HULP hay descritos cinco casos de recién nacidos de madres con EC, en seguimiento por el Servicio de Microbiología, sin que se haya demostrado la transmisión vertical.
Las edades de las pacientes están comprendidas entre los 25 y los 40 años, con una media de edad de 32 años. Todas son de nacionalidad boliviana. En cuanto a los antecedentes familiares de EC, existe constancia de que una de las pacientes tenía un hermano afecto de dicha enfermedad y, en otro caso, varios familiares estaban afectos. No aparecen datos en las historias clínicas sobre los antecedentes personales de las otras tres pacientes.
No existen muchos datos sobre la historia personal de la enfermedad. En todos los casos, los datos que existen van a favor de que la enfermedad se encuentra en una fase crónica y asintomática en el momento del embarazo. Sólo hay constancia de que una paciente hubiera recibido tratamiento.
En cuanto a los antecedentes gineco-obstétricos, tres de las cinco pacientes habían tenido abortos previos (uno o dos). Otras dos eran nulíparas y las otras tres habían tenido dos o tres embarazos con partos a término con pesos de los recién nacidos superiores a los 3.000 gramos. No existían, por lo tanto, antecedentes de prematuridad ni de bajo peso al nacer.
Analizando los datos del seguimiento ecográfico, no se demostraron alteraciones ecográficas graves. En un caso, en la semana 20 se observaron quistes de plexos coroideos bilaterales, por lo que se aconsejó la realización de una cordocentesis para estudio del cariotipo fetal con resultado 46XY, normal. En otro caso se observó un oligoamnios moderado en la semana 29 y la paciente permaneció en reposo con diagnóstico de sospecha de bolsa rota que no llegó a confirmarse. En un tercer caso, el seguimiento ecográfico demostró un feto grande para la edad gestacional (con un CA > 40s en la semana 35), sin otras alteraciones.
En cuanto a la edad gestacional en el momento del parto, en los cinco casos los partos se han producido a término. Los pesos de los recién nacidos estuvieron, en todos los casos, por encima de los 3.000 gramos.
Sobre los datos de seguimiento de los hijos, no se ha podido demostrar en ningún caso la existencia de transmisión vertical. El seguimiento sólo se ha finalizado en tres de los casos, los otros dos todavía están pendientes del resultado de las serologías a los nueve meses del nacimiento. En un caso se identificaron anticuerpos en sangre, pero se interpretaron como de origen materno. Un niño está siendo controlado en otro centro, pero los controles para detectar transmisión vertical han permanecido negativos durante todo el seguimiento. En la Tabla I se presentan resumidos los antecedentes demográficos y perinatales de los casos.
DISCUSIÓN
La enfermedad de Chagas (EC) es una infección parasitaria crónica y sistémica causada por el Trypanosoma Cruzi. Es endémica en América. Causa entre 45.000 y 50.000 muertes al año. La mayor prevalencia se observa en Bolivia, con un 8,26% personas afectadas, seguido de Argentina y Paraguay con prevalencias de 4,47% y 4,46% respectivamente (3). Estos datos concuerdan con los encontrados en este estudio, ya que todas nuestras pacientes eran de nacionalidad boliviana. En cuanto a la clínica, se pueden distinguir dos fases (4):
Fase aguda: desde el momento de la inoculación hasta 1 ó 2 meses después, siendo más prolongada cuando el parásito se transmite por transfusión sanguínea. Cursa de manera asintomática o con signos y síntomas leves como fiebre, fatiga, cefalea, pérdida de apetito, diarrea, vómitos, hepatoesplenomagalia o aparición de una lesión cutánea característica llamada chagoma.
Fase crónica: el 98% de los infectados se diagnostican en esta etapa. Existen 4 formas clínicas:
Indeterminada: asintomática. Puede durar desde varios años hasta toda la vida. Entre el 50 y el 70% de los infectados se encuentran en esta forma clínica y, de éstos, el 30-50% evolucionan a formas clínicas sintomáticas.
Cardiaca: aparece en dos tercios de las personas con sintomatología. Puede provocar complicaciones como muerte súbita, miocardiopatía, insuficiencia cardiaca y alteración de la frecuencia cardiaca.Digestiva: aparece en un tercio de los pacientes sintomáticos. Las principales complicaciones son el megaesófago y el megacolon.
Neuronal: es la forma menos frecuente. Se asocia a estados de inmunodepresión.
Todas las pacientes de nuestro estudio se encontraban en una fase crónica de la enfermedad y permanecían asintomáticas. Existen varias vías de transmisión (5):
Vectorial: es la principal. A través de insectos hemípteros hematófagos (triatoma infestans) que se contaminan al picar a un animal o persona infectada. La infección se propaga a los seres humanos cuando un insecto infectado deposita heces en la piel, de tal manera que, cuando la persona se frota las picaduras, introduce las heces en la herida. Estos vectores sólo existen en países endémicos.Vertical: la segunda vía según orden de importancia. Da lugar a infección crónica. Puede transmitirse desde madres con infección aguda o crónica al feto (6).
Hemotransfusión o donación de órganos: procedentes de personas infectadas. Causan cuadros atípicos fulminantes.
Oral: por ingestión de alimentos contaminados con materia fecal de los vectores infectados.
Accidentes de laboratorio: por manipulación de vectores, cultivos de T. Cruzi o material biológico contaminado.
Manejo de animales contaminados. El diagnóstico de la enfermedad de Chagas puede realizarse tanto mediante pruebas de laboratorio, como demostrando la presencia del parásito. Para poder realizar un diagnóstico adecuado es importante tener información sobre la etapa de la enfermedad que se sospecha: en la etapa aguda el diagnóstico debe ir encaminado a detectar el parásito, mientras que en la etapa crónica las pruebas diagnósticas se dirigirán hacia la determinación de anticuerpos (7).
Diagnóstico parasitológico: Tradicionalmente, la detección de T. Cruzi se realiza mediante la observación de tripomastigotes en una muestra de sangre, ya sea en un examen en fresco, o mediante gota gruesa teñida con Giemsa o después de realizar la prueba de Strout (4). Cuando la parasitemia es baja, es necesario recurrir a técnicas que permitan amplificar la presencia del parásito, como el xenodiagnóstico y el cultivo en medio NNN. Otra opción diagnóstica es la inoculación en ratones, que, aunque se emplea básicamente en investigación, también se ha utilizado con éxito para el diagnóstico en casos agudos y en pacientes agudos con infección por VIH (5). La detección de antígeno en orina y suero mediante ELISA se ha descrito con resultados prometedores (8,9,10). En los últimos años, la detección de ADN mediante PCR se ha convertido en la alternativa más accesible. Aunque requiere un tiempo mayor al empleado en una observación directa, es menor que el que se necesita para la detección de la presencia de parásitos mediante xenodiagnóstico y hemocultivo (11).
Diagnóstico serológico: Se basa en la determinación de inmunoglobulinas tipo G totales anti-T Cruzi. Este tipo de diagnóstico no ha alcanzado el 100% de sensibilidad en ningún ensayo, por lo que, para establecer un diagnóstico serológico de certeza es necesario la concordancia de, por lo menos, dos técnicas de distinto principio y antígenos diferentes. Cuando los resultados son discordantes, es necesario realizar otras pruebas de confirmación y diagnóstico diferencial con otras enfermedades (1).
En las pacientes de este estudio se realizó un diagnóstico serológico, ya que todas ellas se encontraban en una fase crónica de la enfermedad. En el caso de la infección congénita, el diagnóstico del recién nacido es complicado debido a los bajos niveles de parasitemia y a la persistencia de anticuerpos maternos. Es por esto que en el protocolo propuesto por el Grupo de Trabajo de Chagas de la CAM las pruebas diagnósticas que se realizan en el momento del nacimiento y al mes de vida consisten en determinación de parásitos mediante microhematocrito y PCR, realizándose serologías únicamente a los nueve meses junto con la determinación de PCR (8).
La transmisión materno-fetal de la enfermedad de Chagas ocurre por vía transplacentaria y depende de la parasitemia y del nivel de inmunidad materna. El parásito llega al feto por diseminación hematógena atravesando la placenta (12). La infección por T. Cruzi puede ser causa de aborto, se ha observado que el aborto espontáneo es más frecuente en las mujeres chagásicas (13). En este estudio, tres de las cinco pacientes habían presentado abortos previos.
Las afecciones que aparecen con más frecuencia en los hijos infectados son el bajo peso al nacimiento y prematuridad. Sin embargo, muchos hijos de madres con enfermedad de Chagas permanecen asintomáticos (14,15). Ninguno de los neonatos de nuestra muestra presentaron bajo peso al nacer, siendo sus pesos en todos los casos superiores a los 3.000 gramos. Tampoco hubo ningún caso de prematuridad, ni en éste embarazo ni en las gestaciones anteriores de las pacientes.
A nivel placentario el parásito puede producir granulomas, cambios inflamatorios y necrosis de las vellosidades coriales. Si se produce una afectación grave de la misma puede producirse la muerte fetal intrauterina o desencadenarse un parto prematuro, no obstante, la presencia de cambios histológicos a nivel placentario no siempre es sinónimo de afectación fetal (16).
La transmisión materno-fetal es más frecuente si la madre se infecta en el tercer trimestre de la gestación y si la enfermedad se encuentra en fase indeterminada o crónica (17). En los casos de este estudio, a pesar de que todas las pacientes se encontraban en una fase crónica, hasta hoy, no se ha podido confirmar que haya existido transmisión vertical.
La enfermedad de Chagas congénita suele ser más grave en los lactantes. En los países donde esta enfermedad es endémica es un factor importante de mortalidad infantil. Hay varias formas clínicas: prematuridad o bajo peso, síndrome hepatoesplenomegálico, fiebre, edemas e ictericia. La forma meningoencefálica cursa con convulsiones, rigidez y vómitos. Por lo general, no suelen observarse signos de afectación cardiaca.
En cuanto al tratamiento, en la fase aguda, existen tres fármacos que se pueden utilizar para el tratamiento de la enfermedad de Chagas (12). El nifurtimox y el benznidazol han demostrado reducir la severidad de la fase aguda de la enfermedad, pero no tienen gran impacto sobre la progresión a la fase crónica. Las pautas de administración son las siguientes: Benznidazol: 5-7 mg/kg/d vo en dos dosis durante 30-90 días; Nifurtimox: 8-10 mg/kg/d vo en 2-3 dosis durante 90-120 días. El alopurinol es tan efectivo como los dos anteriores.
En la fase crónica el tratamiento debe ir encaminado al manejo de las complicaciones (implantación de marcapasos, cirugía para tratar la afectación cardíaca, el megaesófago y megacolon). Existe controversia sobre la eficacia del tratamiento en esta fase, existiendo básicamente dos trabajos a favor del tratamiento en la fase crónica. Según el estudio de Urbina (18), es eficaz para frenar la evolución de la enfermedad en todas sus fases, evitando las consecuencias a largo plazo. Viotti (19), afirma que reduce el riesgo de cardiopatía y negativiza las pruebas serológicas en la enfermedad indeterminada y crónica. La efectividad del tratamiento depende de la rapidez con que éste se inicie, siendo más efectivo cuando comienza durante los primeros meses de vida (21). No se debe prescribir el tratamiento durante el embarazo por los efectos teratogénicos del mismo. Se ha comprobado la transmisión a través de la leche materna, por lo que estaría contraindicada la lactancia.
Teniendo en cuenta las características de la enfermedad, en nuestro entorno, la probabilidad de detectar casos agudos es baja (12). El insecto vector no existe en España, por lo que la forma en la que pueden aparecer es debido al creciente volumen de inmigrantes procedentes de Latinoamérica. Actualmente, en España residen más de 4,5 millones de inmigrantes, de los que un millón y medio son latinoamericanos (4% de la población española) que proceden fundamentalmente de Ecuador (34,5%), Colombia (18,7%), Argentina (10,6%), Bolivia (6,8%) y Perú (5,9%). En nuestro país residen, aproximadamente, unos 100.000 bolivianos (3).
Los recién nacidos de madres lationamericanas seropositivas pueden cursar también la etapa aguda de la enfermedad. En España, las mujeres embarazadas infectadas procedentes de países endémicos se encuentran en la etapa crónica de la infección. El diagnóstico, manejo y tratamiento de esta población permitirán controlar y reducir la transmisión vertical. Por ello, el cribado serológico de gestantes procedentes de zonas endémicas es fundamental para realizar un diagnóstico precoz de la infección congénita. La detección en las embarazadas infectadas constituye una estrategia importante para realizar una búsqueda activa de las embarazadas infectadas, de los recién nacidos afectos y la instauración precoz del tratamiento específico (20).
CONCLUSIONES
Debido al creciente volumen de población inmigrante procedente de áreas en las que la enfermedad de Chagas es endémica, se está produciendo un aumento de casos de enfermedad de Chagas congénita en nuestro medio. El tamizaje sistemático de la enfermedad en gestantes procedentes de dichas áreas es fundamental para la detección de las embarazadas infectadas. La detección de gestantes infectadas es el mejor medio para llegar al diagnóstico precoz de infección congénita en el recién nacido y establecer así un tratamiento en fases tempranas de la enfermedad, de manera que éste sea más efectivo.
BIBLIOGRAFÍA
1. OMS. Control sobre la enfermedad de Chagas. Ginebra: WHO Press; 2003.
2. OMS. Reporte sobre la enfermedad de Chagas. Buenos Aires-Argentina; 2007.
3. Documento de consenso de recomendaciones para el control de la infección por Trypanosoma Cruzi/ Enfermedad de Chagas en gestantes latinoamericanas. Grupo de trabajo de la CAM. 2008.
4. Flores-Chavez M, Fuentes I, Gárate T, Cañavete C. Diagnóstico de laboratorio de la enfermedad de Chagas importada. Enferm Infec Microbiol Clin 2007;25 Supl 3:29-37.
5. Freilig HC, Corral RS, Katzin AM, Gisnstein S. Antigenuria in infants with acute and congenital Chagas’ disease. J Clin Microbiol 1987;25:133-7.
6. Carlier Y. Factors and mechanisms involved in the transmission and development of congenital infection with Trypanosoma cruzi. Rev Soc Bras Med Trop 2005;38 Suppl 2:105-7.
7. Diez CN, Manattini S, Zanuttini JC, Bottasso O, Marcipar I. The value of molecular studies for the diagnosis of congenital Chagas disease in northeastern Argentina. Am J Trop Med Hyg 2008;78(4):624-7.
8. Riera C, Guarro A, Kassab HE, Jorba JM, Castro M, Angrill R, Gállego M, Fisa R, Martin C, Lobato A, Portús M. Congenital transmission of Trypanosoma Cruzi in Europe (Spain): a case report. Am J Trop Med Hyg 2006;75(6):1078-81.
9. Coelho JS, Soares IS, Lemos EA, Jimenez MC, Kudó ME, Moraes SL, Ferreira AW, Sanchez MC. A multianalyte Dot-ELISA for simultaneous detection of malaria, Chagas disease, and syphiklis-specific IgG antibodies. Diagnostic Microbiology and Infections Disease 2007;58(2):223-30.
10. Leiby DA, Wendel S, Takaoka DT, Fachini RM, Oliveira LC, Tibbals MA. Serologic testing for Trypanosoma cruzi: Comparison on radioinmunoprecipitation. Assay with commercially available indirect inmunofluorescence assay, indirect hemagglutination assay and enzyme-linked immunesorbent assay kits. J Clin Microbiol 2000;38(2):639-42.
11. Sosa-Estani S, Gamboa-León MR, Del Cid-Lemus J, Althabe F, Alger J, Almendares O, Cafferata ML, Chippaux JP, Dumonteil E, Gibbons L, Padilla-Raygoza N, Schneider D, Belizán JM, Buekens P; Working Group. Use of a rapid test on umbilical cord blood to screen for Trypanosoma cruzi infection in pregnant women in Argentina, Bolivia, Honduras, and Mexico. Am J Trop Med Hyg 2008;79(5):755-9.
12. Buekens P, Almendares O, Carlier Y, Dumonteil E, Eberhard M, Gamboa-Leon R, James M, Padilla N, Wesson D, Xiong X. Mother-to-child transmission of Chagas’ disease in North America: why don’t we do more? Matern Child Health J. 2008;12(3):283-6.
13. Torrico F, Alonso-Vega C, Suárez E, Rodríguez P, Torrico MC, Damarix M, et al. Maternal Trypanosoma Cruzi infecion: pregnancy outcome,morbidity and mortality of congenitally infected and non-infected newborns in Bolivia. Am J Trop Med Hyg 2004;70:201-9.
14. Schijman A. Congenital Chagas Disease. Congenital and other related infection diseases of the newborn. New York. Elsevier, 2006; p233-58.
15. Torrico F, Castro M, Solano M, Rodriguez P, Torrico MC, Truyens C, Carlier Y. Effects of maternal infection with Trypanosoma cruzi in pregnancy development and in the newborn infant. Rev Soc Bras Med Trop 2005;38:Suppl 2:73-6.
16. Muñoz J, Portús M, Corachan M, Fumadó V, Gascon J. Congenital Trypanosoma cruzi infection in a non-endemic area. Trans R Soc Trop Med Hyg 2007;101(11):1161-2.
17. Torrico F, Vega CA, Suarez E, Tellez T, Brutus L, Rodriguez P, et al. Are materna re-infections with Trypanososma cruzi associated with higher morbidity and mortality of congenital Chagas disease? Trop Med Int Health 2006;11(5):628-35.
18. Urbina JA, Docampo R. Specific chemoterapy o Chagas disease: controversies and advances. Trends Parasitol 2003;19(11):495-501.
19. Viotti R., Vigliano C., Lococo B., Bertocchi G., Petti M. Alvarez MG., Postan M., Armenti A. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nontrandomized trial. Ann Intern Med. 2006;144(10):724-34.
20. Okumura M, Aparecida dos Santos V, Camargo ME, Schultz R, Zugaib M. Prenatal diagnosis of congenital Chagas’ disease (American trypanosomiasis). Prenat Diagn 2004;24(3):179-81.