2015
3
Autores:
José Manuel Mayorga Torres1, Beatriz Peña1, Ángela Cadavid1
Instituciones:
1Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Colombia.
Tipo de documento:
Casos ClínicosLA IMPORTANCIA CLÍNICA DEL ADN ESPERMÁTICO EN EL ANÁLISIS SEMINAL COTIDIANO
Contenido del documento:
RESUMEN
El objetivo de este reporte es resaltar la importancia de las pruebas funcionales para evaluar la calidad seminal durante el análisis seminal de rutina. Se analizó mediante citometría de flujo el potencial mitocondrial, la integridad de la membrana espermática, la producción de especies reactivas del oxígeno y la suceptibilidad de fragmentación del ADN espermatico, en un paciente que consultó por infertilidad al Grupo Reproducción de la Universidad de Antioquia. Se encontró una producción basal de especies reactivas del oxígeno junto con una actividad mitocondrial alto y un porcentaje elevado de espermatozoides con su membrana plasmatica integra, siendo estos indicadores de una buena calidad espermática; no obstante, se observó una elevada suceptibilidad de fragmentación del material genetico (DFI=42%). A pesar que un hombre aparentemente manifiesta características espermáticas de un individuo sano puede que la calidad del material genético de sus espermatozoides esté incidiendo sobre su éxito reproductivo.
PALABRAS CLAVE: Fertilidad, espermatozoide, ADN
SUMMARY
The aim of this report is highlighting the importance of functional tests to evaluate semen quality during routine semen analysis.Mitochondrial function, membrane integrity, intracellular reactive oxygen species production and sperm DNA fragmentation were evaluated by flow cytometry in a infertil patient from Reprodcution Group at the University of Antioquia.A basal production of reactive oxygen species and mitochondrial activity, and a high percentage of sperm with integrated plasma membrane was found, all indicators of good sperm quality; however, a high susceptibility of genetic material fragmentation (DFI=42%) was observed. Although a men apparently manifested sperm characteristics of a healthy individual may that the quality of genetic material in the spermcells is impacting on their reproductive success.
KEY WORDS: Fertility, spermatozoa, DNA
INTRODUCCIÓN
La infertilidad es definida como la incapacidad de lograr un embarazo clínico depués de 12 o más meses de actividad sexual sin tomar medidas anticonceptivas (1). Para el año 2010 se estimó que 48,5 millones de parejas erán infértiles en el mundo, con tendencia al aumento (2). De otro lado, cada día las pruebas funcionales espermáticas (3,4) toman más importancia en la evaluación clínica de los individuos que consultan por infertilidad. Si bien la Organización Mundial de la Salud (OMS)
(5) mediante la publicación de sus manuales para el análisis de muestras seminales intentan mejorar la estandarización de los procedimientos para el procesamiento de muestras de semen (6-8), estos siguen siendo poco predictivos del éxito reproductivo y es por este motivo que cada día se hace más necesario incluir las pruebas funcionales (4,9-13) en la evaluación seminal de rutina, con el fin de obtener más información sobre el contexto biológico reproductivo del hombre, como: i) evaluación del ADN espermático, ii) potencial de membrana mitocondrial, iii) producción de especies reactivas de oxígeno, y iv) integridad de la membrana plasmática. El objetivo del presente reporte de caso es contrastar las características espermáticas convencionales y funcionales, sugiriendo que existen diferentes aproximaciones metodologicas capaces de explicar algunas causas de infertilidad idiopática.
Caso clínico
Se reporta el caso de un hombre de 45 años, aparentemente sano sin varicocele, que consultó por llevar un año buscando un embarazo sin éxito con su pareja. Se realizó un espermograma completo, bajo los lineamientos del manual de la OMS para el procesamiento y análisis de semen humano del año 2010 (6,8). Además, mediante citometría de flujo se evaluaron la producción intracelular de especies reactivas del oxígeno (ERO) espermáticos, el potencial de membrana mitocondrial (PMM), la integridad de la membrana plasmática (espermatozoides vivos/muertos) y el análisis de integridad de la cromatina espermática (SCSA). Los datos se analizaron usando el software WinMDI (Scripps Research Institute, La Jolla, CA, USA) y cada variable fue expresada como la intensidad media de fluorescencia del compuesto o el porcentaje de células positivas para cada población celular evaluada.
RESULTADOS
El examen seminal convencional fue normal. Todos los valores se encuentran por encima del límite inferior de referencia reportado por la OMS en 2010 (6,8): volumen 2 mL, pH 8.0, viabilidad 98%, concentración 73 x 106, movilidad tipo I: 40%, tipo II: 9% y tipo III: 51%.
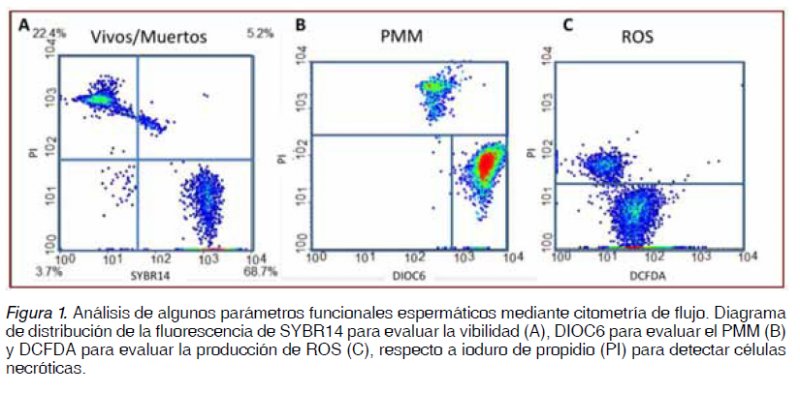
El analisis del PMM de la muestra en fresco muesta que el 79% de los espermatozoides presentaron un PMM alto y el 69% de los espermatozoides presentaban intacta su membrana, estas dos pruebas estan asociadas a la movilidad y viabilidad espermática, respectivamente (Figura 1).
Al evaluar la producción de ERO intracelular se encontró 60 unidades relativas de intensidad media de fluorescencia, un valor basal considerado como moderado de producción de ERO (Figura 2).
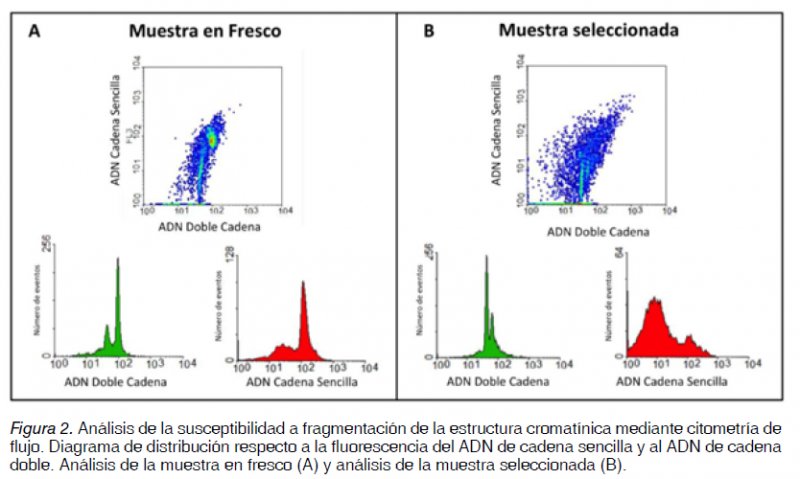
Finalmente, al analizar la integridad de la cromatina espermática de la muestra en fresco se encontró un valor de 42% del índice de fragmentacion del ADN (DFI), indicando que existe una mayor suceptibilidad de daño en el ADN espermático; este valor es alto respecto al ≥30% sugerido en 1999 por Evenson y cols (14), y puede estar relacionado con alteraciones en la fertilidad. Después de realizar una selección espermática mediante un gradiente de densidad, el valor se redujo a 21%, lo que sugiere que los espermatozoides seleccionados además de ser los más móviles, presentan caracteristicas de menor daño del ADN.
DISCUSIÓN
En el presente reporte de caso se observa un análisis seminal convencional sin alteración en los parámetros, sin embargo, los parámetros funcionales presentaron valores alterados. Por lo tanto, el valor predictivo del análisis de rutina se ve reducido al denominar a un individuo con características normales. Probablemente, un gran número de hombres poseen parámetros seminales por encima del límite inferior de referencia reportado por la OMS y son catalogados como normozoospérmicos, sin tener en cuenta otros análisis. Por lo tanto, este reporte ratifica la importancia de la evaluación de la integridad del material genético, junto con otras pruebas funcionales como marcadores fisiológicos del espermatozoide y de la calidad seminal.
Los niveles de ERO estan directamente relacionadas con la funcionamiento de las células germinales masculinas como moléculas involucradas en la señalización y activación de procesos celulares e incidiendo en su capacidad fecundante; sin embargo, debido a su alta reactividad éstas pueden dar origen a efectos negativos al generar un desbalance en el estado redox (reducción/oxidación) espermático. Los espermatozoides son suceptibles al ataque por parte de los ERO y se ha correlacionado con la disminución en la movilidad, la lipoperoxidación de la membrana, el daño en el ADN y la alteración en la capacidad fecundante (15-18), sin embargo estos parámetros no varían durante la eyaculacion diaria durante dos semanas (19).
Adicionalmente, se ha asociado la integridad en el ADN con alteraciones en la fertilidad tanto in vivo como in vitro (20-21), demostrando que alteraciones en el ADN estan asociados con menores tasas de fecundación e incrementos de pérdidas del embarazo (11,12, 22, 23).
CONCLUSIÓN
Realizar las evaluaciones funcionales propuestas en este reporte permitiría tomar decisiones sobre las medidas terapéuticas, con el fin de mejorar la calidad seminal e incrementar la probabilidad de embarazo, además de incrementar el conocimiento sobre el estado funcional y biológico de los espermatozoides.
BIBLIOGRAFÍA
1. Zegers-Hochschild F, Adamson GD, de Mouzon J, Ishihara O, Mansour R, Nygren K, et al. International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology, 2009. Fertil Steril 2009;92(5):1520-4.
2. Mascarenhas MN, Flaxman SR, Boerma T, Vanderpoel S, Stevens GA. National, regional, and global trends in infertility prevalence since 1990: a systematic analysis of 277 health surveys. PLoS Med 2012;9(12):e1001356.
3. Cardona Maya WD, Berdugo Gutierrez JA, de los Rios J, Cadavid Jaramillo AP. Functional evaluation of sperm in Colombian fertile men. Arch Esp Urol 2007;60(7):827-31.
4. Mayorga-Torres BJ, Cardona-Maya W, Cadavid A, Camargo M. Evaluación de los parámetros funcionales espermáticos en individuos infértiles normozooespermicos. Actas Urológicas Españolas 2013;37(4):221-7.
5. De Iuliis GN, Thomson LK, Mitchell LA, Finnie JM, Koppers AJ, Hedges A, et al. DNA damage in human spermatozoa is highly correlated with the efficiency of chromatin remodeling and the formation of 8-hydroxy- 2′-deoxyguanosine, a marker of oxidative stress. Biol Reprod 2009;81(3):517-24.
6. Cardona Maya W. Manual de procesamiento de semen humano de la Organizacion Mundial de la Salud-2010. Actas Urológicas Españolas 2010;34(7):577-8.
7. WHO. WHO Laboratory manual for the examination of human semen and sperm-cervical mucus interaction: WHO 1999.
8. WHO. WHO laboratory manual for the examination and processing of human semen: WHO 2010.
9. Cardona Maya W. Comentarios sobre el artículo “Evaluación de las técnicas de capacitación espermática y su efecto en la fragmentación del ADN». Rev Colomb Obstet Ginecol 2012;63:390-1.
10. Gil-Villa AM, Cardona-Maya W, Agarwal A, Sharma R, Cadavid A. Role of male factor in early recurrent embryo loss: do antioxidants have any effect? Fertil
Steril 2009;92(2):565-71.
11. Gil-Villa AM, Cardona-Maya W, Agarwal A, Sharma R, Cadavid A. Assessment of sperm factors possibly involved in early recurrent pregnancy loss. Fertil Steril 2010;94(4):1465-72.
12. Rodriguez E, Gil-Villa AM, Aguirre-Acevedo DC, Cardona-Maya W, Cadavid AP. Evaluación de parámetros seminales no convencionales en individuos cuyas parejas presentan muerte embrionaria temprana recurrente: en busca de un valor de referencia. Biomedica 2011;31(1):100-7.
13. Cadavid JA, Alvarez A, Markert UR, Cardona Maya W. Differential protein expression in seminal plasma from fertile and infertile males. J Hum Reprod Sci
2014;7(3):206-11.
14. Evenson D, Jost L, Marshall D, Zinaman M, Clegg E, Purvis K, et al. Utility of the sperm chromatin structure assay as a diagnostic and prognostic tool in the human fertility clinic. Hum Reprod 1999;14(4):1039-49.
15. Twigg J, Irvine DS, Houston P, Fulton N, Michael L, Aitken RJ. Iatrogenic DNA damage induced in human spermatozoa during sperm preparation: protective significance of seminal plasma. Mol Hum Reprod 1998;4(5):439-45.
16. Agarwal A, Said TM. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod Update 2003;9(4):331-45.
17. Oehninger S, Blackmore P, Mahony M, Hodgen G. Effects of hydrogen peroxide on human spermatozoa. J Assist Reprod Genet 1995;12(1):41-7.
18. du Plessis S, McAllister D, Luu A, Savia J, Agarwal A, Lampiao F. Effects of H2O2 exposure on human sperm motility parameters, reactive oxygen
species levels and nitric oxide levels. Andrologia 2010;42(3):206-10.
19. Mayorga-Torres BJM, Camargo M, Agarwal A, du Plessis SS, Cadavid AP, Cardona Maya WD. Influence of ejaculation frequency on seminal parameters. Reprod Biol Endocrinol 2015;13:47. doi:10.1186/ s12958-015-0045-9.
20. Muriel L, Garrido N, Fernández JL, Remohí J, Pellicer A, de los Santos MJ, et al. Value of the sperm deoxyribonucleic acid fragmentation level, as measured by the sperm chromatin dispersion test, in the outcome of in vitro fertilization and intracytoplasmic sperm injection. Fertil Steril 2006;85(2):371-83.
21. Schulte RT, Ohl DA, Sigman M, Smith GD. Sperm DNA damage in male infertility: etiologies, assays, and outcomes. J Assist Reprod Genet. 2010;27(1):3-12.
22. Carrell D, Liu L, Peterson C, Jones K, Hatasaka H, Erickson L, et al. Sperm DNA fragmentation is increased in couples with unexplained recurrent pregnancy loss. Arch Androl 2003;49(1):49-55.
23. Kumar K, Deka D, Singh A, Mitra D, Vanitha B, Dada R. Predictive value of DNA integrity analysis in idiopathic recurrent pregnancy loss following spontaneous conception. J Assist Reprod Genet 2012;29(9):861-7.