2006
5
Autores:
Omar Nazzal N.1, Eugenio Suárez P.1, Raúl Larraguibel P.1, Luciano Rojas F.1, Alessandro Bronda M.1
Instituciones:
1Servicio y Departamento de Obstetricia y Ginecología, Hospital Clínico San Borja Arriarán, Facultad de Medicina, Universidad de Chile.
Tipo de documento:
DocumentosLesiones preinvasoras de cuello uterino. Una visión actual.
Contenido del documento:
INTRODUCCIÓN
El cáncer cérvico-uterino es el segundo cáncer más frecuente en la mujer en el mundo, representando cerca del 10% de todos los cánceres en la mujer. En el 2002, se han estimado alrededor de 493.000 nuevos casos de cánceres invasores de cuello uterino, siendo cerca del 83% de los casos diagnosticados en los países en vías de desarrollo (1). Las regiones con mayor riesgo de cáncer cérvico-uterino incluyen el sur y este de África, el Caribe, Centroamérica y algunos países de Latinoamérica, donde la incidencia anual excede los 30 por 100.000 mujeres (2). Cada año se estima que 273.000 mujeres fallecen de cáncer cérvico-uterino, sobre tres cuartas partes de ellos en países en vías de desarrollo. Las tasas de incidencia y mortalidad generalmente se relacionan la una con la otra. Menos del 50% de las mujeres diagnosticadas con cáncer invasor en los países en vías de desarrollo, sobreviven más de 5 años y muchas de las víctimas son habitualmente mujeres jóvenes en edad fértil. En contraste en los países desarrollados donde la sobrevida alcanza cifras del 66% a 5 años.
En Chile, alrededor de 1.200 nuevos casos de cáncer cérvico-uterino fueron diagnosticados en el año 2003, y se produjeron 677 muertes (8,4/100.000) (3-5). Constituyendo en nuestro país la quinta causa de muerte por cáncer en la mujer demostrando un descenso progresivo en los últimos 17 años. En Europa, la incidencia estimada promedio es de 15,7/100.000 mujeres, y fallecen aproximadamente 80 mujeres cada día (6). En Chile fallecen aproximadamente dos mujeres al día por esta enfermedad (3).
ROL DEL VIRUS PAPILOMA HUMANO (VPH)
Infección por VPH oncogénico: un prerrequisito para el cáncer cérvico-uterino. Hoy en día es claro que los subtipos de alto riesgo del virus papiloma son los responsables de las lesiones precancerosas y del cáncer cérvico-uterino (7). La infección persistente por VPH es considerada casi un estado intermedio en la vía hacia el carcinoma cérvico-uterino invasor (8-10). Esto constituye una situación única en oncología: ningún otro cáncer tiene una relación de causalidad tan bien establecida con un virus. Es más en comparación con otros factores de riesgo bien conocidos para cáncer en el hombre, tales como el tabaco (cáncer de pulmón) y el virus de la Hepatitis B (cáncer de hígado), el riesgo asociado al virus papiloma es mucho más alto. El riesgo relativo es alrededor de 10 para fumar y cáncer de pulmón, 50 para el cáncer de hígado y virus hepatitis, y entre 300-400 para cáncer de cuello y VPH (7,9,10).
Historia natural de la infección por VPH. A partir de fines los años 60 y comienzos de los 70 los estudios epidemiológicos han proveído abundante información que sugería que el cáncer cérvico-uterino se transmitía a través de la actividad coital, poniendo énfasis en un posible agente infeccioso como relevante en la etiología de la enfermedad. Inicialmente la evidencia apuntó al Virus Herpes Simple, se han involucrado también a la Neisseria, Clamydia, Citomegalovirus, Tricomonas y otros agentes infecciosos; sin embargo desde el inicio de los 80 la atención gradualmente se fue enfocando en un nuevo candidato, el virus papiloma humano, basado en la rápida evidencia acumulada a través de estudios epidemiológicos, clínicos y de biología molecular (11,12). La asociación es independiente de la población estudiada, del método de detección viral utilizado y satisface todos los criterios de causalidad comúnmente empleados (consistencia, temporalidad, coherencia y evidencia experimental) (8,13,14,15).
Sin embargo, la infección por VPH se sabe que es muy común en la población sexualmente activa; se ha estimado que hasta un 60% de las mujeres y hombres se han expuesto al menos una vez al virus durante su vida. La exposición a estos virus ocurre durante el contacto sexual, siendo la adolescencia el período de mayor exposición, habitualmente con sus primeras parejas. La prevalencia de la infección viral es de alrededor de un 30% antes de los 30 años de edad, cayendo gradualmente a cerca de un 10% entre los 30 y 50 años, y a menos de un 5% en las mayores de 50, aunque algunos estudios revelan un segundo pico de prevalencia en estas mujeres, así como también una mayor tasa de persistencia (16,17).
La lista actual de serotipos de VPH que guardan relación con cáncer cérvico-uterino incluye 15 de alto riesgo: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82; 3 de posible alto riesgo: 26, 53 y 66, y 12 de bajo riesgo: 6, 11, etc. Los subtipos 16 y 18 han sido identificados como los más prevalentes en el cáncer cérvico-uterino, alcanzando esta relación hasta un 66% (18). El DNA viral se identifica en el 99,7% de los casos de canceres invasores. Los casos restantes se han interpretado como falsos negativos de las pruebas empleadas (7,8,12,18).
La mayoría de las mujeres expuestas al virus papiloma desarrollan una inmunidad natural limitada, y en general se hacen negativas en un plazo variable de hasta 24 meses. El tiempo necesario para que el 50% de los casos prevalentes se tornaran negativos a DNA viral fue en promedio de 4,8 meses en los virus de bajo riesgo y entre 8,1 y 16 meses en los de alto riesgo (9,10,19,20,22, 23). Por otra parte, el virus puede persistir por meses e incluso años en un 10 a 20% de las mujeres que son aquellas que potencialmente irán a desarrollar una lesión intraepitelial o un cáncer invasor a menos que sean oportunamente diagnosticadas y tratadas. De esta manera la historia natural de la enfermedad refleja una falla del sistema inmunológico para controlar el virus localmente, situación que es mucho más frecuente con los subtipos 16 y 18 (10,12,20,21,22,23).
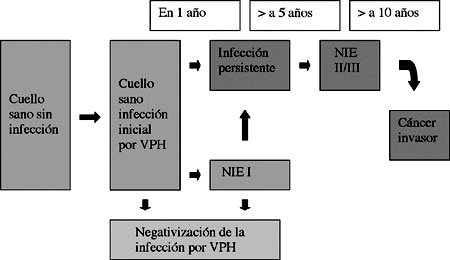
Un modelo simplificado de la carcinogénesis cervical se presenta en la Figura 1.
La infección por VPH es generalmente transiente en la mujer menor a 30 años, pero tiende a ser persistente después de esa edad (23,24,25). Los subtipos 16 y 18 se incluyen entre los más persistentes. Así la presencia del virus puede o no estar asociada con lesiones clínicas, de hecho las infecciones subclínicas suelen ser 10 a 30 veces más frecuentes que las citológicamente evidentes (26). En contraste, la persistencia del DNA viral más allá de 12 a 18 meses es predictor de riesgo de futuras lesiones intraepiteliales, especialmente en caso de infecciones por virus 16 ó 18 (14, 27-30).
Un evento clave en la historia natural de la enfermedad, es la integración del DNA viral al genoma del huésped (31,32). Dicho proceso sería irreversible y desencadenaría la inmortalidad de la célula; la persistencia del virus y su posterior integración al genoma celular, son factores determinantes en la inestabilidad genómica. Tres aspectos son los que principalmente están involucrados en este proceso, el primero: la proteína E6 de los virus oncogénicos genera una degradación del gen supresor p53 y así interfiere con la función apoptótica (32,33); el segundo: la proteína E7 induce desestabilización del complejo proteico del retinoblastoma y así permite a la célula evadir el control del ciclo mediado por pRb (34) y finalmente ambos genes inducen un desorden sustancial de las funciones mitóticas, interfiriendo la síntesis y su funcionamiento, generando un degradación de los cromosomas durante la mitosis y generando aberraciones tanto estructurales como numéricas (35).
Tipificación viral. La ocurrencia de lesiones intraepiteliales de alto grado (NIE II/III) y de cáncer cérvico-uterino invasor no puede ser posible sin la existencia previa de una infección persistente por subtipos de alto riesgo de virus papiloma humano (7,8,24) Esta simple, pero revolucionaria aseveración, llevó al desarrollo y evaluación de métodos sensibles y de aplicación clínica de detección del DNA viral (15,36-39).
La tipificación del DNA de virus de alto riesgo es un marcador muy sensible para mujeres en riesgo de neoplasia intraepitelial moderada y severa, así como de cáncer cérvico-uterino, sin embargo, el método tiene una menor especificidad que la citología convencional (37-40). Su utilización ha sido aprobado como método anexo al tamizaje citológico en mujeres mayores de 30 años (41,42), también para complementar el estudio de citologías atípicas de significado incierto (39,43) y en el seguimiento (curación o persistencia) de lesiones preinvasoras tratadas con métodos ablativos (44). También se ha planteado su uso, aunque sin alcanzar un consenso, en mujeres mayores de 50 años, con controles citológicos ordenados, como una forma de cerrar el tamizaje (45) y en mujeres sexualmente activas para conocer su status con respecto al virus e indicar una eventual vacunación (45).
El fundamento de la tecnología de sonda de DNA es el reconocimiento exquisitamente específico de secuencias de ácido nucleico blanco mediante secuencias complementarias de ácido nucleico sonda; las pruebas no amplificadas de baja sensibilidad se han abandonado a favor de las basadas en amplificación de blanco: reacción en cadena de la polimerasa (PCR), o de la señal: test de captura híbrida 2 (CH-2). Cabe destacar que estos métodos no son capaces de determinar si existe o no integración viral al genoma celular.
CH-2 es un test relativamente simple semi-automatizado, aprobado por la Food and Drug Administration (FDA) para detectar 13 serotipos de virus de alto riesgo y puede ser colectado desde una muestra tipo PAP convencional o de una citología de medio líquido (46). Es una prueba de amplificación de señal, que se basa en híbridos de RNA-DNA que son reconocidos por anticuerpos a RNA-DNA conjugados a fosfatasa alcalina; cada enzima fosfatasa alcalina reacciona con un sustrato quimioluminiscente para producir una corriente constante de fotones que se cuentan con un luminómetro, así las lecturas son transferidas a un programa donde los resultados son analizados y el número de híbridos inmovilizados puede ser expresado en un valor semi-cuantitativo (46).
Analizando ciertos puntos de interés en el enfoque clínico de la infección por virus papiloma en relación con el test de captura híbrida 2 (CH-2) podemos recalcar que posee un valor predictivo negativo muy alto (99%) (48), con sensibilidad entre 88 y 94% (49-52). Supera con frecuencia a laboratorios (PAP) de discreta calidad y que ofrece valores semi-cuantitativos de carga viral, todos ellos aparecen como fortalezas del método. Entre sus debilidades se puede señalar que, la especificidad es más baja que la del PAP, solo de 60% (51,53), lo que puede generar una sobrecarga en los niveles de diagnóstico y elevar los costos de los programas (36). Otro hecho significativo es que un resultado positivo, en presencia de una citología negativa, origina una inquietud psico-social de difícil manejo para el equipo de salud, frente a esta enfermedad de transmisión sexual que no posee tratamiento. No menos relevante es el hecho que el costo operacional final será muy superior al de un programa basado en el PAP. Finalmente, no se debe olvidar que el examen detecta la presencia del virus pero no su integración al genoma celular (54).
La reacción en cadena de polimerasa (PCR) es un ensayo selectivo de amplificación de blanco, capaz de incrementar en forma exponencial las secuencias de DNA viral presentes en un espécimen biológico. Puede teóricamente producir un billón de copias a partir de una simple doble hélice de DNA después de 30 ciclos de amplificación. La sensibilidad y la especificidad, pueden variar dependiendo del mecanismo de extracción de DNA utilizado. En general este procedimiento se considera engorroso y caro y su práctica es muy poco frecuente, en la clínica es más usado en protocolos de investigación (51,55).
EVALUACIÓN INICIAL DE UNA CITOLOGÍA ANORMAL
La implementación del sistema de Bethesda (55) para el reporte de las citologías, se generó en la necesidad de homogeneizar los informes ante situaciones médicas, técnicas y también médico legales. Como todo cambio inicialmente generó incomodidad, sin embargo, el hecho de que todos los laboratorios a nivel mundial pudiesen usar un lenguaje común hace su interpretación y referencia más fácil (Tabla I).
Actualmente con el paso del tiempo, sumado al conocimiento de la historia natural de la enfermedad y el rol que le cabe al VPH, se pueden diseñar planes para evaluar cada tipo de alteración citológica en particular. Los consensos obtenidos a partir de las reuniones de Bethesda responden casi todas las interrogantes que la citología plantea para su enfrentamiento, pero desafortunadamente no reflejan necesariamente las realidades regionales ni de cada país, así como tampoco las diferencias en sistemas de cobertura de salud. En vista de lo anterior, es que planteamos una revisión de dichos acuerdos, basados en nuestras condiciones demográficas, económica y de salud.
Evidentemente los mayores aportes y revisiones se enfocan al manejo de las citologías atípicas de significado incierto; ya que no sólo presentan un mayor número de posibles evaluaciones, sino que representan el mayor porcentaje de citologías alteradas.
Importancia de un frotis atípico. Una pregunta frecuente detrás de una citología alterada es ¿cuantas lesiones de alto grado subyacen detrás de esa alteración? Un frotis atípico de significado incierto, posee un riesgo de un 5 a 17% de LIE de alto grado. Si la paciente es positiva para VPH de alto riesgo, este sube a 17,7% en la evaluación inicial y puede aumentar en 8,8% más durante un período de seguimiento de dos años, alcanzando a 25% (una de cada cuatro pacientes con citología atípica de significado incierto VPH positiva) (56-59). Es de suma importancia, valorar la calidad del laboratorio y un índice para ello es el número de citologías atípicas, estas no deberían representar más de un 2,5% del universo total. Sin duda la judicialización de la medicina ha generado que en vista de disminuir los falsos negativos del método, estas cifras hayan incrementado su número disminuyendo de esa manera la especificidad de la citología (60-62).
El reporte de una citología atípica es difícil, ya que no corresponde a un diagnóstico exacto sino más bien a una interpretación subjetiva y como tal tiene una gran variabilidad inter e incluso intra-observador. La edad también posee influencia en la interpretación de una atípia ya que en mujeres menores de 30 años un porcentaje alto de ellas (al menos un 50%) sólo está expresando presencia de VPH, no así en las mujeres mayores donde aparecen cifras más significativas de NIE II y III (60-62).
Es indudable que la mayoría de las mujeres con una citología atípica de significado incierto, no tienen NIE II/III o cáncer invasor, pero el número de citologías es tan alto que se transforma en la principal fuente de derivación para el diagnóstico de NIE II/III (39%) (63). En Chile 24% de las LIE de alto grado tenían como citología de referencia un atípico de significado incierto (10% de las NIE II y 14% de las NIE III) (64).
En los años en que existe esta denominación se ha generado una dicotomía entre el relativo bajo riesgo individual, versus el alto riesgo acumulado del grupo con citología atípica de significado incierto, generando confusión en su manejo. No obstante, es indudable que esta categoría puede ocultar una incapacidad del laboratorio para efectuar un diagnóstico citológico con mayor precisión, es por lo anterior que se debe estar interiorizado de los rendimientos de cada laboratorio en particular, así como de los controles de calidad tanto internos y externos.
Aquellos frotis atípicos, informados como que no descartan una lesión de alto grado, representan una realidad diferente, si bien no deberían representar más de 5 a 10% del total de los atípicos, poseen un riesgo de 27 a 40% de NIE II/III, lo que motiva su inmediata derivación a colposcopia (65).
El riesgo de cáncer invasor detrás de una citología atípica representa entre un 0,1 a 0,2% (65).
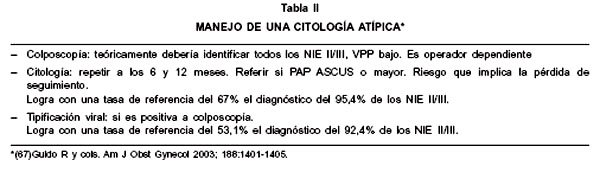
Manejo de una citología atípica. El manejo de una citología atípica de significado incierto, ha generado grandes controversias en la literatura a nivel mundial, un esfuerzo serio por aclarar estas interrogantes lo entrega el estudio ALTS (ASCUS/LSIL TRIAGE STUDY) el cual afirma que existen tres alternativas para su enfrentamiento: 1) colposcopia inmediata, 2) repetir la citología y referir a colposcopia si PAP es atípico o mayor, 3) tipificación viral para VPH de alto riesgo y referir a colposcopia si es positiva (Tabla II). Si la citología era realizada en medio liquido, la tipificación viral sería la alternativa preferida, en esta situación logra con una tasa de referencia a colposcopia de un 53,1% el diagnóstico del 92,4% de los NIE II/III. En la situación de repetir la citología se logra con una tasa de referencia de 67% el diagnóstico del 95,4% de los casos de NIE II/III (31,59-70).
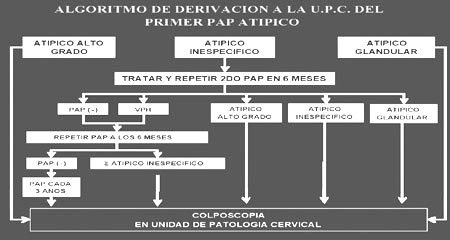
Revisando la conducta ante una citología atípica de significado incierto en nuestro país, el MINSAL en sus normas, recomienda la repetición de la citología en 6 meses, y la referencia al nivel secundario de atención en caso de repetición de la atipía o una alteración mayor (Figura 2). Como vimos anteriormente, esta es una conducta avalada por la literatura internacional; con respecto a la tipificación viral para VPH de alto riesgo, ambas poseen la misma sensibilidad para el diagnóstico de NIE II/III, con un costo mucho menor para nuestra realidad, más aún considerando la inexistente cobertura de citología en medio líquido.
Implicancias clínicas de las otras citologías alteradas. Partiendo de la premisa que ante una citología atípica de significado incierto, cuya tipificación viral es positiva para virus de alto riesgo, su riesgo subyacente de NIE II/III es del orden de un 25% y eso justifica el estudio colposcópico, cualquier alteración citológica que conlleve un riesgo mayor o igual justificaría la misma conducta. ¿Cuál es el riesgo de NIE II/III tras una citología atípica que no descarta lesión de alto riesgo o ante una citología sugerente de LIE ya sea de alto o bajo grado? El riesgo para una atípico que no descarta LIE de alto grado es de entre un 27 a 40%, (65) para una LIE de bajo grado sugerente de NIE I es de entre un 16 a 25% (65) (en Chile de los PAP sugerentes de NIE I, 15% son NIE II y 5% son NIE III) (64,68) y para una LIE de alto grado de entre un 70 a 75% (65). Estos hechos avalan claramente que ante estas pacientes la conducta más recomendable es el estudio colposcópico por sobre las alternativas de repetir la citología o la tipificación viral.
BIBLIOGRAFÍA
- Ferlay J, Bray F, Pisani P, Parkim DM. Globocan 2002. Cancer Incidence, mortality and Prevalence Worldwide IARC Cancer Base Nº 5 version 2.0. Lyon, IARC Press 2004.
- Pisani P, Parkim DM, Bray F, Ferlay J. Estimates of the Worldwide mortality from 25 cancers in 1990. Int J Cancer 1999;83:18-29.
- Suárez E, Prieto M., Rojas I, et al. Programa nacional de cáncer cervicouterino. Rev Chil Obstet Ginecol 2001;66(6):480-91.
- Nazzal O, Reinero M, Abarzúa A, et al. Patología preinvasora del cérvix. Rev Chil Obstet Ginecol 2003;68(3):189-96.
- Serman F. Cáncer cervicouterino: epidemiología, historia natural y rol del virus papiloma humano. Perspectivas en prevención y tratamiento. Rev Chil Obstet Ginecol 2002;67(4):318-23.
- Council of the European Union: Council recommendation of 2 December 2003 on cancer screening. Off J Eur Union 2003;327:34-8.
- Bosch FX, Lorincz A, Muñoz N, Meijer CJLM, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol 2002;55: 244-65.
- Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, Snijders PJ, Peto J, Meiher CJ, Muñoz N. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189:12-9.
- Franco EL, Rohan TE, Villa LL. Epidemiologic evidence and human papillomavirus infection as a necessary cause of cervical cancer. J Natl Cancer Inst 1999;91:506-11.
- Franco EL, Villa LL, Sobrinho JP, Prado JM, et al. Epidemiology of acquisition and clearance of cervical human papillomavirus in woman from a high risk area for cervical cancer. J Infect Dis 1999;180:1415-23.
- Boyle DC, Smith JR: Infection and cervical intraepithelial neoplasia. Int J Gynecol Cancer 1999;9:177-86.
- Bosch FX, Muñoz N. The viral etiology of cervical cancer (review). Virus Res 2002;89:183-90.
- Bosch FX, de San Jose S. Human papillomavirus and cervical cancer: Burden and assessment of causality. J Natl Cancer Inst Monogr 2003;31:3-13.
- Koutsky LA, Holmes KK, Critcholow CW, et al. A cohort study of the risk of cervical intraepithelial neoplasia grade 2 or 3 in relation to papillomavirus infection. N Engl J Med 1992;327:1272-8.
- Nobbenhuis MA, Walboomers JM, Helmerhorst TJ, et al: Relation of human papillomavirus status to cervical lesions and consequences for cervical-cancer screening: A prospective study. Lancet 1999; 354:20-5.
- Rozendaal L,Westerega J, van der Linden JK, Walboomers JM, et al. PCR based risk HPV testing is superior to neural network based screening for predicting incident CIN III in women with normal cytology and borderline changes. J Clin Pathol 2000;53:606-11.
- Melkert PW, Hopman E, van den Brule AJ, Risse EK, et al. Prevalence of HPV in citomorphologically normal cervical smears, as determined by the polymerase chain reaction, is age-depended. Int J Cancer 1993;53:919-23.
- Muñoz N, Bosch FX, de San Jose S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer N Engl J Med 2003; 348:518-27.
- Franco EL. Understanding the epidemiology of genital infection with oncogenic and nononcogenic human papillomavirus: A promising lead for primary prevention of cervical cancer. Cancer Epidemiol Biomarkers Prev 1997;6:759-76.
- Xi LF, Koutsky LA, Galloway DA, et al. Genomics variation of human papillomavirus type 16 and risk for high grade cervical intraepithelial neoplasia. J Natl Cancer Inst 1997;89:796-802.
- Xi LF, Carter JJ, Galloway DA, et al. Acquisition and natural history of human papillomavirus type 16 variant infection among a cohort of female university students. Cancer Epidemiol Biomarkers Prev 2002; 11:343-51.
- Ho GY, Bierman R, Beardlesley L, et al. Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med 1998;338:423-8.
- Evander M, Edlund K, Gustafsson A, et al. Human papillomavirus infection is transient in young women: A population based cohort study. J Infect Dis 1995;171:1026-30.
- Bosch FX, Manos MM, Muñoz N, et al. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. International biological study on cervical cancer (IBSCC) Study group. J Natl Cancer Inst 1995;87:796-802.
- Wang SS, Hildesheim A. Viral and host factors in human papillomavirus persistence and progression. J Natl Cancer Inst Monogr 2003;31:35-40.
- Clifford GM, Smiths JS, Plummer M, et al. Human papillomavirus types in invasive cervical cancer worldwide: A meta-analysis. Br J Cancer 2003;88:63-73.
- Muñoz N. Human papillomavirus and cancer. The epidemiological evidence. J Clin Virol 2000;19:1-5.
- Ho GY, Burk RD, Klein S, et al. Persistent genital human papillomavirus infection as a risk factor for persistent cervical dysplasia. J Natl Cancer Inst 1995;87:1365-71.
- Schlecht NF, Kulaga S, Robitaille J, Ferreira S, et al. Persistent human papillomavirus as a risk factor for persistent cervical intaephitelial neoplasia. JAMA 2001;286:3106-14.
- Wallin KL, Wiklund F, Angstron T, Bergman F, et al. Type specific persistence of human papillomavirus DNA before the development of invasive cervical cancer. N Engl J Med 1999;341:1633-8.
- Castle PE, Solomon D, Schiffman M, Wheeler CM. The ALTS group: Human papillomavirus type 16 infections and 2-year absolute risk of cervical precancer in woman with equivocal or mild cytologic abnormalities. J Natl Cancer Inst 2005;97:1066-71.
- Thomas M, Matlasheweski G, Pim D, Banks L. Inductions of apoptosis by p53 is independent of its oligomeric state and can be abolished by HPV-18 through ubiquitin mediated degradation. Oncogene 1996;13:265-73.
- Mantovani F, Banks L. The human papillomavirus E6 protein and its contribution to malign progression. Oncogene2001;20:7874-87.
- Munger K, Basile JR, Duensing S, et al. Biological activities and molecular targets of the human papillomavirus E7 oncoprotein. Oncogene 2001;20: 7888-98.
- Duesing S, Munger K. Mechanisms of genomic instability in human cancer: insights from studies with human papillomavirus oncoproteins. Int J Cancer 2004;109:157-62.
- Austin RM. Implementing liquid-based gynecologic cytology: Balancing marketing, financial, and scientific issues. Cancer 1998;84:193-6.
- Jacobs MB, Zielinski D, Meijer CJ, et al. A simplified and reliable HPV testing or archival Papanicolaou-stained cervical smears: application to cervical smears from cancer. Br J Cancer 2000;82:1421-6.
- Castle PE, Wacholder S, Lorincz AT, et al. A prospective study of high-grade cervical neoplasia risk among human papillomavirus-infected woman. J Natl Cancer Inst 2002;94:1406-14.
- Solomon D, Schiffman SH, Tarone R. Comparison of tree management strategies for patients with atypical squamous of undetermined significance: baseline results from a randomized trial. J Natl Cancer Inst 2001;93:293-9.
- Cuzick J, Beverley E, Ho L, et al. HPV testing in primary screening of older women. Br J Cancer 1999;81:554-8.
- Schiffman M, Herrero R, Hildesheim A, et al. HPV DNA testing in cervical cancer screening: Result for woman in a high-grade province of Costa Rica JAMA 2000;283:87-93.
- Wright TC Jr, Denny L, Kunh L, et al. HPV DNA testing of self collected vaginal samples compared with cytological screening to detect cervical cancer. JAMA 2000;283:81-6.
- Ferris DG, Wright TC Jr, Litaker MS, et al. Triage of woman with ASCUS and LSIL on Pap smears reports: Management by repeat Pap smears, HPVDNA testing or colposcopy? J Fam Pract 1998;46:124-34.
- Nobbenhuis MA, Meijer CJ, van der Brule AJ, et al. Addition of high-risk HPV testing improves the current guidelines on follow-up after treatment for cervical intraepithelial neoplasia. Br J Cancer 2001;84:796-801.
- Chan YM, Luesley DM. Screening, Diagnosis and Staging of Cervical Cancer. Gershenson DM, McGuire WP, Gore M, Quinn MA, Thomas G (eds.) Gynecologic Cancer: Controversies in Management. Ed. Churchill Livingstone 2004, pp 31-45.
- Monsonego J. Prevention by vaccines: Current Status, Impact and Prospects. Monsonego J (ed.). Emerging Issues on HPV Infections: From Science to Practice. Basel Karger 2006, 184-205.
- Lörincz AT. Hybrid capture method for detection of human papillomavirus DNA in clinical specimens: a tool for clinic management of equivocal pap smears and for population screening. J Obstet Gynecol Res 1996;22:629-36.
- Clavel C, Masure M, Bory JP, et al. Human papillomavirus in primary screening for the detection of high-grade cervical lesions: a study of 7932 women. Br J Cancer 2001;89:1616-23.
- Kulasingam SL, Hughes JP, Kiviat NB, Mao C, et al. Evaluation human papillomavirus testing in primary screening for cervical abnormalities: comparison of sensitivity, specificity, and frequency of referral. JAMA 2002;288:1749-57.
- Denny L, Kuhn P, Pollack A, Wright T. Evaluation of alternative methods of cervical cancer screening in resource poor settings. Cancer 2000;89:826-33.
- Cuzick J, Sasieni P, Davies P, et al. A systematic review of the role of human papillomavirus testing with a cervical programme: summary and conclusion. Br J Cancer 2000;83:561-5.
- Lörincz AT, Ritchart RM. Human papillomavirus DNA testing as an adjunct to cytology in cervical clinics programs. Arch Pathol Lab Med 2003;127:959-68.
- Schneider A, Hoyer H, Lotz B. Screening for high-grade cervical intra-epithelial neoplasia by testing for high-risk HPV, routine cytology or colposcopy. Int J Cancer 2000;89:529-34.
- Lörincz AT. HPV testing by Hybrid Capture. Monsonego J (ed.): Emerging Issues on HPV Infections: From Science to Practice.Basel Karger 2006, 54-62.
- Salomon D, Davey D, Kurman R, Moriarty A, et al: The 2001 Bethesda System JAMA 2002;287:2114-19.
- Cox JT, Lorincz AT, Schifman MH, et al. HPV testing by hybrid capture appears to be useful in triaging women with a cytologic diagnosis of ASCUS. Am J Obstet Gynecol 1995;172:946-54.
- Manos MM, Kinney WK, Hurley LB, et al. Identifying women with cervical neoplasia: using human papillomavirus DNA testing for equivocal Papanicolaou results. JAMA 1999;281:1605-10.
- Wright TC, Lorincz AT, Ferris DG, et al. Reflex human papillomavirus DNA testing in women with abnormal Pap smears. Am J Obstet Gynecol 1998; 178:962-6.
- Cox JT, Schifman M, Solomon D. For the ASCUS-LSIL triage Study (ALTS) Group. Prospective follow-up suggests similar risk of subsequent cervical intraepithelial neoplasia grade 2 or 3 among with cervical intra epithelial neoplasia grade 1 or negative colposcopy and direct biopsy. Am J Obstet Gynecol 2003;188:1406-12.
- Stoler MH, Schifman M. Interobserver reproducibility of cervical cytology and histologic interpretations. Realistic estimates from the ASCUS-LSIL Triage Study. JAMA 2001;258:1500-5.
- ASCUS-LSIL triage Study (ALTS) Group. Results of a randomized trial on the management of cytological interpretations of ASCUS. Am J Obstet Gynecol 2003;188:1383-92.
- Sherman ME, Schifman M, Lorincz AT, et al. Toward objective quality assurance in cervical cytophatology: correlation of cytophatologic diagnosis with detection of high-risk human papillomavirus types. Am J Clin Pathol 1994;102:182-7.
- Kinney WK, Manos MM, Hurley LB, et al. Where is the high-grade cervical neoplasia? The importance of the minimally abnormal Papanicolaou diagnoses. Obstet Gynecol 1998;91:973-6.
- Prado R. Análisis de los datos del Laboratorio de Referencia Nacional. Comunicación personal.
- Sherman ME, Solomon D, Schiffman M, for the ALTS Group. Qualification of ASCUS a comparison of equivocal LSIL and equivocal HSIL cervical cytology in the ASCUS LSIL Triage Study. Am J Clin Pathol 2001;116:386-94.
- Cox JT. Management of women with cervical cytology interpreted as ASCUS or as ASC-H. Clin Obstet Gynecol 2005;48:160-77.
- Guido R, Schiffman M, Salomon D, et al. ASCUS-LSIL triage Study (ALTS) Group. Postcolposcopy management strategies for women referred with low-grade squamous intraepithelial lesions or human papillomavirus DNA-positive atypical squamous cells of undetermined significance. A two-year prospective study. Am J Obstet Gynecol 2003;188:1401-5.
- Wright TC Jr, Cox T, Massad S, Carlson J, et al. 2001 Consensus Guidelines for the Management of Women with Cervical Intraepithelial Neoplasia Am J Obstet Gynecol 2003;189:295-304.
- Ministerio de Salud. Guía Clínica Cáncer Cervicouterino. Hallado en:
- Noller KL, Bettes B; Zinberg S, Schulkin J. Cervical cytology screening practices among obstetrician-gynecologists. Obstet Gynecol 2003;102:259-65.
OBSERVACIONES
* Trabajo leído en la sesión ordinaria de la Sociedad Chilena de Obstetricia y Ginecología del martes 18 de marzo de 2006.