2018
6
Autores:
Sara Rojo Novo, Rosa Albalat Fernández, María Montaño Serrano, Antonio Cordón Gámiz, Manolo La Calle Marcos, Álvaro Gutiérrez Domingo
Tipo de documento:
Casos ClínicosOSTEOSARCOMA PRIMARIO DE MAMA EN UNA PACIENTE CON ANTECEDENTES DE TRATAMIENTO RADIOTERÁPICO LOCO-REGIONAL POR CARCINOMA IN SITU MAMARIO.
Contenido del documento:
RESUMEN
El cáncer de mama es el tumor más prevalente a nivel mundial entre las mujeres. A pesar de que la supervivencia global alcanza cifras cercanas al 90%, sigue suponiendo un importante problema sanitario y económico para la población. Los sarcomas primarios de mama suponen menos del 1% de estas neoplasias, pero sus tasas de recidiva y mortalidad son elevadas. Dado que no existen pruebas de imagen específicas para el diagnóstico, la confirmación de dicha entidad supone un reto a nivel histopatológico. El tratamiento del osteosarcoma de mama es principalmente quirúrgico, con la extirpación de la tumoración con márgenes adecuados, que será trascendental para el pronóstico de las pacientes. No se ha demostrado que sea necesaria una disección axilar, ni un tratamiento adyuvante estándar de quimioterapia ni radioterapia, salvo casos indicados.
Presentamos el caso de una paciente postmenopaúsica que tras haber desarrollado un carcinoma ductal in situ de mama tratado de forma satisfactoria, desarrolla dos años posterior a la finalización del tratamiento radioterápico, y en la misma localización del tumor inicial, un osteosarcoma primario de mama de rápido crecimiento atribuible al efecto de la radioterapia administrada.
PALABRAS CLAVE: Cáncer de mama, osteosarcoma primario de mama, sarcoma de mama radioinducido, mastectomía.
SUMMARY
Breast cancer is the most prevalent tumor worldwide among women. Despite the fact that overall survival reaches figures close to 90%, it continues to be an important health and economic problem for the population. Primary breast sarcomas account for less than 1% of these neoplasms but their rates of recurrence and mortality are high. Given that there are no specific imaging tests for diagnosis, confirmation of this entity is a challenge at the histopathological level. The treatment of the OSM is mainly surgical with the removal of the tumor with adequate margins, which will be transcendental for the prognosis of the patients. It has not been demonstrated that an axillary dissection is required, nor a standard adjuvant treatment of chemotherapy or radiotherapy, unless indicated.
We present the case of a postmenopausal patient who, after having developed a ductal carcinoma in situ of the breast (DCIS) successfully treated, developed two years after the end of the radiotherapy treatment, and in the same location of the initial tumor, an osteosarcoma primary breast of rapid growth attributable to the effect of radiotherapy administered.
KEY WORDS: Breast cancer, primary breast osteosarcoma, radio induced breast sarcoma, mastectomy.
INTRODUCCIÓN
Los sarcomas primarios de mama son neoplasias poco comunes, que suponen menos del 1% de todos los cánceres de mama (CM)1. El osteosarcoma de mama (OSM) es un tumor extremadamente raro que constituye el 12.5% de los sarcomas primarios de este órgano1. La carcinogénesis es aún desconocida2, aunque se han definido distintos factores de riesgo como el trauma previo o la administración de radioterapia (RT) sobre la mama que pueden favorecer la génesis del tumor3. Del 5 al 6% de tumores en mujeres irradiadas podrían ser atribuidos a la RT. El posible desarrollo de un sarcoma radioinducido se estima que ocurra en alrededor del 0.1% de todas las pacientes con CM epitelial tratadas4. No existen características clínicas, mamográficas ni macroscópicas específicas de este tipo de neoplasia5. El tratamiento recomendado incluye la escisión total de la tumoración con márgenes adecuados, sin requerir disección axilar ni RT adyuvante6. En la actualidad, no existe un tratamiento adyuvante estándar para el OSM3; pudiendo valorarse la administración de quimioterapia (QT) si existen factores de mal pronóstico6; ya que en general el pronóstico de la enfermedad es bastante sombrío y tiene una gran propensión a la recurrencia y a la metástasis3, con cifras de supervivencias a 5 años del 38%1.
A continuación presentamos el caso clínico de una paciente intervenida de un carcinoma ductal in situ (CDIS) de mama, tratada con cirugía y posterior administración de radioterapia (RT) locorregional, que tan solo dos años después de finalizar el tratamiento, desarrolla un osteosarcoma de mama en la misma localización del tumor inicial.
CASO CLÍNICO
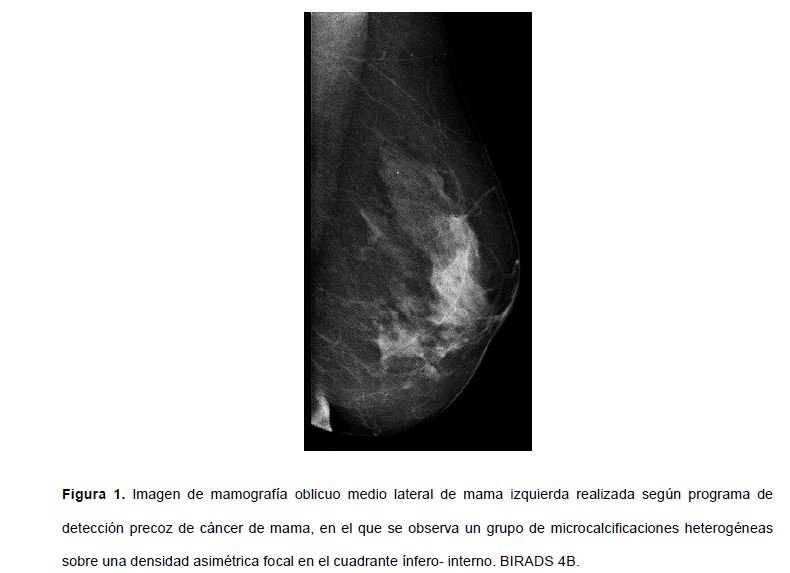
Exponemos el caso de una paciente de 63 años, mujer postmenopaúsica, en seguimiento por oncología, donde consulta por autopalpación de una tumoración en la mama izquierda (MI). Entre sus antecedentes personales destaca el sobrepeso (IMC 26.8), hipercolesterolemia, problemas circulatorios y hábito tabáquico activo (5 cigarros al día); menarquia a los 13 años y menopausia quirúrgica a los 49 años, tras una histerectomía y doble anexectomía por útero miomatoso; un embarazo y parto eutócico, sin lactancia materna. Es de especial interés su historial oncológico. Fue diagnosticada dos años antes de un CDIS de alto grado en la MI, evidenciado a partir de una mamografía bilateral realizada por el programa de detección precoz de cáncer de mama (PDPCM) (figura 1). Tras realizar una biopsia con aguja gruesa (B.A.G.) y confirmar el diagnóstico anatomo- patológico, la paciente fue intervenida realizándose una tumorectomía guiada por arpón y biopsia selectiva del ganglio centinela (BSGC), confirmándose en el estudio anatomo-patológico definitivo de la pieza un CDIS de alto grado con expresión muy débil a receptores de estrógenos (RP<5%) y positividad para receptores de progesterona (RP40%), y ganglio centinela libre de células tumorales (pTisN0M0, estadío 0). El tratamiento adyuvante posterior se completó con la administración de RT locorregional hipofraccionada (40.05Gy con fotones de 6MV) con aparición de efectos secundarios menores (radiodermitis grado I de la RTOG), y hormonoterapia (tamoxifeno y posteriormente letrozol) suspendida muy precozmente por intolerancia.
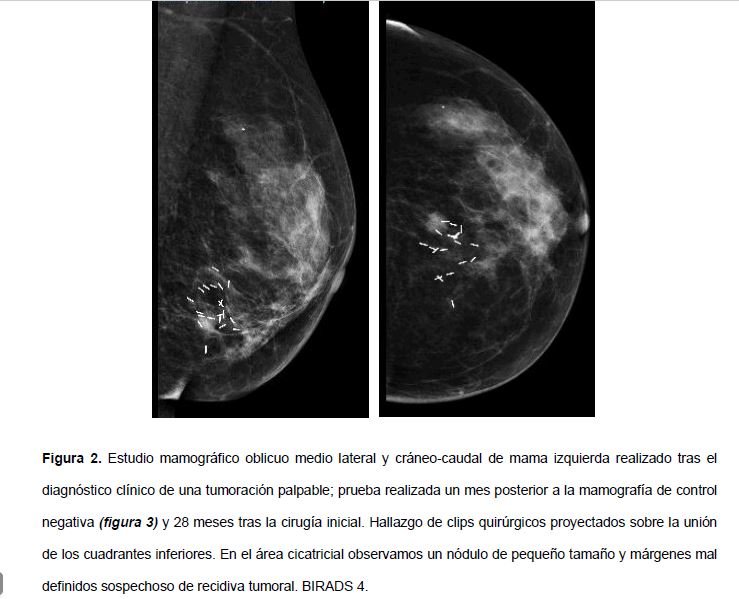
Dos años después es remitida desde Oncología a la Unidad de Mama por autopalpación reciente de una nueva tumoración en la MI. A la exploración se palpa un nódulo, de consistencia dura, de unos 3.5 cm en la misma localización del tumor anterior. En mamografía se identifica un área cicatricial donde destaca un nódulo mal definido sospechoso de recidiva local de crecimiento rápido (Figura 2) (no se identificó en mamografía realizada 1 mes antes (Figura 3)), que por ecografía corresponde con un nódulo de predominio hiperecogénico con áreas quísticas de unos 11.6mm, probablemente en relación con una necrosis grasa (Figura 4). El estudio anatomo-patológico de la B.A.G. confirmó el diagnóstico de un osteocondrosarcoma, con positividad para la proteína S-100 en áreas condroides y positividad del factor de transcripción osteoblástico SATB2 en el componente osteogénico. Tras comentar el caso en el Comité multidisciplinar de mama y habiéndose realizado un estudio de extensión negativo (con tomografía axial computerizada toraco- abdomino- pélvica y gammagrafía ósea negativas), se completó el tratamiento quirúrgico con una mastectomía simple, confirmándose en el estudio histo-patológico la existencia de una tumoración de 3.5 cm que macroscópicamente correspondía con una lesión pigmentada de color violáceo de bordes bien delimitados, heterogénea y firme, carnosa. El examen microscópico mostró una neoplasia maligna de alto grado con amplias áreas de necrosis con marcada atipia nuclear y elevado índice de mitosis, con las mismas características inmunohistoquímicas que la B.A.G. realizada (diferenciación ósea (SATB2 +) y cartilaginosa (S100 +)) con resto de marcadores epiteliales (panCK), hormonales (RE y RP), p63 y HER2 negativos (figura 5); confirmándose el diagnóstico definitivo de un OSM de alto grado. Se plantea el posible origen radioinducido del tumor a pesar de un periodo de latencia relativamente corto desde la RT administrada. Tras la cirugía, la paciente tuvo una recuperación adecuada y actualmente goza de buena salud, y tras decidirse actitud expectante y observación sin administrar tratamiento adyuvante, actualmente completa una supervivencia libre de enfermedad de 10 meses tras la cirugía, confirmada con un TAC de control negativo.
DISCUSIÓN
El CM es el tumor más prevalente en la actualidad y la principal causa de muerte por neoplasias en mujeres a nivel mundial7. Dentro de los tumores malignos infiltrantes epiteliales de la mama, el carcinoma ductal infiltrante (CDI), en la clasificación de la Organización Mundial de la Salud (OMS) de 2012, queda englobado en un grupo denominado “carcinoma infiltrante de tipo no especificado”, definido como un conjunto heterogéneo de tumores en los que no se cumplen todos los criterios para incluirlos en un tipo histológico específico como el carcinoma lobulillar (CLI) o tubular, por ejemplo. Así, la frecuencia de aparición de un CDI de mama (73-80%) es mucho mayor que de otros tipos histológicos menos prevalentes (entre los que destacan el CLI (10%))6. Aquí es donde encontramos a los sarcomas primarios de mama, que representan menos del 0.1% de las neoplasias mamarias6, suponiendo del 2 al 4% de todos los osteosarcomas8. El OSM es un tumor maligno raro que surge del tejido conectivo9. Aunque la histogénesis aún es desconocida2, se sabe que puede originarse a partir de células madre totipotenciales del estroma mamario, o derivar de la transformación de células preexistentes de un fibroadenoma o un tumor filodes2-3. Muy a menudo, surgen como condiciones de novo sin factores de prevención, especialmente después de la RT1. En nuestra paciente encontramos un nuevo tumor en la zona donde previamente había existido una lesión no infiltrante (CDIS) cuya extirpación fue completa, y tras la cual se sometió a tratamiento radioterápico. Se ha demostrado que existe una asociación entre un antecedente de trauma o irradiación, y el desarrollo de este tipo de neoplasia2. La RT tiene una función sólida en el tratamiento del adenocarcinoma de mama, ya que reduce significativamente las tasas de recurrencia. Sin embargo, entre sus efectos secundarios, se ha visto que aumenta el riesgo de tumores a nivel pulmonar, esofágico, óseo, de tejidos blandos y en la mama contralateral; incrementando además el riesgo de desarrollo de leucemias y sarcomas9-10. La mayor parte de los sarcomas inducidos por radiación son angiosarcomas4. La radiación ionizante se considera el factor de riesgo principal para el desarrollo del OSM y otros tipos histológicos de sarcomas en este órgano9. Por lo general se desarrolla en pacientes a las que se ha administrado RT en el área torácica (adenocarcinomas de mama, linfomas), como es el caso de nuestra paciente. Por definición, el osteosarcoma de la mama debe surgir en el tejido incluido como campo de irradiación. Estos sitios suelen recibir dosis de radioterapia de ≥1 Gy10. La mayor parte de los segundos tumores sólidos después del tratamiento de un CM se relacionan con otros factores de riesgo, como el estilo de vida o factores genéticos, aunque un 3% de ellos se podrían deber al tratamiento RT10; así el 5% de CM contralateral y 6% de cánceres sólidos que ocurren tras 1 año de la irradiación en superviventes de CM podrían estar relacionados con la terapia10. Los riesgos son más bajos tras periodos RT reciente y mayores para pacientes tratados en edades más jóvenes. El riesgo disminuye con el aumento de la edad de exposición y es particularmente bajo en mujeres posmenopáusicas10. Después de estas aclaraciones puede entenderse como el diagnóstico definitivo y su asociación con la radioterapia pueda contemplarse en nuestra paciente, aunque estamos ante una mujer postmenopaúsica, con un periodo relativamente corto, de 2 años, tras completar la radioterapia, que hacen menos probable que haya sido tiempo suficiente para el desarrollo de este tumor “de novo”. Sabemos que el riesgo de desarrollo de un osteosarcoma mamario está presente incluso a 20 años tras la administración de RT9. Típicamente se desarrolla en mujeres de mediana edad y ancianas (22-82años) con una edad media de 62 años3 (edad similar a la nuestra paciente, con 63 años al diagnóstico); a diferencia del osteosarcoma de esqueleto, que se desarrolla típicamente en edad juvenil9. La apariencia histológica del osteosarcoma primario de la mama se clasifica de acuerdo a la composición celular (fibroblástico, osteoblástico y osteoclástico)2-11, así como al tipo y cantidad de matriz existente (condroide, osteoide y óseo)11. En nuestra paciente el diagnóstico específico fue de osteocondrosarcoma de mama, por su abundante tejido condroide, evidente por la positividad a la proteina S-100. El diagnóstico patológico del osteosarcoma primario de mama requiere una combinación de tres elementos: (1) presencia de osteoide neoplásico o formación ósea dentro de las células tumorales; (2) exclusión de la neoplasia ósea primaria y (3) ausencia de componentes epiteliales malignos en el células tumorales6-8. En nuestro caso se ha confirmado la inexistencia de otro tumor primario con el TAC y la gammagrafía ósea, la presencia de tejido osteoide neoplásico en la mama (identificado con la inmunorreactividad a factores de transcripción de osteoblastos, SATB2) y la ausencia de elementos epiteliales malignos en las células tumorales (confirmado con la inmunorreactividad negativa a receptores hormonales). Las células tumorales son positivas para vimentina (como la práctica totalidad de los sarcomas no musculares), actina de músculo liso y S-1009.
Menos de 150 casos de osteosarcoma primario de la mama han sido reportados en la literatura12. La mayoría de ellos han sido reportados como informes de casos5, excepto Silver et al. que publicaron un estudio observacional retrospectivo de 50 casos5-13.
Por otro lado, no existen características clínicas, mamográficas ni macroscópicas específicas de este tipo de neoplasia5-8. En nuestro caso, la identificación de una tumoración dura, de crecimiento rápido y en un área previamente afecta de un CDIS y radiada posteriormente hizo sospechar inicialmente en una posible recidiva tumoral, sin poder descartar otros diagnósticos como el de sarcoma, que fue posteriormente confirmado.
Aunque en la actualidad el tratamiento del osteosarcoma de mama no está estandarizado6-8, el tratamiento quirúrgico es la base del abordaje terapeútico de esta neoplasia9, sin estar indicada la disección de los ganglios linfáticos axilares14, ya que las metástasis son predominantemente por vía hematógena13. En nuestra paciente, tras presentar el caso en el Comité multidisciplinar de mama, se optó por realizar una mastectomía simple, ya que dado el antecedente de una tumoración previa en la misma mama, junto a la radiación administrada, suponía la técnica más adecuada en su caso. El uso de radioterapia y quimioterapia es controvertida2. Se podría contemplar la administración de quimioterapia adyuvante (ante características desfavorables que pudiesen empeorar el pronóstico y valorando el tamaño del tumor, grado y subtipo histológico6. Así, pacientes con tumores grandes (mayores de 5cm), de alto grado, con márgenes infiltrativos, necrosis y otras características pronósticas desfavorables podrían beneficiarse de la QT (doxorrubicina, cisplatino, metotrexato e ifosfamida), que pueden mostrar actividad antitumoral en el osteosarcoma2-6, no existe una evidencia clara de su eficacia en este tipo de tumor3, aunque es el tratamiento principal en el estadío metastásico3. En casos de márgenes afectos tras cirugía o una gran masa que no puede extirparse, se puede plantear además la administración RT adyuvante12. En nuestro caso se decidió no asociar ningún tratamiento adyuvante, dada la radicalidad de la cirugía (mastectomía) y el tamaño definitivo de la tumoración (3,5cm).
El márgen de resección quirúrgica adecuado es el determinante más importante de la supervivencia a largo plazo14, así como el tamaño tumoral es otro factor pronóstico muy importante6. Sabemos, que el OSM es un tumor biológicamente agresivo caracterizado por la recurrencia local temprana (43% en el primer año) y la diseminación hematógena como principal vía de metástasis (prevalentes en un 42%)13, siendo los pulmones (80%), huesos (20%), hígado (17%) y tejidos blandos (cutáneo y subcutáneo), los órganos más frecuentemente afectados8-9. Las recurrencias son menos frecuentes en pacientes tratadas con mastectomía que con cirugía conservadora1. A pesar de todos los esfuerzos de diagnóstico y tratamiento precoz, las tasas de supervivencia a 5 años no superan el 38%1.
CONCLUSIONES
El OSM es un tumor poco prevalente y sigue representando un reto diagnóstico y terapeútico para los profesionales, dada la escasa respuesta a tratamiento adyuvante a la cirugía y dada la alta tasa de recidiva y mortalidad por este tipo de neoplasia. Debemos pensar en el posible desarrollo de un sarcoma de mama primario en aquellas pacientes que hayan recibido radioterapia sobre la superficie donde se origina dicha tumoración, para poder sospechar el diagnóstico de forma precoz.
BIBLIOGRAFÍA
1- Sarkar S, Kapur N, Mukri HM, Saurabh A, Kumar N. Chondroblastic osteosarcoma of breast in a case of phyllodes tumour with recurrence, a rare case report. Int J Surg Case Rep. 2016:.27:189-191.
2- Conde DM, Morais LC, Pacheco CF, Ferreira RB, Sousa-e-Silva ÉP, Nunes AR, et al. Primary osteosarcoma of the breast: pathological and imaging findings. Rev Assoc Med Bras (1992). 2015 Nov-Dec;61(6):497-9.
3- Guo W, Cao Y, Teng G, Liu J, Su J. Evolution and prognosis of breast osteosarcoma: A case report. Oncol Lett. 2016 Jan;11(1):789-791.
4- Brustugun OT, Reed W, Poulsen JP, Bruland OS. Primary osteosarcoma of the breast. Acta Oncol. 2005;44(7):767-70.
5- El Ochi MR, Zouaidia F, Kabaj R, El Ouazzanni H, Allaoui M, Oukabli M, et al. Primary chondroblastic osteosarcoma of the breast. Turk Patoloji Derg. 2014;30(3):225-7.
6- Ng CE, Angamuthu N, Fasih T. Rare breast malignancies and review of literature: A single centres experience. Int J Surg Case Rep. 2015;11:11-17.
7- Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J and Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015 Mar; 65(2): 87-108.
8- Marinova L, Hadjieva T, Kanchev E, Vicheva S. Synchronous primary mammary osteosarcoma and invasive breast cancer. A case report – Pathohistological and immunohistochemical analysis. Rep Pract Oncol Radiother. 2014 May 1;20(1):72-6.
9- Nwankwo N, Barbaryan A, Ali AM, Hussain N, Saba R, Prueksaritanond S et al. Breast osteosarcoma 29 years after radiation therapy for epithelial breast cancer. Case Rep Oncol. 2013 Jul 11;6(2):367-72.
10- Berrington de Gonzalez A, Curtis RE, Gilbert E, Berg CD, Smith SA, Stovall M, et al. Second solid cancers after radiotherapy for breast cancer in SEER cancer registries. Br J Cancer. 2010 Jan 5;102(1):220-6.
11- Zhao J, Zhang X, Liu J, Li J. Primary osteosarcoma of the breast with abundant chondroid matrix and fibroblasts has a goodprognosis: A case report and review of the literature. Oncol Lett. 2013 Sep;6(3):745-747.
12- Yoon CS, Kang SS. Primary osteosarcoma of the breast: a case report. Ann Surg Treat Res. 2017 Jul;93(1):57-60.
13- Silver SA and Tavassoli FA. Primary osteogenic sarcoma of the breast: A clinicopathologic analysis of 50 cases. Am J Surg Pathol 1998: 22:925 933.
14- Shabahang M, Franceschi D, Sundaram M, Castillo MH, Moffat FL, Frank DS et al. Surgical management of primary breast sarcoma. Am Surg. 2002 Aug;68(8):673-7; discussion..