2012
1
Autores:
Claudia de la Cruz F., Cristián Navarrete D., Daniela Majerson G., William Romero G., Angie Vergara R., Sergio González B.
Tipo de documento:
Casos ClínicosPENFIGOIDE GESTACIONAL “HERPES GESTATIONIS”. REVISIÓN A PARTIR DE UN CASO CLÍNICO
Contenido del documento:
RESUMEN
La embarazada es susceptible a cambios en la piel y fanéreos que pueden ser fisiológicos como patológicos. El reconocimiento de estas entidades es fundamental para un correcto manejo. La clasificación y nomenclatura de las dermatosis del embarazo ha sido controversial y confusa, principalmente dado el pobre conocimiento que se tiene sobre el origen de estas entidades. El objetivo de esta revisión es informar sobre el conocimiento actual del penfigoide gestacional a partir de un caso clínico, centrándose en su diagnóstico y tratamiento como patología multidiscilpinaria.
PALABRAS CLAVE: Dermatosis, embarazo, enfermedades de la piel, herpes gestacional, penfigoide gestacional
SUMMARY
The pregnant woman is susceptible to both physiologic and pathologic changes of the skin and appendages. Recognition of these entities is important for appropriate management. The classification and nomenclature have been controversial and confusing, mainly because of the poor knowledge that we have regarding the origin of this entities. The purpose of this review is to contribute to the current knowledge of pemphigoid gestationis, based on a case-report its diagnosis and treatment as a multidisciplinary pathology.
KEY WORDS: Dermatoses, pregnancy, skin diseases, herpes gestationis, pemphigoid gestationis
INTRODUCCIÓN
Los cambios cutáneos durante el embarazo son conocidos y muy variados. Múltiples explicaciones se han planteado para estos fenómenos, entre ellas: cambios inmunológicos, metabólicos, vasculares (redistribución de flujos y apertura de nuevos lechos vasculares) y endocrinos (aumento de la hormona melanocito estimulante, aumento de estrógenos y progesterona). Estos cambios pueden ser fisiológicos o patológicos (1). Dentro de los primeros, se encuentran los cambios pigmentarios, se incluyen en este ítem la hiperpigmentación y el melasma; los cambios en los anexos cutáneos como el hirsutismo y la hiperqueratosis subungueal, entre otras. Destacan también los cambios del tejido conectivo, los cambios vasculares y de las membranas mucosas.
Dentro de los cambios patológicos se subdividen en las enfermedades que son afectadas por la gestación y las dermatosis del embarazo. Estas últimas se definen como enfermedades que ocurren exclusivamente durante este período.
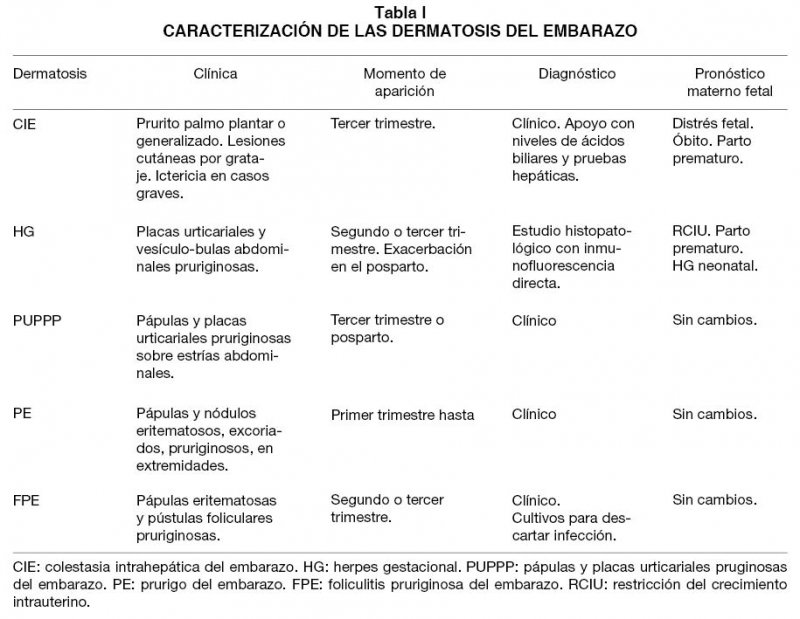
Las dermatosis del embarazo (Tabla I) incluyen al Penfigoide gestacional (PG), las pápulas y placas pruriginosas urticariales del embarazo (PUPPP, por su acrónimo en inglés), el prurigo del embarazo (PE) y la foliculitis pruriginosa del embarazo (FPE).
El PG es la mejor definida y la más importante de diagnosticar ya que se caracteriza por tener implicancias para la unidad feto-placentaria y materno-fetal, pudiendo afectar al feto y producir incluso síndrome de parto prematuro.
El presente artículo tiene por objetivo presentar un caso de PG y una revisión bibliográfica del tema.
Caso clínico
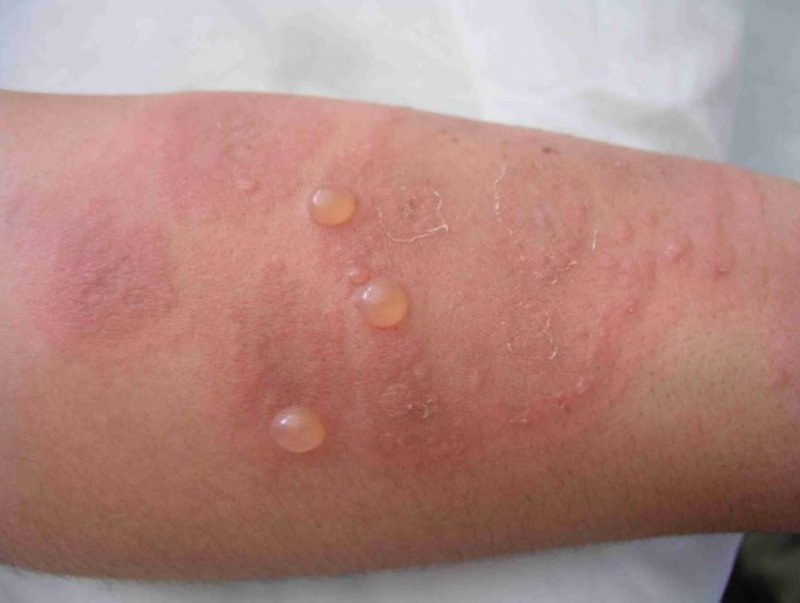
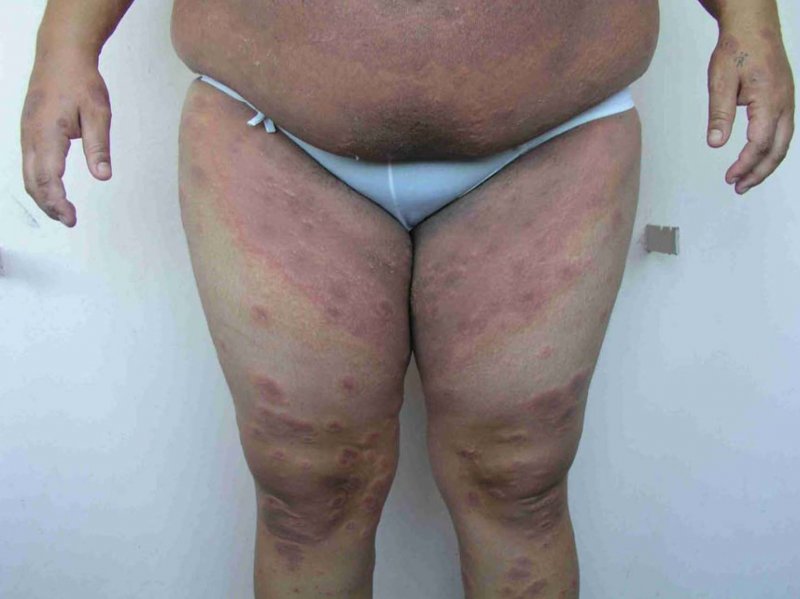
Paciente de 18 años, primigesta, sin antecedentes mórbidos de importancia. Cursando un embarazo de 34+3 semanas consultó por cuadro de 10 días de evolución de lesiones cutáneas máculo-papulares y vesiculares, bordes eritematosos, solevantadas, algunas conformando placas. Se inició en extremidades inferiores, luego en forma centrípeta y hacia extremidades superiores. Con compromiso palmo-plantar y principalmente en caras extensoras de extremidades, tronco y abdomen (Figuras 1, 2 y 3). Respeta cara y mucosas. Con prurito, sin fiebre. Se solicita biopsia de piel y anticuerpos antinucleares (ANA), anti Ro/anti La, los cuales resultan negativos. Se inició tratamiento con prednisona 40 mg/día y clobetasol 0,05% tópico y clorfenamina 4 mg cada 8 horas.
La biopsia de piel mostró ortoqueratosis, espongiosis y esbozo de ampolla subepidérmica no acantolítica con numerosos eosinófilos. Dermis con edema papilar e infiltrado linfocitario, perivascular, superficial y profundo, con granulocitos eosinófilos. Anexos conservados. No se observó ni vasculitis ni granulomas (Figura 4). A la inmunofluorescencia directa (IFD) se observó depósito de C3 lineal, en membrana basal (Figura 5). Negativo para IgA, IgG, IgM o fibrina. Estos hallazgos son compatibles con PG.
Se controló a las 36+1 semanas de edad gestacional, con buena respuesta al tratamiento, y con lesiones principalmente costrosas en caras extensoras de extremidades, tronco y abdomen. Sin prurito, ni aparición de nuevas lesiones. Se mantuvo terapia corticoesteroidal. A las 37 semanas la paciente ingresó en trabajo de parto por rotura prematura de membranas, con cuello 100% borrado y 3 cm de dilatación. Se obtiene parto espontáneo de recién nacido vivo, femenino, Apgar 9-10. Peso de 3.005 gramos. Sin lesiones cutáneas. Se controló a los 7 días posparto, aun en tratamiento esteroidal persistiendo solamente lesiones pigmentarias residuales, sin nuevas lesiones. Se suspende la prednisona de manera escalonada con evolución favorable.
DISCUSIÓN
Esta enfermedad fue descrita por primera vez en el año 1811 por Bunel (1). Su nombre inicial, “Herpes Gestationis”, era una definición elegante debido a la semejanza con las lesiones herpéticas en la etapa prebulosa de la enfermedad. Con el advenimiento de la virología y clasificación inmunológica se pudo descartar la etiología viral, asemejándose a la patogenia del Penfigoide Buloso (2). Por este motivo en Europa se sugiere utilizar una nomenclatura que no de lugar a confusiones, y es la que usaremos en este artículo: Penfigoide Gestacional. Este término fue introducido en 1982 por Holmes y Black¸ quienes propusieron una nueva clasificación de las dermatosis del embarazo (3).
El PG tiene una incidencia estimada en EEUU de aproximadamente 1/50.000 embarazos, algo más frecuente en el Reino Unido con 1/40.000 embarazos. En los estudios actuales no se han encontrado diferencias raciales y suponen incidencias similares entre caucásicos y afroamericanos (4). En Chile no existen datos epidemiológicos de esta enfermedad. En la literatura nacional existen 4 casos reportados: uno el año 1976, otro en al año 1990 y dos publicados el año 2002 en la Revista Chilena de Obstetricia y Ginecología (5).
La enfermedad clásicamente se desarrolla durante el segundo o tercer trimestre (21-28 semanas como promedio), pero existen reportes incluso en el primer trimestre (6).
Se inicia con la aparición súbita de lesiones muy pruriginosas urticariales y eritematosas en el abdomen en cerca de la mitad de los casos. Muchas veces el prurito intenso puede preceder a las lesiones. Éstas pueden verse policíclicas o en diana (target). La región periumbilical es el primer lugar comprometido habitualmente en el 50-90% de las pacientes. Las lesiones rápidamente progresan a una erupción ampular generalizada: aparecen vesículas, tensas ampollas y bulas, extendiéndose de manera centrífuga hacia el tronco y resto del abdomen, la mayor parte de las veces hasta la región flexora de las extremidades. En general respetan la cara, las membranas mucosas y la región palmo plantar. Las lesiones curan sin cicatriz (6).
Las exacerbaciones al momento del parto o en el posparto precoz son clásicas, ocurriendo en el 75% de los casos (6). En el 14-25% de las pacientes la enfermedad puede debutar a las pocas horas posparto. La aparición de lesiones más allá de 3 días posparto hace el diagnóstico muy poco probable, aunque existan reportes que apoyarían esta posibilidad. Un importante número de pacientes experimentan una regresión espontánea semanas o meses posparto (6). Muy poco común, pero también descrito, es que la enfermedad recurra con la menstruación o con el uso de anticonceptivos orales.
En los embarazos siguientes, la enfermedad puede ser menos severa e incluso, ser intermitente alternándose embarazos (skip pregnancies hasta en un 5-8%); pero en general es de aparición precoz, con manifestaciones más floridas y severas, sobretodo cuando gestación corresponde al mismo padre (7).
Se estima que aproximadamente el 10% de los recién nacidos de madres con PG tendrán la enfermedad activa al nacimiento (8). Ocasionalmente se ha descrito como una presentación paraneoplásica secundaria a tumores de la enfermedad trofoblástica, específicamente mola hidatiforme y coriocarcinoma (9).
El PG es una enfermedad autoinmune del grupo de los penfigoides, en la cual anticuerpos circulantes se dirigen contra la membrana basal, específicamente un antígeno compartido por la piel y la placenta. Este antígeno es principalmente el colágeno XVII (antes llamado BP180 o BPAG2), el cual actúa como autoantígeno en otras enfermedades del grupo de los penfigoides (Penfigoide Buloso, Penfigoide cicatricial y Dermatosis por IgA lineal) (10). El colágeno XVII es una proteína de transmembrana y un componente del hemidesmosoma del complejo de anclaje dermoepidérmico que media la adhesión de las células epiteliales a la membrana basal. Se encuentra en la membrana basal de la piel, el epitelio amniótico de la placenta y el cordón umbilical. Los anticuerpos se dirigen a una zona específica del colágeno XVII, la región no-colagenosa 16A (NC16A), pudiendo incluir también otras zonas (10).
Estudios de inmunohistoquímica demostraron expresión de colágeno XVII en células del sinciciotrofoblasto y del citotrofoblasto humano desde el primer trimestre (10). Asimismo, en pacientes con PG se puede observar vilitis leve a moderada, expresada como colecciones de vellosidades fibróticas e inmaduras con áreas de disminución de vellosidades terminales. Esto podría dar luces para generar una teoría que explique la restricción de crecimiento fetal intrauterino (RCIU) propuesta en hijos de madres con PG. Incluso se han observado microdesprendimientos de placenta que podrían llevar a falla funcional placentaria mínima (10). Además, en placentas de madres con PG, se observó tinción contra C3 e IgG en la membrana basal placentaria (10).
Un estudio demostró que no había solo anticuerpos circulantes contra ese epítope, sino también linfocitos T específicos que reconocían la región NC16A (11). Lo que traduciría activación humoral y celular en la patogenia de la enfermedad.
Además de haber anticuerpos que reconocen al colágeno XVII, se demostró que en 10% de estos pacientes, había anticuerpos circulantes contra otro antígeno, la región no-colagenosa de 230 kDa de la proteína de la familia de las plaquinas (BP230). Su rol no se conoce aún ya que es intracelular, pero se sabe que se expone esta proteína en la membrana, después de un daño a los queratinocitos (8).
Se ha descrito una predisposición genética en individuos que portan el HLA-DR3 y DR4. En un estudio se demostró que 61-85% de las pacientes con PG eran DR3 (+) vs. 22% en los controles que eran DR3 (-) (12). En ese mismo estudio: 52% expresaba DR4 vs. 33% DR4 (-), 43-45% expresaban la combinación DR3/DR4 vs. 3% en los controles (12).
Una expresión aberrante de estos MHC tipo II en las células trofoblásticas y las células del estroma amniocorial han sido demostradas y es probablemente uno de los hechos principales en la patogenia del PG. En el embarazo normal, los MHC II no se expresan en el trofoblasto, actuando como mecanismo de silenciamiento y protegiendo al feto del sistema inmune materno. Por lo tanto, la expresión placentaria anómala de MHC tipo II permite una respuesta alogénica al presentar el colágeno XVII a las células inmunes maternas, en el contexto de moléculas de MHC paternas, sin la necesidad de una respuesta de linfocitos T CD4 (8).
Otro hallazgo común en estas pacientes, es la presencia de anticuerpos anti HLA paternos en casi el 100%, en comparación con 10% de las mujeres sanas, multíparas. Estos anticuerpos son en general contra MHC tipo I y completamente diferentes a los anti colágeno XVII circulantes; por esta razón no se sabe su rol patogénico y puede ser considerado un epifenómeno o en el contexto de un ambiente autoinmune en estas pacientes (13).
Como último componente, falta considerar los factores hormonales. Se ha atribuido un rol regulador a los estrógenos y la progesterona. Esta última disminuye la producción de anticuerpos y tiene un efecto inmunosupresor similar a la de los corticoides. Los niveles de progesterona están altos las últimas semanas y caen abruptamente posparto. Esto es consistente con el curso natural de la enfermedad (remisión en el final del último trimestre con reaparición posparto). Podría explicar también las apariciones premenstruales que siguen la caída plasmática de los niveles de progesterona en un número reducido de mujeres. Los estrógenos deprimen la respuesta mediada por linfocitos T, pero tendrían un rol activador de la producción de anticuerpos al aumentar la respuesta de los linfocitos B, formando parte de la patogenia como inmunoactivadores (14).
El PG se ha asociado también a otras enfermedades autoinmunes como la enfermedad de Basedow-Graves y aumentos de los anticuerpos anti-tiroideos y anti-célula parietal gástrica. Esto se explicaría por la asociación que existe con HLA DR3 y DR4. Hasta 10% de los pacientes con PG tienen enfermedad de Graves en comparación con 0,4% en la población general. También se ha documentado asociación con historia familiar de enfermedades autoinmunes (15).
El diagnóstico es clínico-patológico en la gran mayoría de los casos. Se debe plantear el diagnóstico diferencial con las dermatosis del embarazo, sobre todo con el PUPPP, y con otras enfermedades ampulares como el Penfigoide Buloso. Además debe plantearse el diagnóstico diferencial con las dermatitis de contacto, rash secundario a drogas, urticaria aguda, dermatitis herpetiforme y dermatosis lineal por depósito de IgA.
Muchas veces la clínica es suficiente para hacerse una idea inicial, pero en la mayoría de las veces se debe confirmar con biopsia de las lesiones. La biopsia a la microscopía óptica con hematoxilina y eosina, mostrará bulas subepidérmicas con linfocitos y eosinófilos perivasculares dérmicos. Además se puede ver espongiosis, vesículas espongióticas y edema papilar (2). La inmunofluorescencia directa muestra depósito de C3 lineal con o sin depósito de IgG en banda o a lo largo de la membrana basal (positiva en 30-40% de las veces). La IFD es a la fecha, el gold standard en el diagnóstico de PG (3). La positividad de la IFD puede durar de 6 meses a 4 años después de la remisión clínica (16). Si el recién nacido es afectado, también habrá positividad a la IFD contra C3 lineal en la biopsia de piel del neonato (3,17). La inmunofluorescencia indirecta (IFI) resulta positiva en cerca de un 70% de los casos, pero tiene mucha variabilidad y no reacciona contra el segmento de 180 kDa del colágeno XVII que es la región patogénica (18). El año 2004, fue aprobado por el Colegio Americano de Obstetricia y Ginecología (ACOG) un test pack ELISA contra el antígeno del PG de 180 kDa, específicamente contra el dominio no-colagenoso número 16 (que es el blanco principal de los anticuerpos en PG) NC16A. El test se validó en 44 pacientes y tuvo una sensibilidad de 88% y una especificidad de 100% sin ningún falso positivo. El corte para interpretarlo como positivo fue fijado en 0,22 de densidad óptica a 492 nm de longitud de onda (18). Además, el test ELISA NC16A se correlaciona con la actividad de la enfermedad, debido a que es cuantitativo se modifica en forma paralela a las lesiones, lo cual podría ser útil en el seguimiento del tratamiento. Por lo tanto tendría utilidad en diagnóstico y monitorización (18).
Otro estudio del año 2008 (19), comparó ELISA con IFI para el diagnóstico de PG en 24 pacientes con una sensibilidad de 93% vs. 74%. La especificidad fue igual para ambos cercana al 100%. El valor predictivo positivo de 93% y el valor predictivo negativo de 96% y ningún falso positivo en los controles comparado con el gold standard que es la IFD. Los criterios diagnósticos se presentan en la Tabla II (8).
El tratamiento debe considerar los riesgos y beneficios para la unidad materno-fetal. La terapia no debe ser iniciada hasta que la severidad de los síntomas sobrepase los riesgos potenciales para el feto. Por otro lado no existen estudios clínicos randomizados ni meta-análisis que avalen los tratamientos actuales. El objetivo del tratamiento es disminuir los síntomas: prurito intenso y lesiones, la piedra angular son los corticoides (2). Si la paciente tiene brotes premenstruales se pueden dar esteroides tópicos con o sin antihistamínicos orales. La mayoría de las pacientes requerirán corticoides sistémicos, los cuales son relativamente seguros durante el embarazo. Inicialmente se inicia prednisona 20-40 mg/día (0,5 mg/kg/día) y seguimiento por 3 días (2). Si no aparecen nuevas lesiones, se debe mantener a esa dosis por 1-2 semanas para luego ir disminuyendo la dosis gradualmente. En casos severos, pueden requerirse incluso dosis más altas (1 mg/kg/día). En casos leves se pueden usar sólo corticoides tópicos con o sin antihistamínicos para controlar el prurito (2,8). La prednisona es bastante segura durante el embarazo, el único riesgo es la posible supresión adrenal fetal con los riesgos que esto implica, restricción de crecimiento intrauterino y disminución del perímetro cefálico. La prednisona se secreta por la leche, pero dosis inferiores a 40 mg son relativamente seguras y no producen supresión medular en el lactante (20).
Si los corticoides fallan, en casos refractarios y sólo en el posparto, se pueden usar otras drogas: tetraciclinas, nicotinamida e inmunoglobulina intravenosa en dosis alta combinada con ciclosporina (21,22). En algunos reportes de casos aislados se ha visto beneficio con plasmaferesis. Para controlar el prurito se pueden usar antihistamínicos (2,8).
No existe riesgo materno en el PG, salvo las consecuencias sicológicas para la madre en un periodo de estrés como lo es el embarazo, parto y puerperio. Para el feto existe la posibilidad de ser afectado hasta en un 10% por la enfermedad, la que del todo similar a la de la madre (clínica e histopatológicamente). Esto se debe a que los anticuerpos son IgG y atraviesan la barrera placentaria. Se ha dicho, por otro lado, que la enfermedad se asocia a RCIU y prematurez. Por esta razón se recomienda el seguimiento estrecho de la unidad materno-fetal con Doppler de arterias umbilicales 1-2 veces por semana y curva de crecimiento cada 2 semanas. Ninguno de esos esquemas de seguimiento está validado por la evidencia, pero parecen prudentes como esquema de embarazo de alto riesgo obstétrico.
Las lesiones en los lactantes se resolverán espontáneamente y no requieren tratamiento en los primeros días de vida. Más importante es evaluar el eje hipotálamo-hipófisis-suprarrenal por potencial supresión debido a la exposición prolongada a corticoides para el tratamiento de la enfermedad materna (2,8).
En un estudio retrospectivo en 61 embarazadas con PG realizado el año 2009 (23), se informó una tasa de 34% de síndrome de parto prematuro versus un 6% en población general; 34% de recién nacidos pequeños para la edad gestacional vs. 6% en población general y 34% tuvo bajo peso al nacer en comparación con 7% en la población general. Los autores concluyen que cuando la enfermedad se iniciaba en forma precoz; había en promedio menor edad gestacional al parto y menor peso al nacer (10 veces más riesgo si se iniciaba en primer trimestre). El riesgo de bajo peso al nacer era 43% si el PG se iniciaba en primer trimestre, 42% en el segundo y 7% si se iniciaba en el tercer trimestre. La presencia de bulas y vesículas se asoció significativamente a mayor gravedad con menor edad gestacional al momento del parto. Aun más, todas las mujeres que tuvieron parto prematuro, presentaron vesículas y esto se podría correlacionar a mayor grado de desprendimiento placentario. No se encontraron diferencias entre el uso de corticoides sistémicos y eventos adversos durante el embarazo. Tampoco hubo asociación con aumento en el número de pérdidas fetales ni en la mortalidad (23).
BIBLIOGRAFÍA
1. Bunel JBH. Essai sur le pemphigus. Paris 1811.
2. Kroumpouzos G, Cohen LM. Dermatosis of Pregnancy. J Am Acad Dermatol 2001;45:1-19.
3. Holmes RC, Black MM. The specific dermatoses of pregnancy: a reappraisal with special emphasis on a proposed simplified clinical classification. Clin Exp Dermatol 1982;7:65-73.
4. Bedoes P, Kumar V, Mahon M. Pemphigoid gestationis: a rare case and review. Arch Gynecol Obstet 2009;279:235-38.
5. Shornik JK, Bangert JL, Freeman Rg, Gilliam JN. Herpes gestationis: clinical and histologic features of twenty-eight cases. J Am Acad Dermatol 1983;8:214-24.
6. Sukni M, Reinero M, Pardo L, Rybak M, Valderrama O, Rendic E. Herpes Gestationis. Rev Chil Obstet Ginecol 2002;67(3):190-5.
7. Jenkins RE, Hern S, Black MM. Clinical features and management of 87 patients with pemphigoid gestationis. Clin Exp Dermatol 1999;876:102-18.
8. Semkova K, Black M. Pemphigoid Gestationis: Current insights into pathogenesis and treatment. Eur J Obstet Gynecol Reprod Biol 2009; 145:138-44.
9. Djahansouzi S, Nestle-Kraemling C, Dall P, Bender HG, Hanstein B. Herpes Gestationis may present itself as a paraneoplastic syndrome of choriocarcinoma- a case report. Gynecol Oncol 2003;89:334-7.
10. Huilaja L, Hurskainen T, Autio-Harmainen H, Hofmann SC, Sormunen R, Räsänen J, et al. Pemphigoid gestationis autoantigen, transmembrane collagen XVII, promotes de migration of cytotrophoblastic cells of placenta and is a structural component of fetal membranes. Matrix Biology 2008;27:190-200.
11. Lin MS, Gharia M, Fu CH, Olague-Marchan M, Hacker M, Harman KE, et al. Molecular mapping of the major epitopes of BP180 recognized by herpes gestationis autoantibodies. Clin Immunol 1999;92:285-92.+
12. Shornick JK Stastny P, Gilliam JN. High frequency of histocompatibility antigens HLA-DR3 and DR4 in herpes gestationis. J Clin Invest 1981;68:553–5.
13. Shornick JK, Jenkins RE, Briggs DC, Welsh KI, Kelly SE, Garvey MP, et al. Anti HLA antibodies in pemphigoid gestationis (herpes gestationis). Br J Dermatol 1993;129:257-9.
14. Da Silva JA. Sex hormones and glucocorticoids: interactions with the immune system. Ann N Y Acad Sci 1999;876:102-18.
15. Shornick JK, Black MM. Secondary autoimmune diseases in herpes gestationis. J Am Acad Dermatol 1992;26:563-66.
16. Holmes RC, Black MM, Jurecka W, Dann J, James DC, Timlin D, et al. Clues to the aetiology and pathogenesis of herpes gestationis. Br J Dermatol 1983;109:131-9.
17. Cobo MF, Santi CG, Maruta CW, Aoki V. Pemphigoid Gestationis: Clinical and Laboratory evaluation. Clinics (Sao Paulo) 2009;64:1043-7.
18. Sitaru C, Powell J, Messer G, Bröcker EB, Wojnarowska F, Zillikens D. Immunoblotting and Enzyme-Linked Immunosorbent Assay for the Diagnosis of Pemphigoid gestationis. Obstet Gynecol 2004;103:757-63.
19. Barnadas M, Rubiales MV, González MJ, Puig L, García P, Baselga E, et al. Enzyme-linked immunosorbent assay (ELISA) and indirect immunofluorescence testing in a bullous pemphigoid and pemphigoid gestatoinis. Int J Dermatol 2008;47:1245-9.
20. Jackson S, Glichrist H, Nesbitt jr LT. Update on the dermatologic use of systemic glucocorticosteroids. Dermatol Ther 2007;20:187-205.
21. Hern S, Harman K, Bhogal BS, Black MM. A severe persistent case of pemphigoid gestationis treated with intravenous immunoglobulins and cyclosporine. Clin Exp Dermatol 1998;23:185-8.
22. Santos Rodrigues C, Filipe P, Solana MM, Soares de Almeida L, Cirne de Castro J, Gomes MM. Persistent Herpes Gestationis treated with high-dose intravenous immunoglobulin. Act Derm Venereol 2006;86:184-6.
23. Chi C, Wang S, Charles-Holmes R, Ambros-Rudolph C, Powell J, Jenkins R, et al. Pemphigoid Gestationis: early onset and blister formation are associated with adverse pregnancy outcomes. Br J Dermatol 2009;160:1222-8.