2018
4
Autores:
Jorge Gutiérrez Pinto, Marcela Concha Rogazy, Astrid von Oetinger Giacoman, Luz María Trujillo Gittermann
Tipo de documento:
Casos ClínicosPITIRIASIS ROSADA EN EL EMBARAZO: REPORTE DE CASO
Contenido del documento:
INTRODUCCIÓN
La Pitiriasis Rosada fue descrita en 1860, a pesar del tiempo transcurrido, sigue siendo una entidad de etiología poco clara. Respecto a las teorías actuales, estas la asocian a una enfermedad de tipo infeccioso (1,2). Su incidencia es de 170 cada 100.000 personas (3). En cuanto a su epidemiología, el 75% de los casos se observa entre los 10 y los 35 años, afectando a ambos géneros, con un predominio en embarazadas. (4, 5,6).
Esta patología debuta como una dermatosis común inflamatoria, aguda y autolimitada, que etimológicamente se asocia a un origen infeccioso, como la reactivación endógena sistémica del herpes virus humano HHV6 y/o 7 (3). Se caracteriza clínicamente por la aparición de una placa inicial o placa heráldica, seguida por la aparición de placas diseminadas similares pero menores una o dos semanas más tarde (1, 4,7). Algunos pacientes presentan también síntomas sistémicos como náuseas, anorexia, malestar general, cefalea, fiebre, y dolores articulares, que pueden presentarse algunas semanas antes de la aparición de la primera placa o durante el desarrollo de esta patología. (4,8). Las lesiones cutáneas suelen seguir las líneas de Blaschko o líneas invisibles cutáneas, creando una forma de árbol de navidad en el pecho y espalda del paciente y su resolución es espontánea posterior a 4 u 8 semanas desde la aparición de la placa heráldica. (9,10).
El diagnóstico de la Pitiriasis Rosada es clínico y debe ser realizado por un profesional dermatólogo de acuerdo con los criterios morfológicos presentada por Chuh y col. (10). En mujeres embarazadas, para el diagnóstico se recomienda evaluar PCR VHH 6/7 anterior o durante las primeras 15 semanas de gestación, dado que posterior a las 15 semanas los anticuerpos anti-HHV6/7 IgM específicos sólo se detectan en un porcentaje bajo de mujeres embarazadas (11, 12, 13,14). Además, como diagnóstico diferencial se recomienda descartar Sífilis. (7,10).
La Pitiriasis Rosada se clasifica en cinco formas diferentes: 1) clásica y 2) recidivante HHV 6/7, 3) persistente, viremia de HHV 6/7, 4) pediátrica y 5) gestacional (posible transmisión intrauterina) (15). Respecto a esta última la Pitiriasis Rosada ocurre con mayor frecuencia en mujeres embarazadas (18%) que en la población general (6%), (16). La hipótesis es que el deterioro en la respuesta inmune que ocurre durante el periodo de embarazo es lo que favorece la reactivación viral y posiblemente también la transmisión intrauterina de HHV 6/7 (15).
A pesar de que la Pitiriasis Rosada se considera una condición cutánea benigna (3,16-18), en el marco del embarazo, hay estudios que relacionan la aparición de esta patología con complicaciones asociadas. (14,19).
Drago y col el año 2014, estudió a 61 mujeres embarazadas que presentaron durante la gestación Pitiriasis Rosada sin ningún otro factor de riesgo, encontrando que el 36% de ellas tuvieron algún resultado desfavorable (hipotonía fetal, bajo peso de nacimiento, parto prematuro, entre otros) , mientras que otras 8 abortaron (13%); todas las mujeres que abortaron cursaron con un curso agresivo de erupción generalizada, mostrando severos síntomas sistémicos y presentando ADN de HHV 6 en el plasma, placenta, lesiones cutáneas y tejidos fetales, mientras que el ADN del HHV 7 fue detectado en el plasma y lesiones en la piel en 3 de 8 (37,5%) pacientes que abortaron (12). No obstante, la tasa total de abortos en mujeres que desarrollaron Pitiriasis Rosada durante el embarazo (13%) no difiere de la observada en la población general (12,19).
La literatura científica evidencia un mayor número de complicaciones asociadas a esta patología, cuando las mujeres embarazadas inician su sintomatología durante las primeras 15 semanas de gestación (57%) (14,19).
Es muy escasa la literatura mundial sobre este tema y en nuestro país no existen publicaciones que relacionen la Pitiriasis Rosada y el embarazo.
El objetivo de este reporte de caso es describir la evolución y control en una paciente chilena que desarrolló Pitiriasis Rosada durante su segundo trimestre de embarazo y contrastar su evolución con la evidencia científica actual sobre esta temática.
MATERIAL Y MÉTODO
Este estudio es de tipo reporte de caso, prospectivo. Los datos fueron recopilados por el profesional ginecólogo y dermatólogo tratantes de la paciente, atendida en Santiago de Chile en un centro de salud privado.
PACIENTE: Reporte de caso
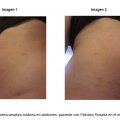
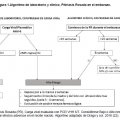
Mujer sana de 36 años, presentó a la semana 12 de gestación una erupción cutánea, mostrando una placa eritematodescamativa cutánea inicial en la espalda. Poco después comenzó a desarrollar placas en el abdomen (imagen 1 y 2), zona axilar, espalda y antebrazos (Imagen 3). A los 10 días posteriores presentó placas en sus extremidades superiores zona proximal y distal, el área total corporal de superficie comprometida fue menor al 50% del cuerpo, sin compromiso de mucosas en cavidades bucal y/o vaginales (Enantema). La paciente no presentó ningún síntoma sistémico asociado. Se estableció un diagnóstico de Pitiriasis Rosada, por parte de un médico dermatólogo a la semana 15 de embarazo, posterior a 2 diagnósticos incorrectos sobre la patología presentada; para confirmar los hallazgos clínicos se realizó una biopsia cutánea en una de las placas ubicadas en su omoplato derecho, se biopsió un fragmento cilíndrico de piel de 3 mm en formalina, cuyo resultado fue: Dermatitis perivascular superficial espongiótica con tinción de PAS negativa para hongos; resultado concordante con lesión cutánea por Pitiriasis Rosada (20). Se realizó también un VDRL, para el diagnóstico diferencial de Sífilis, (20,21) el que fue negativo. No se realizó PCR VHH 6/7, ya que la evidencia recomienda este examen anterior a las 15 semanas de embarazo (11, 12, 13,14). Acorde al algoritmo clínico propuesto por Drago y col el año 2018 y adaptado en este manuscrito para favorecer el entendimiento y aplicación en la población chilena (Fig. 1), la paciente fue catalogada con “Alto riesgo” y el abordaje médico se basó en las recomendaciones para esta clasificación (22).
Las lesiones se resolvieron de manera espontánea entre las semanas 16 y 18 de embarazo, sin ningún tratamiento farmacológico, debido al bajo nivel de evidencia que respalde uso de antivirales para resolución de esta patología en embarazadas (23, 24).
MANEJO GINECOLÓGICO:
Por parte de su médico obstetra se siguió de cerca el embarazo, con constante monitorización, realizando ecografías cada 4 semanas desde la semana 18 de gestación, a fin de estimar si el crecimiento fetal era el adecuado a la edad gestacional, sin presentarse alteraciones.
Parto: A las 38 semanas de embarazo se realizó cesárea debido a causas obstétricas. Al nacimiento la recién nacida tuvo Apgar en uno y cinco minutos fue de 9/9, peso 3065 kg. y midió 49 cm. Al nacimiento el neonatólogo descubrió una fosita en la zona del coxis a lo que se determinó realizar una ecografía para descartar compromiso medular, los resultados fueron favorables mostrando desarrollo neuroanatómico normal.
DATOS RECOPILADOS Y MANEJO DE LA INFORMACIÓN
La paciente autorizó a la publicación de los datos obtenidos con resguardo de su identidad, firmando consentimiento informado, estudio aprobado por el comité de bioética de la universidad Diego Portales, Santiago de Chile.
DISCUSIÓN
La Pitiriasis Rosada se conoce como una patología benigna, sin embargo, cuando se presenta en el embarazo existe mayor probabilidad de presentar complicaciones (12, 14,22, 25). Lo anterior se apoya en varios estudios retrospectivos que han observado eventos adversos que afectan al recién nacido en mujeres que desarrollan Pitiriasis Rosada durante el embarazo (14, 12,25). Se realizó una revisión de la literatura existente incluyendo a 68 casos de mujeres que desarrollaron esta patología, los casos fueron obtenidos de 8 artículos más el de la paciente de este reporte de caso (8, 11, 12, 14, 25-28). Acorde a los casos analizados el desarrollo de la Pitiriasis Rosada gestacional fluctuó entre la semana 8 y 32 de embarazo, donde se presentó la patología con la siguiente distribución; Primer trimestre: 13 mujeres lo que representa el 19%, Segundo Trimestre: 49 Mujeres lo que representa el grupo mayoritario con 72%, Tercer Trimestre: 6 Mujeres representando al 9% de los casos.
Los principales hallazgos encontrados se resumen en la Tabla 1.
De los 68 casos analizados 55 corresponden a recién nacidos vivos (80,8%), y 13 se consideran no nacidos (19%). Llama la atención que, en la totalidad de los casos de niños no nacidos, las madres presentaros síntomas generales asociados a la Pitiriasis Rosada, como lo son, compromiso del estado general, cefaleas, insomnio y síntomas gastrointestinales. En 9 de los 13 casos (70%), los síntomas comenzaron en el primer trimestre de embarazo lo que se relaciona con lo encontrado por Drago y col. el año 2008 que concluye que es peor el pronóstico cuando el inicio de la Pitiriasis Rosada es en el primer trimestre (14), sin embargo, otro estudio publicado el año 2016 (8) plantea que se han encontrado mayores efectos adversos en las mujeres que presentaron la patología en el segundo trimestre de gestación. (8).
Drago y col (2018) en un estudio recientemente publicado, asocia tras análisis de regresión logística, las condicionantes entre la sintomatología presentada durante el curso de la pitiriasis rosada y el riesgo de presentar efectos adversos en el recién nacido; concluyendo que los riesgos mayores son; presentar la Pitiriasis Rosada anterior a la semana 15 de gestación y presentar enantema. Y los riesgos menores; presentar síntomas sistémicos y que el área de superficie del cuerpo afectada sea mayor al 50% (22).
CONCLUSIÓN
Los hallazgos referidos en la escasa literatura encontrada no son concluyentes, y no reflejan la incidencia de esta patología, esto debido a; su resolución espontánea, que las embarazadas suelen tener distintas afecciones a la piel y como la mayoría de los casos no tienen síntomas asociados, a que muchas veces no se diagnostica y si el recién nacido nace con alguna afección suele asociarse a otras causas.
Es importante evidenciar estudios de esta patología y enfatizar el rol del obstetra y matrona en la pesquisa precoz de las lesiones cutáneas, conociendo los riesgos asociados y derivando al dermatólogo para su diagnóstico correcto. Así, una vez diagnosticada se puede lleve un control riguroso del embarazo acorde al algoritmo propuesto.
Esperamos esta publicación sea la antesala a futuros estudios en pacientes chilenas para conocer en mayor detalle la incidencia en nuestro país y cómo afecta a los recién nacidos de madres que presentaron esta patología durante la gestación.
BIBLIOGRAFÍA
1. Arenas R. Dermatología; altas, diagnóstico y tratamiento. Mc Graw Hill, Segunda Edición. Cap. 116: 407-410.
2. Chuang TY, Listrup DM, Perry HO, Kurland LT. Pytiriasis rosea in Rochester, Minnesota 1969-78. J Am Acaf Dermatol 1982; 7:80-89.
3. Wollenberg A, Eames T. Skin diseases following a Christmas tree pattern. Clin Dermatol 2011; 39:189-94.
4. Urbina F, Das A, Sudy E. Clinical variants of pityriasis rosea.Worl J Clin Cases 2017; 5(6):203-211.
5. López I, Duán C, Sáez M, Orozco L, palacios C, Ruíz R. Pitiriasis rosada: un exantema que debe ser reconocido por el médico de primer contacto. Estudio de 30 casos. Acta Pediátr Mex 2014; 35:189-294.
6. González LM, Allen R, Janniger CK, Schwartz RA. Pityriasis rosea: An important papuloscamous disorder. Int J of Dermatol 2005; 44: 757-64.
7. Jiménez M, González S. Pitiriasis Rosada: aspectos generales, bases para el diagnóstico y tratamiento. Hipoc Rev Med 2011; 3:12-14.
8. Loh T, Chohen P. Pityriasis rosea in pregnancy: report of spousal occurrence and craniosyntosis in the healthy newborn. Dermatol Pract Concept 2016;6(3)(8):39-46.
9. Trager JD. What’s your diagnosis? Scaly pubic plaques in a 2-year-old girl—or an “inverse” rash. J Pediatr Adolesc Gynecol 2007; 20:109-11. PMID: 17418397.
10. Chuh A, Zawar V, Lee A. Atypical presentations of pityriasis rosea: case presentations. J Eur Acad Dermatol Venerol 2005; 19:120-6. PMID: 15649208.
11. Chuh AA, Lee A, Chan PK. Pityriasis rosea in pregnancy—specific diagnostic implications and management considerations. Aust N Z J Obstet Gynaecol 2005; 45:252-3. PMID: 15904457.
12. Drago F, Broccolo F, Javor S, Drago F, Rebora A, Parodi A. Evidence of human herpesvirus-6 and -7 reactivations in miscarrying women with pityriasis rosea. J Am Acad Dermatol 2014; 71:1989. PMID: 24927696.
13. Dahl H, Fjaertoft G, Norsted T, Wang FZ, Mousavi-Jazi M, Linde A. Reactivation of human herpesvirus 6 during pregnancy. J Infect Dis 1999; 180:2035-8.
14. Drago F, Broccol F, Zaccaria E, Malnati M, Cocuzza C, Lusso P, Rebora A. Pregnancy outcome in patients with pityriasis rosea. J Am Acad Dermatol 2008; 58: S78-83.
15. Drago F, Ciccarese G, Rebora A, Broccolo F, Parodi A. Pityriasis rosea: A comprehensive classification. Dermatology. 2016; 232:431–7.
16. Sharma L, Srivastava K. Clinicoepidemiological study of pityriasis rosea. Indian J Dermatol Venereol Leprol 2008; 74:647-9.
17. Neoh CY, Tan AW, Mohamed K, Sun YJ, Tan SH. Characterization of the inflammatory cell infiltrate in herald patches and fully developed eruptions of pityriasis rosea. Clin Exp Dermatol 2010; 35:300-4.
18. González LM, Allen R, Janniger CK, Schwartz RA. Pityriasis rosea: an important papulosquamous disorder. Int J Dermatol 2005; 44:757-64.
19. Bianca S, Ingegnosi C, Ciancio B, Gullotta G, Randazzo L, Ettore G. Pityriasis rosea in pregnancy. Reprod Toxicol 2007; 24:277-8.
20. Mahajan K, Relhan V, Relhan AK, Garg VK. Pityriasis Rosea: An Update on Etiopathogenesis and Management of Difficult Aspects. Indian J Dermatol. 2016; 61(4):375-84.
21. Drago F, Ciccarese G. Pityriasis Rosea: An Update on Etiopathogenesis and Management of Difficult Aspects – A Reply. Indian J Dermatol. 2017; 62(1):95.
22. Drago F, Ciccarese G, Herzum A, Rebora A, Parodi A. Pityriasis Rosea during Pregnancy: Major and Minor Alarming Signs. Dermatology 2018; 234:31–36.
23. Chuh V. Zawar G. Sciallis W. Kempf W. A position statement on the management of patients with pityriasis rosea A. J Eur Acad Dermatol Venereol. 2016; 30(10):1670-1681.
24. Drago F, Ciccarese G, Rebora A, Parodi A. The efficacy of macrolides and acyclovir in pityriasis rosea. Indian J Dermatol Venereol Leprol 2015; 81:56.
25. Overton RW. Pityriasis rosea in pregnancy: a case report. J Iowa Med Soc 1969; 58:1239-40.
26. Cruz MJ, Baudrier T, Azevedo F. Atypical pityriasis rosea in a pregnant woman: first report associating local herpes simplex virus 2 reactivation. J Dermatol 2012; 39:490-2.
27. Salin RW, Curtis AC, Wheeler A. The treatment of pityriasis rosea with convalescent plasma, gamma globulin, and pooled plasma. AMA Arch Dermatol 1957; 76:659-62.
28. Zeligman I. Cortisone therapy for pruritic pityriasis rosea. Bull School of Medicine, University of Maryland. 1955; 40:76-7