2019
2
Autores:
Catalina Renata Elizalde M, Peña Dieste P, Laura San Juan M, Cristina Fernandez García, Valentina Fernández L
Tipo de documento:
Casos ClínicosPORFIRIA AGUDA INTERMITENTE CON DEBUT EN EL PUERPERIO
Contenido del documento:
RESUMEN
Objetivo: Las porfirias son trastornos que resultan de un defecto enzimático específico en la vía bioquímica de las porfirias. Los síntomas clínicos incluyen dolor abdominal, alteraciones gastrointestinales y manifestaciones psiquiátricas.
Material y métodos: Mujer de 41 años, con diabetes gestacional y parto por cesárea hace 7 días, que acude a urgencias con convulsiones tónicoclónicas. En tratamiento antibiótico por infección de la herida quirúrgica. Los exámenes de laboratorio demostraron hiponatremia, hipokalemia y anemia. El diagnóstico de porfiria aguda intermitente (PAI) fue confirmado por el hallazgo de porfirinas elevadas en orina. La paciente fue dada de alta después de dos semanas.
Resultados: se solicita un test rápido de PBG cuantitativo en orina, que resulta positivo (>10 mg PBG / g creatinina), por lo que se solicita un estudio completo de la enfermedad y se envían muestras a un hospital de referencia para análisis bioquímico y genético de PBGD/HMBS (Hidroximetilbilano sintetasa /PBG‐desaminasa). Presenta la mutación c.815_818 del AGGA, que se trasmite de forma autosómica dominante, aunque con baja penetrancia.
Conclusión: El diagnóstico de PAI es complejo debido al amplio espectro de síntomas, además el embarazo y el puerperio puede exacerbar la enfermedad.
PALABRAS CLAVE: porfirias, convulsiones, embarazo.
SUMMARY
Objective: Porphyrias are a heterogeneous group of either inherited or acquired disorders of the enzymatic biosynthesis of porphyrins. In these diseases, specific abnormalities of enzymes cause diverse clinical manifestations including abdominal pain, gastrointestinal alterations and psychiatric manifestations.
Materials and methods: A 41-year-old woman with gestational diabetes and cesarean delivery 7 days ago with intradural anesthesia. She was admitted with tonic clonic seizures and diffuse abdominal pain. She is under antibiotic treatment for infection of the surgical wound. Laboratory exams showed hyponatremia, hypokalemia and anemia. A diagnosis of acute intermittent porphyria was confirmed with elevated porphyrinis in urine.
Results: a rapid test of quantitative PBG in urine is permormed, which is positive (>10 mg PBG / g creatinin), so a complete study of the disease is requested and samples are sent to a reference hospital for biochemical and genetic analysis of PBGD / HMBS (Hydroxymethylbilane synthetase / PBG-deaminase). It presents the c.815_818 mutation of the AGGA, which is transmitted in an autosomal dominant manner, although with low penetrance.
Conclusion: The diagnosis of acute intermittent porphyria is complex because of the wide spectrum of symptoms. Pregnancy or the puerperium might exacerbate the disease
KEY WORDS: Porphyrias, seizures, pregnancy.
INTRODUCCIÓN
La hipertensión arterial (HTA), junto con las hemorragias y las infecciones, es una de las principales causas de morbimortalidad durante el puerperio1,2.
Dentro del diagnóstico diferencial de la HTA en una gestante se encuentran las porfirias3. Las porfirias son un grupo de enfermedades metabólicas heterogéneas desde el punto de vista molecular, generalmente hereditarias, ocasionadas por deficiencia en las enzimas que forman las porfirinas, encargadas de la síntesis del grupo hemo. Esta deficiencia produce un aumento de las porfirinas o de sus precursores (ácido aminolevulínico [ALA] y porfobilinógeno [PBG]) en los fluidos biológicos.
En mujeres jóvenes se presentan como crisis recurrentes en relación con la menstruación, los anticonceptivos orales, los progestágenos, la hiperemesis gravídica y, en especial, con la gestación.
CASO CLÍNICO
Puérpera de 41 años, con diabetes gestacional y parto por cesárea hace 7 días, con anestesia intradural, y en tratamiento actualmente con antibioterapia oral por infección de la herida quirúrgica.
Acude a urgencias de nuestro hospital refiriendo dolor abdominal y una crisis tonicoclónica, la cual se repite en urgencias cediendo con Diazepan intravenoso (iv). Al objetivarse tensión arterial (TA) elevada nos consultan para descartar eclampsia. En la analítica destaca un Na+ 120, Cl- 83, GOT 58, GPT 31, Osm 246, Osm orina 218. A la exploración el abdomen es blando y depresible, doloroso a la palpación profunda en hipocondrio derecho.
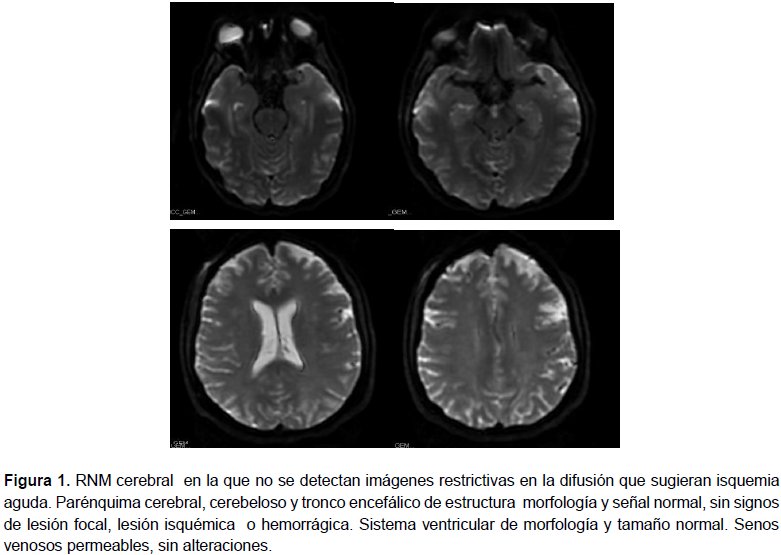
Durante su estancia en boxes convulsiona de nuevo; se le administra ácido valproico iv y se deriva a la Unidad de Medicina Intensiva (UMI), donde realizan una ecografía de abdomen, un TAC craneal y una RNM cerebral (figura 1) informados todos como normales.
La paciente está consciente pero desorientada en espacio, muy dolorida y no dirige la mirada cuando se le habla. La HTA (162/98 mmHg) se trata inicialmente con labetalol iv en perfusión y nifedipino, pero persisten TA elevadas a pesar de ello, por lo que se añade doxazosina vía oral (vo). Ante la sospecha de un síndrome de secreción inadecuado de ADH (SIADH), se trata la hiponatremia con suero salino hipertónico y restricción hídrica4.
Se realiza interconsulta a Cirugía General, Digestivo, Neurología y Psiquiatría descartando patología. Posteriormente, el servicio de Endocrinología solicita determinaciones hormonales con resultado de T4 libre alta. La paciente continúa con dolor abdominal intenso que no cede con analgesia pautada, hasta el extremo de ser necesario administrarle morfina.
Ante el diagnóstico de SIADH sin causa justificada, convulsiones, dolor abdominal persistente con estreñimiento pertinaz, T4 libre alta sin síntomas de hipertiroidismo, HTA, taquicardia y alteraciones del comportamiento (apatía) que presenta la paciente, se sospecha una porfiria aguda intermitente (PAI), y se solicita un test rápido de PBG cuantitativo en orina, que resulta positivo (>10 mg PBG / g creatinina), por lo que se solicita un estudio completo de la enfermedad y se envían muestras a un hospital de referencia para análisis bioquímico y genético de PBGD/HMBS (Hidroximetilbilano sintetasa /PBG‐desaminasa). La paciente presenta la mutación c.815_818 del AGGA, que se trasmite de forma autosómica dominante, aunque con baja penetrancia5,6.
Se instaura por lo tanto tratamiento con suero glucosado, hemina y morfina. Tras normalizarse la TA, se suspende el tratamiento antihipertensivo y debuta con hipotensión arterial severa, resuelta con daño miocárdico secundario (el electrocardiograma presenta taquicardia sinusal con inversión de onda T).
DISCUSIÓN
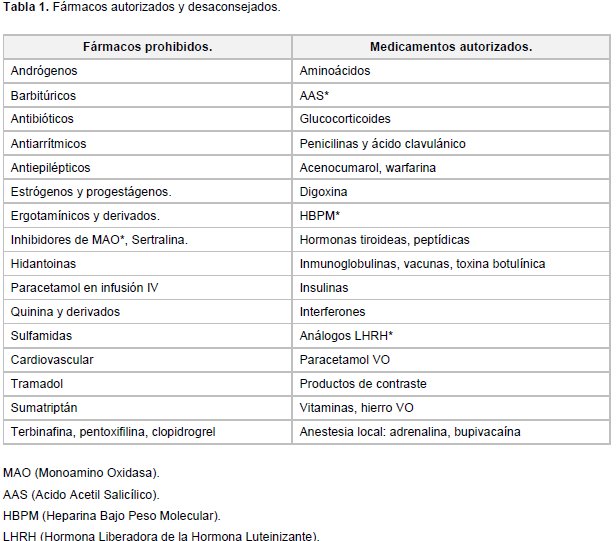
En el caso de nuestra paciente, con los 3 signos clínicos básicos iniciales (HTA en puerperio, convulsiones y SIADH) nos planteamos una larga lista de diagnósticos diferenciales. Entre ellos por supuesto la posibilidad de una Eclampsia, la cual descartamos por la ausencia de proteinuria en orina (a pesar de que existen formas atípicas o incompletas que pueden presentarse sin proteinuria). Otra opción era la Encefalopatía posterior reversible, una entidad clínico-radiológica que puede presentarse de forma aguda o subaguda y cuyo síntoma y signo guía son las convulsiones generalizadas acompañadas de una prueba de imagen en la que se objetive edema cerebral posterior transitorio, lo cual pudimos descartar en nuestra paciente puesto que tanto el TAC como la RMN cerebral fueron normales. Por último la PAI, enfermedad en la que cuesta pensar, pero que una vez que se sospecha es de fácil y rápido diagnóstico. En nuestro caso fue gracias al servicio de Endocrinología quienes con la suma de HTA, convulsiones, SIADH sin causa justificada, dolor abdominal persistente, T4L alta sin síntomas y alteraciones en comportamiento (apatía) decidieron solicitar el test rápido de PBG en orina, dando como resultado positivo. La PAI o “Porfiria Sueca”, llamada así por la prevalencia en ese país (1/1000), es la forma más frecuente de las Porfirias Agudas. Se estima en 1-2/15.000 su prevalencia general. Se asocia a un déficit de la enzima PBG-D (Porfobilinógeno Desaminasa) causado por una gran variedad de mutaciones. La mayoría de los portadores permanecen asintomáticos si no concurren factores desencadenantes como en nuestro caso, en el que fueron el ayuno prolongado, la cesárea, la infección de la herida quirúrgica, los desequilibrios hormonales y los fármacos empleados: piperacilina-tazobactam, metamizol y metoclopramida (tabla 1).
Los signos y síntomas son consecuencia de una disfunción global del sistema nervioso: autónomo (dolor abdominal, náuseas, vómitos, estreñimiento, íleo, hipertensión, taquicardias y sudoración), periférico (neuropatía sensitiva y motora que puede afectar a la musculatura respiratoria) y central (ansiedad, confusión, insomnio, alucinaciones, agitación, convulsiones (20%), depresión e incluso la alteración de la hormona antidiurética (SIADH))8, 9 (Tabla 2).
El diagnóstico se fundamenta en la clínica, los antecedentes familiares o personales y la repetición de factores desencadenantes10. Durante la crisis, la eliminación urinaria de precursores es elevada y produce un tinte típicamente oscuro de la orina que es demostrable mediante el test de Hoesch. Un test negativo prácticamente descarta que un dolor abdominal sea debido a una crisis porfírica. Obviamente, los estudios bioquímicos y genéticos más completos permitirán tipificar la variedad de Porfiria11, 12.
El ataque agudo constituye una urgencia médica, y requiere tratamiento hospitalario13. Se basa en la tríada de infusión venosa de altas dosis de glucosa, que reprime la actividad de la ALA-S; infusión de hematina iv precoz (albuminato-arginato 3-4 mg/kg/ día durante cuatro días), que permite la corrección del déficit de hemo, y administración de Beta-bloqueantes (propanolol), que son capaces de frenar la hiperactividad simpática14.
La mayoría de pacientes con PAI logran una remisión clínica duradera como en este caso, tan sólo una minoría presenta ataques recurrentes. El tipo de mutación en el gen de la porfobilinógeno deaminasa, y también factores asociados al estilo de vida, pueden determinar el curso de la remisión. El estilo de vida, con minimización del estrés, peso ponderal y una dieta correcta parece constituir un factor de importancia mayor para determinar la remisión dela enfermedad 15,16.
CONCLUSIONES
La PAI en pacientes gestantes puede simular cuadros de abdomen agudo, como apendicitis aguda, embarazo ectópico accidentado e incluso abortos. Un retraso en el diagnóstico y/o la no instauración inmediata del tratamiento comporta riesgo de complicaciones neurológicas graves, De ahí la importancia que tienen una actuación médica adecuada y que el paciente y la familia estén bien informados de los factores de prevención: evitar el riesgo forma parte del tratamiento (evitar los fármacos nocivos y las dietas estrictas).
A medida que avanza la gestación pueden surgir complicaciones, como amenaza de parto prematuro, hipertensión del embarazo, e incluso afección fetal, (ascitis o cuadros de retraso de crecimiento intrauterino). No existen criterios obstétricos para la vía del parto. Asimismo, está muy indicada la anestesia epidural.
BIBLIOGRAFÍA
1. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol 2000; 183: S1-S22.
2. Puy H, Gouya L, Deybach JC. Porphyrias. Lancet. 2010;375:924–37.
3. A. Gómez José, J. Campos Blanco, J.L. Pérez Fijo, M.J. Pérez Galisteo, F. Rabadán Bujalance. Porfiria. Diagnóstico diferencial en dolor abdominal. An Med Interna, 20 (2003), pp. 327-328.
4. Lopez Montes A, Lorenzo I, Perez Martınez J. Porphyria and inappropriate antidiuretic hormone syndrome. Nefrologia. 2007; 24: 85–8.
5. Marsden JT, Rees D. Urinary excretion of porphyrins, porphobilinogen and d-aminolaevulinic acid following an attack of acute intermittent porphyria. J Clin Pathol. 2014;67:60–5.
6. Nordmann Y, Puy H, da Silva V, Simonin S, Robreau AM, Bonaiti C, et al. Acute intermittent porphyria: Prevalence of mutations in the porphobilinogen deaminase gene in blood donors in France. J Intern Med. 1997;242: 213–7.
7. Usalan C, Erdem Y, Altun B, Gursoy M, Celik I,Yasavul U, et al. Severe hyponatremia due to SIADH provoked by acute intermittent porphyria. ClinNephrol.1996;45:418.
8. Hoorn EJ, Zietse R. Hyponatremia revisited: Translating physiology to practice.
NephronPhysiol. 2008; 108:46–59.
9. B. Obón-Azuara, I. Gutiérrez-Cía, B. Villanueva-Anadón, E. Millastre-Bocos.
Manifestaciones neurológicas asociadas a Porfiria aguda intermitente. Rev Neurol, 43 (2006), pp. 378-379
10. H. Thadani, A. Deacon, T. Peters. Diagnosis and management of porphyria. Br Med J, 320 (2000), pp. 1451-1647
11. Kushner JP. Laboratory diagnosis of the porphyrias. NEnglJMed.1991; 324:1432–4.
12. Aarsand AK, Villanger JH, Støle E, Deybach JC, Marsden J, To-Figueras J, et al. European specialist porphyria laboratories: Diagnostic strategies, analytical quality, clinical interpretation, and reporting as assessed by an external quality assurance program. Clin Chem. 2011;57:1514–23.
13. K.E. Anderson, J.R. Bloomer, H.L. Bonkovsky, J.P. Kushner, C.A. Pierach, N.R. Pimstone, et al. Recommendations for the diagnosis and treatment of the acute porphyrias. Ann Intern Med, 142 (2005), pp. 439-450
14. American Porphyria Foundation. Drugs and porphyria. Drugs considered unsafe and safe in acute porphyrias [Internet]. Houston: American Porphyria Foundtion; c2007. [cited 2008 Apr 2]. Available from:
http://www.porphyriafoundation.com/about_por/drugs/drugs02.html.
15. Valle’s M, Benito J, Pelayo R, Vidal J. Prognosis of polyneuropathy associated to intermittent acute porphyria. Med Clin (Barc). 2011;137:191.
16. Herrero C, et al. Porfiria aguda intermitente: seguimiento a largo término de 35 pacientes. Med Clin (Barc). 2014.
http://dx.doi.org/10.1016/j.medcli.2014.06.012