2018
6
Autores:
Carlos Cortes Caballero, Silvia Nathalia Vera Campos, Margarita Rosa Mogollón zehr, Juan Manuel Deluque González, Jorge Adolfo Pinto Vasquez, Yanina Andrea Calderón Bautista
Tipo de documento:
Casos ClínicosREACCIÓN DECIDUAL ENDOMETRIAL: UN EFECTO INESPERADO DEL DISPOSITIVO INTRAUTERINO LIBERADOR DE LEVONORGESTREL. REPORTE DE CASO.
Contenido del documento:
RESUMEN
La reacción decidual que se genera en el endometrio involucra el estroma y las glándulas, esta ocurre por sobre estimulación de la progesterona en el tejido. Es inducida por el dispositivo liberador de levonogestrel, el cual es utilizado para el tratamiento de la hemorragia uterina anormal en mujeres postmenopáusicas. Sin embargo, dada su amplia gama terapéutica, sus efectos secundarios no siempre son predecibles y no existe mucha evidencia en la literatura que correlacione la susceptibilidad de la paciente con la aparición de este cuadro morfológico. Se presenta un reporte de caso de mujer posmenopáusica que recibió este tratamiento por 17 meses y presento una reacción decidual exagerada con el objetivo de dar a conocer la presentación histopatológica de la reacción decidual poco documentada y aumentar los conocimientos relacionados con el dispositivo intrauterino.
PALABRAS CLAVE: dispositivo intrauterino, hemorragia uterina anormal, levonorgestrel.
SUMMARY
The decidual reaction that is generated in the endometrium involves the stroma and the glands, this occurs due to over stimulation of progesterone in the tissue. It is induced by the levonogestrel- releasing device, which is used for the treatment of abnormal uterine bleeding in postmenopausal women. However, given its wide therapeutic range, its side effects are not always predictable and there is not much evidence in the literature that correlates the patient’s susceptibility to the appearance of this morphological case. We present a case report of a postmenopausal woman who received this treatment for 17 months and presented an exaggerated decidual reaction in order to publicize the histopathological presentation wich is poorly documented and increase knowledge related to the intrauterine device.
KEY WORDS: intrauterine device, abnormal uterine bleeding, levonorgestrel.
El dispositivo intrauterino liberador de levonorgestrel es un método anticonceptivo reversible, de larga duración, altamente eficaz y con un índice de pearl de 0.16. Consta de una estructura de plástico en forma de T, en cuyo brazo vertical contiene un reservorio de 52 mg de levonorgestrel que se libera a razón de 20 μg/día y tiene una duración o vida efectiva de 5 años1.
El dispositivo tiene acción local en el cérvix y endometrio, siendo en este última su efecto más importante2; está indicado en mujeres que precisan anticoncepción eficaz y duradera, además, también es considerado como parte del tratamiento de la hemorragia uterina anormal, endometriosis, leiomiomas uterinos, adenomiosis y en la profilaxis de hiperplasia endometrial en pacientes en la etapa del climaterio, e incluso es de gran utilidad en el manejo del cáncer de endometrio en estadio temprano.
Entre sus efectos secundarios se encuentra la reacción decidual, esta consiste en una transformación del estroma en decidua completa o incompleta con diversos grados de necrosis o inflamación, causada por el aumento de estímulo de la progesterona3, muy poco común en pacientes posmenopáusicas; sin embargo, es un cuadro que también se ha visto asociado a la terapia de remplazo hormonal, lesiones neoplásicas o no neoplásicas del ovario y glándula adrenal.
Reporte de caso:
Paciente de 58 años con formula obstétrica G4P3C1 que presentaba un cuadro clínico de dos años de evolución, que consistía en sangrado uterino anormal, dolor pélvico crónico, dispareunia y flujo vaginal abundante de coloración blanquecina que no cedió al tratamiento antibiót ico.
Al examen ginecológico se encuentra dolor a la movilización del cuello, con tamaño uterino ligeramente aumentado.
Se realiza una ecografía transvaginal que reporta leiomioma intramural, agrandamiento uterino difuso, e imágenes sugestivas de adenomiosis. Se toma un cuadro hemático encontrándose una hemoglobina de 10 gm por 100 ml, y un perfil ferrocinético disminuido, por lo cual se hace diagnóstico de anemia ferropénica subsecuente a hemorragia crónica. Como tratamiento se decide utilizar el dispositivo intrauterino liberador de levonorgestrel (mirena), sin embargo, en 17 meses la hemorragia no respondió a este. Se propone por la edad, paridad satisfecha y por la severidad del cuadro clínico una histerectomía abdominal, que es realizada el 15 de julio de 2017, con hospitalización de tres días sin complicaciones. El útero es enviado a patología para su diagnóstico histológico.
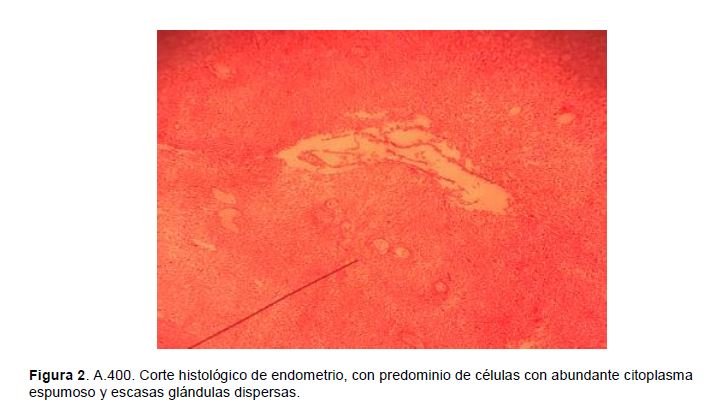
Descripción microscópica: El endocérvix presenta glándulas quísticas, con un infiltrado linfocitico discreto, células plasmáticas, eosinófilos y células gigantes multinucleadas de tipo cuerpo extraño. En el resto del miometrio se observan glándulas tapizadas por un epitelio cúbico simple y estroma endometrial. El endometrio se ha transformado en una gruesa banda en la que predomina el estroma representado por células grandes de forma ovoide, abundante citoplasma espumoso que recuerdan decidua, vasos sanguíneos con paredes prominentes y algunos con luz estrecha, glándulas escasas y dispersas, de tamaño variable revestidas por epitelio cúbico simple. (Figura 2).
El diagnostico microscópico mostró marcada reacción decidual; además se encontró endocervicitis crónica con quistes de retención y reacción granulomatosa de cuerpo extraño. Se confirmaron hallazgos ecográficos de leiomioma intramural y adenomiosis.
La paciente firmo consentimiento informado, autorizando la divulgación científica del caso. Se garantizó confidencialidad, protegiendo su identidad y preservando sus derechos.
Reporte patología:
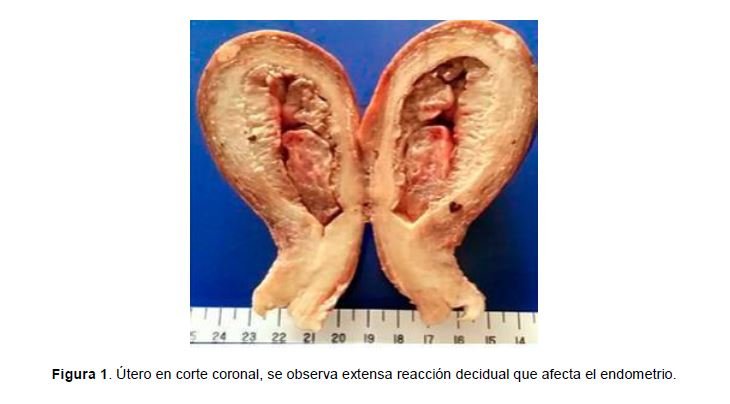
Descripción macroscópica: se recibe útero con anexos adheridos al cuerpo con un peso de 196 gr, mide 10.5x7x 5.3 cms. El miometrio es pálido y firme; promedio 1.2cm. El espesor del endometrio es 1.9cm (Figura 1)
Discusión:
El sangrado uterino en la posmenopausia se refiere al que se presenta después de un año de amenorrea, sin uso de terapia hormonal4.
Todas las mujeres en esta etapa con sangrado uterino inesperado deben ser evaluadas para descartar cáncer endometrial debido a que esta es la causa hasta en un 10% de los casos. Sin embargo, la más común, es la atrofia endometrial. Igualmente, cabe señalar que en los primeros años también es frecuente, la hiperplasia endometrial, los pólipos y leiomiomas submucosos5.
En nuestro caso se puede atribuir al leiomioma como posible origen del sangrado, a pesar de que su prevalencia es diez veces mayor en la mujer premenopausica. Por otro lado, se encontró también la presencia de adenomiosis, sin embargo, esta no genera sintomatología después de la menopausia, en ausencia de terapia hormonal.
Los tratamientos médicos para hemorragia uterina anormal incluyen antiprostaglandinas, antifibrinoliticos y terapias hormonales. Los quirúrgicos, consideran la histerectomía y ablación endometrial, pero estos son indicados solo en casos de paridad satisfecha6. En nuestro caso se prefirió optar primero por un tratamiento médico conservador de terapia hormonal con dispositivo intrauterino liberador de levonorgestrel. Este se comporta como cuerpo extraño dentro del útero e induce una reacción inflamatoria. Además, la liberación mantenida de levonorgestrel produce espesamiento del moco cervical, supresión del crecimiento endometrial, atrofia de glándulas, reacción decidual del estroma y disminución de la síntesis de receptores. En nuestro caso se encontró reacción granulomatosa de cuerpo extraño lo cual coincide con este mecanismo de acción.
Este dispositivo es efectivo contra la hemorragia uterina anormal, siendo comparado con otros métodos como ablación y resección endometrial7. También ha sido utilizado en terapia de reemplazo hormonal, para contrarrestar la hiperplasia endometrial inducida por estrógenos, tiene efecto protector uterino cuando se está suministrando tamoxifeno8, y es una alternativa a la histerectomía en el tratamiento de la hiperplasia endometrial típica y atípica9.
Tiene una amplia gama de usos terapeuticos, es costo-efectivo y la descripción de sus efectos adversos es baja, en la literatura no se encontró reporte de reacción decidual causada por este dispositivo. Ademas se deben tener a consideración situaciones médicas en las que se desaconseja su uso, como cefalea migrañosa, acné, depresión, caída del cabello ; y sus contraindicaciones como tumores dependientes de progestágenos, enfermedad pélvica inflamatoria, cervicitis, endometritis posparto, enfermedad hepática aguda, displasia cervical, aborto séptico en los últimos 3 meses, hipersensibilidad al principio activo o a alguno de los excipientes.
La progesterona produce una transformación del estroma en decidua completa o incompleta, las células pueden presentar pleomorfismo, hipercromatismo e irregularidades nucleares y las glándulas endometriales pueden mostrar el fenómeno de Arias Stella con cambios hipersecretores y atipias celulares desde moderadas a severas, cambios metaplasicos de tipo ciliado, morulados con grupos de células escamosas benignas, células eosinofílicas, rosadas y atipia nuclear, lo mismo que hiperplasia simple, sin atipia o con atipia y alteraciones menores de la arquitectura como glándulas irregularmente dilatadas. También se observan cambios mucinosos, en el que el estroma exhibe este material extracelular con aspecto basófilo y mixoide. Pueden encontrarse cambios inflamatorios con infiltrado granulocítico estromal denso, infiltración de neutrófilos subepiteliales o intraepiteliales, células plasmáticas, en grupos o individuales y ocasionales y en muy baja proporción se observan ulceraciones focales.10 Estos cambios histológicos son uniformes al cabo de un mes de la inserción y se mantienen estables durante el uso prolongado del dispositivo. La remoción de este produce una regresión en su morfología y función.
Los cambios encontrados en el endometrio, como el fenómeno de Arias Stella, fue encontrado por el Dr. Arias Stella; estudió dos pacientes que ingresaron por metrorragias y que mostraron en los estudios del tejido endometrial alteraciones que fueron interpretadas por sus profesores como atipias consistentes con neoplasias glandulares, pero descubrió que eran secundarias a estímulos hormonales11.
La supresión endometrial que ocurre por el uso de progesterona y la atrofia glandular podría estar relacionadas con alteraciones en la expresión de factores de crecimiento endometrial12. La supresión del factor de crecimiento insulínico 1 ha sido postulado como uno de los mecanismos moleculares para la actividad antiproliferativa de la progesterona.
En nuestro caso había una marcada reacción decidual por el efecto local producido por la liberación de levonorgestrel que género una supresión del endometrio. Las alteraciones descritas en la literatura y observados en nuestro caso se debieron a los efectos directos de la progesterona en el endometrio y las reacciones de tipo mecánico del dispositivo: incluyen atrofia glandular, reacción decidual estromal, e infiltración de leucocitos. A pesar de estas, poco frecuentes, debe promoverse su uso dado a su alta eficacia y continuidad. Se debe ofrecer a la paciente información y asesoramiento del método elegido, asegurándose que la mujer ha entendido los posibles efectos secundarios generados
BIBLIOGRAFÍA
1. Martínez F, Haimovich S, Avecilla-Palau A, Bugella I, Giménez E, Yáñez E. DIU de levonorgestrel como método anticonceptivo: aceptación, continuidad y asesoramiento en España. Prog Obstet Ginecol. 2008;51(11):664-72
2. Peláez Mendoza Jorge. Utilidad del sistema intrauterino liberador de levonorgestrel (Mirena) en el tratamiento de las metrorragias. Rev Cubana Obstet Ginecol. 2010; 36( 2 ): 121-129
3. Vasconcellos C Adriana, Villagrán V Eduardo, Peña Patricio, Miska Werner, Sánchez G Raúl.
Endometrio con reacción decidual idiopática en una mujer postmenopáusica: evaluación inmunocitoquímica de receptores de estrógeno, de progesterona y de su proteína transportadora (CBG). Rev. méd. Chile. 2002 Abr; 130( 4 ): 425-429.
4. Breijer M. Diagnostic Strategies for Postmenopausal Bleeding. Obstetrics and Gynecology International 2010: 1155
5. Lieng M, Istre O, Qvigstad E. Treatment of endometrial polyps: a systematic review. Acta Obstet Gynecol Scand 2010; 89:992
6. Ashraf MN, Habib-Ur-Rehman A, Shehzad Z, AlSharari SD, Murtaza G. Clinical efficacy of levonorgestrel and norethisterone for the treatment of chronic abnormal uterine bleeding. J Pak Med Assoc. 2017 Sep;67(9):1331-1338.
7. Crosignani PG, Vercellini P, Mosconi P, et al. Levonorgestrel-releasing intrauterine device versus hysteroscopic endometrial resection in the treatment of dysfunctional uterine bleeding. Obstet Gynaecol. 1997; 90:257-256
8. Gardner FJ, Konje JC, Abrams KR, et al. Endometrial protection from tamoxifen-stimulated changes by a levonorgestrel-releasing intrauterine system: a randomised controlled trial. Lancet. 2000;356:1711-1717.
9. Wildermeesrsch D, Dhont M. Treatment of nonatypical endometrial hyperplasia with a levonorgestrel-releasing intrauterine system. Am J Obstet Gynecol. 2003;188: 1297-1298.
10. Hejmadi R; Chaudhri S; Ganesan R; Rollason T; Morphologic Changes in the Endometrium Associated With the Use of the Mirena Coil: A Retrospective Study of 106 Cases; International Journal of Surgical Pathology / Vol. 15, No. 2, April 2007
11. Arias-Stella J; atypical endometrial changes associated with the presence of chorionic tissue; e M. A. Archives of Pathology August 1954, Vol. 58, pp. 112-128 Copyright, 1954, by American Medical Association
12. Rutanen EM, Salmi A, Nyman T. mRNA expression of insulin-like growth factor-I (IGF-I) is suppressed and those of IGF-II and IGF-binding protein are constantly expressed in the endometrium during use of an intrauterine levonorgestrel system. Mol Hum Reprod. 1997;3:749- 754.