2015
3
Autores:
Juan Carlos Bustos Vidal1
Instituciones:
1Unidad de Perinatología, Departamento de Obstetricia y Ginecología, Hospital San Juan de Dios, Universidad de Chile.
Tipo de documento:
Artículo EspecialTROFOBLASTO, IMPRONTA Y CONFLICTO GENÓMICO EN GINECO-OBSTETRICIA
Contenido del documento:
RESUMEN
La teoría del Conflicto Genómico es parte de la biología evolutiva y actúa en los mamíferos a través del mecanismo de impronta genética, estos genes cumplen un rol central en el desarrollo fetal y del trofoblasto contribuyendo a un balance entre los requerimientos nutricionales fetales (genes con impronta paterna) y el aporte materno (genes con impronta materna). El desbalance de estos genes tiene implicancias en la etiopatogenia de diversas patologías en Gineco-Obstetricia: en Medicina Fetal (preeclampsia, diabetes gestacional, síndrome de Beckwith-Wiedemann), oncología (mola completa, mola incompleta, teratomas) y fertilidad. Se presenta un caso de displasia mesenquimática placentaria asociado a Beckwith-Wiedemann.
PALABRAS CLAVE: Conflicto genómico, impronta genética, trofoblasto
SUMMARY
The theory of Genomic Conflict is part of evolutionary biology and acts in mammals through the mechanism of genetic imprinting, these genes play a central role in fetal and trophoblastic development producing a balance between fetal nutritional requirements (genes with paternal imprinting) and maternal supply (genes with maternal imprinting). The imbalance of these genes has implications in the pathogenesis of various diseases in Obstetrics and Gynecology: in Fetal Medicine (preeclampsia, gestational diabetes, Beckwith- Wiedemann syndrome), oncology (complete and partial hydatiform mole, teratomas) and fertility. A case of placental mesenchymal dysplasia associated with Beckwith-Wiedemann is presented.
KEY WORDS: Genomic conflict, genetic imprinting, trophoblast
INTRODUCCIÓN
En nuestra práctica clínica como gineco-obstetras se plantean múltiples preguntas sobre aspectos de la reproducción que -por evidentes y repetidas- no han sido claramente contestadas: ¿por qué la preeclampsia es única en el humano?, ¿por qué la mola es tan agresiva?, ¿por qué la mola con cariotipo 46 XX no se desarrolla como un feto femenino normal?, ¿los teratomas son óvulos partenogenéticos? La respuesta a estas preguntas puede hallarse en algunas hipótesis biológicas en boga en las últimas décadas como la Teoría del Conflicto Genómico y la Impronta Genética.
TEORÍA DEL CONFLICTO GENÓMICO Y LA IMPRONTA GENÉTICA
El Conflicto Genómico es una teoría de la ciencia de la biología evolutiva (1), que está implicada en numerosos aspectos reproductivos y no reproductivos. En el ámbito de la ginecología y obstetricia tiene un rol en varias áreas como medicina perinatal, oncología e infertilidad.
Clásicamente, la teoría de la evolución se ocupa del conflicto genómico interespecies (1). Un caso típico es la lucha evolutiva entre predadores versus presas, quienes evolucionan en forma conjunta: el predador mejorando sus técnicas de caza y depredación, y la presa mejorando sus técnicas de escape o protección manteniendo un balance entre ellos; un desbalance puede significar la extinción de una de las especies. Esta evolución conjunta ha sido llamada la Hipótesis de la Reina Roja aludiendo al pasaje de la novela de Lewis Carroll “Alicia a través del espejo”, segunda parte de “Alicia en el País de las Maravillas”, en aquella historia, los habitantes del País de la Reina Roja deben correr lo más rápido que puedan, sólo para permanecer donde están, pues el país se mueve con ellos. Otro tipo de conflicto es el que enfrenta a individuos de la misma especie en el cual prevalece y se reproduce el fenotipo más ventajoso (selección natural de Darwin) (2).
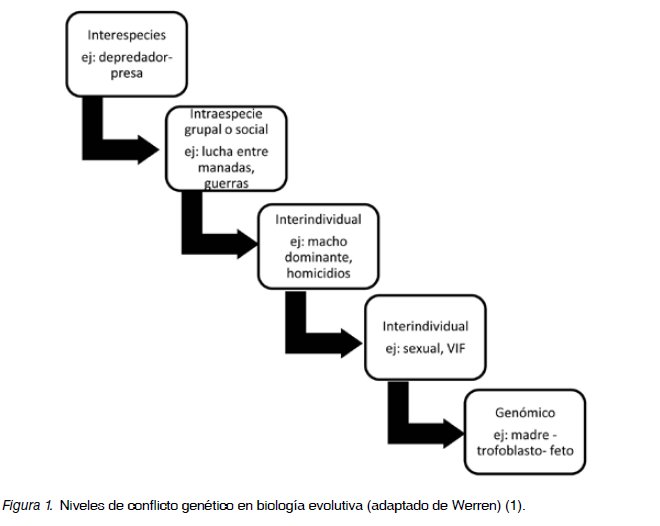
En 1989, Haig planteo la Hipótesis evolutiva del “Conflicto Genómico” (1,3), que consiste en una extensión de la selección natural, ya no solamente como la lucha inter o intra especies, sino que entre genomas (Figura 1). El conflicto genómico aparece en los mamíferos placentarios y se expresa como una lucha entre los genomas de padre y madre y manifestándose específicamente en el embarazo a través de un conflicto entre madre y feto. Esto es más evidente en las especies multizigóticas con embarazos múltiples, donde el padre privilegia su propia paternidad a través de aumentar el tamaño de su descendencia, incluso a expensas de la vida de la madre (y de los otros hermanos), por otro lado el interés de la madre es distribuir equitativamente sus recursos en toda su progenie, aunque resulte el nacimiento de crías pequeñas.
La hipótesis del conflicto genómico actúa a través de la aparición de diferencias epigenéticas (postconcepcionales) (3,4,5) entre los genomas materno y paterno. Esto es mediado por el mecanismo de imprinting o impronta genética, o de sellado: la mayor parte de los genes se expresan por ambos alelos paternos y maternos, es decir, son equivalentes funcionalmente, sin embargo, existe un grupo de genes cuya expresión es funcionalmente distinta dependiendo del origen parental de donde provienen, esta expresión diferencial se logra a través de un sello o impronta (en general por metilación del DNA) que impide la transcripción del alelo.
Los genes imprintados, por lo tanto, se expresan de forma distinta según provengan del padre o de la madre (3,5), ambos genomas tienen silenciados distintos grupos de genes y existe una asimetría de los genomas materno y paterno que es necesaria para el correcto desarrollo embrionario. Esto se comprobó en la década de 1980 en experimentos de trasplante de pronúcleos en embriones unicelulares en mamíferos, donde se producían embriones ginogenontes (6) (con un genoma diploide de exclusivo origen femenino) que no eran viables porque la placenta era pequeña; los embriones androgenontes (con genoma diploide de exclusivo origen masculino) tenían placenta grande pero escaso desarrollo fetal, por lo tanto ambos tipos de embriones eran inviables.
La cantidad de genes sellados o imprintados es pequeña, alrededor del 1-2%, en la especie humana se han identificado alrededor de 100 genes sellados, que normalmente se encuentran agrupados en los cromosomas en racimos. Estos genes codifican dos grandes tipos de fenotipos: un grupo implicado en el desarrollo y crecimiento embrionario y otro grupo de factores cognitivos y de comportamiento (7) (Tabla I).
Según la teoría del conflicto genómico los genes estimuladores de crecimiento evolucionaron hacia impronta con el alelo paterno expresado y el materno inactivo. Estos genes producen crecimiento de los tejidos extraembrionarios que tienden a aumentar los recursos que la madre suministra al feto, el ejemplo más estudiado de gen imprintado paterno es el IGF2 o insuline growth factor 2 (estimulador de crecimiento).
Al contrario, los genes inhibidores de crecimiento evolucionaron hacia impronta con el alelo paterno inactivo y el materno expresado. Estos genes maternos (con sellado paterno) producen desarrollo del feto, pero tenderían a reducir los recursos: los más estudiados son PHLDA2 (8), H19 (9) (inhibe IGF2) y p57 kip2 (10) (regulador del ciclo celular que tiene funciones en diferenciación y apoptosis), lo cual confiere a la madre una ventaja evolutiva al permitir futuros embarazos.
En la placenta humana los genes imprintados se expresan tempranamente durante la embriogénesis y en las primeras etapas fetales y se inactivan precozmente ya que el feto humano necesita nacer prematuramente y más pequeño que otros mamíferos, ya que la pelvis materna está alterada por la bipedestación. En el adulto pueden volver a expresarse como genes oncofetales en diversas neoplasias, como el gen H19 (10).
Existen diversas enfermedades debido a errores de impronta con activación de un alelo normalmente sellado o silenciamiento del único alelo expresado. Los ejemplos más estudiados son el síndrome de Prader-Willi y el síndrome de Angelman (6,9) que se deben a falla del imprinting paterno y materno respectivamente en una misma zona del cromosoma 15. También se han visto implicados en diversas neoplasias y en enfermedades mentales (6).
LA IMPRONTA GENÉTICA Y MEDICINA MATERNO FETAL
En Obstetricia y Ginecología hay varias patologías en que la impronta está alterada y que se citarán a continuación, como las patologías del crecimiento fetal (macrosomía/restricción del crecimiento fetal), diabetes gestacional y la preeclampsia. Patologías del crecimiento fetal (macrosomía).
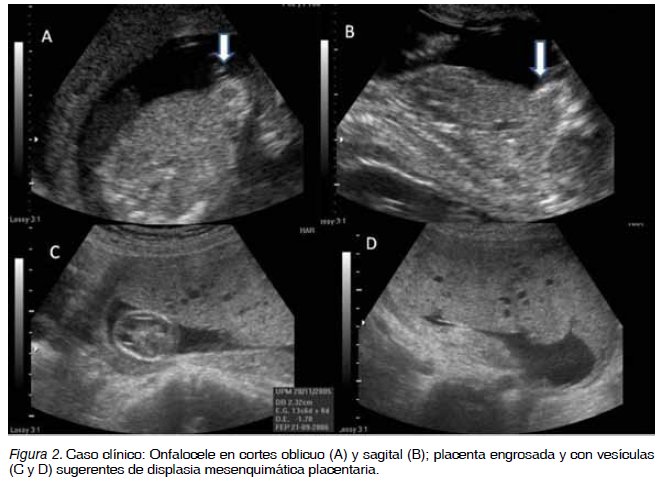
El síndrome de Beckwith-Wiedemann (SBW) (6,9) es una patología fetal rara (1/13700). Se produce por alteración de la impronta en el cromosoma 11 en la región 11p15, donde se ubica un racimo de genes imprintados con activación de IGF2 e inhibición de H19 y p57kip2, entre otros. Se produce una desinhibición del crecimiento fetal y se desarrolla macrosomía, macroglosia, hepatomegalia, onfalocele, nevo en flama y tumores en la edad infantil como tumor de Wilms y hepatoblastoma. El crecimiento placentario también es desinhibido y algunos fetos desarrollan displasia mesenquimática placentaria, preeclampsia y síndrome HELLP (11,12). Nuestra Unidad debió tratar un caso muy sugerente de SBW que desarrolló preeclampsia severa y síndrome Hellp, lamentablemente no se obtuvieron pruebas genéticas para confirmar el SBW, que se resume a continuación: MMHA. Multípara de 1, sin antecedentes importantes, embarazo de 16 semanas. Ingresa a nuestro Hospital por intenso dolor en epigastrio y dorso, náuseas y vómitos. Al examen físico: paciente en regulares condiciones generales, presión arterial de 165/100, disnea, ictericia, y dolor a la palpación de epigastrio, en hemitórax derecho hay murmullo pulmonar disminuido. En los exámenes de laboratorio destacan: anemia, trombocitopenia, alteración de enzimas hepáticas, hiperbilirrubinemia y proteinuria. La radiografía de tórax es compatible con edema pulmonar agudo. La ultrasonografía muestra feto vivo, biometría para 16 semanas con probable onfalocele, translucencia retronucal de 2 mm, hueso nasal presente, ductus venoso con flujo diastólico ausente, Doppler de uterinas y umbilical normal, placenta displásica: trofoblasto engrosado en cara anterior con numerosas vesículas (Figura 2). Se plantea el diagnóstico de Preeclampsia Severa, síndrome HELLP, edema pulmonar agudo, displasia mesenquimática placentaria y sospecha de síndrome de Beckwith- Wiedemann. Evoluciona con deterioro progresivo: hipertensión severa, ictericia, oligoanuria, bilirrubina de 8,5 mg%, plaquetas de 30 mil/mm, LDH de 680 UI, se decide interrupción del embarazo con misoprostol. Se obtiene un feto de 70 gramos con onfalocele y tejido trofoblástico de 350 gramos. La paciente mejora luego de la interrupción del embarazo, con alta al sexto día. La biopsia confirma displasia placentaria mesenquimática, no se dispone de pruebas genéticas para confirmar el síndrome de Beckwith- Wiedemann.
Diabetes gestacional (3). El conflicto genómico actúa a través de la Teoría de la Reina Roja. La placenta produce hormonas como estrógenos, lactógeno placentario y hormona de crecimiento para aumentar su disponibilidad de sustratos, estas hormonas producen en la madre resistencia a la insulina, hipoglicemia de ayuno, hipertrigliceridemia e hipoaminoacidemia. El metabolismo materno reacciona con hiperplasia de las células beta pancreática e hiperinsulinemia; además el feto produce insulinasas placentarias. En la mayoría de las pacientes el feto y la madre logran balancear el metabolismo de lis carbohidratos, pero en algunas pacientes predominan los factores fetales y aparece diabetes gestacional y macrosomía.
Patologías del crecimiento fetal (restricción del crecimiento fetal). Se relaciona a la disminución de los genes estimuladores de placenta IGF2 y aumento de PHLDA2 (8). El IGF2 está inhibido en el síndrome de Silver Russel. Esta patología es la enfermedad “inversa” del Beckwith-Wiedemann con inhibición del crecimiento fetal y placentario, los fetos evolucionan con RCIU severo y precoz e hemiatrofia somática (9).
Preeclampsia. En la génesis de la preeclampsia los autores (13,14,15) coinciden en dos hechos aparentemente relacionados: primero, que la placenta humana es la más invasiva de todos los mamíferos y segundo que la preeclampsia es una enfermedad única del ser humano. La teoría del conflicto genómico nos dice que el trofoblasto invade a la madre (16,17) con el objeto de aprovechar para sí el máximo de oxígeno y nutrientes, y evitando el rechazo inmunológico: a. Invasión de anatomía macroscópica: hay remodelación de la anatomía gruesa materna, acumulación de grasa, aumento del volumen plasmático y eritrocitario, aumento de mamas, útero, etc. b. Invasión hormonal: la placenta libera hormonas y otras sustancias directamente a la circulación materna. Remodela el metabolismo materno, con enormes cambios en hormonas principalmente esteroidales. c. Invasión inmunitaria: bloqueo de mecanismos de rechazo tisular. d. Invasión trofoblástica endovascular: remodelación de arterias espirales con reemplazo del endotelio y capa muscular por trofoblasto intermedio, los vasos espirales se hacen dilatados y no contráctiles, con un gran aumento de la irrigación placentaria. De esta manera el feto gana acceso directo a la sangre materna, el flujo sanguíneo a la placenta es independiente de la regulación vascular materna local y la madre no puede disminuir los nutrientes que llegan a la placenta sin disminuir el aporte a sus propios tejidos.
La Teoría de la Reina Roja interpreta la preeclampsia como un conflicto genómico entre la invasión trofoblástica y la defensa endometrial materna, en un embarazo normal hay un balance entre ambas, en la preeclampsia predominan los factores endometriales que impiden la invasión profunda del trofoblasto en primer trimestre (déficit p57kip2?, alteración en macrófagos?), la placenta se vuelve hipóxica y los factores placentarios (genes fetales) segregan sustancias vasoconstrictoras para elevar la presión y mejorar la perfusión, mientras que los factores maternos van a disminuir la presión arterial. La vasoconstricción y los radicales libres dañan el endotelio y desencadena la cascada de la preeclampsia.
Existen datos concretos respecto al papel del p57 kip2 en preeclampsia (10,18). Ratones con mutaciones para este gen desarrollan hiperplasia placentaria, hipertensión arterial y proteinuria, en la práctica clínica la preeclampsia es frecuente en varias patologías con déficit de p57kip2 como en la mola, la trisomía 13 y el SBW.
También se han implicado los mecanismos de impronta en relación con la programación prenatal de Barker y en el aborto espontaneo.
LA IMPRONTA GENÉTICA Y ONCOLOGÍA GINECOLÓGICA
En 1977, Kajii y Ohama (19-21) describieron los cariotipos de la mola completa, la mola parcial y su etiopatogenia. Ellos describieron que en la mola completa el origen es androgenético, resultado de la fecundación de un óvulo anucleado por uno o dos espermios, el cariotipo más frecuente es 46XX, sin embargo, hay ausencia total de los genes con imprinting materno indispensables para el desarrollo embrionario, por lo tanto no se desarrolla un embrión femenino como era de esperarse por la genética clásica. Los genes supresores de crecimiento como P57 kip2 están ausentes y hay un superávit de genes estimuladores de crecimiento como IGF2. ElP57 kip2 se utiliza como marcador inmuno histoquímico, si esta negativo en las muestras de un vaciamiento se confirma el diagnóstico de mola completa (10-22,23).
La presencia de estos genes estimulantes de crecimiento no contrarrestados por genes inhibidores explican la hiperplasia trofoblástica, el crecimiento agresivo de la mola y también el mayor potencial maligno: la mola tiene 1000 veces más riesgo de coriocarcinoma que un embarazo normal. El riesgo de neoplasia en la enfermedad trofoblástica depende entre otros factores del número de copias de genes paternos imprintados, por ejemplo la mola invasora o persistente tiene un cariotipo similar a la mola original, pero es más frecuente en casos de mola diespermica.
En la mola parcial (20) el cariotipo es triploide con 69 cromosomas. Se han descrito dos genotipos en las triploidías de la especie humana: en el primer tipo tiene un juego de cromosomas paterno (1P) y dos juegos maternos (2M), el segundo tipo tiene dos juegos de cromosomas paterno (2P) y un juego materno (1M). En los fetos 1P+2M predomina la impronta materna fetal y su fenotipo es un feto malformado, con placenta pequeña y RCIU severo, similar a los embriones ginogenontes de la biología experimental. En los fetos 2P+1M predomina la impronta paterna “extraembrionaria”, el feto es muy pequeño, pero con una gran placenta, es decir una mola parcial típica, similar a los androgenontes.
El ejemplo inverso se da en los quistes dermoides que se producen por partenogénesis de gametos maternos, serían por lo tanto embriones ginogenontes naturales y solo contienen tejidos embrionarios y no extraembrionarios (24).
LA IMPRONTA GENÉTICA E INFERTILIDAD
En la fertilización in vitro existe un aumento leve pero significativo (9) en la incidencia de las enfermedades por imprinting, como por ejemplo: los síndromes de Angelmann y Prader-Willi. Por otro lado algunos autores piensan que la dificultad en lograr la clonación de mamíferos se debe probablemente a que las células somáticas utilizadas para la transferencia nuclear carecen de los patrones de imprinting necesarios para la viabilidad embrionaria.
CONCLUSIÓN
La teoría del Conflicto Genómico es parte de la biología evolutiva y actúa en los mamíferos a través del mecanismo de imprinting, tendría un papel central en el desarrollo fetal y del trofoblasto, con implicancias en la etiopatogenia de diversas patologías en Gineco-Obstetricia.
BIBLIOGRAFÍA
1. Werren JH. Selfish genetic elements, genetic conflict, and evolutionary innovation. Proc Natl Acad Sci USA 2011; 108 Suppl 2:10863-70.
2. Pijnenborg R, Vercruysse L, Hanssens M. Fetalmaternal conflict, trophoblast invasion, preeclampsia, and the red queen. Hypertens Pregnancy 2008; 27(2):183-96.
3. Moore T, Reik W. Genetic conflict in early development: parental imprinting in normal and abnormal growth. Rev Reprod 1996; 1(2):73-7.
4. Saladrigas MV. Monografía: Genomic Imprinting. Panace@ 2001;2(5): 57-72.
5. Vasco GC, Gil Villa AM, Piedrahita Ochoa C, Cardona Maya W, Cadavid Jaramillo A. Influence of the male genomic imprinting on the reproduction. Actas Urol Esp 2008;32(10):1004-12.
6. Lyle R. Gametic imprinting in development and disease.J Endocrinol 1997;155(1):1-12.
7. Isles AR, Davies W, Wilkinson LS. Genomic imprinting and the social brain. Philos Trans R Soc Lond B Biol Sci 2006;361(1476):2229-37.
8. Salas M, John R, Saxena A, Barton S, Frank D, Fitzpatrick G, Higgins MJ, Tycko B. Placental growth retardation due to loss of imprinting of Phlda2. Mech Dev 2004; 121(10):1199-210.
9. Ishida M, Moore GE. The role of imprinted genes in humans. Mol Aspects Med 2013;34(4):826-40.
10. Pateras IS, Apostolopoulou K, Niforou K, Kotsinas A et col. p57KIP2: «Kip»ing the cell under control. Mol Cancer Res 2009;7(12):1902-19
11. Cerón M, Vander Linde V. Displasia mesenquimal placentaria: caso clínico. Rev Chil Obstet Ginecol 2014;79(4):311-4.
12. Romanelli V, Belinchón A, Campos-Barros A, Heath KE, García-Miñaur S, et cols. CDKN1C mutations in HELLP/preeclamptic mothers of Beckwith-Wiedemann Syndrome (BWS) patients. Placenta 2009; 30(6):551-4.
13. Dekker G, Robillard PY, Roberts C. The etiology of preeclampsia: the role of the father. J Reprod Immunol 2011;89(2):126-32.
14. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The «Great Obstetrical Syndromes» are associated with disorders of deep placentation. Am J Obstet Gynecol 2011; 204(3):193-201.
15. Carter AM, Enders AC, Pijnenborg R. The role of invasive trophoblast in implantation and placentation of primates. Philos Trans R Soc Lond B Biol Sci 2015; 370(1663): 20140070.
16. Kaufmann P, Black S, Huppertz B. Endovascular trophoblast invasion: implications for the pathogenesis of intrauterine growth retardation and preeclampsia. Biol Reprod 2003;69(1):1-7.
17. Pacora-Portella P. El origen de la preeclampsia y la eclampsia: la placentación. Rev Per Ginecol Obstet 2006;52(4):202-12.
18. Knox K, Baker JC. Genome-wide expression profiling of placentas in the p57Kip2 model of pre-eclampsia. Mol Hum Reprod 2007;13(4):251-63.
19. Scucces M. Algunas consideraciones acerca de la biología del trofoblasto en la mola hidatidiforme. Re Obstet Ginecol Venez 2008;68(2):98-104.
20. Hoffner L, Surti U. The genetics of gestational trophoblastic disease: a rare complication of pregnancy. Cancer Genet 2012 r; 205(3):63-77.
21. Aplin J. Developmental cell biology of human villous trophoblast: current research problems. Int J Dev Biol 2010;54(2-3):323-9.
22. Fisher R, Hodges M. Genomic imprinting in gestational trophoblastic disease – a review. Placenta 2003;24 Supplement A:S111-88.
23. Seckl M, Sebire N, Berkowitz R. Gestational trophoblastic disease. Lancet 2010;376(9742):717-29.
24. Varmuza S, Mann M. Genomic imprinting–defusing the ovarian time bomb. Trends Genet 1994;10(4):118-23.