2018
4
Autores:
Ricardo Álvarez-Carrasco, Marcos Espinola-Sánchez, Fernando Angulo-Mendeza, Luís Cortez-Carbonell, Marina Cabezudo-Reáteguia
Tipo de documento:
Trabajos OriginalesAPLICACIÓN DEL ALGORITMO INVERSO PARA DIAGNÓSTICO DE SÍFILIS GESTACIONAL EN EL INSTITUTO NACIONAL MATERNO PERINATAL, PERÚ. 2011-2017.
Contenido del documento:
RESUMEN
Introducción y objetivos: El propósito es evaluar los resultados de la aplicación del algoritmo inverso para el diagnóstico de sífilis gestacional en el Servicio de Medicina Preventiva del Instituto Nacional Materno Perinatal de Lima, entre 2011 al 2017.
Método: Estudio observacional, descriptivo y retrospectivo. Revisión de los resultados de los exámenes del Algoritmo inverso de sífilis gestacional. La Prueba Rápida de Sífilis (PRS) se utilizó como tamizaje, su positividad obligaba a efectuar la RPR, cuya reactividad definía la actividad de la enfermedad cuando era igual o mayor de 8 diluciones, títulos menores obligaban al seguimiento serológico.
Resultado: Se tamizaron 46,880 embarazadas, la incidencia de sífilis activa fue de 1.02 por mil tamizadas, la frecuencia de títulos menores alcanzó el 29.33% de las positivas al PRS y la discordancia entre PRS y RPR el 57.87%, el seguimiento serológico fue insuficiente (7.27%), al igual que la evaluación de las parejas y/o contactos sexuales de las gestantes con sífilis activa (4.17%).
Conclusión: El algoritmo permite un diagnóstico rápido y la instauración oportuna de la terapia antibiótica, pero su fiabilidad se optimizará con la sistematización de los controles de calidad internos y externos, seguimiento serológico sistemático, planificación de la estrategia que asegure la evaluación serológica y tratamiento de las parejas y/o contactos sexuales, y en los casos de discordancia, el algoritmo debe incluir otra prueba treponémica.
PALABRAS CLAVE: Sífilis, gestación, algoritmo inverso, prueba rápida de sífilis, incidencia.
SUMMARY
Introduction and objectives: The purpose is to evaluate the results of the application of the inverse algorithm for the diagnosis of gestational syphilis in the Preventive Medicine Service of the National Maternal and Perinatal Institute of Lima, between 2011 and 2017.
Method: Observational, descriptive and retrospective study. The results of the diagnostic tests applying the inverse algorithm gestational syphilis were reviewed. The Rapid Syphilis Test (PRS) ) was used as a screening, its positivity required to perform the RPR, whose reactivity defined the activity of the disease when it was equal to or greater than 8 dilutions, minor titers required serological follow-up.
Result: The incidence of active syphilis was 1.02 per thousand screened, the frequency of minor titres reached 29.33% of those positive for PRS and the discordance between PRS and RPR was 57.87%, serological follow-up was insufficient (7.27%), as well as the evaluation of sexual partners and / or contacts of pregnant women with active syphilis (4.17%).
Conclusion: The algorithm allows a rapid diagnosis and the timely establishment of antibiotic therapy, but its reliability will be optimized with the systematization of internal and external quality controls, systematic serological monitoring, strategy planning to ensure the serological evaluation and treatment of couples and / or sexual contacts, and in cases of discordance, the algorithm must include another treponemal test.
KEY WORDS: Syphilis, gestation, inverse algorithm, rapid syphilis test, incidence.
ANTECEDENTES
En el Perú, durante varios lustros, el algoritmo diagnóstico para la sífilis gestacional sólo contemplaba el tamizaje mediante una prueba no treponémica, usualmente la Reagina Plasmática Rápida (RPR), que en caso de resultar reactiva requería la confirmación con una prueba treponémica, comúnmente el Anticuerpo Treponémico Fluorescente Absorvido (FTA-Abs) o la Micro Hemaglutinación del Treponema pallidum (MHATP)(1).
En 2010 se inició el proyecto Cura Inmediata de la Sífilis Neonatal (CISNE), una investigación de la Universidad Peruana Cayetano Heredia(2), que realizó en colaboración con el Instituto Nacional Materno Perinatal (INMP), el cual introdujo un algoritmo inverso, que empleaba como prueba de tamizaje a la Prueba Rápida de Sífilis (PRS)(3) por el método de inmunocromatografía.
En diciembre de 2010, el INMP adoptó formalmente a la PRS como única prueba de tamizaje en gestantes(4). En 2014, el Ministerio de Salud incorporó a la PRS y las pruebas duales para VIH y sífilis en dicho tamizaje, aunque mantuvo como alternativa el uso de la RPR(5).
El objetivo del estudio es revisar y evaluar los resultados de la aplicación del algoritmo inverso para el diagnóstico de sífilis gestacional en el INMP, entre 2011 al 2017.
MÉTODO
La investigación fue observacional, retrospectiva y descriptiva, se circunscribió a las embarazadas atendidas en el servicio de Medicina Preventiva del INMP, entre 2011 y 2017, que cumplieron los siguientes criterios de inclusión: a) No tener diagnóstico previo de sífilis; b) Habérsele aplicado íntegramente el algoritmo inverso. Los criterios de exclusión fueron tener diagnóstico previo de sífilis y/o no completar el algoritmo inverso. La información se obtuvo de los registros del área de Inmunología, Servicio de Patología Clínica, Departamento de Patología, INMP.
El algoritmo inverso utilizó la PRS, por el método de inmunocromatografía, como ensayo de tamizaje, la cual sólo obtenía resultados cualitativos y como todas las pruebas treponémicas no discernía si la infección estaba activa, ya que los anticuerpos persisten por largo tiempo(6), entre el 85 a 90% de los casos tratados previamente(7), a este fenómeno se le denomina Cicatriz Inmunológica.
La gestante PRS Positiva, obligatoria e inmediatamente era sometida a la RPR para definir dicha actividad(8,9), permitiendo la administración del tratamiento antibiótico el mismo día de la primera atención. El resultado de la RPR podía presentarnos tres escenarios:
Si era No Reactiva se consideró que la gestante no era portadora de infección activa, tal discordancia podía explicarse fundamentalmente por la Cicatriz Inmunológica.
Si era Reactiva con menos de 8 diluciones, más aún si existían antecedentes de diagnóstico y/o tratamiento, se debía efectuar consejería de soporte y el seguimiento serológico de la gestante(1), si el título no se incrementaba era probable que se tratara de una Cicatriz Inmunológica, y con menos frecuencia de un error de laboratorio.
Si era Reactiva igual o mayor a 8 diluciones, se definía como un caso de sífilis activa que debía recibir tratamiento y ser monitoreado con la RPR(1), a partir del mes posterior a su administración, siendo repetida a los 3, 6, 12 y 24 meses(10,11), la evolución de los títulos seguirá los tiempos definidos para cada estadio de la enfermedad(12,13).
La seroreversión de la RPR luego del tratamiento es un proceso lento, en la sífilis primaria se hacen no reactivas entre los 6 a 12 meses después de la aplicación de dicha terapia, en la secundaria de 12 a 18 meses(12,13,14), en la infección latente temprana se puede observar una reducción significativa de los títulos luego de los 12 meses(15), y en la latente o sintomática tardía la terapia tiene poco efecto en los títulos y no debería emplearse para estimar su eficacia(12,13).
Se necesita un cambio de dos diluciones en el título para demostrar una diferencia clínicamente significativa entre dos pruebas consecutivas(16); en los pacientes con historia de sífilis tardía tratada adecuadamente, el aumento de una dilución no tiene significación clínica, pero a partir de dos diluciones debe sospecharse de reinfección o reactivación.
El control de calidad interno de los resultados obtenidos en la PRS y RPR se efectuó en el área de Inmunología del INMP, en el primer caso bajo dos modalidades: el control diario contenido en el propio dispositivo y la evaluación trimestral efectuada por el personal Tecnólogo Médico a los ejecutantes de la prueba. En lo que respecta a la RPR se procesaron diariamente los controles positivos y negativos, proporcionados por el fabricante, paralelamente a las muestras de las gestantes.
El control de calidad externo se realizó mediante el Programa de Evaluación Externa de la Calidad para el diagnóstico serológico de sífilis, organizado por el Laboratorio de Referencia Nacional de Bacterias de Transmisión Sexual, Centro Nacional de Salud Pública, Instituto Nacional de Salud, Lima-Perú. En los años que se evaluaron, la concordancia cualitativa y cuantitativa, según correspondiera a la PRS y RPR, fue del 100%.
En el análisis de datos se utilizó la estadística descriptiva para reportar los resultados obtenidos con las pruebas del algoritmo inverso para diagnosticar Sífilis gestacional, se medió la tendencia de la incidencia anual de sífilis activa. Se utilizó la estadística inferencial con un intervalo de confianza del 95% para estimar serodiscordancia y sífilis activa según resultados del algoritmo inverso. Se utilizó el programa SPSS versión 22. La investigación fue aprobada por el comité de ética del INMP.
RESULTADOS
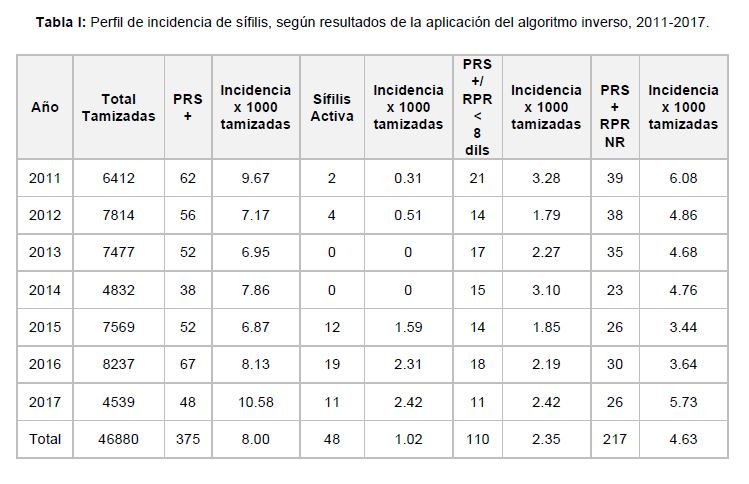
Entre 2011 y 2017 se tamizaron 46,880 embarazadas de las cuales 375 fueron Positivas a la PRS – incidencia 8.0 por mil tamizadas – (Tabla I).
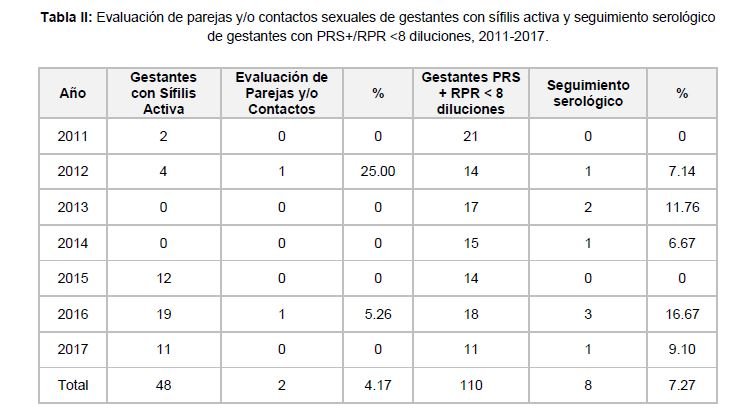
Cuarenta y ocho cumplieron los criterios de sífilis activa, lo que significó una incidencia de 1.02 por mil tamizadas, variando de 0 en 2013 a 2.42 en 2016 (Tabla I). Únicamente dos de sus parejas y/o contactos sexuales fueron evaluadas serológicamente, que corresponde al 4.17% de las gestantes diagnosticadas con sífilis activa (Tabla II).
Ciento diez fueron PRS Positiva / RPR Reactiva menor de 8 diluciones, con una incidencia de 2.35 por cada mil tamizadas, de ellas ocho fueron seguidas serológicamente, es decir el 7.27% (Tabla II). Doscientas diecisiete fueron discordantes – PRS Positivo / RPR No Reactiva -, con una incidencia de 4.63 por cada mil tamizadas (Tabla I).
La incidencia anual de sífilis activa tendió al incremento, variando entre 0.31 (2011) a 2.42 (2017) por cada mil gestantes tamizadas (Figura 1). La discordancia presentó una tendencia a la disminución entre 2011-2015, variando entre 6.08 (2011) a 3.44 (2015) cada mil embarazadas tamizadas, a partir de 2016 se presentó un incremento, que en 2017 alcanzó la incidencia de 5.73 por cada mil tamizadas. La incidencia de PRS Positiva / RPR Reactivo menor de 8 diluciones se mantuvo estable (Figura 2).
Las gestantes discordantes representaron el 57.87% del total de Positivas al PRS, aquellas que presentaron PRS Positiva / RPR Reactiva menor de 8 diluciones fueron el 29.33%, y las que cumplieron los criterios de actividad alcanzaron el 12.80% (Tabla III).
DISCUSIÓN
La incidencia de sífilis activa hallada en este estudio – 1.02 por mil gestantes tamizadas -, no se pudo comparar con la información oficial del país, el informe estadístico nacional de infecciones de transmisión sexual 2002-2011 no menciona la sífilis gestacional(17). Dicha estadística y diversas fuentes sólo mencionan datos acerca de la sífilis congénita (18,19,20), también existe información sobre la prevalencia de la sífilis gestacional(19,21,22,23). Algo análogo sucede con investigaciones extranjeras (21,22,23,24,25).
Es llamativa la frecuencia de la discordancia entre la PRS Positiva y RPR No Reactiva (57.87%), la causa más usual es la Cicatriz Inmunológica, fenómeno que no necesariamente implica un fracaso terapéutico(26), ya que en algunos pacientes tratados adecuadamente en las etapas latentes o tardías, los anticuerpos no treponémicos pueden persistir a bajo título durante un largo período de tiempo, a veces de por vida(27-29).
Sin embargo, esta discordancia inesperadamente alta puede tener otras explicaciones probables: a. El periodo de ventana de la RPR, que es el lapso que trascurre desde la infección hasta que las pruebas diagnósticas son capaces de detectar los anticuerpos, es más prolongado que en las pruebas treponémicas, aunque es difícil corroborarlo en todos los casos(30), ello teóricamente puede ocasionar una discordancia momentánea, que definirá el seguimiento serológico con el trascurrir de las semanas. b. La PRS, como todo ensayo treponémico, tiene limitantes(31), su especificidad alcanza el 99%(3,32), por lo que son posibles las reacciones inespecíficas. c. Un error de laboratorio, que es poco probable, aunque posible, debido al estricto sistema de control de calidad interno y externo que se implantó durante el período del estudio.
Se recomienda que en los casos de discordancia se utilice otra prueba treponémica (FTA-Abs o MHATP) para darle mayor fiabilidad al diagnóstico(33), práctica que no se siguió en este algoritmo. Incluso cuando los antecedentes epidemiológicos de la gestante sugieren conductas de riesgo propias y/o de sus parejas y/o contactos sexuales, ello ameritaría un seguimiento serológico, aunque la RPR inicial sea No Reactiva(34).
La PRS Positiva seguida de una RPR Reactiva menor a 8 diluciones fue la segunda en frecuencia (29.33%), en estos casos el algoritmo establecía la necesidad de efectuar el seguimiento serológico para definir si se trataba de sífilis activa u otra causa: a) Una Cicatriz Inmunológica. b) La etapa inicial de seroconversión, ya que la evolución natural de los anticuerpos permitiría hacer este discernimiento(12). c) El fenómeno de prozona(16,35,36), que puede ocurrir hasta en el 10% de la sífilis secundaria(37), en que el exceso de anticuerpos bloquea la reacción antígeno-anticuerpo, reduciendo artificialmente los títulos, y en algunos casos incluso puede dar resultados falsamente negativos(26); en el 100% de los casos la solicitud remitida por los clínicos no especificaba el estado de la enfermedad, lo que impidió que el laboratorio desarrollara una variante técnica para desbloquear dicho fenómeno(38).
Tal información era particularmente trascendente si consideramos que la mayoría de las gestantes que padecen sífilis acude al INMP durante la etapa secundaria(39), que se inicia al cabo de 2 a 12 semanas de la infección inicial(35). En la práctica, el seguimiento serológico de estas gestantes fue muy deficiente (7.27%), haciendo probable que algunos casos de sífilis activa no se diagnosticaran oportunamente.
Otro aspecto relevante fue la insuficiente evaluación serológica de las parejas y/o contactos sexuales de las gestantes con diagnóstico de sífilis activa (4.17%), ya que la sífilis no genera inmunidad duradera, de tal manera que se puede producir la infección tantas veces como contactos sexuales se tenga con enfermos activos(40), aunque persistan ciertos anticuerpos(30).
La frecuencia de los resultados no concluyentes de la RPR, respecto a la actividad de la sífilis, provocó la modificación informal del algoritmo, ya que se instauró la política de iniciar el tratamiento antibiótico en todas las gestantes que tenían una PRS Positiva. Ello incrementó el número de terapias innecesarias, aunque ello no se cuantificó.
De haberse seguido estrictamente el algoritmo, es probable que la incidencia de sífilis activa hubiera sido mayor, aunque no es posible cuantificarlo, no obstante, a partir de 2014 se observó que estos casos presentaron una tendencia sostenidamente creciente.
CONCLUSIONES
El algoritmo inverso es una metodología sencilla que permite resultados inmediatos e instaurar oportunamente la terapia, disminuyendo la posibilidad que una infectada quede sin diagnóstico y terapia, sin embargo, para ser más fiable se requiere: a. Controles de calidad internos y externos. b. Seguimiento serológico sistemático. c. Planificar la estrategia para asegurar la evaluación serológica y tratamiento de las parejas y/o contactos sexuales de las gestantes PRS Positivas, con lo cual se reducirá la sífilis neonatal, que puede ocasionar muerte perinatal, parto prematuro, peso bajo al nacer, anomalías congénitas y sífilis activa en el neonato(10,41). d. En los casos de discordancia, el algoritmo debe incluir otra prueba treponémica, para conferirle mayor confiabilidad al diagnóstico. e. Complementariamente, si no es posible contar con la colaboración de los clínicos, se dispondrá que ante toda reactividad cualitativa de la RPR, la muestra será diluida hasta títulos 1/8, desbloqueando el fenómeno de prozona, ya que el tiempo adicional de esta actividad y el costo agregado es marginal por el bajo precio de cada determinación de la RPR.
BIBLIOGRAFÍA
1. Norma Técnica N° 064-MINSA/DGSP-V.01. Norma técnica de salud para la profilaxis de la transmisión madre-niño del VIH y la sífilis congénita. Aprobada por Resolución Ministerial N° 336-2008/MINSA. Lima, 20 de mayo de 2008:9,12,13,14,23.
2. Instituto Nacional Materno Perinatal, 2011. MINSA incorpora pruebas rápidas para detectar sífilis a nivel nacional. Hallado en:
http://www.inmp.gob.pe/noticia/minsa-incorpora-pruebas-rapidas-para-detectar-sifilis-a-nivel-nacional. Acceso el 21 de mayo de 2018.
3. Calderón-Anyosa R, Ponce O, Tapia-Tapia C, García P. Aplicación de pruebas rápidas para el diagnóstico de sífilis en zonas rurales. Rev Peru Med Exp Salud Publica 2012; 29(1):160,161.
4. Guía de práctica clínica y procedimientos en obstetricia y perinatología. Adenda: Guía de práctica clínica: atención de la gestante con sífilis. Lima: Instituto Nacional Materno Perinatal, 2010; 4-6,9,10.
5. Norma Técnica N° 108-MINSA/DGSP-V.01. Norma técnica de salud para la prevención de la transmisión madre-niño del VIH y la sífilis. Aprobada por Resolución Ministerial N° 619-2014/MINSA. Lima, 18 de agosto de 2014:18,20-23,40,41.
6. Organización Mundial de la Salud. El uso de las pruebas rápidas para sífilis. Programa especial de investigación y enseñanzas sobre Enfermedades Tropicales. Hallado en:
whqlibdoc.who.int/hq/2007/TDR_SDI_06.1_spa.pdf?ua=1. Acceso el 08 de abril de 2018.
7. Procedimiento técnico para el diagnóstico serológico de sífilis. Santiago de Chile: Instituto de Salud Pública, 2015; 4,5,11,13.
8. The Global Elimination of Congenital Syphilis: rational and strategy for action. Ginebra, Suiza: World Health Organization, 2007; 7-9,27.
9. Workowski K, Berman S. Sexually Transmitted Diseases Guidelines, 2010. Morbity and Mortality Weekly report 2010;(59)RR12:26-40.
10. Samalvides-Cuba F, Banda-Flores C. Sífilis en la gestación. Rev Per Ginecol Obstet 2010; 56(3): 202-208.
11. Ratnam S. The laboratory diagnosis of syphilis. Can J Infect Dis Med Microbiol 2005; 16(1):45-51.
12. Sanguineti-Díaz A, Rodríguez J. Actualización en el diagnóstico de la sífilis. Dermatol Perú 2004; 14(3):192-199.
13. Corrales H. Sífilis, algunos aspectos de interés. Eev. Med. Hondue 1975; 43:49-70.
14. Fröhlich D, Graf N, Lauten S, Weber R, Bosshard P. Serological response to treatment of syphilis according to disease stage and HIV status. Clin Infect Dis 2012; 55(12):1615–1622.
15. Casas R, Rodríguez M, Rivas J. Sífilis y embarazo: ¿Cómo diagnosticar y tratar oportunamente? Rev Colom Obstet Ginecol 2009; 60(1):49-56.
16. Who guidelines treatment terponema pallidum (syphilis). Ginebra: Servicio de producción documentaria de la Organización Mundial de la Salud, 2016; 10,12,13.
17. Boletín estadístico sobre infecciones de transmisión sexual. Perú 2002-2011. Lima: Ministerio de Salud, 2012.
18. Escudero A. Situación Epidemiológica de la sífilis congénita (a la SE 53). Perú, 2014. Boletín Epidemiológico (Lima) 2015; 24(3):68-71.
19. Plan Nacional de prevención y control de la transmisión madre-niño del VIH y sífilis. Lima: Ministerio de Salud, 2007; 11,12,15,16.
20. Boletín epidemiológico. Instituto Nacional Materno Perinatal 2017; (4):8,9.
21. Galban E, Benzaken A. Situación de la sífilis en 20 países de Latinoamérica y el Caribe: año 2006. J bras Doenças Sex Transm 2007; 19(3-4):166-172.
22. Valderrama J, Zacarías F, Mazin R. Sífilis materna y sífilis congénita en América Latina: un problema grave de solución sencilla. Rev Panam Salud Publica/Pan Am J Public Health 2004; 16(3):211-217.
23. Casas R, Rodríguez M, Rivas J. Sífilis y embarazo: ¿Cómo diagnosticar y tratar oportunamente? Rev Colom Obstet Ginecol 2009; 60(1):49-56.
24. Galeano-Cardina C, García-Gutiérrez W, Congote-Arango L, Vélez-García M, Martínez-Buitriago D. Prevalencia de sífilis gestacional e incidencia de sífilis congénita, Cali, Colombia, 2010. Rev Colomb Obstet Ginecol 2012; 63(4):321-326.
25. Prevalence of syphilis and HIV infection during pregnancy in incarcerated women and the incidence of congenital syphilis in births in prison in Brazil. Cad. Saúde Pública 2017; 33(11):1-15.
26. Larsen S, Steiner B, Rudolph A. Laboratory diagnosis and interpretation of tests for syphilis. Clinical Microbiology Reviews 1995; 8(1):1-21.
27. Hook E, Marra C. Acquired syphilis in adults. N Engl J Med 1992; 326(16):1060-1069.
28. Fiumara N. Serologic responses to treatment of 128 patients with late latent syphilis. Sex Transm Dis 1979; 6(4):243-246.
29. Clement M, Okeke N, Hicks C. Treatment of Syphilis: a Systematic Review. JAMA. 2014; 312(18): 1905-1917.
30. Farhi D, Dupin N. Diagnostic sérologique de la syphilis. Ann Dermatol Venereol 2008; 135(5):418-425.
31. Satomi N. Syphilis – Recognition, Description and Diagnosis. Sao Paulo, Brasil: INTECH, 2011; 95,100,101,117.
32. Roehl K. Diagnostic Performance of a Rapid Syphilis Test Among Pregnant Women in Lima, Perú. [Tesis de maestría]. Durham, Estados Unidos de América: Department of Global Health in the Graduate School, Duke University, 2011; IV
33. Binnicker M, Jespersen D, Rollins L. Treponema-Specific Tests for Serodiagnosis of Syphilis:
Comparative Evaluation of Seven Assays. J Clin Microbiol 2011; 49(4):1313-1317.
34. Pestoni C, Lado F, Cabarcos A, Sánchez D. Sífilis: perspectivas terapéuticas actuales. An Med Interna Madrid 2002; 19(2):89-95.
35. Contreras E, Zuluaga S, Ocampo V. Sífilis: la gran simuladora. Infectio 2008; 12(2):340-347.
36. Mera B, Batthar S, Saxena S, Rawat D, Bhalla P. Evaluation of SD BIOLINE Syphilis 3.0 for Rapid Diagnosis of Syphilis: Report from a Regional Sexually Transmitted Infection Reference Laboratory in North India. J Lab Physicians 2016; 8(1):36–40.
37. Chernieski T. An update and and review of the diagnosis and management of syphilis. New York, Estados Unidos de América: Department of health and mental higiene – New York City; 2006, 14,16,31,32.
38. Gatti J, Cardama J. Manual de Dermatología. Octava edición. Buenos Aires Argentina: Librería editorial El Ateneo, 1980; 169-172,190.
39. Ahumada C, Hanna M, Villadiego M. Sífilis gestacional: enfermedad de interés en salud pública, Córdoba – Colombia, 2015. Rev Cuid 2017; 8(1):1449-58.
40. Recommandations en santé publique: évaluation a priori du dépistage de la syphilis en France. Synthèse et perspectives. Spectra Biologie 2007; 163:34-47.
41. Emerson C. Syphilis: A Review of the Diagnosis and Treatment. The Open Infectious Diseases Journal 2009; 3:143-147.