2020
6
Autores:
Sochog
Instituciones:
Solis, JA1-2, Olivares, J1-2, Tudela, B1-2. Veillon, G1-2. Perrot, I1-2. Lazcano, G1-2.
1 Unidad de Radioterapia, Hospital Carlos Van Buren, Hontaneda 2560, Valparaíso, Chile.
2 Universidad de Valparaíso, Facultad de Medicina, Angamos 655, Reñaca, Viña del Mar, Valparaíso Region. Chile.
Correspondencia: Jorge Olivares, jorgea.olivaresg@gmail.com
Tipo de documento:
Trabajos OriginalesBraquiterapia adaptativa guiada por resonancia magnética para el cáncer cervical localmente avanzado: Experiencia del Hospital Carlos Van Buren
Contenido del documento:
INTRODUCCIÓN
El cáncer de cuello uterino es el cáncer ginecológico más común en todo el mundo(1). En los países de ingresos bajos y medios, es más frecuente, siendo el segundo cáncer en incidencia entre las mujeres y el tercero en términos de mortalidad (2). En Chile, según datos de GLOBOCAN, en el año 2018 se notificaron 1.549 nuevos casos y 725 muertes por esta causa (3).
El tratamiento del cáncer de cuello uterino se realiza mediante cirugía en etapas tempranas, seguida de radioterapia con o sin quimioterapia según los hallazgos histopatológicos (2). La radioquimioterapia concomitante seguida de braquiterapia se considera el tratamiento estándar para pacientes con cáncer cervical localmente avanzado (CCLA) (4).
Durante la última década, el uso de braquiterapia adaptativa guiada por imágenes (BTAGI) de resonancia magnética se ha implementado con éxito de acuerdo a las recomendaciones de la European Society of Radiotherapy and Oncology (ESTRO). La BTAGI permite la individualización del tratamiento con adaptación de la dosis y escalamiento de la dosis cuando sea apropiado, teniendo en cuenta el tamaño del tumor en el momento del diagnóstico y en el momento de la braquiterapia, al mismo tiempo que permite reducir dosis a órganos en riesgo (5,6,7,8). Con este enfoque, se han descrito mejoras significativas en los resultados clínicos con respecto al control local, sobrevida general y la morbilidad relacionada al tratamiento(9,10).
A contar del 2019, la unidad de radioterapia del Hospital Carlos Van Buren, implementó un protocolo de braquiterapia adaptativa guíada por imágenes de resonancia magnética en pacientes con CCLA tratadas con radioquimioterapia concomitante seguido de braquiterapia.
Este informe constituye un análisis descriptivo de las primeras pacientes tratadas durante el año 2019-2020, con el fin de evaluar los resultados preliminares respecto a la reducción del volumen tumoral observado en resonancia magnética.
MÉTODOS
La población de estudio incluyó a pacientes con CCLA tratados desde mayo de 2019 a marzo del 2020 en el Hospital Carlos Van Buren de Valparaíso, Chile. Se incluyeron todas las pacientes que cumplieron con los siguientes criterios: al menos 18 años de edad, diagnosticadas de cáncer cervical localmente avanzado (FIGO 2018 IB – IVA) que hayan recibido radioquimioterapia concomitante con intención curativa y braquiterapia posterior. Se excluyeron 41 pacientes por poseer alguno de los siguientes factores de exclusión: etapa IVB, pacientes sin posibilidad de obtención de resonancia magnética, por contraindicación médica o negativa personal y las pacientes con cáncer cervical recidivadas.
Para esta cohorte retrospectiva, se extrajo información de las historias clínicas de los pacientes y de los planes de tratamiento de radioterapia disponibles en el software de planificación de la unidad de radioterapia del Hospital Carlos Van Buren. Nuestra investigación fue aprobada previamente por el comité de ética local del servicio de salud Valparaíso – San Antonio.
El Objetivo general fue describir los resultados iniciales del protocolo institucional de Braquiterapia adaptativa guiada por resonancia magnética para pacientes con CCLA tratadas en el Servicio de Oncología del Hospital Carlos Van Buren de Valparaíso.
Los objetivos específicos fueron describir los parámetros dosimétricos obtenidos en los planes de tratamiento y objetivar la reducción tumoral, posterior a la Radioquimioterapia concomitante, a través de resonancia magnética. Describir las características demográficas y clínicas de los pacientes y determinar la frecuencia y gravedad de la toxicidad aguda.
Protocolo de tratamiento
Todas las pacientes se realizaron una resonancia magnética T2w fast spin echo de pelvis en resonador 1.5 Tesla, Signa General Electric Healthcare, con gel endovaginal antes de iniciar el tratamiento de radioquimioterapia. Las pacientes fueron tratadas con un esquema de radioterapia de 45 Gy sobre pelvis fraccionada en 25 sesiones de 1,8 Gy. En el caso de ganglios linfáticos comprometidos, la dosis a los ganglios linfáticos fue de 57,5 Gy, con técnica de sobreimpresión (Boost) integrado simultáneo. El acelerador lineal utilizado para radioterapia tridimensional convencional fue Varian, Clinac 600 con energías de 6 MV y para la técnica de arcoterapia volumétrica de intensidad modulada un equipo Elekta, Versa HD con energías de 6 y 10 MV. El sistema de planificación de tratamiento de la radioterapia externa fue Monaco, versión 5.11.02 (© 2017 Elekta, Inc). La quimioterapia concomitante consistió en cisplatino 40 mg / m2 semanal por 5 ciclos.
La braquiterapia de alta tasa de dosis se realizó con técnica remote afterloading con equipo GammaMedplus iX (Varian Medical System, Palo Alto, CA). El sistema de planificación del tratamiento utilizado fue BrachyVision (versión 13.6). Los volúmenes objetivos y los órganos en riesgo se definieron de acuerdo a las recomendaciones de GEC-ESTRO al igual que las prescripciones y restricciones de dosis (5,6). En el momento de la primera aplicación de braquiterapia, se realizó una tomografía computada para evaluar el correcto posicionamiento del dispositivo (Figura 1) y una nueva resonancia magnética para evaluar la enfermedad residual con el dispositivo de braquiterapia in situ.
La planificación del tratamiento considero las dosis equivalentes totales, tomando en cuenta las dosis administradas por la radioterapia externa y braquiterapia, para la prescripción de dosis a los volúmenes objetivos. De acuerdo al módelo lineal cuadrático se utilizo un valor a/b (indicador de radiosensibilidad del tejido) = 10 Gy y 3 = Gy para volúmenes objetivos y para órganos de riesgo, respectivamente (5,6). Las prescripciones a los volúmenes objetivos se describen en término de la dosis mínima administrada al 90% del volumen de interés (D90).
Tabla 1: Prescripciones de dosis a los volúmenes objetivos y restricciones a los OAR.
Definición de volúmenes objetivos
En el año 2000, GEC-ESTRO estableció los conceptos básicos para la definición y delimitación de los diferentes volúmenes necesarios para la planificación tridimensional en braquiterapia. Destacando el papel de la resonancia magnética en secuencias T2W, como la modalidad de imagen que permite la visualización de la extensión tumoral, tanto en el cérvix como en las regiones adyacentes. Respecto a los volúmenes objetivos, estos se definen de acuerdo a la extensión tumoral al momento del diagnóstico y en la braquiterapia. High risk clinical target volume (CTV-HR), se define como la región con mayor riesgo de recidiva local por enfermedad macroscópica residual; incluye el tumor macroscópico en el momento de la BT, la totalidad del cérvix y la extensión patológica extra-cervical. Intermediate risk clinical target volume (CTV-IR), es la extensión tumoral macroscópica al diagnóstico y con mayor riesgo de recidiva local por enfermedad microscópica al momento de la BT.
En el presente estudio, el CTV IR y el CTV HR fueron delimitados al momento del diagnóstico y en la primera aplicación de braquiterapia, respectivamente (figuras 2,3). Directamente del software de planificación, se cuantificaron los volúmenes de riesgo en centímetros cúbicos de acuerdo al volumen delimitado. Al CTV HR se le considero como volumen bruto (con dispositivo de braquiterapia in situ) y como un volumen neto (sin dispositivo). Para una mayor precisión del volumen del CTV HR no consideramos el volumen del dispositivo de braquiterapia. La sustracción del volumen del dispositivo se realizó a través de un procedimiento que consideraba las dimensiones físicas conocidas del dispositivo, de acuerdo al fabricante (r = 1.5 mm), y luego calculamos el volumen aritméticamente, de acuerdo a la longitud del dispositivo inserto en el CTV HR:
Volumen aplicador = Área x d à= π x r2 x d =altura del aplicador en centímetros en el CTV HR.
Respecto a la reducción tumoral, se definió como:
La planificación del tratamiento también considera la delimitación de los órganos en riesgo para objetivar las dosis recibidas y permitir ajustar las dosis en el proceso de optimización. Se informan la dosis mínima que recibe el volumen de tejido más irradiado adyacente al aplicador en términos de D2 centímetros cúbicos.
Toxicidad Aguda: La toxicidad aguda se definió como aquellos efectos que ocurrieron dentro de 90 días posteriores a la finalización de la braquiterapia y se evaluó de acuerdo con el score de morbilidad por radiación aguda de la Radiation Therapy Oncology Groug (RTOG)(11).
ANÁLISIS ESTADÍSTICO
El análisis de datos fue realizado con el paquete estadístico STATA versión 16.1 (2020, Statacorp LLC, Texas, Estados Unidos de América). Para el análisis descriptivo se calcularon medidas de tendencia central y dispersión correspondientes. La mediana de seguimiento se definió como el tiempo transcurrido entre el inicio de la radioterapia externa y el último control médico registrado en ficha clínica. Pruebas de hipótesis fueron aplicadas considerando un valor-p menor a 5% como umbral de significancia estadística. Específicamente, se aplicó la prueba de Kruskal-Wallis, extensión para múltiples grupos de la prueba U de Mann-Whitney, para evaluar diferencias en toxicidad aguda en función de la dosis prescrita.
RESULTADOS
Identificamos 34 pacientes elegibles. La mediana de seguimiento fue de 157 días con rango intercuartil (RIC) de 79.5 – 210). La mediana de edad fue 41 años [RIC 33 – 50]. El tipo histológico más frecuente fue el carcinoma epidermoide (91%). La mayoría de las pacientes tenían una etapa IIIC FIGO 2018 (41%). La mediana del tamaño tumoral clínico fue de 4 cm [RIC 3 – 6] y 14 pacientes presentaron tumores mayores de 4 cm (41.1%). Todos los pacientes contaban con tomografía computada de tórax – abdomen – pelvis a modo de etapificación. Dieciséis pacientes presentaron ganglios linfáticos comprometidos. Doce pacientes se etapificaron con tomografía por emisión de positrones – tomografía computada con Flúor Deoxi Glucosa, de éstos 6 pacientes tenían captaciones en ganglios pélvicos, 1 paciente en ganglios paraórticos y 3 pacientes en ganglios pélvicos y paraaórticos. Las principales características de nuestra población se describen en la tabla 2.
Morbilidad relacionada al tratamiento:
Seis pacientes presentaron toxicidad aguda gastrointestinal y/o genitourinaria. No hubo diferencias estadísticamente significativas al comparar aquellas pacientes que recibieron dosis equivalentes totales desde los 85 Gy con las que recibieron menor dosis respecto a toxicidad gastrointestinal (p=0.33) y genitourinaria (p=0.97). Los grados de toxicidad en relación a las dosis prescritas se describen en la figura 4.
Resultados del tratamiento
Todas las pacientes completaron el tratamiento de radioterapia y 27 pacientes recibieron los 5 ciclos de cisplatino concomitante. Dieciocho pacientes recibieron radioterapia con técnica de arcoterapia volumétrica de intensidad modulada. En 24 pacientes se aplicaron 3 sesiones de braquiterapia. Las aplicaciones de braquiterapia se realizaron con el dispositivo FSD en 32 pacientes; dispositivo en anillo se utilizo en 2 pacientes, y 3 pacientes además recibieron braquiterapia intersticial. Las prescripciones de dosis en los volúmenes objetivos y restricciones a los OAR se describen en la Tabla 2. La mediana del tiempo de tratamiento fue 54.5 días. Las características del tratamiento se describen en la tabla 3.
La mediana del volumen del CTV IR al diagnóstico fue de 34.35 cc [RIC 21.9 – 70.4], la mediana del volumen CTV HR en la primera aplicación de braquiterapia fue 16.15 cc [RIC 11.7 – 26.8] y 15.87 cc [RIC 11.49 – 26.51] para los volúmenes bruto y neto, respectivamente. La mediana de las dosis equivalentes totales prescritas al D90 CTV HR fue de 83.6 Gy [RIC 83.6 – 85.5]. Una dosis equivalente total > 80 Gy se logro en todos los pacientes. La reducción del volumen tumoral desde el diagnóstico hasta el momento de la braquiterapia se logro en las 34 pacientes. Doce pacientes presentaron reducción del volumen tumoral mayor al 70%. La mediana de las dosis equivalentes totales prescritas al D2cc de vejiga fue 73.9 Gy, al recto 65.6 Gy y al intestino fue de 69.1 Gy.
Discusión
La radioquimioterapia concomitante seguida de braquiterapia adaptativa guiada por imágenes de resonancia magnética es el tratamiento estándar del CCLA (4,5,12). La resonancia magnética se ha convertido en una técnica de imagen crucial para definir el volumen tumoral en pacientes con CCLA ya que proporciona una correcta visualización del tumor cervical en múltiples planos, lo que permite una definición volumétrica confiable de los volúmenes objetivos para la planificación del tratamiento con braquiterapia (8,13).
El informe ICRU 89 (14) y las recomendaciones de la ESTRO (6) introdujeron el enfoque de braquiterapia adaptativa que se basa en el riesgo de recurrencia y la respuesta al tratamiento. Este enfoque permite un aumento de la dosis al momento de la braquiterapia con el objetivo de tratar dirigidamente los volúmenes que contienen tumor macroscópico residual posterior a la radioquimioterapia y los volúmenes con posible enfermedad microscópica que estaban presentes al momento del diagnóstico. Sin embargo, el aumento de la dosis de manera segura está limitada por la proximidad de los OAR. Nuestro protocolo de tratamiento descrito en el presente estudio incorpora tales recomendaciones a la práctica local cumpliendo con los estándares internacionales actuales.
Los análisis volumétricos de tumores con resonancia magnética permiten determinar la respuesta del cáncer cervical a la radioquimioterapia, con estudios que sugieren que la tasa de regresión tumoral después de una dosis externa de 40 a 50 Gy se asocia con mejores resultados (15). Varios estudios prospectivos y retrospectivos demostraron una correlación entre la dosis de radiación total administrada a los volúmenes objetivo y la probabilidad de control local, y que el beneficio proporcionado por el aumento de la dosis conduce a una mayor probabilidad de sobrevida sin progresión (16,17,18). Potter et al. demostraron que el uso de braquiterapia guiada por resonancia magnética se asoció con un aumento en la tasa de control local del 71% al 90% a los 3 años para los tumores de tamaño > 5 cm en el momento del diagnóstico y una disminución importante en las toxicidades tardías digestivas y urinarias grado 3 – 4 del 10% al 2% (19). Lindegaard et al. demostraron que la braquiterapia 3D adaptada por resonancia magnética en comparación con la braquiterapia 2D basada en imágenes ortogonales aumentó significativamente la sobrevida del 63% al 79%, mientras que disminuyó las toxicidades tardías en más del 50% (20).
Dentro del marco del estudio multicéntrico retroEMBRACE, el año 2016 se publicaron dos estudios con resultados oncológicos importantes. En el primer estudio se identifico que las pacientes tratadas con IGABT basada resonancia magnética lograron un control local a 3 años del 95% para tumores < 5 cm vs 85% > = 5 cm (p <= 0,001)(9). El segundo estudio demostró que una dosis mínima administrada al 90% del volumen del CTV HR ⩾ 85 Gy administrado en 7 semanas proporcionó tasas de control local a 3 años > 94% con CTV HR de tamaños de 20 cm3 , > 93% en tamaños intermedios de 30 cm3 y > 86% en tamaños grandes de 70 cm3 (10). La reciente literatura citada valida el rol integral de la IGABT como parte del tratamiento estándar para el CCLA.
La reducción del volumen tumoral posterior a la radioquimioterapia como factor predictivo de control local y sobrevida en pacientes con CCLA, también ha sido interés de estudio por distintos autores (21,22). Schernberg et al. estudiaron el valor pronóstico de la reducción del volumen tumoral después de la radioquimioterapia, basada en la medición de 3 diámetros tumorales en resonancia magnética, y se correlacionó de manera independiente la reducción tumoral > 90% con una mejor sobrevida global, sobrevida libre de progresión, control local y metástasis a distancia (P <0,001). En este estudio, no se informó ningún beneficio del aumento de la dosis por encima de 80 Gy en pacientes con una reducción del tumor > 90%, mientras que aquellos con una respuesta tumoral deficiente tuvieron un mejor control local si recibieron una dosis total > 80 Gy (23). Estos resultados avalan el beneficio otorgado del enfoque adaptativo de la IGABT que permite aumentar la dosis dirigidamente en casos seleccionados, por tanto, logrando un tratamiento personalizado. Nuestros resultados cuantificaron la reducción tumoral basada en resonancia magnética en todos los pacientes, logrando identificar una tendencia de una mayor reducción tumoral en el grupo de pacientes con etapas IIIC1 o mayor. Sin embargo, no se encontró correlación con las dosis equivalentes totales prescritas, lo que pudiera ser efecto de insuficiencia de potencia estadística (figura 5).
El riesgo de morbilidad gastrointestinal y genitourinaria relacionada al tratamiento también ha sido investigado. Las relaciones dosis efectos han sido demostradas por diferentes series (12,26,27,28,29) que establecen una correlación entre el D2cc de la vejiga, recto e intestino con el riesgo de presentar efectos secundarios. Las restricciones de dosis a los OAR establecidas por la evidencia recién descrita, es respetada por nuestro protocolo institucional, lo que se traduce en que solo 6 pacientes presentaron toxicidad general aguda, con solo una paciente con toxicidad gastrointestinal grado ⩾ 3, a pesar de que en 11 pacientes se aumento la dosis por sobre los 85 Gy. Por tanto, las dosis equivalentes totales prescritas no se asociaron con mayor incidencia de toxicidad. Sin embargo, cabe mencionar que es difícil determinar si las toxicidades agudas son secundarias exclusivamente a la radioquimioterapia o la combinación con braquiterapia.
Los resultados dosimétricos obtenidos en nuestras pacientes se compararon con dos estudios dentro del marco del estudio multicéntrico retroEMBRACE (9,24) y con los resultados publicados de un centro similar al nuestro (25). En nuestra cohorte, todas las pacientes recibieron dosis equivalentes totales > 80 Gy a diferencia de las experiencias internacionales citadas (tabla 4), que incluyeron en sus prescripciones dosis menores a 80 Gy. Respecto a las restricciones de dosis a la vejiga, nuestros valores en promedio son inferiores a las dosis recibidas en los otros centros y el 100% de las prescripciones respetan los límites de dosis. Las restricciones para el recto e intestino se respetan en más del 82 % y 91 %, respectivamente, sin diferencias con los centros comparados. El resumen de la comparación de los resultados dosimétricos se describe en la tabla 4.
Los resultados oncológicos respecto a control local, sobrevida global, libre de enfermedad y toxicidad tardía serán reportados cuando se alcance un seguimiento apropiado de forma prospectiva.
Conclusión
Este estudio demostró la factibilidad y seguridad del protocolo de BTAGI de resonancia magnética, instaurado en la unidad de radioterapia del Hospital Carlos Van Buren, logrando las recomendaciones estándares requeridas para la práctica clínica. Por tanto, la braquiterapia guiada por resonancia magnética se puede realizar en el sistema publico de salud, evaluando objetivamente la reducción tumoral, logrando resultados dosimétricos y de toxicidad aguda similares a los de la literatura internacional.
REFERENCIAS
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424.
- Bhatla N, Aoki D, Sharma DN, Sankaranarayanan R. Cancer of the cervix uteri. Int J Gynaecol Obstet. 2018;143 Suppl 2:22-36.
- International Agency for Research on Cancer. World Health Organization. Globocan 2018. Hallado en www: https://gco.iarc.fr. Acceso el 17 de agosto 2020.
- Gillian M. Thomas, Concurrent chemotherapy and radiation for locally advanced cervical cancer: The new standard of care. Semin Radiat Oncol, Volume 10, Issue 1, 2000,Pages 44-50.
- Haie-Meder C, Pötter R, Van Limbergen E, Briot E, De Brabandere M, Dimopoulos J, et al. Recommendations from Gynaecological (GYN) GEC- ESTRO Working Groupq (I): concepts and terms in 3D image based 3D treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV. Radiother Oncol 2005;74:235–45.
- Pötter R, Haie-Meder C, Van Limbergen E, Barillot I, De Brabandere M, Dimopoulos J, et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology. Radiother Oncol 2006;78:67–77.
- Hellebust TP, Kirisits C, Berger D, Pérez-Calatayud J, De Brabandere M, De Leeuw A, et al. Recommendations from Gynaecological (GYN) GEC-ESTRO Working Group: considerations and pitfalls in commissioning and applicator reconstruction in 3D image-based treatment planning of cervix cancer brachytherapy. Radiother Oncol 2010;96:153–60.
- Dimopoulos JCA, Petrow P, Tanderup K, Petric P, Berger D, Kirisits C, et al. Recommendations from Gynaecological (GYN) GEC-ESTRO Working Group (IV): Basic principles and parameters for MR imaging within the frame of image based adaptive cervix cancer brachytherapy. Radiother Oncol 2012;103:113–22.
- Sturdza A, Pötter R, Fokdal LU, Haie-Meder C, Tan L, Mazeron R, et al. Image guided brachytherapy in locally advanced cervical cancer: Improved pelvic control and survival in RetroEMBRACE, a multicenter cohort study. Radiother Oncol. 2016;120(3):428-433.
- Tanderup K, Fokdal LU, Sturdza A, Haie-Meder C, Mazeron R, Limbergen E, et al: Effect of tumor dose, volume and overall treatment time on local control after radiochemotherapy including MRI guided brachytherapy of locally advanced cervical cancer. Radiother Oncol 120:441-446, 2016.
- Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys. 30 de marzo de 1995;31(5):1341–6.
- Chino J, Annunziata CM, Beriwal S, Bradfield L, Erickson B, Fields E, et al. Radiation Therapy for Cervical Cancer: Executive Summary of an ASTRO Clinical Practice Guideline. Pract Radiat Oncol. 2020;10(4):220-234.
- Paulson ES, Erickson B, Schultz C, Li X: Comprehensive MRI simulation methodology using a dedicated MRI scanner in radiation oncology for external beam radiation treatment planning: Comprehensive MRI simulation methodology for external beam RTP. Med Phys 42:28-39, 2014.
- The international commission on radiation units and measurements prepared in collaboration with Groupe Europeen de curietherapie – European Society for Radiotherapy and Oncology (GEC-ESTRO): prescribing, recording, and reporting brachytherapy for cancer of the cervix. Report no. 89. Journal of the ICRU Vol 13 No 1–2 (2013). Oxford University Press.
- Mayr NA, Magnotta VA, Ehrhardt JC, Sorosky J, Wen BC, et al: Usefulness of tumor volumetry by magnetic resonance imaging in assessing response to radiation therapy in carcinoma of the uterine cervix. Int J Radiat Oncol 35:915-924, 1996.
- Chargari C, Deutsch E, Blanchard P, Gouy S, Martelli H, Guerin F, et al: Brachytherapy: An overview for clinicians. CA Cancer J Clin 69:386-401, 2019.
- Fields EC, Hazell S, Morcos M, Schimdt E, Chargari C, Viswanathan A, et al: Image-guided gynecologic brachytherapy for cervical cancer. Semin Radiat Oncol 30:16-28, 2020.
- Potter R, Tanderup K, Kirisits C, Leeuw A, Kirchheiner K, Nout R, et al: The EMBRACE II study: The outcome and prospect of two decades of evolution within the GEC-ESTRO GYN working group and the EMBRACE studies. Clin Transl Radiat Oncol 9:48-60, 2018.
- Potter R, Dimopoulos J, Georg P, Lang S, Walhusl C, Wachter- Gerstner N, et al: Clinical impact of MRI assisted dose volume adaptation and dose escalation in brachytherapy of locally advanced cervix cancer. Radiother Oncol 83:148-155, 2007.
- Lindegaard JC, Fokdal LU, Nielsen SK, Juul- Christensen J, Tanderu K. MRI-guided adaptive radiotherapy in locally advanced cervical cancer from a Nordic perspective. Acta Oncol 52:1510-1519, 2013.
- Mayr NA, Taoka T, Yuh WTC, Denning LM, Zhen WK, Paulino AC, et al. Method and timing of tumor volume measurement for outcome prediction in cervical cancer using magnetic resonance imaging. Int J Radiat Oncol Biol Phys 52:14-22, 2002.
- Wang JZ, Mayr NA, Zhang D, Li K, Grecula JC, Montebello JF, et al. Sequential magnetic resonance imaging of cervical cancer: The predictive value of absolute tumor volume and regression ratio measured before, during, and after radiation therapy. Cancer 116:5093-5101, 2010.
- Schernberg A, Bockel S, Annede P, Fumagalli I, Escande A, Mignot F, et al. Tumor shrinkage during chemoradiation in locally advanced cervical cancer patients: Prognostic significance, and impact for image-guided adaptive brachytherapy. Int J Radiat Oncol Biol Phys 2018.
- Fokdal L, Sturdza A, Mazeron R, Haie-Meder C, Tee Tan L, Gillham C, Segedin B, et al. Image guided adaptive brachytherapy with combined intracavitary and interstitial technique improves the therapeutic ratio in locally advanced cervical cancer: Analysis from the retroEMBRACE study. Radiother Oncol. 2016;120(3):434-440.
- Mahantshetty U, Krishnatry R, Hande V, Jamema S, Ghadi Y, Engineer R, et al. Magnetic Resonance Image Guided Adaptive Brachytherapy in Locally Advanced Cervical Cancer: An Experience From a Tertiary Cancer Center in a Low and Middle Income Countries Setting. Int J Radiat Oncol Biol Phys. 2017;99(3):608-617.
- Georg P, Potter R, Georg D, Lang S, Dimopoulos J, Sturdza AE, et al. Dose effect relationship for late side effects of the rectum and urinary bladder in magnetic resonance image guided adaptive cervix cancer brachytherapy. Int J Radiat Oncol Biol Phys 82:653-657, 2012.
- Mazeron R, Maroun P, Castelnau-Marchand P, Dumas I, Rivin del Campo E, Cao K, et al. Pulsed-dose Rate Image-Guided Adaptive Brachytherapy in Cervical Cancer: Dose-volume Effect Relationships for the Rectum and Bladder. Radiother Oncol 116, 2015.
- Mazeron R, Fokdal LU, Kirchheiner K, Georg P, Jastaniyah N, Segedin B, et al. Dose-volume effect relationships for late rectal morbidity in patients treated with chemoradiation and MRI-guided adaptive brachytherapy for locally advanced cervical cancer: Results from the prospective multicenter EMBRACE study. Radiother Oncol. 2016;120(3):412-419.
- Tanderup K, Nesvacil N, Kirchheiner K, Serban M, Spampinato S, Jensen NB, et al. Evidence-Based Dose Planning Aims and Dose Prescription in Image-Guided Brachytherapy Combined With Radiochemotherapy in Locally Advanced Cervical Cancer. Semin Radiat Oncol. 2020;30(4):311-327.
TABLAS Y FIGURAS
Tabla 1. Características de las pacientes
| Número de pacientes | 34 pacientes | Mediana [Rango intercuartil] o
n (%) |
| Edad | 41 [33 – 50] | |
| PS
|
0 | 33 (97%) |
| Índice de masa corporal (Kg/m2) | 27.1 [24.4 – 32.3] | |
| Tabaquismo | NO SI | 22 (65%)
12 |
| Histología | CCE ADC | 31 (91%)
3
|
| Etapa FIGO 2018 | IB2 IB3 IIA IIB IIIC1 IIIC2 IVA | 2 (6 %)
5 (15 %) 2 (6 %) 10 (29 %) 9 (26 %) 5 (15 %) 1 (3 %) |
| Estado nodal
|
N (+) N (-) | 16 (47%)
18 |
| Tamaño tumoral clínico*(cm) | 4 [3 – 6] | |
| TC TAP | 34 (100%) | |
| PET-CT | SI | 12 (35%) |
| N (-) | 2 | |
| N (+) pelvis | 6 | |
| N(+) Aórticos | 1 | |
| N(+) pelvis + aórticos | 3 | |
| Abreviaciones: ADC = adenocarcinoma; FIGO = International Federation of Gynecology and Obstetrics; PS = performance status; CCE = carcinoma de células escamosas; * = al diagnóstico; TC: tomografía computada; PET-CT: tomografía por emisión de positrones – tomografía computada. | ||
Tabla 2. Prescripciones de dosis a los volúmenes objetivo y OAR
(dosis equivalente por fracción de 2 Gy con a / b = 10 Gy para el tumor)
| CTV HR | D90 80 – 90 Gy EQD2 |
| OARs | Vejiga 2Dcc <= 90 Gy EQD2
Recto 2Dcc <= 75 Gy EQD2 Intestino 2Dcc <= 75 Gy EQD2 |
Abreviaciones : CTV HR = volumen clínico objetivo de alto riesgo al momento de la braquiterapia; D2cc: dosis mínima que recibe el volumen de tejido más irradiado en centímetros cúbicos; D90 = dosis mínima administrada al 90% del volumen de interés; EQD2= dosis equivalentes totales; OAR = órganos en riesgo.
Table 3. Características del tratamiento
| Subgrupos | Mediana [rango intercuartil] o n (%) | |
| TTG (días) | 54.5 [50 – 58] | |
| Dosis RT (Gy) | pelvis: 45 Gy adenopatías: 57.5 Gy | 20 (59%)
14 |
| Tipo de RT | 3D
VMAT |
16
18 (53%) |
| Fracciones de RT | 25 fracciones | 34 (100%) |
| Tipo de QT | Cisplatino | 23 (100%) |
| Ciclos de QT
|
5 4
3 |
27 (79%)
6 (18%) 1 (3%) |
| Volumen al diagnóstico/ CTV IR (cm3) | 34.35 [21.9 – 70.4] | |
| Volumen después RTQ/ CTV HR bruto (cm3) | Con volumen del dispositivo | 16.15 [11.7 – 26.8] |
| Volumen después RT/ CTV HR neto (cm3) | Sin volumen del dispositivo | 15.87 [11.49 – 26.51] |
| EQD2 D90 CTV HR (Gy) | 83.6 [83.6 – 85.5] | |
| EQD2 D90 CTV HR (Gy) ³ 80 Gy | 34 (100%) | |
| Reducción del volume tumoral (++)
|
< 50 % 50 – 70 % > 70 % | 13 (38 %)
9 (27 %) 12 (35 %) |
| D2cc vejiga (Gy) | 73.9 [71.3 – 76.6] | |
| D2cc recto (Gy) | 65.6 [59.9 – 68.2] | |
| D2cc intestino (Gy) | 69.15 [64.6 – 72.6] |
Abreviaciones: CTV HR = volumen clínico objetivo de alto riesgo al momento de la braquiterapia; CTV IR = volumen clínico objetivo de riesgo intermedio al diagnóstico; D2cc: dosis mínima que recibe el volumen de tejido más irradiado en centímetros cúbicos; D90= dosis mínima administrada al 90% del volumen de interés; FSD = Fletcher-Suit-Delclos; QT = quimioterapia; RT = radioterapia; RTQ: radioquimioterapia; VMAT: arcoterapia volumétrica de intensidad modulada; TTG: tiempo de tratamiento general; 3D: radioterapia tridimensional convencional; ++= cuantificado en RM respecto al CTV HR neto.
Tabla 4. Comparación de resultados dosimétricos
| Fokdal et al, N= 610 (23) | Sturdza et al, N =731 (9) | Cohorte de estudio actual, N=34 | Mahantshetty et al, N = 94 (24) | |
| CTV HR
D90 EQD2 (Gy) Volumen, cm3 |
88 ± 14 36 ± 24 |
87 ± 15 37 ± 24 |
84.1 ± 2 21.3 ± 14 |
88.3 ± 4.4 46.9 ± 24.6 |
| D2cc Vejiga (Gy) | 81 ± 22 | 81 ± 22 | 73.4± 7.6 | 85.7 ± 9.8 |
| D2cc Recto (Gy) | 64 ± 8 | 64 ± 9 | 65.4 ± 7.1 | 65.5 ± 7.2 |
| D2cc Intestino (Gy) | 65 ± 10 | 64 ± 9 | 67.6 ± 6.9 | 67 ± 8.8 |
| Abreviaciones: CTV HR = volumen clínico objetivo de alto riesgo al momento de la braquiterapia; D90 = dosis mínima administrada al 90% del volumen de interés; EQD2 = dosis equivalentes totales; D2cc: dosis mínima que recibe el volumen de tejido más irradiado en centímetros cúbicos. Datos presentados como promedio ± desviación estándar. | ||||
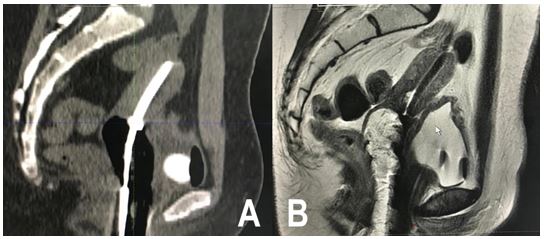
Figura 1. Paciente de 28 años con CCLA, etapa IIIC1. Imagen A: Tomografía computada, corte sagital. Se visualiza tándem central del dispositivo FSD junto a los dos ovoides en vagina, posterior a la inserción del dispositivo FSD que verifica el correcto posicionamiento. Imagen B: RM T2w, corte sagital, tándem central intrauterino se visualiza con una hipointensidad central y bordes con intensidad intermedia.
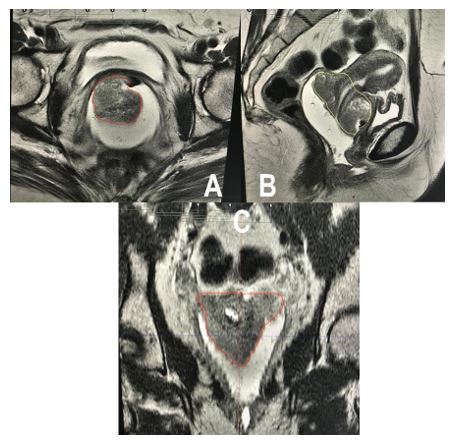
Figura 2. Paciente de 30 años con CCLA etapa IIB. Se describe la delimitación del CTV IR en RM T2W. Imagen A: en corte axial; Imagen B: corte sagital; imagen C: corte coronal. Se visualiza cuello uterino con área de hiperintensidad intermedia – alta correspondiente a tumor. Se observa hiperintensa la cavidad de la vagina y fondos de sacos ocupados por el gel endovaginal. Volumen del CTV IR=70 cc.
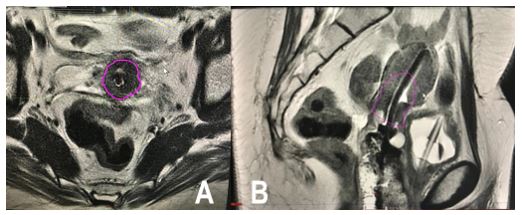
Figura 3. Describe la delimitación del CTV HR de la paciente anterior en la primera aplicación de braquiterapia. RM T2w. Imagen A: corte axial; imagen B: corte sagital. Se observa cuello uterino de menor tamaño, con intensidad intermedia baja y con tándem central en el interior de borde hiperintenso. Hacia anterior se observa nítidamente pared vesical con vejiga colapsada y sonda Foley en su interior. Hacia posterior se identifica el tabique rectovaginal y la pared rectal. Volumen del CTV HR=18 cc.
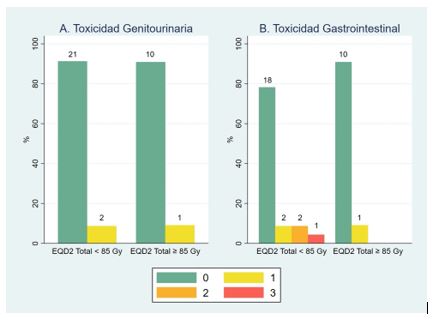
Figura 4. Gráfico que muestra la relación de toxicidad aguda respecto a las dosis equivalentes totales prescritas. GI = gastrointestinal; GU = genitourinaria.
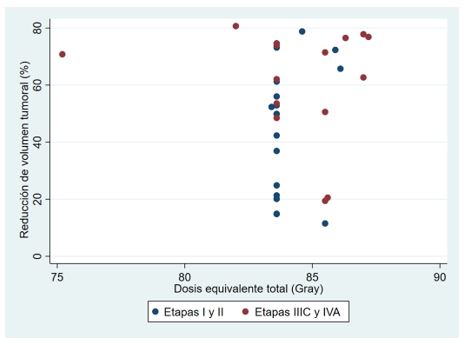
Figura 5. Gráfico que muestra la relación de reducción del volumen tumoral (%) con las dosis equivalentes totales.



