2015
5
Autores:
Andrea Agustín O1, Ricardo Savirón C1, Diego Lerma P1, Ana Herrero I2, José Manuel Campillos M1
Instituciones:
1Servicio de Obstetricia y Ginecología, 2Servicio de Oncología. Hospital Universitario Miguel Servet. Zaragoza, España.
Tipo de documento:
Casos ClínicosCORIOCARCINOMA POSTGESTACIONAL
Contenido del documento:
RESUMEN
El coriocarcinoma es una patología infrecuente pero potencialmente fatal si no se trata. Se incluye dentro de las neoplasias trofoblásticas gestacionales, un grupo de tumores malignos altamente invasivos, metastáticos y muy vascularizados. Su presentación tras una gestación a término conlleva peor pronóstico que tras un aborto o una mola hidatiforme porque reflja un retraso en el diagnóstico y tratamiento. Describimos el caso de una paciente que acudió al servicio de urgencias, refiiendo metrorragia escasa desde un parto normal hace dos meses y posteriormente presentó un sangrado grave durante su hospitalización. Los elevados niveles de β-hCG, la ecografía-Doppler, las pruebas de imagen y las manifestaciones clínicas fueron sufiientes para diagnosticar un coriocarcinoma postparto. El tratamiento precoz con poliquimioterápicos permitió una evolución favorable de la paciente.
PALABRAS CLAVE: Enfermedad trofoblástica gestacional, coriocarcinoma, embarazo
SUMMARY
Choriocarcinoma is an infrequent disease but potentially fatal if untreated. It is included in trophoblastic gestational neoplasia, a range of malignant tumors highly invasive, metastatic and very vascular. Its presentation after term pregnancies carries a worse prognosis than after a miscarriage or a hydatidiform mole because it reflcts a delay in diagnosis and treatment. We report the case of a patient who presented to the emergency department referring little metrorrhagia from a normal delivery two months ago and severe bleeding later during her hospital stay. The high serum β-hCG level, the Doppler ultrasonography, the imaging test and the clinical manifestation were enough to diagnose a non-metastatic postpartum choriocarcinoma. Early treatment with polychemotherapy allowed a favorable evolution of the patient.
KEY WORDS: Gestational trophoblastic disease, choriocarcinoma, pregnancy
NTRODUCCIÓN
El coriocarcinoma (CC) es un tumor epitelial maligno derivado de las vellosidades coriales, productor de gonadotropina coriónica humana (β-hCG) que se incluye dentro de la enfermedad trofoblástica maligna (ETM), junto a la mola invasiva y al tumor trofoblástico del lecho placentario (1). Todos ellos se caracterizan por su gran capacidad invasiva, debido a un fallo en el mecanismo regulador de la invasión del tejido trofoblástico a la decidua y su rica vascularización, la cual condiciona su extensión vía vascular (2,3). La incidencia del CC en Europa y Norteamérica se estima en 3/100.000 gestaciones (1), mientras que en Asia estos valores ascienden a 5-200/100.000 embarazos. Estas diferencias se han asociado a la utilización de diferentes clasifi caciones histológicas, la dieta o condicionantes genéticos (2,4). La clínica principal es la metrorragia, tanto en las etapas iniciales de la gestación como en el posparto. La determinación de β-hCG es utilizada tanto para el diagnóstico como para el seguimiento de la evolución del coriocarcinoma (3). Presentamos el caso clínico de un coriocarcinoma diagnosticado dos meses después de un parto a término sin complicaciones y con evolución favorable pos tratamiento.
Caso clínico
Paciente de 37 años, con antecedentes personales de hipercolesterolemia y una única gestación, con serologías negativas, que había fializado su gestación dos meses antes en el Servicio de Obstetricia y Ginecología del Hospital Universitario Miguel Servet. En el cribado combinado de primer trimestre obtuvo como resultado un riesgo alto de Trisomía 21 (1/18) con una translucencia nucal de 1,77 mm, hueso nasal presente y valores de β-hCG libre de 3,727 MoM y de PAPP-A de 0,404 MoM. Se realizó amniocentesis genética a las 16+1 semanas de gestación obteniendo un cariotipo disómico para los cromosomas 13, 18 y 21, y monosómico para los cromosomas X e Y. La ecografía morfológica a las 20 semanas describió una placenta de espesor y ecoestructura normal sin anomalías fetales. A las 35 semanas la placenta no mostró alteraciones y con un grado II de Grannum.
Ingresó a las 39+6 semanas de gestación por rotura prematura de membranas. Nació un feto varón sano por vacuo extracción debido a una detención del expulsivo. Peso neonatal de 3610 g, Apgar 9-10, pH 7.30 de arteria umbilical. El alumbramiento espontáneo, con placenta macroscópicamente normal. Se constató sangrado vaginal moderado y atonía uterina, que se corrigió con misoprostol intrarrectal y perfusión de oxitocina. Se realizó revisión manual de cavidad. El puerperio cursó sin incidencias salvo anemia con Hb: 7,9 g/dl que precisó hierro intravenoso. Alta a las 48h del parto.
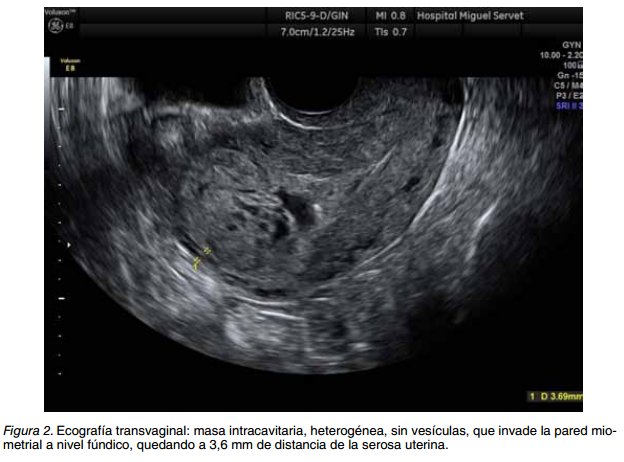
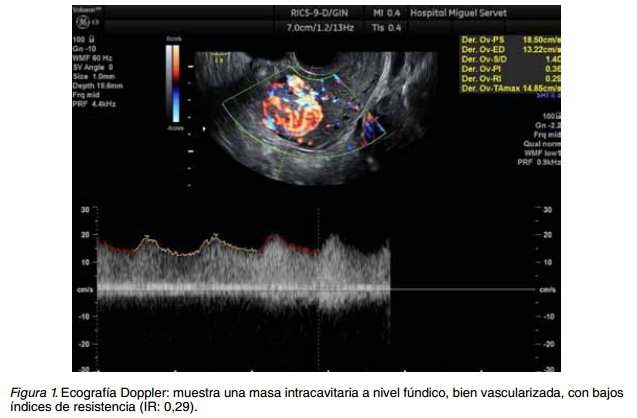
Dos meses después del parto acudió al servicio de urgencias por hemorragia vaginal mayor a una menstruación y dolor leve en hipogastrio. La exploración mostró un abdomen blando depresible, no doloroso a la palpación, sin signos de irritación peritoneal y cérvix permeable. La analítica 1 hora después de su llegada mostró una anemia leve (Hb 10,9 g/dl y hematocrito de 35%), β-hCG de 212.000 mUI/l. La ecografía transvaginal describió un útero de 91x50x50 mm con masa ocupante a nivel fúndico de 44x31x37 mm, ampliamente vascularizada, con valores de impedancia baja (IR: 0,29-0,34) y sin vesículas, que invadía miometrio anterior, posterior y fondo, quedando a 3,6 mm de fondo uterino (Figuras 1 y 2); los anejos eran normales y no se visualizaba líquido libre en pelvis. Se planteó un diagnóstico diferencial entre mola hidatiforme invasiva versus coriocarcinoma.
Dos horas después de su ingreso se produjo una hemorragia genital intensa con hipotensión arterial. Para controlar el sangrado fue necesaria la administración de 3 ampollas intravenosas de ácido tranexámico, con una dosis total de 1,5 g. Veinticuatro horas después la analítica refljaba una hemoglobina de 8,8 g/dl y un hematocrito de 28%.
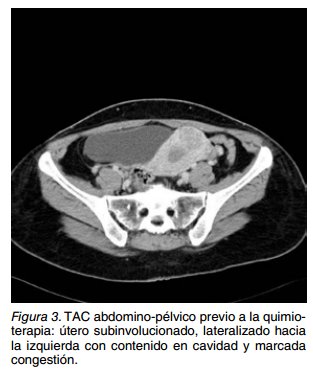
Estabilizada la paciente se solicitó un TAC tó- raco-abdómino-pélvico con contraste, que mostró hepatoesplenomegalia homogénea, uréter izquierdo dilatado sin repercusión por compresión del mismo por útero subinvolucionado, lateralizado hacia la izquierda con contenido en cavidad y marcada congestión (Figura 3). Pequeños ganglios retroperitoneales de <7 mm y un ganglio inguinal de 12 mm. Se realizó TAC y RM cerebral sin hallazgos signifiativos.
La paciente fue informada de las alternativas terapéuticas de las que disponía. El tratamiento quirúrgico mediante histerectomía, si consideraba cumplido su deseo genésico, o el tratamiento mé- dico mediante quimioterapia. La paciente optó por esta última opción por deseo genésico a futuro. La paciente fue trasladada al servicio de oncología para iniciar tratamiento tres días después del ingreso. Se catalogó como una enfermedad trofoblástica maligna postgestacional no metastá- tica, de alto riesgo (FIGO Risk Score 7) y se inició tratamiento poliquimioterápico con esquema EMACO (Etopósido 100 mg/m2 días 1-2, Actinomicina D 0,5 mg días 1-2, Metotrexate 300 mg/m2 día 1, Vincristina 1 mg/m2 día 8 y Ciclofosfamida 600 mg/ m2 día 8, ciclos repetidos cada 14 días).
Los valores de β-hCG descendieron desde el inicio del tratamiento: 191.702,31 mUI/l a los tres días y 36.353,73 mUI/l a los siete días. Tras el inicio de la quimioterapia el sangrado genital fue disminuyendo rápidamente hasta desaparecer por lo cual la paciente pudo ser dada de alta para continuar manejo ambulatorio.
Los valores de la β-hCG continuaron en descenso hasta 6.558,97 mUI/l catorce días tras el diagnóstico y 80,38 mUI/l un mes después. La cuantifiación se negativizó (<1,2 mUI/l) tras la administración de 6 ciclos, recibiendo posteriormente seis semanas de tratamiento adicional. Las últimas pruebas de imagen realizadas (ecografía ginecoló- gica y TAC) y la exploración ginecológica no muestran evidencia de enfermedad.
DISCUSIÓN El coriocarcinoma puede aparecer después de cualquier tipo de gestación: un aborto, una mola hidatiforme, un embarazo ectópico o una gestación a término (5). La incidencia de este último caso varía según los estudios desde 1/50.000 a 1/200.000 nacidos vivos, agrupando entre un 16,1% a un 22,5% de los CC (7,8,9). Puede aparecer incluso años después de un parto normal, lo que se asociaría a peor pronóstico (2,8,9). Los CC intraplacentarios son raros pero suelen ocurrir tras gestaciones a término aparentemente no complicadas. En nuestro centro la incidencia del coriocarcinoma postparto es de 1/36.000 partos.
Los factores de riesgo relacionados con la aparición del CC son: la edad materna inferior a 20 años o superior a 39 y la historia previa de enfermedad trofoblástica. Algunos estudios también afiman que hay un aumento de la incidencia cuando la edad paterna es superior a 40 años, independientemente de la edad materna, aunque estos resultados aún están por confimar. La multiparidad se ha asociado a un incremento del riesgo, pero únicamente en aquellas mujeres con más de 5 gestaciones previas. El riesgo de CC aumenta de 2,0 a 6,4 en aquellas mujeres que en algún momento usaron anticonceptivos orales (ACO), aunque su uso no incrementa el riesgo de ETG tras un embarazo molar. Algunos estudios únicamente afiman un incremento del riesgo con ACO cuando se trata de un uso prolongado superior a 7 años (4,7). Nuestra paciente no presentaba factores de riesgo para el desarrollo de un coriocarcinoma postparto, nunca había tomado ACO y su pareja era menor de 40 años.
En muchas ocasiones se produce un retraso en el diagnóstico tras una gestación no molar, ya que los síntomas y los signos son muy sutiles y no se realizan determinaciones de β-hCG ni estudio histológico de la placenta de forma rutinaria. Hasta un 74% de los CC postparto la manifestación más común es el sangrado persistente 6 semanas postparto, bien escaso o bien llegando a producir un shock hemorrágico (9). Otras manifestaciones del tumor son la subinvolución uterina o la clínica derivada de las metástasis: cefaleas, alteraciones neurológicas, disnea, hemoptisis, dolor abdominal o hematuria (3).
Debe sospecharse un CC en toda mujer en edad reproductiva con metástasis de origen desconocido. Nuestra paciente fue diagnosticada con una presentación típica de la enfermedad: un sangrado leve constante desde el momento del parto que a su llegada a urgencias se convirtió en una hemorragia abundante y niveles de β-hCG muy elevados, así como una imagen ecográfia en la que se apreciaba una masa intrauterina muy vascularizada que invadía la pared miometrial.
La presentación clínica de una ETM es más importante para determinar e iniciar el tratamiento que un diagnóstico histológico preciso, por lo que muchos de estos casos se diagnostican sin un estudio anatomopatológico. De hecho, no se aconseja la realización de una biopsia tumoral o de la lesión metastática si no existe garantía de controlar el sangrado, ya que son lesiones con una gran vascularización, en nuestro caso fue una de las razones por las que no realizamos biopsia. Existen casos publicados en los que, tras la realización de una biopsia, ésta no es diagnostica de CC debido al importante componente necrótico y hemorrágico del tumor (2,8,9,10).
Ante la sospecha o el diagnóstico de un CC se debe realizar una ecografía-Doppler pelviana (5), que permite observar índices de baja resistencia, y una radiografía de tórax para descartar metástasis pulmonares, ya que estás son las más frecuentes. El TAC tóraco-abdómino-pélvico puede revelar metástasis pulmonares no detectadas en la radiografía de tórax hasta en un 40% de las ETG (1). Se recomienda la realización de una RM para descartar metástasis cerebrales en los casos de alto riesgo o ante la existencia de metástasis pulmonares.
Cuando se diagnostica un CC siempre está indicado el tratamiento quimioterápico y éste debe iniciarse en el momento oportuno para evitar complicaciones hemorrágicas y diseminación metastá- tica. Dado el antecedente hemorrágico y el deseo genésico de la paciente, se decidió no realizar estudio histológico de la lesión e iniciar tratamiento quimioterápico precoz.
Se han identifiado como factores de buen pronóstico un intervalo entre la gestación y el diagnóstico de CC menor a 4 meses y niveles de β-hCG <1.000 UI/l previos al inicio de la quimioterapia. Como factores de mal pronóstico se encuentra un diagnóstico >12 meses postparto y niveles de β-hCG >100.000 UI/l (8).
Históricamente existen 3 clasifiaciones para etapifiar y establecer el tratamiento de las neoplasias trofoblásticas gestacionales (9):
National Institutes of Health (NIH) Clinical Classification: segrega a los pacientes con enfermedad metastática y no metastática. Considera que los pacientes sin metástasis pueden ser curados con monoquimioterapia independientemente de los factores de riesgo.
World Health Organization (WHO) Prognostic Index Score: divide a las pacientes en riesgo bajo (≤4), riesgo moderado (5-7) y riesgo alto (≥8). International Federation of Gynecology and Obstetrics (FIGO) Anatomic Staging: basado únicamente en la extensión anatómica de la enfermedad (Tabla I).
En un estudio publicado sobre el pronóstico del CC postparto en el que se incluyeron 123 casos, un 79,7% de ellos presentaba metástasis en el momento del diagnóstico y en el 31% de este grupo, las metástasis fueron multifocales (8). Las pacientes de bajo riesgo fueron tratadas con monoquimioterapia (Metrotrexate o Actinomicina D) consiguiendo hasta un 50-90% de remisiones (2). Por ello podemos considerar que el CC es una entidad con un pronóstico incierto.
El grupo de alto riesgo precisa poliquimioterapia y en ocasiones puede ser necesario tratamiento con radioterapia o cirugía. La histerectomía precoz no parece mejorar el resultado en las pacientes de alto riesgo con enfermedad metastática y en aquellas sin metástasis. La histerectomía puede acortar la duración y la dosis de quimioterapia necesaria,
pero no se establece como tratamiento de primera línea, sobre todo en aquellas mujeres que no han cumplido sus deseos genésicos (1). El tratamiento poliquimioterápico más aceptado en estos casos es el EMA-CO (Etopósido, Metrotrexate y Actinomicina D alterno cada semana con Ciclofosfamida y Vincristina) con tasas de remisión de hasta el 91% (1,2). La quimioterapia debe continuarse hasta que los controles semanales de β-hCG se encuentren por debajo del rango normal y posteriormente al menos 2 o 3 ciclos de mantenimiento para asegurar la erradicación del tumor. La supervivencia a los 5 años con este tratamiento se encuentra entre el 75-90%, aunque esta cifra se ve reducida en el caso de metástasis hepáticas o cerebrales. La mayor parte de las muertes se producen por hemorragia o por alteraciones metabólicas derivadas de la diseminación de la enfermedad. Hasta un 13% de las pacientes de alto riesgo desarrollarán recurrencias posteriores a la remisión inicial. El riesgo de recurrencia (aparición de nuevas metástasis o incremento de β-hCG tres meses tras la remisión completa) es mayor durante el primer año y se estima <3% (2).
En el año 2000 el sistema FIGO integró los factores pronósticos incluidos en la clasifiación de la WHO para determinar el riesgo de resistencia al tratamiento con monoquimioterapia (Tabla II) (1,6). Esta nueva clasifiación permite describir con mayor precisión la lesión y su extensión. Este nuevo FIGO Risk Score clasifia a las pacientes en dos grupos: riesgo bajo (de 0 a 6) y riesgo alto (≥7).
Se considera remisión completa de la enfermedad cuando existen 3 títulos semanales consecutivos de β-hCG normales. Tras fializar el tratamiento los pacientes deben seguir controles de β-hCG semanales durante 6 semanas y posteriormente controles quincenales hasta completar un año desde la normalización de los valores hormonales (10)
Tras la quimioterapia es posible que queden masas residuales en las áreas metastáticas o en el útero y, a diferencia del tumor del sitio placentario, en el caso del coriocarcinoma no es necesario extirparlas ya que no reduce el riesgo de recurrencia (2).
Durante la monitorización hormonal posterior al tratamiento quimioterápico se aconseja evitar el embarazo al menos durante 12 meses para reducir la teratogenicidad y evitar confusiones en los controles de β-hCG. Para ello se indican los ACO, si la mujer no tiene una contraindicación médica previa, ya que no alteran los niveles de β-hCG y disminuyen hasta casi un 50% los embarazos durante este primer año en comparación con aquellas mujeres que utilizan métodos de barrera (9). En aquellas que pese a las advertencias se embarazan, no se ha visto incrementado el riesgo de recaída, morbilidad fetal o muerte materna; hasta el 70% de estas pacientes pueden tener un embarazo a término por lo que se estima que estas gestaciones tienen una evolución favorable (2).
A pesar de presentar inicialmente factores de mal pronóstico (antecedente de parto a término previo, valores de β-hCG >105 y tamaño tumoral de 4 cm) que hacían considerar a la lesión como de Alto Riesgo (FIGO Risk Score 7), la respuesta clínica, radiológica y hormonal, a la poliquimioterapia fue buena. Actualmente se está siguiendo con controles periódicos de β-hCG.
CONCLUSIÓN
El coriocarcinoma postgestacional es una enfermedad poco frecuente pero que puede poner en peligro la vida de la paciente a corto plazo, sobre todo en el caso de existir metástasis, muy frecuentes en esta tumoración, dada su diseminación vía hemática. En nuestra paciente no existía enfermedad metastática pero se presentó inicialmente con factores de mal pronóstico debido al antecedente de gestación a término y los niveles muy elevados de β-hCG, que luego de tres meses de tratamiento con poliquimioterapia obtuvo una remisión completa de la enfermedad. Se destaca la rapidez en el diagnóstico del caso, mediante la exploración ecográfia y la determinación de β-hCG, herramientas imprescindibles para el diagnóstico y seguimiento del CC. A pesar de no contar con un diagnóstico histopatológico de la lesión, debido al riesgo de sangrado incoercible y deseo genésico futuro, se inició el tratamiento de precozmente, medida fundamental dada la rapidez con la que se puede desarrollar este tumor
BIBLIOGRAFÍA
1. Gerulath AH. Gestational Trophoblastic Disease. SOGC Clinical Practice Guideline. 2002 May;(114). Disponible en: http://sogc.org/wp-content/ uploads/2013/01/114E-CPG-May2002.pdf.
2. Seckl MJ, Sebire NJ, Berkowitz RS. Gestational trophoblastic disease. Lancet. 2010; 376:717-29.
3. Guerrero-Hernández A, Jennings-Aguilar Y, LópezZúñiga DF, Ochoa-Carrillo FJ, Briones-Garduño JC. Coriocarcinoma gestacional. Caso clínico de medicina crítica en ginecología y obstetricia. GAMO 2012; 11(1). Disponible en: http://apps.elsevier.es/watermark/ctl_ servlet?_f=10&pident_articulo=90123238&pident_ usuario=0&pcontactid=&pident_revista=305&ty=82& accion=L&origen=zonadelectura&web=www.elsevier. es&lan=es&fichero=305v11n01a90123238pdf001. pdf.
4. Altieri A, Silvia Franceschi JF, Smith J, Vecchia CL. Epidemiology and aetiology of gestational trophoblastic diseases. Lancet Oncol 2003; 4(11):670-8.
5. Rotas M, Khulpateea N, Binder D. Gestational choriocarcinoma arising from a cornual ectopic pregnancy: a case report and review of the literature. Arch Gynecol Obstet 2007;276:645-7.
6. Goldstein DP, Zanten-Przybysz IV, Bernstein MR, Berkowitz RS. Revised FIGO staging system for gestational trophoblastic tumors. Recommendations regarding therapy. J Reprod Med 1998;43(1):37-43.
7. García-Benasach F, Ríos-Vallejo M, Savirón-Cornudella R, Díaz-Terán E, Iglesias-Goy E. Metástasis cerebrales de coriocarcinoma tras una gestación a término. Prog Obstet Ginecol 2006;49(2):98-101.
8. Ma Y, Xiang Y, Wan XR, Chen Y, Feng FZ, Lei CZ, et al. The prognostic analysis of 123 postpartum choriocarcinoma cases. Int J Gynecol Cancer 2008;18(5):1097-101.
9. Soper JT, Mutch DG, Schink JC. Diagnosis and treatment of gestational trophoblastic disease: ACOG Practice Bulletin No. 53. Gynecologic Oncology 2004;93(3):575-85.
10. Seckl MJ, Sebire NJ, Fisher RA, Golfir F, Massuger L, Sessa C; ESMO Guidelines Working Group. Gestational trophoblastic disease: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013;24 Suppl 6:vi39-50.