2020
5
Autores:
Sochog
Instituciones:
Leidy Jhulliana Saldarriaga Monsalve1 , Walter Darío Cardona Maya1 .
1 Grupo Reproducción, Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Correspondencia
Nombre: Walter Darío Cardona maya
Email: wdario.cardona@udea.edu.co
Tipo de documento:
Trabajos OriginalesEfecto del zumo de sandía (Citrullus lanatus) en el estrés oxidativo en espermatozoides humanos
Contenido del documento:
INTRODUCCIÓN
El factor masculino esta presente en al menos el 50% de las parejas que consultan por infertilidad 1-3. Después de estudiar las etiologías de infertilidad masculina en el 32% a 50% no se logra identificar una posible causa y son catalogadas como idiopáticas 1,4,5. Al realizar un estudio funcional y molecular de los espermatozoides de los pacientes infértiles, un alto porcentaje presenta niveles elevados de estrés oxidativo 2,6.
El estrés oxidativo se produce por el desbalance entre la generación de moléculas altamente inestables conocidas como especies reactivas de oxígeno (ROS) 2,6, entre las que se incluyen el radical hidroxilo, el peróxido de hidrógeno (H2O2) y el anión superóxido 7 y la capacidad antioxidante del plasma seminal; Las ROS son responsables de regular procesos celulares como la secreción y acción de la insulina, la producción de hormonas de crecimiento y citosinas, y específicamente en los espermatozoides están implicados en la transducción de señales durante la capacitación, la hiperactivación y la reacción acrosomal 8,9. Sin embargo, cuando las concentraciones de ROS son excesivas alteran constituyentes celulares e inducen la muerte celular 10. Los espermatozoides son particularmente susceptibles a los efectos oxidativos de las ROS, debido a las grandes cantidades de ácidos grasos insaturados en la membrana celular (peroxidación de lípidos) 11.
El proceso de oxidación de lípidos conduce a la pérdida de la integridad de la membrana, al aumento en su permeabilidad, a la inactivación de enzimas celulares, al daño estructural del ADN y a la apoptosis celular induciendo a consecuencias como la reducción de la concentración, la movilidad y la morfología normal espermática 11 lo cual repercute negativamente sobre el potencial fértil masculino. Con el fin de contrarrestar los efectos nocivos de las ROS, los espermatozoides y el plasma seminal poseen sistemas antioxidantes (catalasa superóxido dismutasa y glutatión peroxidasa) que capturan las ROS evitando el daño celular 7.
Con el propósito de evitar los efectos negativos del estrés oxidativo, se ha propuesto que el consumo de una dieta rica y balanceada de frutas y verduras podrían proveer un efecto protector antioxidante 12, incluso se ha correlacionado epidemiológicamente que el consumo de antioxidantes ofrece una serie de beneficios para la salud 13.
Entre los compuestos provenientes de frutas y verduras con potente capacidad antioxidante que ha tomado importancia en los últimos años se encuentra el licopeno, un pigmento lipofílico que confiere el color rojo característico a algunas frutas y verduras incluyendo tomates, sandías, pomelos rosados y papayas 14. Además, el licopeno está implicado en algunas reacciones inmunitarias, señales de unión de hendidura, regulación del crecimiento celular y la expresión génica 15 en diferentes tejidos como el hígado, el riñón, las glándulas renales, los testículos y la próstata 8.
Las propiedades del licopeno del tomate han sido ampliamente estudiadas 16,17, sin embargo su disponibilidad en la sandía (Citrullus lanatus) ha tomado fuerza debido a que a diferencia del tomate, en el cual el licopeno está disponible en cantidades relativamente mayores después de un tratamiento térmico por la descomposición del complejo de proteína-carotenoide, el licopeno de la sandía está disponible para su absorción al momento del consumo 17. Adicionalmente en la sandía el porcentaje de licopeno comprende entre un 70-90% del total de carotenoides y excede al tomate en el contenido promedio de licopeno con una concentración media de 4868 µg/100 g, un 40% más alta que la media para el tomate crudo (3025 µg/100 g) 18.
Se han realizado varios estudios 3,6,19-21 con el fin de determinar el efecto de los antioxidantes sobre la calidad seminal evaluando el efecto de la ingesta del antioxidante licopeno. En general, se reporta que el alto consumo del antioxidante se asocia con niveles reducidos de la fragmentación del ADN espermático y la peroxidación lipídica a través de su efecto antioxidante, también de mejorar la movilidad espermática en los pacientes infértiles. Además, otro estudio 20 determinó que los antioxidantes mantienen la movilidad de los espermatozoides in vitro neutralizando la acción de los oxidantes.
Por lo tanto, el objetivo del presente estudio fue determinar el efecto in vitro e in vivo del zumo de sandía (Citrullus lanatus) sobre los parámetros seminales convencionales y funcionales.
MATERIALES Y MÉTODOS
Muestras de semen
Se incluyeron 65 muestras de semen donadads por 20 voluntarios aparentemente sanos, ninguno fumaba o consunia alguna drogra recreativa. Las muestras de semen fueron obtenidas por masturbación en un recipiente estéril, después de 2 a 5 días de abstinencia sexual y analizadas máximo 2 horas después de su recolección.
Cinco muestras seminales fueron usadas para los ensayos in vitro y 20 individuos donaron cada uno tres muestras de semen durante los estudios in vivo (Figura 1).
Los voluntarios tenían un promedio de edad de 23 ± 3,6 años, 1,74 ± 0,07 metros de estatura y 72,5 ± 10,21 kiloogramos de peso.
Cada individuo firmó un consentimiento informado aprobado por el Comité de Bioética, Facultd de Medicina, de la Universidad de Antioquia, después de leer y entender el propósito de la investigación.
Zumo/extracto de sandía
Las preparaciones de sandía (Citrullus lanatus, Universidad Nacional de Colombia, Voucher COL000257511) fueron obtenidos licuando 424,9 ± 33,5 g de fruta libre de azúcar, agua y semillas propias de la fruta. Para los ensayos in vitro se procedió a centrifugar dos veces el producto del licuado de sandía a 1500rpm/10 min con el fin de eliminar los residuos propios del extracto, mientras que para los los ensayos in vivo se entregaba a los voluntarios aproximadamente 424 mL (16 onzas) de zumo de sandía sin centrifugar.
Ensayos in vitro
Se seleccionaron los espermatozoides móviles de 5 muestras mediante un gradiente de selección (PureSperm® 40/80. Nidacon International AB, Goteborg, Suecia). Brevemente, en un tubo se depositaron 600µL de cada gradiente y 1mL de la muestra seminal, se centrifugó a 300g/20 min, el botón recuperado fue lavado con 1mL de medio HAM F10 (Sigma Chemical Company, St Louis, MO, EE.UU.) a 300g/5min y resuspendido en 1,5mL de medio HAM F10. Finalmente, los espermatozoides puros se dividieron en tres alícuotas y fueron incubados en tres diferentes condiciones: i) medio HAM F10 solo; ii) medio HAM F10 más H2O2 (5mM), y medio HAM F10 más H2O2 (5mM); y iii) 0,45% de extracto de zumo de sandía. A cada muestra se le cuantificó la movilidad espermática al tiempo cero, a los 30 y 60 minutos (Figura 1).
Ensayos in vivo
Cada uno de los 20 individuos donó tres muestras de semen: la primera antes de iniciar el consumo diario del zumo, las otras a los 7 y 15 días de la ingesta de 424mL (16 onzas) del zumo. A cada muestra seminal se le valoraron los parámetros seminales convencionales, funcionales y la capacidad antioxidante del plasma seminal (Figura 2).
Pruebas convencionales
Se determinaron los parámetros seminales macroscópicos (viscosidad, volumen, pH y licuefacción) y microscópicos (concentración, movilidad, viabilidad y morfología celular) siguiendo los lineamientos previamente establecidos por la OMS 22. Además, la concentración espermática se determinará mediante la cámara de Makler 23.
Pruebas funcionales
Se tomaron alícuotas de 1×106 de espermatozoides para evaluar cada uno de los siguientes parámetros funcionales: potencial de membrana mitocondrial, lipoperoxidación de la membrana espermática, integridad de la membrana de los espermatozoides y niveles de ROS intracelulares espermáticas mediante citometría de flujo (CoulterEpics XL -BeckmanCoulter, CA, EE.UU.) analizando al menos 10.000 espermatozoides, los resultados de las citometrías de flujo de cada parámetro funcional fueron graficadas y procesados utilizando el programa Flow Jo 7.6 (Tree Star, Inc. Oregon, EE.UU.).
Detección del potencial de membrana mitocondrial
Los espermatozoides se incubaron con ioduro de propidio (IP, 0,25 mg/mL, Molecular Probes®Inc, OR, EE.UU.) y 3,3’dihexi-loxacarbocianina (DIOC6 10nM, Molecular Probes®) a 37°C/30 minutos, los espermatozoides se lavaron centrifugando a 300g/5 minutos. El botón se resuspendió en PBS (Gibco®, NY, EE.UU.) y se realizó la lectura en el citómetro de flujo 1,2,24-26.
Análisis de la lipoperoxidación de la membrana espermática
Se incubaron los espermatozoides con 4,4-difluoro-4-bora-3a-4a-diaza-s-indaceno (BODIPY C11, Molecular Probes®Inc, OR, EE.UU.) a 37°C/30 minutos, los espermatozoides se lavaron una vez, se resuspendieron en PBS y se realizó la lectura en el citómetro de flujo 1,2,24-26.
Detección de la integridad de la cromatina espermática
Se diluyeron los espermatozoides en buffer TNE (TRIS-HCl, NaCl, EDTA – disódica, pH: 7,4). Justo antes de leer la muestra en el citómetro de flujo, se adicionaron 200 µL de solución detergente ácida (HCl, NaCl, Tritón X-100, pH: 1,2) y 30 segundos después se adiciono a la solución colorante naranja de acridina (0,006 mg/mL, Sigma-Aldrich, St Louis, MO, EE.UU.), finalmente se realizó la lectura en el citómetro de flujo 1,2,24-26.
Determinación de la integridad de la membrana de los espermatozoides
Los espermatozoides se incubaron en una mezcla de IP y Sybr 14 (LIVE/DEAD® Sperm-Viability Kit, Molecular Probes®) a 37°C/30 minutos, se realizó un lavado con PBS y posteriormente se resuspendió el botón antes de realizar la lectura en el citómetro de flujo 1,2,24-26.
Evaluación de los niveles de especies reactivas de oxígeno intracelulares espermáticas.
Se realizó una incubación de los espermatozoides con di-acetato de 2’,7’ diclorofluoresceína (DCFH-DA, Sigma-Aldrich, St Louis, MO, EE.UU.) más IP a 37°C/5 minutos, posteriormente se realizaron 3 lavados. Finalmente, el botón obtenido se resuspendió en PBS y se realizó la lectura en el citómetro de flujo 1,2,24-26.
Capacidad antioxidante del plasma seminal
Las muestras de semen se centrifugaron a 175 rpm durante 20 minutos, 200 μL de sobrenadante se le adicionaron a 3 mL de solución de radical 1,1-difenil-2-picril hidrazilo (DPPH, 6,09 × 105 mol/L de metanol Sigma-Aldrich Company, St. Louis, MO, EE.UU.). La reacción se incubó a temperatura ambiente durante una hora para estabilizar la reacción de color y fue cuantificada en un espectrofotómetro (Nanodrop, ND1000 Spectophotometer, Thermo-Scientific, EE. UU.) a 515 nm contra un blanco que contenía metanol 2,26.
Análisis de datos
Los resultados fueron analizados mediante estadística descriptiva, usando media y desviación estándar. Los resultados in vitro fueron comparados usando una prueba de t pareada entre la muestra de espermatozoides con H2O2 con y sin sandia. Para las comparaciones entre las muestras iniciales y las muestras del día siete y el día quince después del consumo de sandía se usó la prueba de Wilcoxon (pareada no paramétrica) utilizando el programa estadístico GraphPad Prism 6.0.
RESULTADOS
La movilidad total espermática en los ensayos in vitro evidenció que la sandía (0,45%) protege a los espermatozoides del efecto negativo inducido por el H2O2 (5mM) a los 30 minutos (p<0,0001) y 60 minutos (p<0,0003). En las muestras incubadas con H2O2 (5mM) los espermatozoides fueron inmovilizados en su totalidad antes de los 30 minutos de incubación (Figura 2).
De otro lado, in vivo se observó que los parámetros seminales convencionales no variaron respecto a la muestra inicial (Tabla 1), sin embargo, algunos parámetros funcionales como la lipoperoxidación de la membrana espermática disminuyó en 72% a los días siete (p<0,05) y en 45,5% a los días quince (p<0,05) con respeto al día cero (Tabla 1). Adicionalmente, se redujo la producción intracelular de ROS a los 7 (16%, p<0,05) y 15 días (27%, p<0,05) con respecto al día cero (Tabla 1), el índice de fragmentación del ADN disminuyó alrededor de 30% en el día 15 (Tabla 1) y la capacidad antioxidante del plasma seminal para el día 7 y 15 aumentó cerca del 17% (p<0,05) con respecto al día cero en los voluntarios evaluados (Tabla 1).
DISCUSIÓN
La responsabilidad de las alteraciones reproductivas generalmente era atribuida principalmente a las mujeres, sin embargo, en la actualidad se reconoce que los hombres son tan responsables como las mujeres durante los procesos reproductivos 3,27. Múltiples factores asociados a la infertilidad masculina continúan sin ser identificados, sin embargo se ha sugerido el estrés oxidativo como un factor clave, especialmente en casos de infertilidad idiopática 8. El estrés oxidativo induce generalmente daño del ADN e incremento en la lipoperoxidación de la membrana de los espermatozoides debido a que estas membranas son particularmente vulnerables por los altos niveles de ácidos grasos poliinsaturadas en la bicapa lipídica los cuales pueden ser oxidados, además el estrés oxidativo se ha relacionado con parámetros espermáticos alterados 28.
La sandía (Citrullus lanatus) contiene altas concentraciones de licopeno, un antioxidante natural reconocido por su papel preventivo en algunas enfermedades crónicas provocadas por el estrés oxidativo 29. En el ensayo in vitro se indujo el estrés oxidativo con H2O2 y el extracto de sandía evitó el efecto negativo bloqueando el efecto oxidativo del peróxido. Esta capacidad protectora generada por el extracto de sandía se puede considerar clave durante la lucha contra las especies oxidantes en el semen debido a que los niveles suprafisiológicos de ROS pueden afectar la movilidad, la morfología y la concentración 30. En concordancia con estos resultados, un estudio previo 31 demostró que la preincubación de espermatozoides humanos con licopeno los protege frente al daño en el ADN en muestras incubadas con H2O2. De hecho, en estudios in vitro 20,32 en los cuales los espermatozoides son expuestos a altas concentraciones de ROS, se evidenció un aumento significativo en el daño del ADN, una disminución de la movilidad progresiva y la inducción de procesos apoptóticos afectando las funciones espermáticas cruciales para la adecuada fecundación 20,33.
Por su parte, el consumo de sandía no indujo ningún cambio sobre los parámetros seminales convencionales. Es importante recalcar que hasta la fecha, los parametros seminales son la única herramienta que permite valorar el potencial fértil masculino aunque éste no proporciona una información sobre la capacidad de fecundante de un hombre 34, incluso varios estudios han sugerido que el espermograma no deja de ser un análisis subjetivo e incapaz de diferenciar entre individuos infértiles y fértiles como de describir las propiedades funcionales y biológicas del espermatozoide 35,36, adicionalmente se han encontrado que hombres con parámetros seminales por debajo del limite inferior de referencia son fértiles 22.
Por lo tanto, otras pruebas diagnósticas conocidas como pruebas funcionales espermáticas complementan el espermograma y permiten valorar algunas características fisiológicas de las células. En el presente estudio se observó que en algunos parámetros funcionales como la lipoperoxidación de la membrana espermática, la producción intracelular de ROS y el índice de fragmentación del ADN disminuyeron con el consumo de sandía. Acorde a la literatura la disminución en la peroxidación de lípidos se asocia con el aumento de la defensa antioxidante y con la capacidad del antioxidante de reducir la producción de ROS protegiendo la membrana e impidiendo la alteración del ADN espermático 12,32,37 evitando algunos efectos negativos de los ROS como la apoptosis, la reducción de la concentración, de la movilidad y de la morfología normal espermática 11 lo cual altera el potencial fértil masculino.
De otro lado, aumentos del daño en el ADN se han relacionado con parejas que presentan pérdida recurrente de la gestación, aunque no todos los estudios reportan correlaciones positivas con la alteración del ADN espermático 23,24 si se reporta incremento de la fragmentación del ADN en hombres con infertilidad de origen desconocido 1. Por lo tanto el consumo de zumo de sandía (altas concentraciones de licopeno) al prevenir la lipoperoxidación de la membrana espermática, la producción intracelular de especies y el daño del ADN podría servir de tratamiento en estos hombres como terapia antioxidante contra las ROS que estarían induciendo la infertilidad.
El consumo diario del zumo de sandía generó un aumentó en la concentración del agente antioxidante evidenciado por el aumento de la capacidad antioxidante (Tabla 1), seguramente debido a que la concentración plasmática de licopeno depende casi exclusivamente de su ingesta dietética, debido a que éste no se metaboliza en el organismo 16. Aunque se encontraron diferencias del 17% en la capacidad antioxidante en el día quince, el porcentaje no es mayor debido a que posiblemente se está generando un equilibrio entre los oxidantes y los antioxidantes en ese periodo de tiempo por el previo consumo del zumo de sandía y para ejercer el efecto protector es necesario que el antioxidante se encuentre a mayores concentraciones que el agente oxidante, como se evidenció en el día siete. Además, el antioxidante tiene una vida media en plasma seminal entre 9 y 16 días 38, lo cual podria repercutir en los aumentos encontrados.
Finalmente, después del consumo del zumo de sandía, el licopeno es incorporado dentro de las micelas de los lípidos dietarios y por difusión pasiva es absorbido en la mucosa intestinal, donde es incorporado a los quilomicrones y liberado al sistema linfático para ser transportado al hígado y distribuido a diferentes tejidos por medio de lipoproteínas dentro del plasma 29, esta distribución del antioxidante en el organismo no se realiza de un manera uniforme, se cree que existen tejidos específicos en los cuales éstos realizan su acción 39. Así, después de darse una distribución a diferentes tejidos como la próstata, el licopeno es almacenado en prostasomas en la próstata durante la eyaculación alcanza al semen 40,41, una vez en semen el antioxidante empieza a hacer parte del sistema de defensa no enzimático logrando retrasar la producción y acción de los radicales libres ayudando a combatir los efectos perjudiciales de las especies de oxígeno reactivo, además se ha establecido una clara correlación con niveles más bajos de licopeno que se encuentran en el plasma seminal de los hombres infértiles respecto a los hombres fértiles 42. Goyal et al., en 2007 40 confirman la presencia de licopeno en el semen humano, cuyos niveles pueden aumentar significativamente después una suplementación en la dieta con una fuente natural de licopeno.
En conclusión, en el presente estudio se observó que el extracto de sandía induce un efecto protector sobre los espermatozoides humanos protegiendo su movilidad del efecto negativo del H2O2. Además, en los ensayos in vivo el consumo de sandía mejora los parámetros funcionales como la lipoperoxidación de la membrana espermática, la producción intracelular de especies y el daño del ADN.
Finalmente, este es el primer reporte en el que se evidencia tanto in vitro como in vivo que el zumo de sandía podría ser beneficioso para la infertilidad masculina, y permiten pensar en un tratamiento natural, al alcance de todos. Sin embargo, se requieren más estudios con un mayor número de individuos, pacientes con alteraciones funcionales espermáticas y un periodo de tiempo más prolongado con la ingesta del antioxidante para dilucidar mejor el efecto.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Por el apoyo financiero: Convocatoria Programática 2017-2018 Área Ciencias de la Salud (2017-15642), Universidad de Antioquia.
REFERENCIAS
- Mayorga-Torres BJ, Cardona-Maya W, Cadavid A, Camargo M. Evaluacion de los parametros funcionales espermaticos en individuos infertiles normozooespermicos. Actas Urol Esp 2013;37:221-7.
- Mayorga-Torres JM, Agarwal A, Roychoudhury S, Cadavid A, Cardona-Maya WD. Can a Short Term of Repeated Ejaculations Affect Seminal Parameters? J Reprod Infertil 2016;17:177-83.
- Yamamoto Y, Aizawa K, Mieno M, et al. The effects of tomato juice on male infertility. Asia Pac J Clin Nutr 2017;26:65-71.
- Cardona Maya W. Límite inferior de referencia-nuevos valores de referencia en el análisis seminal. Medicina & Laboratorio 2014;20:93-4.
- Ko EY, Siddiqi K, Brannigan RE, Sabanegh ES, Jr. Empirical medical therapy for idiopathic male infertility: a survey of the American Urological Association. J Urol 2012;187:973-8.
- Ghyasvand T, Goodarzi MT, Amiri I, Karimi J, Ghorbani M. Serum levels of lycopene, beta-carotene, and retinol and their correlation with sperm DNA damage in normospermic and infertile men. Int J Reprod Biomed (Yazd) 2015;13:787-92.
- Kolettis PN, Sharma RK, Pasqualotto FF, Nelson D, Thomas AJ, Jr., Agarwal A. Effect of seminal oxidative stress on fertility after vasectomy reversal. Fertil Steril 1999;71:249-55.
- Agarwal S, Rao AV. Tomato lycopene and its role in human health and chronic diseases. CMAJ 2000;163:739-44.
- Mayorga Torres B, Camargo M, Cadavid ÁP, Maya C, Walter D. Estrés oxidativo: ¿un estado celular defectuoso para la función espermática? Revista Cubana de Obstetrícia y Ginecología 2015;80:486-92.
- Macedo-Márquez A. La producción de especies reactivas de oxígeno (EROs) en las mitocondrias de Saccharomyces cerevisiae. TIP Revista Especializada en Ciencias Químico-Biológicas 2012;15:97-103.
- Zini A, San Gabriel M, Baazeem A. Antioxidants and sperm DNA damage: a clinical perspective. J Assist Reprod Genet 2009;26:427-32.
- González-Torres MC, Betancourt-Rule M, Ortiz-Muñiz R. Daño oxidativo y antioxidantes. Bioquimia 2000;25:3-9.
- Covarrubias DH, Pomares CF, Aranda GE. El licopeno y su papel en la prevención del cáncer de próstata. eNeurobiologia 2013;4.
- Tadmor Y, King S, Levi A, et al. Comparative fruit colouration in watermelon and tomato. Food Research International 2005;38:837-41.
- Armstrong D, Stratton R. Oxidative stress and antioxidant protection. John Willy and Sons 2016.
- Messina D, Fontana CL, Elizalde RP, Uvilla A, Vanrell C, Laur JDL. Correlación entre la ingesta de licopeno y el poder antioxidante total. Revista Argentina de Urología 2010;75:38-46.
- Naz A, Butt MS, Sultan MT, Qayyum MM, Niaz RS. Watermelon lycopene and allied health claims. EXCLI J 2014;13:650-60.
- Edwards AJ, Vinyard BT, Wiley ER, et al. Consumption of watermelon juice increases plasma concentrations of lycopene and beta-carotene in humans. J Nutr 2003;133:1043-50.
- Tvrda E, Kovacik A, Tusimova E, et al. Antioxidant efficiency of lycopene on oxidative stress – induced damage in bovine spermatozoa. J Anim Sci Biotechnol 2016;7:50.
- Twigg J, Fulton N, Gomez E, Irvine DS, Aitken RJ. Analysis of the impact of intracellular reactive oxygen species generation on the structural and functional integrity of human spermatozoa: lipid peroxidation, DNA fragmentation and effectiveness of antioxidants. Hum Reprod 1998;13:1429-36.
- Twigg J, Irvine DS, Houston P, Fulton N, Michael L, Aitken RJ. Iatrogenic DNA damage induced in human spermatozoa during sperm preparation: protective significance of seminal plasma. Mol Hum Reprod 1998;4:439-45.
- World Health Organization. World Health Organization laboratory manual for the examination and processing of human semen. World Health Organization: Geneva, Swtizerland 2010.
- Cardona-Maya W, Berdugo J, Cadavid A. Comparacion de la concentracion espermatica usando la camara de Makler y la camara de Neubauer. Actas Urol Esp 2008;32:443-5.
- Gil-Villa AM, Cardona-Maya W, Agarwal A, Sharma R, Cadavid A. Assessment of sperm factors possibly involved in early recurrent pregnancy loss. Fertil Steril 2010;94:1465-72.
- Mayorga-Torres BJ, Camargo M, Agarwal A, du Plessis SS, Cadavid AP, Cardona Maya WD. Influence of ejaculation frequency on seminal parameters. Reprod Biol Endocrinol 2015;13:47.
- Mayorga-Torres BJM, Camargo M, Cadavid AP, du Plessis SS, Cardona Maya WD. Are oxidative stress markers associated with unexplained male infertility? Andrologia 2017;49.
- Tamayo Hussein S, Cardona Maya WD. Evaluar el factor masculino mediante un espermograma durante la consulta de infertilidad. Revista Cubana de Obstetricia y Ginecología 2017;43.
- Agarwal A, Majzoub A. Role of antioxidants in assisted reproductive techniques. The world journal of men’s health 2017;35:77-93.
- Waliszewski KN, Blasco G. Propiedades nutraceúticas del licopeno. salud pública de méxico 2010;52:254-65.
- Agarwal A, Roychoudhury S, Bjugstad KB, Cho CL. Oxidation-reduction potential of semen: what is its role in the treatment of male infertility? Ther Adv Urol 2016;8:302-18.
- Zini A, San Gabriel M, Libman J. Lycopene supplementation in vitro can protect human sperm deoxyribonucleic acid from oxidative damage. Fertil Steril 2010;94:1033-6.
- Agarwal A, Saleh RA, Bedaiwy MA. Role of reactive oxygen species in the pathophysiology of human reproduction. Fertil Steril 2003;79:829-43.
- Agarwal A, Said TM. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod Update 2003;9:331-45.
- Montes J, Cantu L, Cánepa M, Alciaturi J, Machado M, Bruné M. ¿ Es posible obtener del estudio de semen mejores predictores de fertilidad. Séptimo Congreso de la Federación Latinoamericana de Sociedades de Esterilidad y Fertilidad, FLASEF; 2002. p. 15-24.
- de los Rios J, Cardona WD, Berdugo JA, et al. Los valores espermaticos de 113 individuos con fertilidad reciente no mostraron correlacion con los parametros establecidos por la OMS. Arch Esp Urol 2004;57:147-52.
- Cardona Maya WD, Berdugo Gutierrez JA, de los Rios J, Cadavid Jaramillo AP. Functional evaluation of sperm in Colombian fertile men. Arch Esp Urol 2007;60:827-31.
- Bennetts LE, Aitken RJ. A comparative study of oxidative DNA damage in mammalian spermatozoa. Mol Reprod Dev 2005;71:77-87.
- Britton G. Structure and properties of carotenoids in relation to function. FASEB J 1995;9:1551-8.
- Periago MJ, Martínez-Valverde I, Ros G, Martínez C, López G. Propiedades químicas, biológicas y valor nutritivo del licopeno. Anales de Veterinaria de Murcia; 2001. p. 51-66.
- Goyal A, Chopra M, Lwaleed BA, Birch B, Cooper AJ. The effects of dietary lycopene supplementation on human seminal plasma. BJU Int 2007;99:1456-60.
- Goyal A, Delves GH, Chopra M, Lwaleed BA, Cooper AJ. Prostate cells exposed to lycopene in vitro liberate lycopene-enriched exosomes. BJU Int 2006;98:907-11.
- Palan P, Naz R. Changes in various antioxidant levels in human seminal plasma related to immunoinfertility. Arch Androl 1996;36:139-43
TABLA Y FIGURAS.
Tabla 1. Parámetros seminales de los 20 individuos que participaron en el estudio in vivo.
| Parámetro seminal | Día 0 | Día 7 | Día 15 | ||
| Media ± DS | Media ± DS | valor p | Media ± DS | valor p | |
| Volumen (mL) | 3,23 ± 1,9 | 3,08 ± 1,4 | 0,87 | 2,64 ± 2,6 | 0,05 |
| Concentración (106/ mL) | 72,12± 61,1 | 66,16 ± 47,4 | 0,86 | 59,1± 41,7 | 0,50 |
| Concentración Total (106/eyaculado) | 202,6 ± 150,1 | 208,8 ± 172,6 | 0,61 | 164,2 ± 140,7 | 0,14 |
| Movilidad Total (%) | 49,09 ± 40 | 46,26 ± 35,7 | 0,82 | 42,64 ± 33,7 | 0,61 |
| Viabilidad (%) | 78,48 ± 8,5 | 78,59 ± 9,7 | 0,72 | 79,42 ± 8,6 | 0,56 |
| Recuento total de espermatozoides móviles (moviles totales/eyaculado) | 140,9 ± 118,8 | 147,5 ± 130,3 | 0,54 | 117,7 ± 108,4 | 0,27 |
| Morfología anormal cabeza (%) | 97,64 ± 4,1 | 97,51 ± 3,2 | 0,82 | 93,81 ± 14,2 | 0,57 |
| Morfología anormal pieza intermedia (%) | 31,15 ± 16 | 28,12 ± 11,9 | 0,48 | 27,53 ± 9,0 | 0,71 |
| Morfología anormal cola (%) | 11,21 ± 6,9 | 11,27 ± 9,9 | 0,98 | 12,3 ± 11,1 | 0,70 |
| Células con potencial de membrana mitocondrial alto (%) | 47,65 ± 16,9 | 44,98 ± 17,0 | 0,26 | 45,79 ± 14,2 | 0,45 |
| Células con potencial de membrana mitocondrial bajo (%) | 8,08 ± 4,9 | 9,12 ± 5,3 | 0,31 | 7,46 ± 6,4 | 0,29 |
| Células necróticas (%) | 44,2 ± 16,2 | 45,91 ± 16,1 | 0,35 | 45,68 ± 13,3 | 0,42 |
| Integridad y viabilidad de la membrana plasmática (Íntegra-Viable) (%) | 50,16 ± 16,7 | 47,58 ± 17,7 | 0,42 | 47,99 ± 14,8 | 0,40 |
| Integridad y viabilidad de la membrana plasmática (Desintegrada-Moribunda) (%) | 2,35 ± 1,2 | 2,012 ± 1,2 | 0,52 | 2,06 ± 1,3 | 0,59 |
| Integridad y viabilidad de la membrana plasmática (Necróticas) (%) | 40,54 ± 15,5 | 43,2 ± 16,7 | 0,31 | 43,15 ± 13,3 | 0,33 |
| Lipoperoxidación de la membrana plasmática (%) | 17,96 ± 20,1 | 5,07 ± 5,2 | 0,002 | 9,79 ± 17,3 | 0,03 |
| Producción intracelular de las especies reactivas del oxígeno (ROS, (%)) | 47,57 ± 18,1 | 40,05 ± 19,6 | 0,036 | 34,95 ± 23,2 | 0,03 |
| Índice de fragmentación de ADN (%) | 13,5 ± 6,4 | 14,22 ± 6,6 | 0,78 | 9,53 ± 3,3 | 0,01 |
| Capacidad antioxidante del plasma seminal (%) | 62,7 ± 9,7 | 71,96 ± 11,8 | 0,02 | 73,39 ± 10,9 | 0,01 |
Los datos son expresadon como media ± desviación estándar (DS) y el valor p respecto al control (día cero).
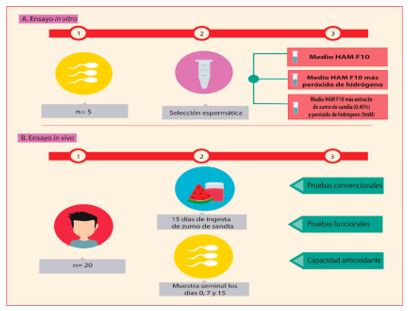
Figura 1. Resumen gráfico de la metodología desarrollada en este estudio. A. Ensayos in vitro. B. Ensayos in vivo.
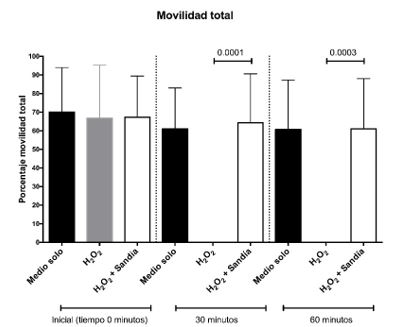
Figura 2. Efecto del extracto de sandía sobre la movilidad espermática total in vitro en función del tiempo. Porcentaje de movilidad espermática normalizado versus el control de la movilidad total de los ensayos in vitro evaluada a los 0, 30 y 60 minuto, n=5. ** p<0,001, *** p<0,003.



