2021
1
Autores:
Sochog
Instituciones:
Ana Cristina Ruiz P. (1), Edurne Álvarez S. (2), Cristina Miyares E. (2), María Muñoz O. (1), Mariano Laguna O. (2), Lucía Vilas S.(1), Marta Isabel Giménez C. (1)
1_ Residente Obstetricia y Ginecología. Servicio Obstetricia y Ginecología, Hospital San Pedro. Logroño. La Rioja. España
2_ Facultativo Especialista de Área de Obstetricia y Ginecología. Servicio Obstetricia y Ginecología, Hospital San Pedro. Logroño. La Rioja. España
Correspondencia: Ana Cristina Ruiz Peña, anaruiz1919@gmail.com.
Tipo de documento:
Artículo de RevisiónGran feto acardio: diagnóstico tardío de gestacion gemelar monocorial biamniótica complicada por secuencia TRAP. Reporte de un caso y revisión de la literatura
Contenido del documento:
INTRODUCCIÓN
Las gestaciones múltiples suponen una situación de riesgo materno-fetal por lo que requieren un mayor control gestacional. Reportan mayor riesgo las gestaciones monocoriales (1/250 embarazos) por la existencia de una única placenta que puede dificultar la situación hemodinámica de los fetos. Ante una gestación gemelar monocorial complicada, es preciso realizar un diagnóstico diferencial según edad gestacional 1,2:
- Malformación discordante (12-14 semana)
- Retraso crecimiento intrauterino selectivo
- Precoz (15-28 semana)
- Tardío (29-36 semana)
- Secuencia de perfusión arterial inversa gemelar (PAIG), denominado en inglés Twin Reverse Arterial Perfusion (TRAP) (12-36 semana)
- Síndrome de Transfusión feto-fetal
- Aguda (29-36 semana)
- Crónica (15-28 semana)
- Secuencia anemia-policitemia (29-36 semana)
- Muerte intrauterina de uno o ambos fetos (cualquier edad gestacional)
- Tumores intraamnióticos o placentarios (cualquier edad gestacional):
- Teratomas placentarios
- Teratomas del cordón umbilical
La secuencia TRAP es una entidad muy infrecuente que complica las gestaciones múltiples monocoriales.
En 1953 la incidencia estimada era de 1/35.000 gestaciones 1-3, constituyendo el 1% de las gestaciones gemelares monocoriales. En una revisión realizada en 2015, la incidencia era de hasta 1/11.000 gestaciones ó 2.6% gemelos monocoriales 4.
Para su diagnóstico es necesaria la coexistencia de un feto normal y un feto acardio, nombre atribuído a aquellos que carecen de función cardíaca especializada (agenesia cardíaca total o parcial) 2. El gemelo acardio actúa de receptor mientras que el gemelo estructuralmente normal actúa de perfusor para mantener la circulación periférica de ambos, pudiéndo ésto provocarle una sobrecarga cardíaca. Esto se debe a la existencia de anastomosis arteriales y venosas: la sangre escasamente oxigenada que sale del feto perfusor llega al feto receptor, constituyendo una circulación completamente invertida 1, 5, 6.
Esta situación origina múltiples anomalías en el feto receptor mientras que la sobrecarga hemodinámica en el perfusor le condiciona desarrollar una insuficiencia cardíaca congestiva acompañada de polihidramnios, anemia y la posibilidad de desencadenar un parto pretérmino, todo asociado a un mal pronóstico con una tasa de mortalidad mayor al 50% 4.
La identificación de las estructuras en cada feto acardio es compleja. Las dos clasificaciones más utilizadas son:
- Según el grado de diferenciación alcanzado (es la más conocida) 1:
- Acardio acephalus (65%): existe desarrollo del tronco y piernas. No existe polo cefálico, ni órganos torácicos ni brazos.
- Acardio anceps (22%): tiene brazos, piernas y un desarrollo parcial de la cabeza con tejido cerebral y estructuras faciales.
- Acardio amorphous (8%): constituye una masa laxa de tejido conectivo indiferenciada, desorganizada, sin forma humana definida.
- Acardio acormus (4%): es una cabeza unida a una placenta.
- Acardio myelocephalus (1%): similar al amorphous con extremidades rudimentarias.
- Según la existencia de tejido cardíaco 7, 8:
- Holoacardius: no existe musculatura cardíaca. Es el equivalente al acardio acephalus.
- Hemiacardius: tiene musculatura cardíaca pero no es funcionante. Es el equivalente al acardio anceps.
El mecanismo etiopatogénico del feto acardio es aún una incógnita pero la teoría vascular es la más aceptada 5:
- Vascular. Las anastomosis arteriales placentarias comunican las arterias umbilicales de ambos gemelos permitiendo que la sangre escasamente oxigenada procedente del gemelo sano se dirija de forma retrógrada hacia el otro a través de sus arterias umbilicales 2. La sangre entra en el feto acardio de forma pulsátil y sale de forma continua con una insuficiente oxigenación y nutrición tisular, lo que provoca polimalformaciones 5,6.
Finalmente, la sangre regresa a través de la vena umbilical, y por las anastomosis veno-venosas placentarias, se completa el circuito 5, 8.
- Cardiogénica. Consiste en una agenesia cardíaca primaria de uno de los fetos creciendo éste como un parásito por las anastomosis arteriales entre ambos 5, 8, 9.
- Cromosómica. Existen trabajos 9, 10 que exponen la incidencia de hasta un 50% de cromosomopatías, fundamentalmente trisomías.
- Inmunológica. El gemelo acardio sería inmunocompetente, lo que le haría ser rechazado por el gemelo sano 5, 8.
Con el objetivo de hacer una revisión de la literatura sobre esta entidad y la importancia de su diagnóstico y tratamiento precoces, presentamos el caso de una gestación gemelar monocorial biamniótica con diagnóstico tardío de complicación por secuencia TRAP. Es necesario recalcar la importancia de realizar un diagnóstico diferencial correcto y temprano ante una gestación gemelar monocorial complicada. El caso presentado es de gran relevancia debido a su diagnóstico tardío y elevado peso al nacimiento del feto acardio sin repercusión en el feto sano.
CASO CLÍNICO
Paciente de 29 años, natural de Colombia y sin antecedentes medicoquirúrgicos de interés, únicamente anemia ferropénica en tratamiento con hierro oral. La paciente cursa su segunda gestación espontánea (la primera fue un aborto diferido en primer trimestre tratado médicamente) y no tiene factores de riesgo infecciosos ni hábitos tóxicos.
La gestación es catalogada en la ecografía de primer trimestre en semana 12 como gemelar bicorial-biamniótica con uno de los gemelos evanescente (feto de 17 mm sin latido cardíaco) (Figura 1 A). La traslucencia nucal del feto vivo es de 1.4 mm y el cribado combinado de aneuploudías de 2º trimestre en semana 15 resulta ser de bajo riesgo (edad materna + traslucencia nucal fetal + ß-hCG + PAPP-A séricas).
Se realiza una ecografía de control en semana 18 donde se ve al feto evanescente de iguales medidas a ecografía de primer trimestre y el otro feto acorde a edad gestacional con latido cardíaco positivo.
En semana 21 se continua visualizando al feto evanescente con iguales medidas y al feto vivo acorde a edad gestacional y morfológicamente normal.
En semana 28, el feto evanescente aumenta de tamaño (40 mm), considerándose éste aumento secundario a degeneraci ciente muy afectada por dolor,idio y gran aumento Se diagnostica de a degeneracifbarazos no deseados.
ón hidrópica.
Desde semana 28 a la 32, la paciente acude en una única ocasión a urgencias por dolor en flanco derecho y pierna izquierda descartándose trombosis venosa profunda así como otras patologías y sin solicitar valoración al obstetra, se diagnostica de dolor lumbar mecánico tipo ciático para lo que se pauta analgesia. La paciente aumenta 8 kg de peso durante este mes además de aumento brusco y doloroso del perímetro abdominal. La paciente no consultó por éste motivo y no acudió a sus controles de obstetricia por lo que no se realizaron ecografías a lo largo de estas 4 semanas.
En semana 32, se visualiza masa de gran tamaño que ocupa la mitad de la cavidad uterina que parece estar en relación con la placenta (se objetiva vascularización a través de la arteria umbilical) y en la que se distinguen huesos. Se diagnostica de gestación gemelar monocorial: secuencia TRAP (Figura 1 B). Se aprecia polihidramnios del feto acardio con columna máxima de líquido amniótico de 17 cm. El primer feto es el “bomba” en presentación cefálica con un peso fetal estimado de 1958 gramos y flujos Doppler sin signos de insuficiencia cardíaca (ductus venoso, IP arteria umbilical y vena umbilical) (Figura 2).
Se objetiva una altura de fondo uterino de 35 cm (mucho mayor a la edad gestacional), así como abdomen a tensión. La paciente refiere dolor abdominal tipo cólico con sensación de contracciones y la cervicometría es de 12 mm. Ingresa para maduración pulmonar y tocolisis por amenaza de parto pretérmino sin conseguirse ya que la paciente inicia trabajo de parto pretérmino. Se indica cesárea por trabajo de parto en gestación gemelar monocorial complicada por secuencia TRAP.
La cesárea transcurre sin incidencias en semana 32+1. El primer feto (bomba) se extrae en cefálica, mujer, sin malformaciones anatómicas aparentes y pesa 1932 gramos. Apgar 7/10. pH arterial 7,21 con pCO2 53 y pH venoso 7,26 con pCO2 42.
El segundo feto (acardio) se extrae en “podálica” con salida de líquido amarillento en gran cantidad y pesa 1800 gramos. Tras primera inspección macroscópica, se cataloga como acardius anceps.
El feto bomba es dado de alta a los 21 días de vida (35+2 semanas) pesando 2212 g y sin otros hallazgos. Primer año de vida en seguimiento por pediatra de atención temprana sin alteraciones.
El feto acardio realiza espamos tras su extracción. Solicitamos radiografías (Figura 3) y lo enviamos a anatomía patológica por su análisis exhaustivo. En el informe anatomopatológico describen un feto polimalformado edematoso de 1800 gramos, con longitud vértico-podálica de 31 cm (Figura 4). Extremidades inferiores deformadas con 3 dedos en cada pie. Cara deformada con comunicación entre nariz y boca, presencia de pelo y bolsa exocraneal de contenido gelatinoso y parte de cerebro (Figura 5). En la cavidad abdominal se objetivan intestinos y riñones. Se realizan cortes en cavidad torácica sin objetivar presencia de pulmones ni corazón. Se analiza la placenta (Figura 6) única con comunicaciones vasculares, con cordón umbilical de 20 cm con 3 luces del feto bomba insertado en espesor placentario y remanente de cordón umbilical de feto acardio insertado a vaso comunicante.
MATERIAL Y MÉTODOS
Con base a la pregunta: ¿cuál es la etiopatogenia, diagnóstico y tratamiento de los fetos acardios?, se realizó una búsqueda de la literatura en las bases de datos Medline vía PubMed, OVID, Embase y SciE- LO con los siguientes términos MeSH: “Abnormalities”, “Multiple/diagnostic imaging”, “Anencephaly/diagnostic imaging”, “Fetofetal Transfusion/diagnostic imaging”, “Heart Defects”, “Congenital/diagnostic imaging”, “Ultrasonography”, “Doppler”. Se incluyeron reportes de caso y series de casos y revisiones bibliográficas en inglés y español desde enero de 1950 hasta enero de 2020, que incluyeran embarazadas humanas con gestaciones gemelares monocoriales biamnióticas complicadas por la secuencia TRAP y que describieran la etiopatogenia, diagnóstico y tratamiento.
Por parte de dos autores, de manera independiente, se seleccionaron los artículos por título y resumen, excluyendo los artículos más desactualizados y que repetían información comentada por otros más actuales a excepción de aquellos que tenían un amplio tamaño muestral o que en su día fueron pioneros en diagnóstico o tratamiento. De los artículos que cumplían con los criterios de población y diseño se buscó el texto completo y se verificó el cumplimiento de los criterios de inclusión.
Las variables evaluadas fueron: edad gestacional al diagnóstico, edad gestacional al nacimiento, peso al nacimiento, diagnóstico, tratamiento, vía de parto y complicaciones materno-fetales.
Aspectos éticos
La paciente firmó el respectivo consentimiento informado autorizando la publicación del caso a partir de la historia clínica y las imágenes tomadas. Se garantizó la confidencialidad de la información.
RESULTADOS
Más de 80 referencias bibliográficas resultaron de la búsqueda con las palabras clave por las diferentes bases de datos, pero sólo se incluyeron los 39 artículos más actuales que cumplían con los criterios de búsqueda. Se revisaron 6 series de casos, 6 reportes de caso y 27 revisiones bibliográficas. De todas las referencias, 23 hablaban de las diferentes actitudes terapéuticas, 8 se relacionaban con el proceso diagnóstico y las otras 8 exponían fundamentos teóricos de esta complicación (Tabla 1).
El diagnóstico prenatal precoz del feto acardio es muy importante para un correcto seguimiento. Su diagnóstico inicial es ecográfico y debe sospecharse siempre que se observe un feto polimalformado en una gestación monocorial 11. Por tanto, es importante un correcto diagnóstico de la corionicidad en la ecografía de primer trimestre ya que la secuencia TRAP es una complicación infrecuente pero particular de las gestaciones monocoriales. Los diagnósticos tardíos suelen deberse a una confusión con una gestación bicorial, comunmente con la situación de “feto evanescente” y, de hecho, en muchos casos suele ser el diagnóstico inicial. La aplicación del Doppler facilita la diferenciación mostrando en el feto acardio la existencia de circulación periférica 12, 13.
Al tratarse de una gestación monocorial, ambos gemelos han de tener el mismo sexo, habiéndose descrito una mayor incidencia del sexo femenino 5. Aunque habitualmente no existen estructuras cardíacas reconocibles, la visualización de éstas, incluso con actividad pulsátil, no excluyen el diagnóstico 11. La visualización del corazón es importante no sólo desde el punto de vista diagnóstico sino también pronóstico 2, ya que su presencia disminuye la sobrecarga y mejora la situación hemodinámica del feto bomba. Es importante la evaluación cardiológica del feto normal para detectar precozmente signos de descompensación hemodinámica (aumento de tamaño de las cavidades, derrame pericárdico e insuficiencia tricuspídea) 5, 6, 11.
La identificación de las anastomosis vasculares existentes entre las circulaciones de ambos gemelos se realiza mediante la aplicación del Doppler pulsado y Doppler color 17. Estas conexiones arteriales y venosas son grandes y suelen situarse en la placa corial entre las inserciones placentarias de los cordones o en el seno del espesor placentario. Es común que en el cordón umbilical del acardio exista una sola arteria umbilical y que ésta tenga un flujo retrógrado (Figura 7) 17.
Se han introducido criterios hemodinámicos 18 indicativos del grado de resistencia vascular ofrecida por el feto acardio (a menor resistencia, mayor robo vascular y más probabilidad de fracaso cardíaco del feto bomba) y del grado de sobrecarga existente en el gemelo normal. Por tanto, esta justificado mantener una actitud expectante cuando la fracción de acortamiento del ventrículo izquierdo se mantenga en límites normales (25-35%), cuando el índice de pulsatilidad en la arteria umbilical del feto acardio sea > 1.3 o cuando el cociente entre los índices de pulsatilidad de ambos fetos sea ≥ 1 17.
La evolución de estas gestaciones es imprevisible y pueden darse diferentes situaciones: involución (riesgo de fenómenos trombóticos) 2, 4, parasitismo (sobrecarga bien tolerada por el feto normal) 2, 14 ó sobrecarga (fracaso cardíaco, polihidramnios, parto pretérmino y rotura prematura de membranas) 2, 11. Se relacionan con una mortalidad de hasta un 70% si las complicaciones aparecen antes de la viabilidad del feto normal 11, 19.
No existe consenso sobre qué método es el más adecuado debido a la escasa experiencia en el manejo de esta infrecuente situación 20-27, pero se han utilizado diversas medidas terapéuticas prenatales, en especial, para reducir el exceso de líquido amniótico, que es frecuentemente el causante de la prematuridad (responsable de más de la mitad de la mortalidad)11.
Medidas conservadoras
No son curativas ni definitivas, si no paliativas.
- Digoxina (inotrópico positivo). Se administra vía oral a la madre y atravesando la placenta sirve de tratamiento y de profilaxis de la insuficiencia cardíaca asociada a las taquiarritmias 20, 29.
- Indometacina (inhibidor reversible de las prostaglandinas). Su objetivo es disminuir la diuresis fetal y así controlar la cantidad de líquido amniótico administrándosela vía oral a la madre. Se aconseja hasta semana 32 para evitar el cierre precoz del ductus arterioso y el fracaso renal.
- Amniocentesis evacuadora. Reduce la cantidad de líquido amniótico, la sobredistensión uterina y consecuentemente la posibilidad de un parto prematuro 20, 30.
Medidas invasivas
Para el tratamiento curativo es necesario obstruir las anastomosis vasculares entre ambos fetos para lo que se han ideado procedimientos invasivos mediante fetoscopia 28. En la mayoría de los casos se consigue prolongar la gestación y la supervivencia del gemelo normal, pero conllevan múltiples complicaciones: lesión placentaria, hemorragias del feto sano, infartos y desprendimientos placentarios, coagulación intravascular diseminada, rotura prematura de membranas, parto prematuro, preeclampsia materna. Por tanto, deben reservarse para aquellos casos con evolución rápidamente desfavorable y que no respondan a tratamientos conservadores 6, 25, 31.
- Clips metálicos. Se colocan clips en el cordón del feto acardio guiado por ecografía 24,31,32 y se realiza ligadura mediante fetoscopia 14, 23, 33, 34 o tras exteriorizarlo por una pequeña histerotomía 26.
- Láser. Se realiza coagulación con láser 33, 35-37 o con fórceps bipolar 32 del cordón del feto acardio.
- Introducción de alcohol 25, silicona o “coils” metálicos 20. Son procedimientos ecoguiados para ocluir la arteria umbilical del feto acardio y así formar un trombo que interrumpa la circulación. Algunas de estas técnicas estan obsoletas dado el riesgo que existe de que el émbolo formado pase al gemelo normal.
- Termocoagulación. Hay descritos buenos resultados mediante la termocoagulación monopolar selectiva y ecoguiada a nivel de vasos intraabdominales del feto acardio o a nivel de la inserción fetal del cordón, produciendo así una detención inmediata del flujo sanguíneo 27, 33-38.
- Histerotomía selectiva. Existen casos aislados de histerotomías selectivas con extracción del feto acardio, algunas exitosas 21, 22.
- Radiofrecuencia o ultrasonido enfocado de alta frecuencia. Ablación percutánea del feto acardio 33, 34, 35, 37, 39.
- Interrupción de la gestación. El feticidio selectivo convencional con inyección intracardíaca de cloruro potásico no es útil en estas gestaciones debido a las comunicaciones vasculares existentes (embolización involuntaria al gemelo normal).
La circulación inversa explica la gasometría del gemelo normal al nacimiento: ligera acidosis (pH 7,20-7,25) e hipercapnia (pCO2 55-60 mmHg) (2,6-8). En este caso, el pH fue 7,21 con pCO2 de 53, ligeramente acidótico e hipercápnico, similar a lo descrito en la bibliografía.
Asimismo, aparece hasta en un 50% de los casos un polihidramnios de origen multifactorial, siendo el factor más importante el aumento de la diuresis del feto normal como consecuencia del aumento del trabajo cardíaco y de flujo sanguíneo 11, 14, acompañándose de oligoamnios del feto acardio. En contraposición, también puede haber polihidramnios del feto acardio, dato que nos informa sobre la existencia de riñones funcionantes en el feto acardio.
La secuencia TRAP está asociada a un mayor número de partos pretérmino tanto espontáneos (secundarios a la sobredistensión uterina provocada por el polihidramnios) como inducidos (aparición complicaciones y riesgo de muerte del gemelo sano). Sólo en el 25% de los casos el parto tiene lugar a término, según las series más largas con 49 casos 14 siendo la mortalidad global del feto sano de hasta un 70% de los casos.
Moore et al, observaron que la aparición de polihidramnios, parto pretérmino y el pronóstico perinatal estaban muy relacionados con el cociente entre los pesos del feto bomba y del feto acardio. Concluyeron que 14:
- Si había fracaso cardíaco, el feto acardio pesaba alrededor de un 88% del peso del feto bomba. Sin embargo, en aquellos casos en los que no había insuficiencia cardíaca, el feto acardio pesaba un 21% del peso del feto bomba.
- En los casos en los que se desarrollaba un polihidramnios, el feto acardio pesaba un 81% del peso del feto bomba frente a un 44% en casos de cantidad normal de líquido amniótico.
- Si se instauraba un parto pretérmino, el feto acardio pesaba un 60% del peso del feto bomba frente a un 25% en los casos en los que el parto fue a término.
Es decir, hay mejor evolución cuanto menor sea el tamaño del feto acardio, adoptándose como nivel de corte para establecer mal pronóstico un peso del feto acardio que supusiera el 50% del peso del feto normal 16. Por el contrario, cuando el peso estimado del acardio es inferior al 25% del peso del otro gemelo, la evolución suele ser favorable. Es por esto por lo que el peso se ha establecido como el factor pronóstico más importante.
En este caso, el peso del feto acardio fue muy elevado en comparación con otros casos publicados según la recopilación realizada, sólo comparable con los casos de Brassard en 1999 y Ramírez en 2009 (Tabla 1).
Nuestro feto acardio suponía un 93% del peso del feto bomba y, según la literatura revisada 14, con riesgo muy elevado de fracaso cardíaco, polihidramnios y parto pretérmino (estas 2 últimas complicaciones instauradas al diagnóstico en nuestro caso). La principal limitación que determinó el diagnóstico tardío fue el escaso control de la gestación que realizó la paciente, ya que el diagnóstico ecográfico de esta patología en semana 12 es realmente complejo. También nos encontramos limitaciones terapéuticas, ya que en nuestro hospital no hay técnicas invasivas para su tratamiento. En contraposición, como fortaleza, podemos recalcar que, al diagnosticarlo en semana 32, pudimos optar por la posibilidad de finalizar la gestación con una prematuridad asumible y no habiendo desarrollado el feto sano una insuficiencia cardíaca hasta ese momento, algo que se esperaba que sucediese a corto plazo debido al porcentaje de peso del feto acardio con respecto al sano.
La aparición de las complicaciones descritas y su intensidad están también en relación con el ritmo de crecimiento (el pronóstico es más favorable si éste es lento) y con la existencia o no de víscera cardíaca rudimientaria. La presencia de ésta no excluye el diagnóstico de feto acardio y le proporciona a éste un cierto grado de autonomía circulatoria con una frecuencia pulsátil diferente a la del feto normal 11, 15. En estas situaciones, la sobrecarga que representa el feto acardio puede reducirse al existir en éste dicha actividad pulsátil propia, lo que permite una evolución más favorable, sin signos de sobrecarga hemodinámica en el feto normal 16.
CONCLUSIONES
El feto acardio es una complicación infrecuente de embarazos gemelares monocoriales. Se requiere la presencia de anastomosis arterio-arteriales y veno-venosas placentarias entre ambas circulaciones fetales, de forma que el gemelo normal bombee la sangre del gemelo acardio mediante una circulación inversa (pobre en oxígeno para el gemelo acardio) provocando una malformación completa del mismo. El gemelo normal puede desarrollar insuficiencia cardíaca secundaria a este proceso.
La correcta y precoz identificación prenatal del feto acardio es posible gracias a la ecografía, lo que deriva en un incremento del número de casos y en la necesidad de plantear alternativas terapéuticas para mejorar el pronóstico. Es necesario un seguimiento estricto con examen periódico ecocardiográfico y ultrasónico global tanto del feto sano, para detectar precozmente la aparición de complicaciones, así como del feto acardio, para la estimación de su peso y ritmo de crecimiento y así determinar la actitud más apropiada a seguir. El diagnóstico precoz implica un mejor manejo y elección de los procedimientos terapéuticos ideales.
Tras la revisión bibliográfica, se aconseja empezar por medidas conservadoras y usar los procedimientos invasivos sólo en casos en los que las primeras hayan fracasado.
AGRADECIMIENTOS
Gracias a todos y cada uno de los miembros del Servicio de Obstetricia y Ginecología del Hospital San Pedro de Logroño por su implicación en el caso. Agradecer también su trabajo al Servicio de Radiología y Anatomía Patológica, por su estudio detallado y al Servicio de Pediatría por su dedicación.
REFERENCIAS
- Khanduri S, Chhabra S, Raja A, Bhagat S. Twin reversed arterial perfusion sequence: a rare entity. J Clin Imaging Sci. 2015; 5:9.
- Urbano J, Martinez JM, Eixarch E, Crispi F, Puerto B, Gratacos E. Complicaciones del embarazo gemelar monocorial: claves para el diagnóstico y tratamiento. Diagn Prenat. 2012; 23 (3): 93-101.
- Mone F, Devaseelan P, Ong S. Intervention versus a conservative approach in the management of TRAP sequence: a systematic review. J Perinat Med. 2016; 44:619.
- van Gemert MJ, van den Wijngaard JP, Vandenbussche FP. Twin reversed arterial perfusion sequence is more common than generally accepted. Birth Defects Res A Clin Mol Teratol. 2015; 103:641.
- Hartge DR, Weichert J. Prenatal diagnosis and outcome of multiple pregnancies with reversed arterial perfusion (TRAP-sequence). Arch Gynecol Obstet. 2012;286(1):81-88.
- Nizyaeva, Natalia V, K V Кostyukov, Kristina Gladkova, Galina V Kulikova and Aleksandr Shchegolev. Role of twin reversed arterial perfusion syndrome in the development of fetus acardius. Arkhiv patologii. 2016; 78 (4)54-57 .
- Manzanera G, Marco C, Riera JC, Hernández J, Echevarría JM. Monstruo acardio. A propósito de un caso. Prog Diagn Prenat. 1991; 1:101-105.
- Ruiz-Cordero R, Birusingh RJ, Pelaez L, Azouz M, Rodriguez MM. Twin Reversed Arterial Perfusion Sequence (TRAPS): An Illustrative Series of 13 Cases. Fetal Pediatr Pathol. 2016;35(2):63-80.
- Steffensen TS, Gilbert-Barness E, Spellacy W, Quintero RA. Placental pathology in trap sequence: clinical and pathogenetic implications. Fetal Pediatr Pathol. 2008; 27:13.
- Zhao DP, Cohen D, Middeldorp JM, et al. The role of veno- venous anastomoses in twin-twin transfusion syndrome. Placenta. 2014. 35:334–336.
- Barth RA, Crowe HC. Ultrasound evaluation of multifetal gestations. Ultrasonography in Obstetrics and Gynecology, 4th ed. 2000: 171-205.
- Byrne FA, Lee H, Kipps AK, Brook MM, Moon-Grady AJ. Echocardiographic risk stratification of fetuses with sacrococcy- geal teratoma and twin-reversed arterial perfusion. Fetal Diagn Ther. 2011;30:280–8.
- Berg C, Holst D, Mallmann MR, Gottschalk I, Gembruch U, Geipel A. Early vs late intervention in twin reversed arterial perfusion sequence. Ultrasound Obstet Gynecol. 2014;43: 60–4.
- Moore TR, Gale S, Bernirschke K. Perinatal outcome of forty-nine pregnancies complicated by acardiac twinning. Am J Obstet Gynecol. 1990; 163:907-912.
- Benirschke K, Kaufmann P, Baergen R. Pathology of the Human Placenta. 2006. 5th ed. New York: Springer.
- Redline RW, Ariel I, Baergen RN, DeSa DJ, Kraus FT, Roberts DJ, Sander CM, the Society for Pediatric Pathology, Perinatal Section, Fetal Vascular Obstruction Nosology Committee. Fetal vascular obstructive lesions: nosology and reproducibility of placental reaction patterns. Pediatr Devel Pathol. 2004. 7:443–452.
- Buyukkaya A, Tekbas G, Buyukkaya R. Twin Reversed Arterial Perfusion (TRAP) Sequence; Characteristic Gray-Scale and Doppler Ultrasonography Findings. Iran J Radiol. 2015;12(3): e14979.
- Brassard M, Fouron JC, Leduc L, Girgnon A, Proulx F. Prognostic markers in twin pregnancies with an acardiac fetus. Obstet Gynecol. 1999; 94(3):409-413.
- Suresh S, Krishnamurthy R, Anand B. Twin reversed arterial perfusion (TRAP) sequence: Diagnostic and management options based on sonography. Radiology. 1998; 209 (Suppl):17.
- Mone F, Devaseelan P, Ong S. Intervention versus a conservative approach in the management of TRAP sequence: a systematic review. J Perinat Med. 2016; 44:619.
- Ginsberg NA, Applebaum M, Rabin SA, Caffarelli MA, Kuuspalu M, Daskal JL, et al. Term birth after midtrimester hysterotomy and selective delivery of an acardiac twin. Am J Obstet Gynecol. 1992; 167:33-7.
- Dubey S, Verma M, Goel P, et al. Twin reversed arterial perfusion: to treat or not.J Clin Diagn Res. 2017;11(1): QD05–D07.
- McCurdy CM, Childres JM, Seeds JW. Ligation of the umbilical cord of an acardiac-acephalus twin with an endoscopic intrauterine technique. Obstet Gynecol. 1993; 82:708-11.
- Quintero RA, Reich H, Puder KS, Bardicef M, Evans MI, Coton DB, et al. Brief report: Umbilical cord ligation of an acardiac twin by fetoscopy at 19 weeks of gestation. N Engl J Med. 1994; 330:469-71.
- Guven MA, Koc O, Bodur H, et al. Acardiac twin pregnancy: successful intrauterine ablative treatment with alcohol at 14 weeks of gestation. Clin Exp Obstet. Gynecol 2016; 43:460.
- Foley MR, Clewell WH, Finberg HJ, Mills MD. Use of the Foley Cordostat grasping device for selective ligation of the umbilical cord of an acardiac twin: a case report. Am J Obstet Gynecol. 1995; 172:212-4.
- Rodeck C, Deans A, Jauniaux E. Thermocoagulation for the early treatment of pregnancy with an acardiac twin. N Engl J Med. 1998; 339:1293-5.
- Aoyagi Y, Kai K, Sumie M, Fujiyoshi N, Furukawa Y, Narahara H. Therapeutic dilemma in twin reversed arterial perfusion sequence. SAGE Open Med Case Rep. 2019; 7:2050313X19836342.
- Galindo A, Gutiérrez-Larraya F, De la Fuente P. Manejo clínico de las arritmias fetales. Diagnóstico prenatal. Cuadernos de Medicina Reproductiva. Edit. Panamericana. 2001; 7:275.
- Saunders NJ, Snijders RJM, Nicolaides KH. Therapeutic amniocentesis in twin-twin transfusion syndrome appearing in the second trimester of pregnancy. Am J Obstet Gynecol. 1992; 166:820-824.
- Pagani G, D’Antonio F, Khalil A, et al. Intrafetal laser treatment for twin reversed arterial perfusion sequence: cohort study and meta-analysis. Ultrasound Obstet Gynecol. 2013; 42:6.
- Deprest JA, Audibert F, Van Schoubroeck D, Hecher K, Mahieu-Caputo D. Bipolar coagulation of the umbilical cord in complicated monochorionic twin pregnancy. Am J Obstet Gynecol. 2000; 182:340-5.
- Tavares de Sousa M, Glosemeyer P, Diemert A, et al. First-trimester intervention in twin reversed arterial perfusion sequence. Ultrasound Obstet Gynecol. 2020; 55:47.
- Lee H, Bebbington M, Crombleholme TM, North American Fetal Therapy Network. The North American Fetal Therapy Network Registry data on outcomes of radiofrequency ablation for twin-reversed arterial perfusion sequence. Fetal Diagn Ther. 2013; 33:224.
- Seo K, Ichizuka K, Okai T, et al. Treatment of twin-reversed arterial perfusion sequence using high-intensity focused ultrasound. Ultrasound Obstet Gynecol. 2019;54(1):128-134.
- Hecher K, Lewi L, Gratacos E, Huber A, Ville Y, Deprest J. Twin reversed arterial perfusion: fetoscopic laser coagulation of placental anastomoses or the umbilical cord. Ultrasound Obstet Gynecol. 2006;28(5):688-691.
- Sugibayashi R, Ozawa K, Sumie M, et al. Forty cases of twin reversed arterial perfusion sequence treated with radio frequency ablation using the multistep coagulation method: a single-center experience. Prenat Diagn. 2016; 36:437.
- Holmes A, Jauniaux E, Rodeck C. Monopolar thermocoagulation in acardiac twinning. Br J Obstet Gynaecol. 2001; 108:1000-2.
- Lewi L, Valencia C, Gonzalez E, et al. The outcome of twin reversed arterial perfusion sequence diagnosed in the first trimester. Am J Obstet Gynecol. 2010; 203:213.e1.
TABLAS
Tabla1. Tabla Comparativa de casos de feto acardio. Recopilación de las series de casos y artículos publicados con mayor número de casos de feto acardio.
| Autor | N | Edad madre
(media en años) |
Ges.
Ant. |
Media EG al DG | Corionicidad | Intervención | Sexo fetal | EG y vía de parto | Pesos sano-acardio
(gr) |
| Fleitas y col. Venezuela 1989 | 3 | 27,6 | 2-3 | 29 | Mono/Mono(3) | Ninguna | F (2)
M (1) |
1 CS 36 s
1 PV 24 s 1 PV 32 s |
1450 -655 |
| Brassard y col. Canadá 1999 | 9 | 30,3 | 2-3 | 20,7 | Mono/Bi (6)
Mono/Mono(2) Bi/Bi (1) |
Ninguna | F (8)
M (1) |
7 CS
2 PV |
1787 -1814 |
| Blaicher y col. Austria 2000 | 1 | 26 | 1 | 22 | Mono/Bi (1) | Controles ecográficos | F (1) | 1 CS 42 s | 2860 – ND |
| Porreco y col. EEUU 2003 | 1 | 29 | 1 | 12 | Mono/Mono(1) | Ablación Láser 17s | M (1) | 1 PV 39 s | 2657 – ND |
| Sepúlveda y col. Chile 2003-2008 | 5 | 34,4 | 0-3 | 15,2 | Mono/Bi (2)
Mono/Tri (3) |
Ablación Láser 17s (2)
Ninguna (2) Amniodrenaje (1) |
F (3)
M (2) |
5 CS (31-37 s) | 2083 -1038 |
| Faria y col. Brasil 2004 | 2 | 24 | 2-3 | 25,5 | Mono/Mono(1)
Mono/Bi (1) |
Controles ecográficos | F (1)
M (1) |
1 CS 30 s
1 PV 31 s |
1332 -1050 |
| Wong y col. Singapur 2007 | 1 | 33 | 3 | 15 | Mono/Mono(1) | Controles ecográficos | F (1) | 1 CS 35 s | 2820 – ND |
| Ramírez y col. Venezuela 2009 | 1 | 23 | 2 | 31 | Mono/Mono(1) | Ninguna | F (1) | 1 CS 31s | 1240 -2000 |
| Barroso y col. México 2011 | 1 | 38 | 4 AB | 12 | Mono/Bi (1) | Controles ecográficos | M (1) | 1 CS 37s | 2500 -1300 |
| Finali y col. Venezuela 2013 | 1 | 28 | 2 | 23 | Mono/Bi (1) | Controles ecográficos | M (1) | 1 CS 39 s | 3100 -50 |
| Ruiz y col. España 2019 | 1 | 29 | 1 AB | 32 | Mono/Bi (1) | Ninguna | F (1) | 1CS 32 s | 1932 -1800 |
Ges. Ant: Gestaciones anteriores; EG: Edad gestacional, DG: Diagnóstico; AB: Aborto; Mono/Mono: Monocorial/Monoamniótico; Mono/Bi: Monocorial/Biamniótico; Bi/Bi: Bicorial/Biamniótico; Mono/Tri: Monocorial/Triamniótico F: Femenino; M: Masculino; CS: Cesárea; PV: Parto Vaginal; s: Semanas; gr:Gramos; ND: no disponible
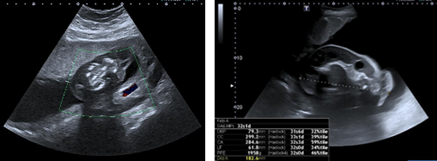
Figura 1. A) Imagen ecográfica semana 12. Diagnostico de feto evanescente en gestación gemelar. B) Imagen al diagnóstico de feto acardio
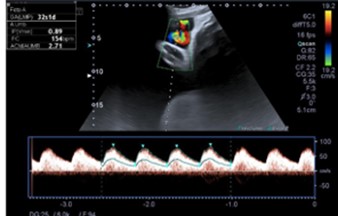
Figura 2. Doppler normal de nuestro caso de secuencia TRAP. Índice de Pulsatilidad media de arteria umbilical en rango normal.
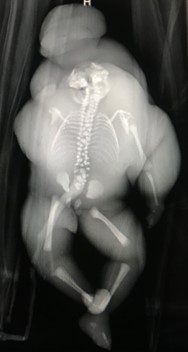
Figura 3. Radiografía de feto acardio.
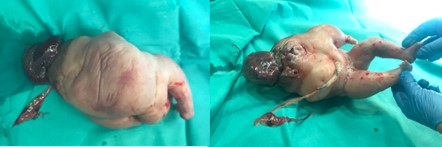
Figura 4. Feto acardio. A) Visión posterior. B) Visión lateral.
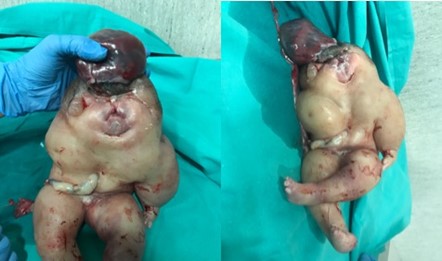
Figura 5. Feto acardio. A) Visión anterior cefálica. B) Visión anterior global.
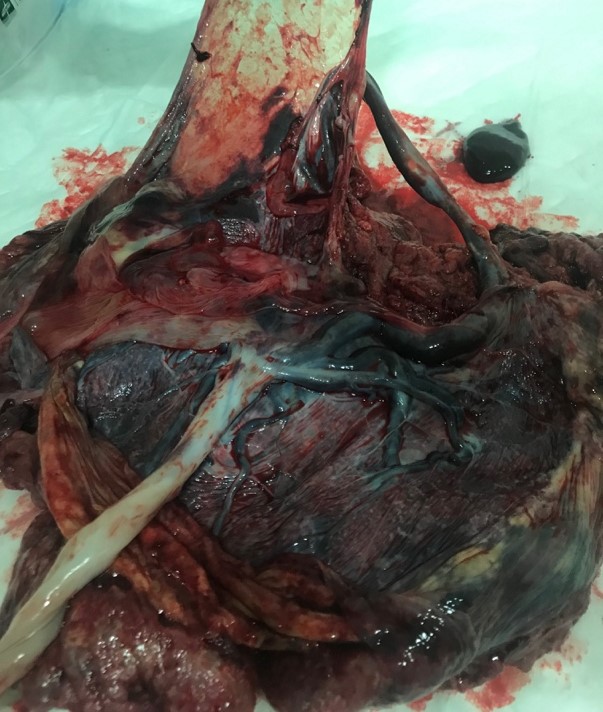
Figura 6. Anastomosis vasculares placentarias de secuencia TRAP.
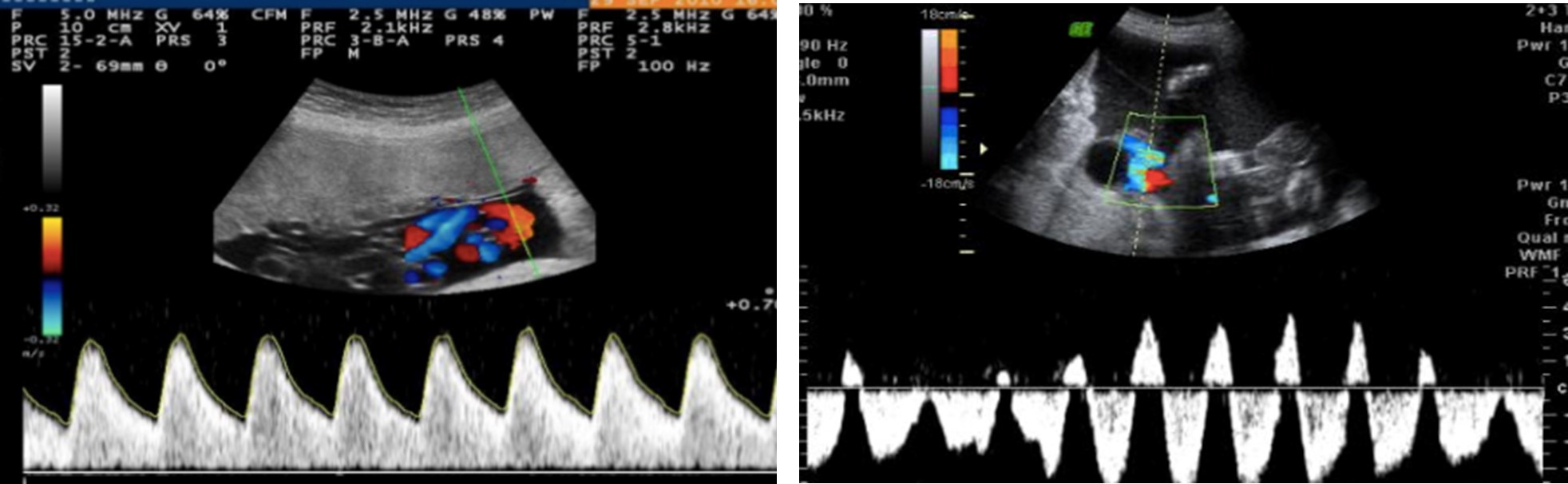
Figura 7. A) Doppler de arteria umbilical normal. B) Doppler con flujo retrógrado de arteria umbilical del feto acardio.



