2011
4
Autores:
Instituciones:
Laura Blasco G., Blanca Paredes R., Roberto Rodríguez G., Mar Muñoz M., Lucía Deiros B.
Tipo de documento:
Casos ClínicosHIDROPS FETAL NO INMUNE POR ANEMIA DISERITROPOYÉTICA CONGÉNITA
Contenido del documento:
RESUMEN
La anemia diseritropoyética congénita se engloba dentro de un grupo raro y heterogéneo de trastornos eritrocitarios caracterizados por eritropoyesis ineficaz, anemia megaloblástica, hemosiderosis secundaria e hidrops fetal. Presentamos el caso de un feto de 20 semanas con hidrops como consecuencia de una anemia fetal intensa por eritropoyesis ineficaz. Ante el hallazgo de hidrops fetal no inmune es fundamental un diagnóstico etiológico precoz para ofrecer a la pareja las alternativas terapéuticas más adecuadas.
PALABRAS CLAVE: Anemia fetal, hidrops fetal, arteria cerebral media, eritropoyesis ineficaz, anemia diseritropoyética congénita
SUMMARY
Congenital dyserythropoietic anemia is a rare group of heterogeneous disorders characterized by ineffective erythropoiesis, megaloblastic anemia, secondary hemosiderosis and fetal hydrops. We report a case of a 20 week old fetus with hydrops as a consequence of a severe fetal anemia resulting from ineffective erythropoiesis. When non-immune fetal hydrops is found, it is essential an early etiological diagnosis to give the parents the most appropriate therapeutic options.
KEY WORDS: Fetal anemia, fetal hydrops, middle cerebral artery, ineffective erythropoiesis, congenital dyserythropoietic anemia
INTRODUCCIÓN
La anemia fetal puede ser de etiología inmune o no inmune, dependiendo de si es consecuencia de producción de anticuerpos contra los hematíes fetales o si se produce por otros mecanismos. Clásicamente la mayoría de las anemias fetales eran de causa inmune, pero desde la introducción del screening materno del Rh y de anticuerpos anti-D, la tasa de anemia de causa inmune ha descendido considerablemente (1).
Tradicionalmente, la evaluación de los fetos con sospecha de anemia se hacía determinando el nivel de bilirrubina en líquido amniótico mediante densitometría óptica (1). Desde la introducción del doppler para el diagnóstico de sospecha de anemia fetal, la amniocentesis ha quedado en desuso. Mediante el doppler podemos medir la velocidad del pico sistólico en la arteria cerebral media (PS-ACM) cuyos valores se expresan como múltiplos de la mediana (MoM). Cuando el valor del mismo es superior a 1,5 MoM se considera que el feto padece una anemia moderada o grave con una sensibilidad y un valor predictivo negativo del 100% y una tasa de falsos positivos del 12% (1).
La cordocentesis permite un diagnóstico de certeza de anemia ya que se extrae directamente sangre fetal. Pero el hecho de que sea una técnica agresiva, que puede producir la pérdida fetal hasta en un 1-2% de los casos, hace que quede reservada para ciertas circunstancias, como cuando se alcanzan valores críticos en las curvas de Liley o Queenan mediante amniocentesis o cuando la medida del pico sistólico en la arteria cerebral media es superior a 1,5 MoM (2). El tratamiento de la anemia fetal de causa no inmune es la transfusión intrauterina.
Caso clínico
Secundigesta de 35 años, sin antecedentes personales ni familiares de interés. Su pareja era portadora de una betatalasemia heterocigota. La gestación previa cursó sin complicaciones. La gestación actual se consiguió mediante técnica de fecundación in vitro.
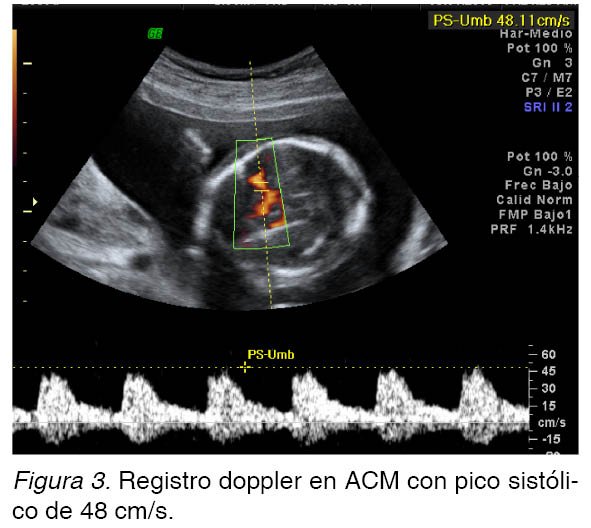
Es remitida al servicio de Fisiopatología Fetal del Hospital Universitario La Paz, Madrid, España, en la semana 20 de gestación para valoración de derrame pericárdico. La paciente aportaba un cariotipo fetal con dotación cromosómica 46 XX normal. Se realizó una ecografía en la que se observó un feto con biometría acorde a la edad gestacional, con un derrame pericárdico moderado (Figura 1). La morfología cardiaca era normal, sin apreciarse disfunciones valvulares y ritmo sinusal estable a 148 latidos por minuto. También se observó ascitis mínima con hidramnios moderado y cierto grado de edema de calota. En cuanto a los parámetros doppler, el índice de resistencia en la arteria umbilical era de 0,8 (Figura 2) y se observó flujo continuo en la vena umbilical. El pico sistólico en la arteria cerebral media fue de 48 cm/s (>1,5 MoM), con una hemoglobina fetal estimada de 5,16 g/dl (Figura 3).
Ante la sospecha de anemia fetal, se solicitó grupo sanguíneo y Rh, despistaje de anticuerpos irregulares y batería de infección connatal en sangre materna, seguidos de amniocentesis para estudio por PCR de infección fetal. Ante el resultado negativo de todas estas pruebas, en la semana 21 se realizó una cordocentesis para confirmación de la sospecha de anemia fetal, se determinó una hemoglobina fetal de 2,1 g/dl con un hematocrito de 8,9%. Tras valorar los datos obtenidos en el estudio y el pronóstico fetal, la pareja decidió interrumpir la gestación.
Al realizar la necropsia fetal se apreciaron múltiples focos hematopoyéticos extramedulares, eritroblastosis fetal y hemosiderosis hepática, en ausencia de hemorragia fetal, hemólisis o hiperbilirrubinemia, además de derrame pericárdico intenso, derrame pleural y derrame peritoneal.
DISCUSIÓN
El derrame pericárdico moderado, asociado a hidramnios moderado y ascitis mínima, en presencia de un corazón estructural y funcionalmente normal, sin descartar trastornos del ritmo no presentes en el momento de la exploración, nos obliga a buscar anomalías fetales asociadas, descartar alteración cromosómica e investigar causas de hidrops.
Se puede definir el hidrops fetal como el acúmulo de líquido en al menos dos compartimentos de los siguientes: subcutáneo (siempre que el edema sea mayor de 5 mm), en la cavidad abdominal, cavidad torácica o a nivel pericárdico (3).
El hidrops fetal se puede clasificar en función de la etiología del mismo, siendo un hidrops inmune el que tiene lugar como consecuencia de la producción de anticuerpos contra los hematíes fetales, y no inmune el producido por otro mecanismo.
Dentro de las causas que pueden dar lugar a un hidrops de etiología no inmune, las más frecuentes son las fetales. Las anomalías cardiovasculares son responsables en un 25-30% de los casos, seguidas en frecuencia por las malformaciones (15-20%) y las cromosomopatías (15-20%). Otras causas fetales menos frecuentes son las infecciones, las alteraciones placentarias y la anemia fetal. Pero el hidrops fetal no inmune también puede estar producido por alteraciones maternas como la anemia, la hipoproteinemia, el hipotiroidismo o la diabetes y hasta un 20-25% de los casos de hidrops no inmune son de causa desconocida (4).
En este caso, el Rh positivo con recuento de anticuerpos irregulares negativo, descartó que se tratara de un hidrops de etiología inmune. El estudio morfológico fetal fue normal, salvo para los hallazgos comentados y la gestante aporta cariotipo normal, por lo tanto, quedaban descartadas las causas fetales más frecuentes. Se descartó la infección fetal determinando PCR en líquido amniótico. La posibilidad de que se tratara de algún tipo de alteración placentaria se desestimó al observarse una placenta de características ecográficas normales. Por lo tanto, en este caso, parecía que la causa fundamental del cuadro de hidrops fetal era la anemia.
El cuadro de anemia fetal de etiología no inmune puede producirse como consecuencia de diversas alteraciones como la alfatalasemia, un déficit enzimático, defectos a nivel de la membrana eritrocitaria, o por la existencia de una baja producción eritrocitaria (5). Es precisamente la eritropoyesis ineficaz el mecanismo que mejor concuerda con este caso clínico. A su vez, la baja producción de eritrocitos puede ser debida a trastornos raros como el síndrome de Pearson, la anemia de Diamond-Blakfan o a la existencia de una anemia diseritropoyética congénita (5). Los hallazgos ecográficos, analíticos y necrópsicos sugerían en este caso, el diagnóstico de anemia congénita diseritropoyética.
La anemia diseritropoyética congénita se engloba dentro de un grupo raro y heterogéneo de trastornos eritrocitarios caracterizados por eritropoyesis ineficaz, anemia megaloblástica, hemosiderosis secundaria e hidrops fetal (6,7). Existen tres tipos: el tipo I y II se transmiten con herencia autosómica recesiva y son debidos a alteraciones en los cromosomas 15 y 2, respectivamente (8). El tipo I cursa con anemia moderada o grave y en el tipo II el grado de anemia puede ser variable (9,10). El tipo III se transmite de forma autosómica dominante, produce un cuadro de anemia leve y se debe a una mutación a nivel del comosoma 15 (11).
El seguimiento de los pacientes que padecen este tipo de trastorno se realiza haciendo determinaciones seriadas de hemograma y perfil férrico (12). En el caso de que la anemia sea diagnosticada intraútero la medida del pico sistólico en la arteria cerebral media nos va a dar información sobre la evolución del cuadro (13). Siempre que el valor de éste se encuentre por debajo del límite establecido de 1,5 MoM, ante una sospecha de anemia, estará indicado hacer controles periódicos. Cuando el PS-ACM tiene un valor superior a 1,5 MoM la actitud dependerá de la edad gestacional. En embarazos que hayan superado las 34-35 semanas se harán seguimientos periódicos del PS-ACM finalizando la gestación cuando éste se altere o el embarazo llegue a término. Si la edad gestacional es inferior a 34 semanas y el valor del PS-ACM superior a 1,5 MoM será necesario realizar una cordocentesis para confirmar la sospecha de anemia y realizar transfusión intrauterina si ésta está indicada (14).
El tratamiento en todos los casos de anemia diseritropoyética congénita es sintomático mediante transfusiones, ferroterapia y tratamiento de las infecciones concomitantes (6). Existe controversia acerca del beneficio de la esplenectomía en estos casos. Actualmente se está ensayando un tratamiento con interferón -2a para las anemias de tipo I (9). El único tratamiento intraútero de este tipo de trastornos es la transfusión intrauterina que estará indicada cuando el hematocrito sea inferior al 30% o la hemoglobina se encuentre por debajo de 2 DS (2). Esta técnica no está exenta de complicaciones, pudiéndose producir bradicardia, hemorragia intraamniótica, hematomas a nivel del cordón, corioamnionitis y muerte fetal. Las transfusiones se pueden repetir cada 3-5 semanas intentando demorar el parto hasta la semana 38 ó 39, pero si aparecen complicaciones después de la semana 32, se optará por finalizar la gestación en ese momento. En este caso, dada la gravedad de la anemia y la precocidad de la afectación, la pareja decidió interrumpir el embarazo.
CONCLUSIÓN
La anemia diseritropoyética congénita es uno de los transtornos más raros como causa de hidrops fetal no inmune. El diagnóstico precoz de la misma, junto con la determinación del PS-ACM es fundamental para seguir la evolución del cuadro y así poder ofrecer tratamiento antes de que la afectación fetal sea grave.
BIBLIOGRAFÍA
1. Imbar T, Lev-Sagie A, Cohen S, Yanai N, Yagel S. Diagnosis, surveillance and treatment of the anemic fetus using middle cerebral artery peak systolic velocity measurement. Perinat Diagn 2006;26:45-51.
2. Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Gilstrap III LC, Wenstrom KD. Enfermedades y lesiones del feto y el recién nacido. Obstetricia de Williams. 22ª ed. Mexico: Editorialn McGraw-Hill-Interamericana; 2006. pp 661-74.
3. Liao C, Wei J, Li Q, Li J, Li L, Li D. Nonimmune hydrops fetalis diagnosed during the second half of pregnancy in southern China. Fetal Diagn Ther 2007;22:302-5.
4. Callen P. Hidrops fetal no inmune. Ecografía en
Obstetricia y Ginecología. 3ª ed. Buenos Aires (Argentina): Editorial
Panamericana; 1996.
5. Steiner LA, Gallagher PG. Erythrocyte disorders in the perinatal period. Semin Perinatol 2007;31:254-61.
6. Carter C, Darbyshire PJ, Wickramasinghe SN. A congenital dyserythropoietic anaemia variant presenting as hydrops foetalis. Brit J Haemat 1989;72:289-90.
7. Wickramasinghe SN. Dyserythropoiesis and congenital dyserythropoietic anaemias. Brit J Haemat 98:785-97.
8. Delaunay J. Congenital dyserytropoyetic anemias. Orphanet Encyclopedia. October 2003.
9. Parez N, Dommergues M, Zupan V, Chambost H, Fieschi JB, Delaunay J, et al. Severe congenital dyserythropoietic anaemia type I: prenatal management, transfusion support and alpha-interferon therapy. Brit J Haemat 2000;110:420-3.
10. Enquist RW, Gocherman JP, Jenis EH, Warkel RL, Dillon DE. Type II congenital dyserythropoietic anemia. Ann Intern Med 1972;77:371-6.
11. Goudsmit R, Beckers D, De Bruijne JI, Engelfriet CP, James J, Morselt AFW, et al. Congenital dyserythropoietic anaemia type III. Brit J Haemat 1972;23:91-105.
12. Wickramasinghe SN, Wood WG. Advances in the understanding of the congenital dyserythropoietic anaemias. Brit J Haemat 2005;131:431-46.
13. Williams G, Lorimer S, Merry CC, Greenberg CR, Bishop AJ. A variant congenital dyserythropoietic anaemia presenting as a fatal hydrops foetalis. Brit J Haemat 1990;76:372-9.
14. Jauniaux E. Diagnosis and management of early non-immune hydrops fetalis. Prenat Diagn 1997; 17:1261-8.