2020
2
Autores:
Laguna Olmos Mariano1 , Esteban Figuerola, Ada3, Ruiz Peña Ana Cristina1, Díaz-Rabasa, Beatriz2, Fernández García Cristina1, Arrieta Bretón, Sara2, Vilas Saura Lucía1, Peralta Benitez, Raiza Soraya4 .
Instituciones:
1 Residente Ginecología y Obstetricia, Hospital San Pedro, Logroño, La Rioja (España).
2 Facultativo Ginecología y Obstetricia, Hospital San Pedro, Logroño, La Rioja (España).
3 Facultativo Hematología, Hospital San Pedro, Logroño, La Rioja (España).
4 Residente Hematología, Hospital San Pedro, Logroño, La Rioja (España).
Correspondencia: Mariano Laguna Olmos
E-mail: laguna_pole@hotmail.com
Tipo de documento:
Casos ClínicosLeucemia mieloide aguda y pre-eclampsia coexistente. Algunas dificultades diagnósticas. A propósito de un caso.
Contenido del documento:
INTRODUCCIÓN
La preeclampsia (PE) según el consenso actual, se define como la aparición de novo de hipertensión (>140/90) y proteinuria (>0,3g en orina de 24 horas) más allá de las 20 semanas. Si bien, esto no siempre se cumple, una PE severa puede cursar con tensión arterial normal o sin proteinuria, tal y como ocurre en el 10-20% de los síndromes de HELLP 1. Por ello, algunas sociedades como la “Society of Obstetricians and Gynecologists of Canada” 2 admiten en la definición de PE la existencia de insuficiencia renal o disfunción hepática como consecuencia del compromiso multisistémico materno, siendo la presencia de éstas junto con hipertensión suficientes para el diagnóstico.
El síndrome de HELLP presenta una incidencia de un 4-15% en las embarazadas con PE grave y un 0.2-0.6% en las gestaciones normales. Las iniciales de este síndrome corresponden a las características bioquímicas que lo definen: anemia hemolítica microangiopática (Hemolysis), elevación de las enzimas hepáticas (Elevated Liver enzymes) y Plaquetopenia (Low Platelets). Los criterios más ampliamente aceptados para identificar este síndrome son los propuestos por Sibai y cols3 (Tabla 1) y sus manifestaciones clínicas son muy variables (Tabla 1). Hablamos de Síndrome de HELLP incompleto cuando están presentes dos de los criterios anteriormente mencionados y completo cuando aparecen los tres.
La anemia y trombocitopenia son hallazgos analíticos frecuentes durante la gestación. Es importante hacer un correcto diagnóstico diferencial ya que entre las posibles etiologías responsables pueden existir entidades de gravedad, como un Síndrome de HELLP, una púrpura trombocitopénica inmune o incluso una neoplasia hematológica.
El diagnóstico de cáncer durante el embarazo es infrecuente (0,07-0,1%)4, aunque supone la segunda causa de muerte entre las mujeres gestantes. En la medida en que se retrasa la edad materna, la incidencia de cáncer en estas pacientes está aumentando.
Los tumores más frecuentes en esta población son, por orden de frecuencia: el cáncer de mama, el cáncer de cérvix y los tumores hematológicos 5, 6. Dentro de estos últimos, el linfoma de Hodgkin es el más prevalente, seguido a distancia por las leucemias agudas, presentando estas últimas una baja prevalencia, de aproximadamente, 1 de cada 75.000-100.000 embarazos 7.
Se presenta un caso de una Leucemia Mieloide Aguda (LMA) asociada a una preeclampsia, describiendo el complejo proceso de diagnóstico diferencial con Síndrome de HELLP y la importancia del mismo.
CASO CLÍNICO
Mujer de 25 años, gestante de 37+3 semanas, natural de Ecuador, acudió al servicio de urgencias remitida desde atención primaria por malestar general, náuseas, cefalea y alteración analítica grave (Tabla 2). Entre sus antecedentes obstétricos, secundigesta con una cesárea anterior por fracaso de inducción tras diagnóstico de preeclampsia leve hace 10 años. Gestación normocontrolada, amenaza de parto prematuro en semana 32 que precisó tratamiento tocolítico y maduración pulmonar con controles analíticos normales, recibiendo el alta a las 48 horas. En la ecografía de tercer trimestre, peso fetal estimado en percentil 89, placenta anterior normoinserta.
A su llegada a urgencias la paciente refería malestar general y astenia, tensión arterial de 160/100. Se realizó nuevo control analítico urgente: Hemoglobina (Hb) 5.0 g/dl (12-16), Hematocrito (Hto) 14% (36-46), Plaquetas 86.000 (150-425), Leucocitos 2.5 (4-11), Neutrófilos 31.9% (40-74), Lactato Deshidrogenasa (LDH) 353 (120-250), GOT/AST 37 (0-40), GPT/ALT 26 (0-40) y cociente proteínas/creatinina en orina positivo (Tabla 2).
Ante los hallazgos analíticos de anemia con elevación de LDH que pudiera sugerir un origen hemolítico de la misma, trombocitopenia progresiva, enzimas hepáticas en rango de la normalidad, pico tensional (160/100) con proteinuria positiva en orina junto con el antecedente de preeclampsia, se sospechó un cuadro de preeclampsia grave y Síndrome de HELLP incompleto. Se realizó un extendido de sangre periférica para corroborar el diagnóstico de sospecha, sin embargo, no se observaron esquistocitos, a diferencia de cómo se esperaría ante la hipótesis diagnóstica de Síndrome de HELLP u otras anemias hemolíticas (Figura 1).
Atípicamente, la paciente presentaba neutropenia además de la anemia y la trombocitopenia, por lo que, dada la ausencia de células atípicas, agregados plaquetares y alteraciones morfológicas en las series eritroide y granulocítica en el estudio de sangre periférica, añadido al contexto clínico agudo de la paciente, sugirió una situación de estrés medular y se decidió seguimiento morfológico analítico estrecho. Tras valorar las condiciones obstétricas (Bishop 3, cesárea anterior) se consideró la finalización de la gestación mediante cesárea, previa transfusión de 2 concentrados de hematíes e inicio de perfusión de sulfato de magnesio. Nació un varón con APGAR 9-10 y 3300 gr, Ph arterial 7,21 con buena adaptación neonatal. La placenta presentaba un aspecto macroscópico normal.
El postoperatorio inmediato transcurrió en la Unidad de Cuidados Intensivos (UCI) donde presentó tensión arterial en rango sin tratamiento antihipertensivo y resolución de la neutropenia, confirmando el carácter reactivo de la misma, pero con persistencia de anemia y empeoramiento progresivo de la trombocitopenia junto con elevación de enzimas hepáticas por encima de sus niveles normales (Tabla 2). En ese momento, el estudio de sangre periférica presentó normalidad morfológica de las 3 series en ausencia de esquistocitos pero con presencia por primera vez de células atípicas. Por lo que seguidamente se completó el estudio por inmunofenotipo confirmando la naturaleza blástica de dichas células con marcador CD34+ (Figura 2). El aspirado de médula ósea mostró una infiltración por un 93% de blastos de morfología indiferenciada con expresión de marcadores mieloides por citometría de flujo; alcanzándose el diagnóstico de Leucemia Mieloide Aguda M0 (LMA con mínima diferenciación) (Figura 3 y 4). Se inició tratamiento con quimioterapia de inducción según PETHEMA LMA para menores de 65 años IDA+ARAC (3+7). Actualmente la paciente sigue en tratamiento con quimioterapia de reinducción, 2º ciclo en respuesta parcial, con presencia > 5% blastos.
El estudio de proteinuria en orina de 24 horas objetivó una proteinuria de 1256 mg/24 horas en orina por parte del servicio de Obstetricia.
DISCUSIÓN
Las leucemias agudas son consecuencia de la transformación neoplásica de las células precursoras hematopoyéticas, caracterizándose por la proliferación de células progenitoras inmaduras o blastos en la médula ósea y dando lugar a citopenias que incluyen anemia, neutropenia y trombocitopenia. Aproximadamente, 2/3 de las leucemias agudas en gestantes son leucemias mieloides y su diagnóstico tiene lugar generalmente en el segundo (37%) y tercer trimestre de la gestación (40%)9. La LMA representa el 3,2% de los cánceres en el embarazo10.
Cuando la leucemia coincide con el embarazo, se ha demostrado un aumento de la incidencia de aborto espontáneo, muerte fetal intrauterina, retraso del crecimiento intrauterino y parto pretérmino11-13. En el caso de nuestra paciente el diagnóstico fue a término sin apreciarse ninguno de los efectos descritos anteriormente. Por otro lado, el embarazo no parece afectar a la historia natural de la leucemia, aunque si supone un reto importante para el obstetra, debiendo ser abordado de forma multidisciplinar junto con hematólogos y pediatras.
El enfoque diagnóstico es el mismo que en la población general, basado en el aspirado de médula ósea para su examen morfológico, inmunofenotipo, citogénetica y estudios moleculares14. Su diagnóstico durante la gestación es difícil, ya que los hallazgos de anemia y trombocitopenia son comunes y multifactoriales. En ocasiones, son los cambios formes en los componentes sanguíneos o la aparición de nuevas citopenias, los desencadenantes de su estudio etiológico. La persistencia de citopenias de causa inexplicada puede apuntar a una infiltración medular por células blásticas y requieren un estudio más profundo como fue nuestro caso 11,15,16.
La concomitancia de anemia con una elevación de la LDH y trombocitopenia junto con el antecedente de preeclampsia de la paciente orientó la impresión diagnóstica hacia un Síndrome de HELLP incompleto. Fue la persistencia de la anemia severa en ausencia de esquistocitos, los niveles de bilirrubina total normales y el empeoramiento de la trombocitopenia lo que hizo sospechar un origen diferente del cuadro y realizar la valoración hematológica inmediata del frotis de sangre periférica que, con la presencia de células atípicas, acabó confirmando la sospecha de un cuadro leucémico agudo.
La visualización de formas celulares inmaduras en sangre periférica junto con la determinación en médula ósea de la presencia de más de un 20% de blastos, fue confirmatorio de leucemia aguda.
La LMA durante la gestación requiere un tratamiento inmediato, ya que demorarlo hasta el postparto se asocia con un aumento de la mortalidad materna9. En nuestro caso tras valoración de las condiciones obstétricas desfavorables de la gestante y las sospechas diagnósticas, síndrome de HELLP incompleto vs leucemia aguda, se decidió la finalización de la gestación, indicada en ambos casos.
Cuando la presentación tiene lugar más allá de las 32 semanas, puede ser razonable finalizar la gestación antes de iniciar el tratamiento quimioterápico. De este modo, actualmente las tasas de remisión informadas en estas pacientes son del 70-75%10. Sin embargo, es entre las semanas 24 y 32 cuando aparece la situación más conflictiva, debiendo sopesar los riesgos fetales secundarios a la quimioterapia y los derivados de la prematuridad. Se han descrito buenos resultados obstétricos con una vigilancia estrecha del bienestar fetal, sobre todo del crecimiento14. El parto debe programarse al menos tres semanas después del último ciclo de quimioterapia para una adecuada recuperación medular y minimización de los riesgos materno-fetales.
CONCLUSIONES:
Queremos subrayar la importancia de realizar un adecuado diagnóstico diferencial ante el hallazgo de anemia y trombopenia en una gestante. El diagnóstico y tratamiento precoces, así como el manejo multidisciplinar pueden mejorar el pronóstico de gestantes con patologías graves y poco frecuentes como la leucemia mieloide aguda, para lo que es imprescindible un enfoque multidisciplinar de cada caso.
La literatura publicada sobre el manejo de la leucemia aguda durante la gestación es escasa, y se basa en estudios retrospectivos y pequeñas series de casos. Únicamente encontramos estudios retrospectivos y series de casos pequeñas cuya publicación data de hace más de 10 años. Dada la evolución que han sufrido los tratamientos onco-hematológicos en este tiempo, resulta difícil su interpretación. Por ello, abogamos por una mayor investigación en este campo y por la futura publicación de nuevos avances científicos.
BIBLIOGRAFÍA
- Protocolos asistenciales en Obstetricia. Trastornos hipertensivos del embarazo. Sociedad Española de Obstetricia y Ginecología (SEGO). 2006. Disponible en: http://www.sego.es.
- Magee LA, Helewa M, Moutquin JM, von Dadelszen P; Hypertension Guideline Committee; Strategic Training Initiative in Research in the Reproductive Health Sciences (STIRRHS) Scholars. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. J Obstet Gynaecol Can. 2008;30(3 suppl):S1-48.
- Sibai BM, Talsimi M, El Nazar A, Amon E, Mabie B, Ryan G. Maternal-perinatal outcome associated with the syndrome of hemolysis, elevated liver enzymes, and low platelets in severe preeclampsia-eclampsia. Am J Obstet Gynecol. 1986;155:501-509.
- Avivi I, Brenner B. Management of acute myeloid leukemia during pregnancy. Future Oncol. 2014;10:1407—15.
- Ali S, Jones GL, Culligan DJ, Marsden PJ, Russell N, Embleton ND, Craddock C; British Committee for Standards in Haematology. in pregnancy. Br J Haematol 2015;170(4):487-95.
- Sanz MA, Montesinos P, Casale MF, Díaz-Mediavilla J, Jiménez S, Fernández I, et al. Maternal and fetal outcomes in pregnant women with acute promyelocytic leukemia. Ann Hematol 2015;94:1357-61.
- Lichtman MA, Liesveld JL. Acute myelogenous leukaemia. En: Beutler E, Lichtman MA, Coller BS, Kipps TJ, Seligsohn U, editors. Williams haematology. 6th ed. New York: McGraw-Hill; 2001. p. 1047-84.
- Sibai B. A practical plan to detect and manage HELLP syndrome. OBG Management 2005; 17:52-69.
- Odunco FS, Kimming R, Hepp H, Emmerich B. Cancer in pregnancy: maternal conflict. J Cancer Res Clin Oncol. 2003;129:133-46.
- Cohen JB1, Blum KA. Evaluation and management of lymp- homa and leukemia in pregnancy. Clin Obstet Gynecol. 2011;54:556-66.
- Ali S, Jones GL, Culligan DJ, et al. Guidelines for the diagnosis and management of acute myeloid leukaemia in pregnancy. Br J Haematol. 2015;170:487-95.
- Fernandez FC, Pérez-Prieto B, Arguelles- Álvarez S, et al. Leuce- mia aguda mieloblástica en gestante de 28 semanas. Clin Invest Gin Obst. 2008;35:184-6.
- Brell J, Kalaycio M. Leukemia in pregnancy. Semin Oncol. 2000;27:667-77.
- Thomas X. Acute myeloid leukemia in the pregnant patient. Eur J. Haematol 2015;95(2):124-36.
- Avivi I, Brenner B. Management of acute myeloid leukemia during pregnancy. Future Oncol. 2014;10:1407-15.
- Abadi U, Koren G, Lishner M. Leukemia and lymphoma in preg- nancy. Hematol Oncol Clin North Am. 2011;25:277-91.
TABLAS Y FIGURAS
TABLA 1. Manifestaciones clínicas y analíticas del síndrome de HELLP.
| MANIFESTACIONES CLÍNICAS | MANIFESTACIONES ANALÍTICAS |
| Dolor epigástrico e hipocondrio derecho 70% Náuseas y/o vómitos 36%
Cefalea y/o fotopsias 30% Hipertensión arterial 84% Proteinuria (300mg/24 h) 74% Manifestaciones hemorrágicas 5-9% Ictericia 5% Omalgia 5% |
Hemólisis:
– Bilirrubina >1.2mg/dl – LDH > 600 U/L – Haptoglobina < o = 25mg/dl – Esquistocitos en frotis sanguíneo
Alteración del perfil hepático: – AST/ALT: >70 U/L – LDH > 600 U/L
Plaquetopenia: < 100.000 cels/mL |
TABLA 2. Valores analíticos.
| Valor analítico (Valor de referencia) | Atención Primaria | Urgencias | Unidad Cuidados Intensivos |
| Hemoglobina (12-16g/dl) | 6.1 g/dl | 5 g/dl | 8.3 g/dl |
| Hematocrito (36-46%) | 17.8 % | 14 % | 24.1 % |
| Plaquetas (15.000-425.000/µL) | 108.000/µL | 86.000/µL | 68.000/µL |
| Leucocitos (4-11 x 1000/µL) | 3.300/ µL | 2.500/µL | 2.300/µL |
| Neutrófilos (40-74%) | 28.2% | 31.9% | 46.5% |
| GOT /AST (0-40 U/L) | – | 37 U/L | 100 U/L |
| GPT /ALT (0-40 U/L) | – | 26 U/L | 63 U/L |
| Bilirrubina Total (0-1.2 mg/dl) | – | – | 0.4 |
| Lactato Deshidrogenasa (LDH) (120-250 U/L) | – | 353 U/L | 646 U/L |
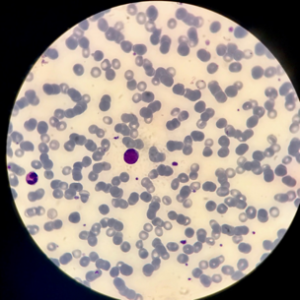
Figura 1. 100x Tinción May Grünwald-Giemsa Sangre periférica
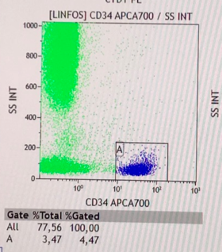
Figura 2. Citometría de Flujo Sangre periférica 4% células CD34+
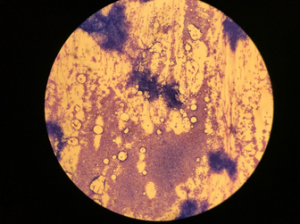
Figura 3. 10x Tinción May Grünwald-Giemsa Médula ósea.
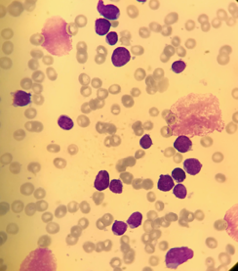
Figura 4. 10x Tinción May Grünwald-Giemsa Médula ósea



