INTRODUCCIÓN
Durante el embarazo, el estrógeno y sus receptores clásicos (REs), RE-α y RE-β, intermedian en las acciones vasculares del endotelio uterino (2). El endotelio vascular uterino es capaz de reaccionar al corto y largo plazo cuando es expuesto a concentraciones fisiológicas de estrógeno (2-4). Estas reacciones son clasificadas como genómicas (clásica/nuclear) y no-genómicas (no-clásica/membrana). Los REs son abundantes en el núcleo donde controlan la transcripción de genes, mientras que otra población está en la membrana (3-5% de RE totales) involucrada en la regulación de señales rápidas (5). El embarazo tiene un mecanismo complejo que ayuda a la dramática adaptación vascular uterina la cual abarca eventos angiogénicos y vasodilatadores. El objetivo de esta revisión es resumir e integrar la evidencia que apoya el papel vital del REs endoteliales en las adaptaciones vasculares uterinas durante el embarazo. Se evaluará la información relacionada con el rol de la base estructural en torno a la diversidad funcional y selectividad del REs; el rol del estrógeno y REs en las reacciones genómicas y no-genómicas de células endoteliales de arteria uterina.
Las abreviaciones utilizadas en este documento se presentan en Anexo 1.
BASE ESTRUCTURAL DE DIVERSIDAD FUNCIONAL Y SELECTIVIDAD DEL REs
Aunque el estrógeno tiene afinidad por RE-α y RE-β, otros agonistas y antagonistas farmacológicos revelan la diferencia molecular y estructural entre estos receptores la cual permiten una amplia gama de funciones. Estas diferencias pueden explicar la selectividad del estrógeno entre diversas o mismas células o tejidos. Los Res son miembros de una superfamilia de receptores nucleares que comparten regiones conservadas. Las regiones son dominios A/B, C, D, E y F, con dominios de transactivación terminal-N, de ADN (DA), de dimerización, de secuencia de localización nuclear (SLN), y de unión a ligandos (DUL) (6,7). Sin embargo, los Res son productos de dos genes distintos (ESR1 y ESR2, respectivamente) que se encuentran en diferentes cromosomas (8,9). Los RE-α y RE-β comparten una homología del 12% en regiones A/B, 16% en la región D, 59% en el dominio E, y 9% en la región de F (10,11). Adicionalmente, los RE-α y RE-β comparten sólo 56% de homología de aminoácidos en sus DUL, y difieren mucho en su terminal-N y terminal-C (6,7,12,13). La región A/B, es la región expuesta al solvente y el dominio de función de activación de carga negativa, (AF)-1, difiere en longitud y secuencia en numerosos sitios de fosforilación de la transducción de señales (6). La investigación de la plasticidad dinámica del bolsillo de DUL demostró que esta región difiere entre los dos REs.
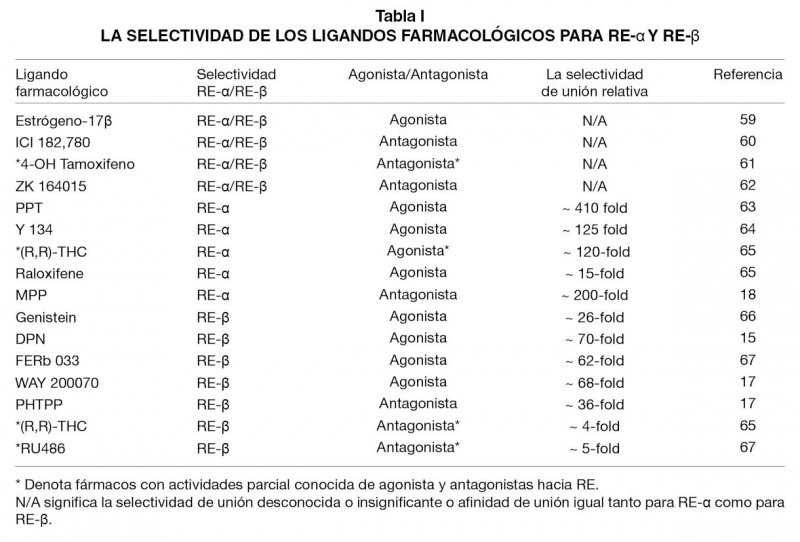
Las diferencias estructurales entre los REs sugieren una selectividad dependiente de ligandos para la activación del receptor (14). Las diferencias en estructuras han dado lugar al desarrollo de numerosos ligandos farmacológicos que discriminan entre los dos Res en base de afinidad, eficacia y diferencias hereditarias en el enganche con otros componentes de señalización (Tabla I). Por ejemplo, los diarylethylenes tales como diarylpropionitrile (DPN) han demostrado poseer una alta selectividad y eficacia 72-veces más alta para el RE-β sobre el RE-α debido a su interacción con el residuo clave en el DUL (15). En contraste, los fármacos como propilpirazoltriol (PPT) manifiestan una afinidad 410-veces más agonística para el RE-α sobre el RE-β (16). Con respecto a los antagonistas, los fármacos que contienen fenol tales como 4-[2-fenil-5,7-bis (trifluorometil)pirazolo[1,5-a]pirimidin-3-il]fenol (PHTPP) demuestran una afinidad selectiva considerablemente más alta hacia el RE-β que sobre RE-α (17). Del mismo modo, 1,3-bis (4-hidroxi-fenil)-4-metil-5-[4-(2-piperidiniletoxi)fenol]-1Hpyrazoledi clorhidrato (MPP) demuestra un antagonismo selectivo 200-veces más alto para RE-α sobre el RE-β (18,19).
Estos fármacos selectivos poseen una utilidad específica para el enfoque farmacológico que ayudan a dilucidar las diferentes y/o distintas funciones del REs en el rol fisiológico iniciado por el estrógeno. Es importante destacar que estos fármacos, descritos en la Tabla I, también apoyan la noción de que las diferencia estructurales entre RE-α y RE-β pueden explicarse por el hecho que la activación inducida por el estrógeno a través del REs cumplen con respuestas fisiológicas completas, distintas e independientes del otro receptor. El uso de estos fármacos, junto con el enfoque moleculares de si RNA y sobreexpresión de RE-α y RE-β usando adenovirus en celulares proporcionan evidencias muy convincentes sobre los roles individuales y complementarios de los receptores (20). Sin embargo, los mecanismos moleculares que sustentan la selectividad fisiológica del estrógeno endógeno hacia RE-α y/o RE-β siguen siendo desconocidos y es el objetivo principal de las investigaciones básicas.
Las evidencias sobre la diversidad funcional entre RE-α y RE-β se ha derivado del estudio de procesos genómicos y/o no-genómicos en el endotelio. Estos estudios demuestran los distintos niveles de deterioro en ratones con desactivación genética del REs o ratones “knockout” (RE-KO). Por ejemplo, en comparación con ratones genéticamente intactos “wild-type” y ratones RE-α-KO, los ratones RE-β-KO exhiben una adaptación genómica alterada que deteriora gravemente la proliferación y la migración de células endoteliales (21). Sin embargo, la comparación con ratones wild-type o ratones RE-β-KO, la vasodilatación rápida mediada por la producción de óxido nítrico (ON) del endotelio es reducida significativamente en ratones deficientes del RE-α (22,23). En este sentido, es posible que, aunque ambos REs son importantes para la homeostasis vascular, la heterogeneidad funcional permitan la mediación selectiva de diversas acciones estrogénicas. Estas posibilidades también sugieren que la localización espacial y sub-celular del REs entre la membrana y el núcleo confiere otro nivel de funciones atribuidas a las acciones agudas o prolongadas del REs. No obstante, poco se sabe acerca de las diferencias estructurales y las posibilidades que existen entre subpoblaciones del REs en la membrana plasmática o si esto puede representar una diversidad más compleja de RE-α o RE-β y los efectos fisiológicos que el estrógeno puede mediar.
FUNCIÓN DEL ESTRÓGENO Y LOS REs EN LOS EFECTOS GENÓMICOS DE CEAU
Efectos genómicos de estrógeno mediados por REs en el sistema vascular uterino incluyen: (a) el mantenimiento de la vasodilatación a través de la regulación de expresión de enzimas clave y genes o proteínas (por ejemplo, eNOS), (b) la promoción de angiogénesis mediante el aumento de la proliferación, migración y formación de vasos sanguíneos, y (c) remodelación de los vasos sanguíneos en proporción con el crecimiento de la unidad uteroplacentario.
Los aumentos prolongados del estrógeno durante la fase folicular (1 a 3 días), que son agrandados aún más durante el embarazo (>100 días), producen alteraciones en la expresión de varios genes y proteínas asociados con el balance de la vasodilatación y vasoconstricción; que en conjunto sirven para regular el tono vascular (21). Por ejemplo, algunos vasoactivos producidos localmente incluyen endotelina-1 (24), eNOS (25-27) y múltiples componentes del sistema de renina-angiotensina (28). MacRitchie et al, demostraron in vitro que cuando las células endoteliales pulmonares de fetos ovinos son expuestas por 2 días a niveles fisiológicos de estrógeno resultó en el aumento en ARNm, niveles de proteína, e incrementó la actividad de eNOS (27). Otros reportes sugieren un papel tanto para RE-α como para RE-β en los efectos vasodilatadores a largo plazo del estrógeno. En el endotelio, el estrógeno modula la expresión de eNOS a través de su interacción con RE-α y/o RE-β (29,30). En contraste en ratones deficientes de RE-β, el estrógeno aumentó la vasoconstricción de los vasos sanguíneos. Sin embargo, el mecanismo de regulación de esta reacción estrogénica aparentemente contradictoria sigue sin resolverse.
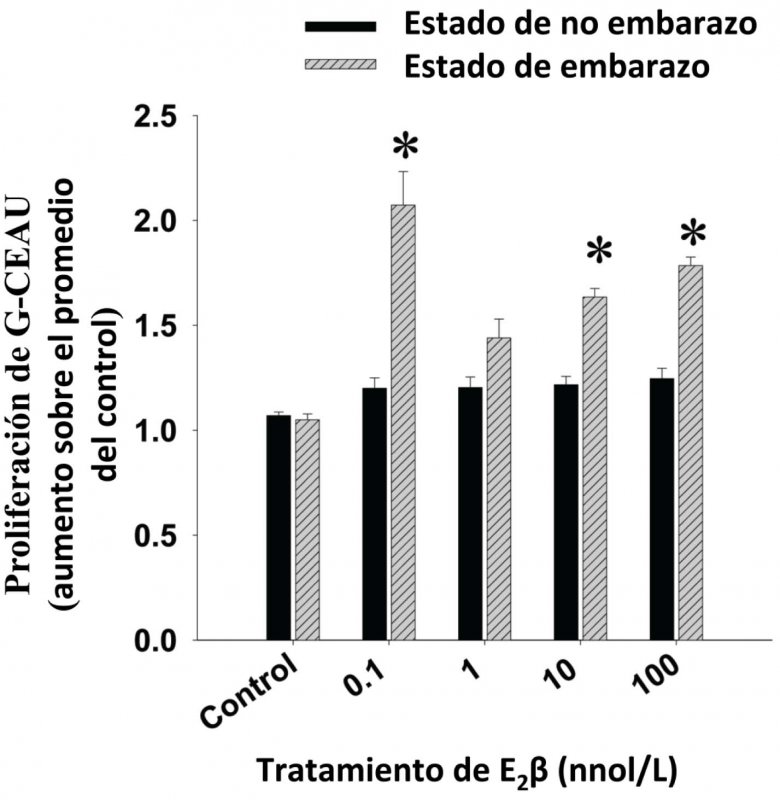
En este resumen revisaremos el rol general del estrógeno y REs en la proliferación de células endoteliales con respecto a la regulación angiogénica de FSU durante la gestación. Bajas concentraciones de estrógeno provocan, ya sea a través de RE-α y/o RE-β, la proliferación de células endoteliales de vena umbilical humanas (CEVUs) y de arteria uterinas ovinas derivadas durante el estado de gestación (G-CEAU); lo cual demuestra que los REs tienen un papel importante en angiogénesis inducida durante la gestación (31-33). En este sentido, el antagonista del REs, ICI 182,780, suprimió completamente las acciones mitogénicas de estrógeno sobre estas células (32,33). Los resultados de nuestro laboratorio han demostrado también (Figura 1) que el estrógeno no induce la proliferación de las células endoteliales de arteria uterina ovina derivadas del estado de no gestación (NG-CEAU), demostrando una adaptación endotelial uterina vascular inducida por el embarazo, así como la programación de reacciones estrogénicas durante el embarazo (32).
Debido a la importancia que podría tener la selectividad del REs en la función vascular, existe un considerable interés por investigar la heterogeneidad funcional en la regulación de proliferación endotelial inducida por el estrógeno. En este sentido, hemos explorado varios de los agonistas y antagonistas farmacológicos del Res, que están detallados en la Tabla I. Nuestros estudios demostraron que la proliferación inducida por el estrógeno en G-CEAUs es inalterada por MPP, el antagonista de RE-α (Figura 2) (15,32). Estos resultados sugieren que RE-α no juega un papel principal en la angiogénesis de CEAUs inducida por el embarazo (32). Igualmente importante y consistente con los datos de MPP, PPT agonista del RE-α, no estimula la proliferación de G-CEAUs en las concentraciones estudiadas (Figura 3) (32). En contraste, el antagonista de RE-β, PHTPP, inhibe completamente la proliferación de G-CEAUs inducida por el estrógeno demostrando la selectividad del RE-β (Figura 2). También observamos que el agonista de RE-β, DPN, induce la proliferación de G-CEAUs (Figura 3), lo cual indica que la proliferación es producida principalmente a través del RE-β y completamente independiente del RE-α. Adicionalmente, también se ha demostrado que el RE-β es el receptor estrogénico principal que se expresa en el endotelio vascular y perivascular de primates, y por lo tanto puede ser el único mediador de acciones angiogénicas y genómicas en el endotelio vascular uterino inducido por el estrógeno (34).
Además de inducir la proliferación de células endoteliales, el estrógeno induce la migración, la formación del tubo, y de la matriz extracelular, así como la producción de factor de adhesión en las células endoteliales a través de un mecanismo mediado por RE; colectivamente, estas funciones son componentes integrales del paradigma de angiogénesis. En este contexto, el ICI-182,780 abroga la migración, incorporación de H3-timidina, la formación del tubo, y los efectos de cierre de «heridas» inducidos por estradiol sobre las células del endotelio de arteria uterina y vena umbilical (CEVU) (31,33). El bloqueo de angiogénicos a través de los antagonistas del REs demuestra que este proceso inducido por el estrógeno en el endotelio vascular uterino es mediado específicamente por sus receptores clásicos. Estos datos también ilustran que el estrógeno a través del REs clásicos juega un papel importante en la proliferación endotelial, la migración, y la adhesión que están íntimamente implicadas en la angiogénesis uterina, una importante adaptación vascular que conduce a aumentos en el FSU durante el embarazo normal. Sin embargo, en la actualidad no está claro si el estrógeno demuestra su especificidad a través de ya sea RE-α o RE-β para inducir otros efectos angiogénicos distintos de la proliferación endotelial, por lo tanto esto requiere más investigación.
FUNCIÓN DEL ESTRÓGENO Y LOS REs EN LOS EFECTOS NO-GENÓMICOS DE CEAU
El mantenimiento del tono vascular está regulado por múltiples vasodilatadores que son derivados del endotelio. Los más estudiados son el óxido nítrico (ON) y prostanoides como la prostaciclina. Estos dos vasodilatadores aumentan durante el embarazo, sin embargo, experimentos in vivo no han confirmado que la contribución de PGI2 en mantener el FSU elevado durante la gestación (35,36). Aunque prostaciclina es un potente vasodilatador, su función en el embarazo no se conoce así como la del ON, el cual ha mostrado tener un papel definitivo en la regulación parcial del FSU durante la gestación. Por lo tanto, la siguiente sección se enfoca en los efectos de E2β-RE-ON durante el embarazo.
Generalmente es aceptado que las reacciones rápidas estrogénicas que contribuyen a la producción del ON son mediadas por los REs en varios lechos vasculares incluyendo la aorta (37), la arteria pulmonar (38,39) CEVU (40,41) que produce la vasodilatación y el mantenimiento de la perfusión. Los receptores de estrógeno de membrana (mRE) se localizan y vinculan funcionalmente a distintas subpoblaciones de regiones dinámicas en la membrana plasmática. Estas regiones se llaman “caveolae” y compartimentan muchos receptores y moléculas de señalización para crear un «módulo de señalización funcional» (42,43). Dentro de estas caveolas, los REs y eNOS se colocalizan con la caveolina (Cav)-1, la proteína principal del andamiaje (44,45). Las interacciones entre Cav-1 y eNOS se producen a través del dominio de andamio de caveolae (DAC) en Cav-1, y la DAC expande el dominio de unión de calmodulina en eNOS. Calmodulina es necesaria para la activación dependiente de Ca2+/calmodulin de eNOS (46). La estimulación de los niveles endógenos de REs, así como la sobreexpresión de los receptores son capaces de iniciar la activación de eNOS (Figura 4 y 5) (47,48). Aunque el mecanismo de E2β-RE-ON está todavía bajo investigación, muchos trabajos se han centrado en el estudio de la señalización intracelular producida por RE-α. Sin embargo, poco se sabe acerca de la señalización de RE-β. Chambliss y cols, informaron del aumento en la actividad de eNOS después del tratamiento de estrógeno y su abrogación cuando las membranas endoteliales aisladas se pre incubaron con ICI-182,780 o el anticuerpo-RE-α pero no con inmunoglobulina G (47) (Figura 4). Además, otro estudio demostró que las caveolas purificadas de estas células perdieron la actividad de eNOS inducida por el estrógeno cuando se utilizó ICI-182,780 o THC, un antagonista de RE-β (49) (Figura 5). Recientemente demostramos que la S-nitrosilación de proteínas es incrementada a través de un mecanismo dependiente de E2β-RE-ON en G-CEAUs. Sin embargo, los tratamientos con PPT o DPN fueron incapaces de iniciar estos cambios proteómicos mediados por ON, pero, la combinación de PPT y DPN indujo la S-nitrosilación de proteínas a niveles similares como las observadas con el estrógeno. Estos datos sugieren indirectamente que RE-α y RE-β son capaces y necesarios para la producción de ON.
Aunque varios grupos de investigación han establecido que los REs pueden localizarse en la membrana endotelial o caveola (40,44,45,50,51) y que inducen la producción de ON, el mecanismo de tráfico de REs a las caveolas sigue siendo desconocido. Se ha postulado que a pesar que los REs pueden carecer de dominios de transmembrana (50,51), los Res se han vinculado con la modificación de ácidos grasos a través de la palmitoilación, como un cambio postraduccional responsable por su presencia dentro de la caveola y su asociación con proteínas reguladoras tales como Cav-1 (51,52). En la búsqueda de un mayor entendimiento de los mecanismos del tráfico del REs, Pedram y cols (51), identificaron una secuencia en Cav-1 altamente conservada en los RE-α, RE-β, receptores de progesterona y receptores de andrógeno. Esta secuencia se encuentra en el dominio E, que contiene DUA. Serina-522 y cisteína-447 son necesarios para la interacción entre RE-α y Cav-1; cisteína-447 también fue identificado como el sitio de palmitoilación (51). Además, Acconcia y cols demostraron que el RE-α fue palmitoilado por palmitoyl acyl transferase (PAT) y que el punto de mutación C447A extinguió el reconocimiento de palmitoilación del PAT. La mutación C447A también neutralizó la rápida activación de ERK/MAPK (53), requerida para la activación de eNOS (47,53). Curiosamente, el RE-β también posee este mismo sitio de reconocimiento, y la mutación de cisteína altera la palmitoilación de RE-β y completamente suprime la activación rápida mediada por estrógenos a través de p38b (51). Sin embargo, no hay una explicación que detalle la baja abundancia del REs en caveolas (3-5%), en comparación con otras localizaciones celulares (~90%) o su orientación física en la membrana (intracelular o extracelular).
Aunque los pasos exactos que subyacen la activación de eNOS inducida por el estrógeno no son totalmente conocidos, se sabe que eNOS es regulado por eventos complejos de fosforilación en múltiples sitios (54,55). El eNOS es fosforilado en cuatro sitios de serina/treonina que se han vinculado con su activación: Ser635 situado dentro del dominio de unión con NADPH, Ser1179 situado en el dominio de unión con FMN, Ser116 situado en el dominio oxigenasa, y Thr495 situado en el dominio de unión con calmodulina (CaM) (54). Los dos sitios ampliamente estudiados son la fosforilación estimuladora de Ser1179, Ser635 y la inhibitoria de Thr495 (56-58). La fosforilación en la posición 1179 y/o 635 se ha asociado con un aumento en la producción de ON en los niveles basales de [Ca2+]. Ser1179 se cree que aumenta la producción de ON mediante la eliminación de la cola autoinhibitoria de eNOS (46), mientras que la ubicación del Ser635 en la secuencia de auto inhibitorio de CaM está teorizada mantener la actividad alta de eNOS después del incremento de [Ca2+] inicial (46). La fosforilación en Thr495 se observa en la actividad basal de eNOS, y los informes han observado una fosforilación y producción de ON baja después del tratamiento con agonista (46). La fosforilación en Ser114 es controvertido donde se observaron un aumento y disminución en la producción de ON dependiendo del agonista utilizado (54). Sin embargo, un estudio amplio acerca de los cambios de fosforilación de eNOS inducido por el estrógeno a través de RE-α y/o RE-β en diferentes dominios subcelulares es necesario.
CONCLUSION
Por lo tanto las áreas de gran interés son las cuales tratan de explicar las razones por la cual los Res exhiben especificidad sobre la regulación genómica de largo plazo frente a los efectos rápidos no-genómicos en el endotelio. Esta regulación sobre el endotelio puede representar una complejidad de señalización del estrógeno muy poco apreciado. Sin embargo, no podemos descartar una concordancia en los mecanismos del Res para mediar efectos genómica contra los mecanismos de señalización no-genómicos en la vasculatura uterina durante el embarazo. Es razonable plantear hipótesis sobre los efectos selectivos del REs. Por lo tanto basado en las pruebas presentadas aquí, proponemos la hipótesis de que los mecanismos de señalización no-genómicos de ER-α y/o ER-β pueden representar funciones celulares activados rápidamente que son necesarios para la vasodilatación dinámica aguda; mientras que la señalización genómica por ER-β puede mediar la programación celular a largo plazo necesaria para las adaptaciones crónicas del mantenimiento de los aumentos de FSU durante el embarazo normal.
AGRADECIMIENTOS
Queremos agradecer a Sheik O. Jobe, Jayanth Ramadoss, Cindy L. Goss, Terrance M. Phernetton, y Jason L. Austin por su ayuda con estos estudios y preparación del manuscrito. Estos estudios son parte del cumplimiento parcial del doctorado (MBPR) en el programa de Endocrinología y Fisiología Reproductiva.
BIBLIOGRAFÍA
1. Pastore MB, Jobe SO, Ramadoss J, Magness RR. Estrogen receptor-alpha and estrogen receptor-beta in the uterine vascular endothelium during pregnancy: functional implications for regulating uterine blood flow. Semin Reprod Med. 2012;30(1):46-61.
2. Magness RR, Phernetton TM, Gibson TC, Chen DB. Uterine blood flow responses to ICI 182 780 in ovariectomized oestradiol-17beta-treated, intact follicular and pregnant sheep. J Physiol. 2005;565(Pt 1):71-83.
3. Chen DB, Bird IM, Zheng J, Magness RR. Membrane estrogen receptor-dependent extracellular signal-regulated kinase pathway mediates acute activation of endothelial nitric oxide synthase by estrogen in uterine artery endothelial cells. Endocrinology. 2004;145(1):113-125.
4. Magness RR, Phernetton TM, Zheng J. Systemic and uterine blood flow distribution during prolonged infusion of 17beta-estradiol. Am J Physiol. 1998;275(3 Pt 2):H731-743.
5. Chen DB, Bird IM, Zheng J, Magness RR. Membrane estrogen receptor-dependent extracellular signal-regulated kinase pathway mediates acute activation of endothelial nitric oxide synthase by estrogen in uterine artery endothelial cells. Endocrinology. 2004;145(1):113-125.
6. Kumar R, Johnson BH, Thompson EB. Overview of the structural basis for transcription regulation by nuclear hormone receptors. Essays Biochem. 2004;40:27-39.
7. Kumar R, Thompson EB. The structure of the nuclear hormone receptors. Steroids. 1999;64(5):310-319.
8. Gosden JR, Middleton PG, Rout D. Localization of the human oestrogen receptor gene to chromosome 6q24—-q27 by in situ hybridization. Cytogenet Cell Genet. 1986;43(3-4):218-220.
9. Krust A, Green S, Argos P, et al. The chicken oestrogen receptor sequence: homology with v-erbA and the human oestrogen and glucocorticoid receptors. EMBO J. 1986;5(5):891-897.
10. Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 1994;22(22):4673-4680.
11. Ascenzi P, Bocedi A, Marino M. Structure-function relationship of estrogen receptor alpha and beta: impact on human health. Mol Aspects Med. 2006;27(4):299-402.
12. Zhou W, Liu Z, Wu J, et al. Identification and characterization of two novel splicing isoforms of human estrogen-related receptor beta. J Clin Endocrinol Metab. 2006;91(2):569-579.
13. Kumar R, Thompson EB. Transactivation functions of the N-terminal domains of nuclear hormone receptors: protein folding and coactivator interactions. Mol Endocrinol. 2003;17(1):1-10.
14. Hsieh RW, Rajan SS, Sharma SK, et al. Identification of ligands with bicyclic scaffolds provides insights into mechanisms of estrogen receptor subtype selectivity. J Biol Chem. 2006;281(26):17909-17919.
15. Meyers MJ, Sun J, Carlson KE, Marriner GA, Katzenellenbogen BS, Katzenellenbogen JA. Estrogen receptor-beta potency-selective ligands: structure-activity relationship studies of diarylpropionitriles and their acetylene and polar analogues. J Med Chem. 2001;44(24):4230-4251.
16. Stauffer SR, Coletta CJ, Tedesco R, et al. Pyrazole ligands: structure-affinity/activity relationships and estrogen receptor-alpha-selective agonists. J Med Chem. 2000;43(26):4934-4947.
17. Compton DR, Sheng S, Carlson KE, et al. Pyrazolo[1,5-a]pyrimidines: estrogen receptor ligands possessing estrogen receptor beta antagonist activity. J Med Chem. 2004;47(24):5872-5893.
18. Sun J, Huang YR, Harrington WR, Sheng S, Katzenellenbogen JA, Katzenellenbogen BS. Antagonists selective for estrogen receptor alpha. Endocrinology. 2002;143(3):941-947.
19. Krom YD, Pires NM, Jukema JW, et al. Inhibition of neointima formation by local delivery of estrogen receptor alpha and beta specific agonists. Cardiovasc Res. 2007;73(1):217-226.
20. Zhang HH, Feng L, Wang W, Magness RR, Chen DB. Estrogen-responsive nitroso-proteome in uterine artery endothelial cells: role of endothelial nitric oxide synthase and estrogen receptor-beta. J Cell Physiol. 2012;227(1):146-159.
21. Wang L, Andersson S, Warner M, Gustafsson JA. Estrogen receptor ERbeta knockout mice reveal a role for ERbeta in migration of cortical neurons in the developing brain. Proc Natl Acad Sci U S A. 2003;100(2):703-708.
22. Rubanyi GM, Freay AD, Kauser K, et al. Vascular estrogen receptors and endothelium-derived nitric oxide production in the mouse aorta. Gender difference and effect of estrogen receptor gene disruption. J Clin Invest. 1997;99(10):2429-2437.
23. Dupont S, Krust A, Gansmuller A, Dierich A, Chambon P, Mark M. Effect of single and compound knockouts of estrogen receptors alpha (ERalpha) and beta (ERbeta) on mouse reproductive phenotypes. Development. 2000;127(19):4277-4291.
24. Bilsel AS, Moini H, Tetik E, Aksungar F, Kaynak B, Ozer A. 17Beta-estradiol modulates endothelin-1 expression and release in human endothelial cells. Cardiovasc Res. 2000;46(3):579-584.
25. Hishikawa K, Nakaki T, Marumo T, Suzuki H, Kato R, Saruta T. Up-regulation of nitric oxide synthase by estradiol in human aortic endothelial cells. FEBS Lett. 1995;360(3):291-293.
26. Weiner CP, Knowles RG, Moncada S. Induction of nitric oxide synthases early in pregnancy. Am J Obstet Gynecol. 1994;171(3):838-843.
27. MacRitchie AN, Jun SS, Chen Z, et al. Estrogen upregulates endothelial nitric oxide synthase gene expression in fetal pulmonary artery endothelium. Circ Res. 1997;81(3):355-362.
28. Hayashi A, Kobayashi A, Takahashi R, Suzuki F, Nakagawa T, Kimotro K. Effects of voluntary running exercise on blood pressure and renin-angiotensin system in spontaneously hypertensive rats and normotensive Wistar-Kyoto rats. J Nutr Sci Vitaminol (Tokyo). 2000;46(4):165-170.
29. Kim-Schulze S, McGowan KA, Hubchak SC, et al. Expression of an estrogen receptor by human coronary artery and umbilical vein endothelial cells. Circulation. 1996;94(6):1402-1407.
30. Sumi D, Ignarro LJ. Estrogen-related receptor alpha 1 up-regulates endothelial nitric oxide synthase expression. Proc Natl Acad Sci U S A. 2003;100(24):14451-14456.
31. Morales DE, McGowan KA, Grant DS, et al. Estrogen promotes angiogenic activity in human umbilical vein endothelial cells in vitro and in a murine model. Circulation. 1995;91(3):755-763.
32. Jobe SO, Ramadoss J, Koch JM, Jiang Y, Zheng J, Magness RR. Estradiol-17beta and its cytochrome P450- and catechol-O-methyltransferase-derived metabolites stimulate proliferation in uterine artery endothelial cells: role of estrogen receptor-alpha versus estrogen receptor-beta. Hypertension. 2010;55(4):1005-1011.
33. Oviedo PJ, Sobrino A, Laguna-Fernandez A, et al. Estradiol induces endothelial cell migration and proliferation through estrogen receptor-enhanced RhoA/ROCK pathway. Mol Cell Endocrinol. 2011;335(2):96-103.
34. Critchley HO, Brenner RM, Henderson TA, et al. Estrogen receptor beta, but not estrogen receptor alpha, is present in the vascular endothelium of the human and nonhuman primate endometrium. J Clin Endocrinol Metab. 2001;86(3):1370-1378.
35. Magness RR, Rosenfeld CR, Faucher DJ, Mitchell MD. Uterine prostaglandin production in ovine pregnancy: effects of angiotensin II and indomethacin. AmJ Physiol. 1992;263(1 Pt 2):H188-197.
36. Naden RP, Iliya CA, Arant BS, Jr., Gant NF, Jr., Rosenfeld CR. Hemodynamic effects of indomethacin in chronically instrumented pregnant sheep. AmJ ObstetGynecol. 1985;151(4):484-494.
37. Klinge CM, Blankenship KA, Risinger KE, et al. Resveratrol and estradiol rapidly activate MAPK signaling through estrogen receptors alpha and beta in endothelial cells. J Biol Chem. 2005;280(9):7460-7468.
38. Lantin-Hermoso RL, Rosenfeld CR, Yuhanna IS, German Z, Chen Z, Shaul PW. Estrogen acutely stimulates nitric oxide synthase activity in fetal pulmonary artery endothelium. Am J Physiol. 1997;273(1 Pt 1):L119-126.
39. Shaul PW, Smart EJ, Robinson LJ, et al. Acylation targets emdothelial nitric-oxide synthase to plasmalemmal caveolae. J Biol Chem. 1996;271(11):6518-6522.
40. Haynes MP, Sinha D, Russell KS, et al. Membrane estrogen receptor engagement activates endothelial nitric oxide synthase via the PI3-kinase-Akt pathway in human endothelial cells. Circ Res. 2000;87(8):677-682.
41. Haynes MP, Li L, Sinha D, et al. Src kinase mediates phosphatidylinositol 3-kinase/Akt-dependent rapid endothelial nitric-oxide synthase activation by estrogen. J Biol Chem. 2003;278(4):2118-2123.
42. Prabhakar P, Cheng V, Michel T. A chimeric transmembrane domain directs endothelial nitric-oxide synthase palmitoylation and targeting to plasmalemmal caveolae. J Biol Chem. 2000;275(25):19416-19421.
43. Shaul PW, Anderson RG. Role of plasmalemmal caveolae in signal transduction. Am J Physiol. 1998;275(5 Pt 1):L843-851.
44. Chen D, Zangl AL, Zhao Q, et al. Ovine caveolin-1: cDNA cloning, E. coli expression, and association with endothelial nitric oxide synthase. Mol Cell Endocrinol. 2001;175(1-2):41-56.
45. Chambliss KL, Shaul PW. Rapid activation of endothelial NO synthase by estrogen: evidence for a steroid receptor fast-action complex (SRFC) in caveolae. Steroids. 2002;67(6):413-419.
46. Bird IM, Zhang L, Magness RR. Possible mechanisms underlying pregnancy-induced changes in uterine artery endothelial function. Am J Physiol Regul Integr Comp Physiol. 2003;284(2):R245-258.
47. Chambliss KL, Shaul PW. Estrogen modulation of endothelial nitric oxide synthase. Endocr Rev. 2002;23(5):665-686.
48. Chambliss KL, Yuhanna IS, Mineo C, et al. Estrogen receptor alpha and endothelial nitric oxide synthase are organized into a functional signaling module in caveolae. Circ Res. 2000;87(11):E44-52.
49. Chambliss KL, Yuhanna IS, Anderson RG, Mendelsohn ME, Shaul PW. ERbeta has nongenomic action in caveolae. Mol Endocrinol. 2002;16(5):938-946.
50. Song RX, Barnes CJ, Zhang Z, Bao Y, Kumar R, Santen RJ. The role of Shc and insulin-like growth factor 1 receptor in mediating the translocation of estrogen receptor alpha to the plasma membrane. Proc Natl Acad Sci U S A. 2004;101(7):2076-2081.
51. Pedram A, Razandi M, Sainson RC, Kim JK, Hughes CC, Levin ER. A conserved mechanism for steroid receptor translocation to the plasma membrane. J Biol Chem. 2007;282(31):22278-22288.
52. Acconcia F, Ascenzi P, Bocedi A, et al. Palmitoylation-dependent estrogen receptor alpha membrane localization: regulation by 17beta-estradiol. Mol Biol Cell. 2005;16(1):231-237.
53. Acconcia F, Ascenzi P, Fabozzi G, Visca P, Marino M. S-palmitoylation modulates human estrogen receptor-alpha functions. Biochem Biophys Res Commun. 2004;316(3):878-883.
54. Mount PF, Kemp BE, Power DA. Regulation of endothelial and myocardial NO synthesis by multi-site eNOS phosphorylation. J Mol Cell Cardiol. 2007;42(2):271-279.
55. Ramadoss J, Liao WX, Morschauser TJ, et al. Endothelial caveolar hub regulation of adenosine triphosphate-induced endothelial nitric oxide synthase subcellular partitioning and domain-specific phosphorylation. Hypertension. 2012;59(5):1052-1059.
56. Chen Z, Yuhanna IS, Galcheva-Gargova Z, Karas RH, Mendelsohn ME, Shaul PW. Estrogen receptor alpha mediates the nongenomic activation of endothelial nitric oxide synthase by estrogen. J Clin Invest. 1999;103(3):401-406.
57. Boo YC, Hwang J, Sykes M, et al. Shear stress stimulates phosphorylation of eNOS at Ser(635) by a protein kinase A-dependent mechanism. Am J Physiol Heart Circ Physiol. 2002;283(5):H1819-1828.
58. Michell BJ, Griffiths JE, Mitchelhill KI, et al. The Akt kinase signals directly to endothelial nitric oxide synthase. Curr Biol. 1999;9(15):845-848.
59. Kuiper GG, Carlsson B, Grandien K, et al. Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta. Endocrinology. 1997;138(3):863-870.
60. Wakeling AE, Dukes M, Bowler J. A potent specific pure antiestrogen with clinical potential. Cancer Res. 1991;51(15):3867-3873.
61. Wakeling AE, Valcaccia B, Newboult E, Green LR. Non-steroidal antioestrogens–receptor binding and biological response in rat uterus, rat mammary carcinoma and human breast cancer cells. J Steroid Biochem. 1984;20(1):111-120.
62. Walter G, Liebl R, von Angerer E. Synthesis and biological evaluation of stilbene-based pure estrogen antagonists. Bioorg Med Chem Lett. 2004;14(18):4659-4663.
63. Kraichely DM, Sun J, Katzenellenbogen JA, Katzenellenbogen BS. Conformational changes and coactivator recruitment by novel ligands for estrogen receptor-alpha and estrogen receptor-beta: correlations with biological character and distinct differences among SRC coactivator family members. Endocrinology. 2000;141(10):3534-3545.
64. Yang C, Xu G, Li J, et al. Benzothiophenes containing a piperazine side chain as selective ligands for the estrogen receptor alpha and their bioactivities in vivo. Bioorg Med Chem Lett. 2005;15(5):1505-1507.
65. Sun J, Meyers MJ, Fink BE, Rajendran R, Katzenellenbogen JA, Katzenellenbogen BS. Novel ligands that function as selective estrogens or antiestrogens for estrogen receptor-alpha or estrogen receptor-beta. Endocrinology. 1999;140(2):800-804.
66. Malamas MS, Manas ES, McDevitt RE, et al. Design and synthesis of aryl diphenolic azoles as potent and selective estrogen receptor-beta ligands. J Med Chem. 2004;47(21):5021-5040.
67. Minutolo F, Bertini S, Granchi C, et al. Structural evolutions of salicylaldoximes as selective agonists for estrogen receptor beta. J Med Chem. 2009;52(3):858-867.