2006
5
Autores:
José Solís C.1
Instituciones:
1Unidad de Radioterapia Oncológica, Servicio Oncología, Hospital Carlos Van Buren, Valparaíso, Chile y Cátedra Oncología, Escuela de Medicina, Universidad de Valparaíso, Chile.
Tipo de documento:
DocumentosManejo del cáncer cérvico uterino localmente avanzado
Contenido del documento:
INTRODUCCIÓN
El cáncer cérvico uterino es el segundo cáncer más frecuente en mujeres, siendo una de las principales causas de muerte oncológica en mujeres de países subdesarrollados, donde la enfermedad frecuentemente se presenta en etapas avanzadas (1-3), afectando a mujeres jóvenes con un promedio de 26 años de vida perdido por cada paciente (4,5). En Chile constituye la primera causa de muerte en mujeres en el grupo entre 20 a 44 años y la sexta en el grupo entre 45 a 64 años (6).
La definición de cáncer cérvico uterino localmente avanzado incluye a pacientes con etapa IB2 a IVA (7). La cirugía no es una opción terapéutica para pacientes con etapa IIB, III y IV debido a una elevada proporción de márgenes positivos y factores de alto riesgo de recidiva, aumentando la utilización de radioterapia postoperatoria, incrementando la morbilidad asociada al tratamiento. La radioterapia ha constituido el tratamiento definitivo estándar para pacientes con cáncer localmente avanzado (8-11), sin embargo la dosis de radioterapia necesitada para lograr alta proporción de control tumoral en lesiones de gran tamaño exceden las dosis toleradas por tejidos normales en la pelvis (12), siendo las recurrencias locales un problema significativo con proporciones de falla pelviana en etapas II y III de 35% a 90% (8-11). Por lo anterior esfuerzos para mejorar resultados han consistido en estrategias que utilizan 2 o más modalidades de tratamiento como son cirugía, radioterapia y quimioterapia.
Esta revisión evaluara críticamente la evidencia que apoya las modalidades de tratamiento disponible para cáncer cérvico uterino localmente avanzado.
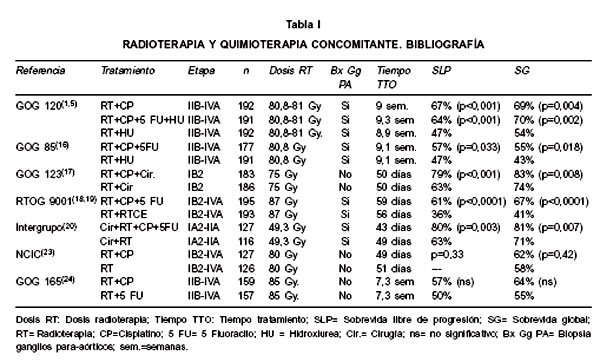
RADIOTERAPIA Y QUIMIOTERAPIA CONCOMITANTE (TABLA I)
En 1979 el GOG publicó los resultados de un trabajo randomizado fase III de pacientes con cáncer cérvico uterino etapa III y IVA comparando radioterapia exclusiva versus radioterapia asociado a hidroxiurea (13). El estudio demostró superioridad de radioquimioterapia pero fue criticado debido a que casi la mitad de los pacientes fueron inelegibles o no evaluados y haber utilizado bajas dosis de radiación. A pesar de lo anterior, desde esa fecha hidroxiurea fue siempre agregado al brazo control de estudios posteriormente conducidos por el GOG.
Symonds y cols (14) realizaron una revisión sistemática del uso concomitante de radioterapia e hidroxiurea encontrando deficiencias mayores en 8 estudios randomizados, no existiendo evidencia de calidad que sugiera efecto terapéutico de esta droga.
El GOG 120 (15) fue un estudio prospectivo fase III que randomizó 526 pacientes con cáncer cérvico uterino etapas IIB a IVA con ganglios para-aórticos negativos confirmados por cirugía a radioterapia asociado a: grupo 1 cisplatino 40 mg/m2 semanal por 6 ciclos, grupo 2 cisplatino 50 mg/m2 y Fluoracilo 1000 mg/m2 por 4 días durante días 1 y 29 de radioterapia asociado a hidroxiurea 2 g/m2 oral 2 veces por semana desde la 1ª a 6ª semana de radioterapia y el grupo 3 hidroxiurea 3 g/m2 oral 2 veces por semana durante 1ª a 6ª semana de radioterapia. Con una mediana de seguimiento de 35 meses se observó sobrevida libre de progresión a 24 meses de 67%, 64% y 47% en los grupos 1, 2 y 3, respectivamente (p<0,001). La proporción de sobrevida global fue significativamente mayor en los grupos 1 y 2 que en el grupo 3, con riesgo relativo de muerte de 0,61 y 0,58, respectivamente. Se observó mayor frecuencia de toxicidad grado 3 y 4 en el grupo 2, siendo la frecuencia en los otros 2 grupos similar.
El GOG 85 (16) fue un estudio prospectivo fase III que randomizó 368 pacientes con cáncer cérvico uterino etapa IIB a IVA con ganglios para-aórticos negativos confirmados por cirugía a radioterapia asociado a cisplatino 50 mg/m2 y Fluoracilo 1000 mg/m2 por 4 días durante días 1 y 29 de radioterapia comparado a hidroxiurea oral 80 mg/kg 2 días por semana durante radioterapia. Con una mediana de seguimiento de 8,7 años de pacientes vivos la sobrevida libre de progresión (p=0,033) y sobrevida global (p=0,018) favorecieron al régimen de fluoracilo y cisplatino versus hidroxiurea. Leucopenia severa fue más frecuente en el brazo con hidroxiurea.
El GOG 123 (17) fue un estudio prospectivo fase III que randomizó 369 pacientes con cáncer cérvico uterino IB2 a radioquimioterapia preoperatorio basada en cisplatino (40 mg/m2/semanal por 6 semanas) versus radioterapia exclusiva preoperatorio. Con una mediana de seguimiento de 36 meses la sobrevida libre de progresión (p<0,001) y sobrevida global (p=0,008) fue de 79% y 83% comparado 63% y 74% en el grupo de radioquimioterapia versus radioterapia exclusiva, respectivamente. En el grupo de tratamiento combinado se observó mayor frecuencia de efectos adversos grado 3 y 4, principalmente hematológicos y gastrointestinales transitorios.
El RTOG 9001 (18,19) fue un estudio prospectivo fase III que randomizó 389 pacientes con cáncer de cérvix IB2-IIA con diámetro tumoral ž5 cm o con etapa IIB-IVA con ganglios para-aórticos sin metástasis confirmados por cirugía a radioterapia pelviana y para-aórtica profiláctica comparado a radioquimioterapia pelviana consistente en 3 ciclos de cisplatino 75 mg/m2 y fluoracilo 1000 mg/m2/día por 4 días, cada 3 semanas. Con una mediana de seguimiento de pacientes vivos de 6,6 años, la sobrevida global a 5 y 8 años en el grupo de radioquimioterapia comparado al grupo de radioterapia con campos extendidos fue de 73% y 67% comparado con 52% y 41%, respectivamente (p<0,0001). El grupo de radioquimioterapia tuvo menor proporción de falla locoregional (p<0,0001), metástasis a distancia (p=0,0013) y mayor sobrevida causa específica (p=0,00012). La proporción de morbilidad aguda fue mayor en el brazo de radioquimioterapia. El análisis de subgrupo de radioquimioterapia observó que etapas IB-IIB tuvieron mayor sobrevida global y sobrevida libre de enfermedad (p<0,0001) y en etapas III y IVA sólo se observó mejor sobrevida libre de enfermedad (p=0,05).
El estudio intergrupo (20) fue un protocolo prospectivo fase III que randomizó 243 pacientes con cáncer cérvico uterino etapa IA2, IB o IIA tratados con histerectomía radical y linfadenectomía pelviana con factores de alto riesgo a radioterapia pelviana o radioterapia pelviana con 4 ciclos de quimioterapia basada en cisplatino 70 mg/m2 día 1 y Fluoracilo 1000 mg/m2/día por 4 días, día 1, 22, 43 y 64. Con una mediana de seguimiento de 42 meses, la sobrevida libre de progresión y sobrevida global estimada a 4 años fue de 80% y 81% en el brazo de radio-qumioterapia versus 63% y 71% en el brazo de radioterapia exclusiva (p=0,003; p=0,007). Análisis retrospectivo univariable de subgrupo (21) observó que el mayor beneficio de radioquimioterapia se produjo en pacientes con tumores >2 cm (p=0,009) y ž2 ganglios comprometidos (p=0,006).
Wong y cols (22) realizaron un estudio prospectivo fase III que randomizó 220 pacientes con cáncer cérvico uterino gran volumen etapa I a III a radioterapia pelviana o radioquimioterapia con epirubicina concomitante (60 mg/m2) y 5 ciclos de epirubicina adyuvante (90 mg/m2). Con una mediana de seguimiento de 77 meses se observó mejor sobrevida libre de progresión (p=0,024), sobrevida global (p=0,04) y menos metástasis a distancia (p=0,12) en el grupo de radioquimioterapia.
Pearcey y cols (23) informaron el estudio prospectivo fase III que randomizó 259 pacientes con etapas IB2 a IIA con enfermedad central ž5 cm y pacientes con etapa IIB a IVA etapificados con TAC a recibir radioterapia asociado a cisplatino (40 mg/m2 por semana por 5 ciclos) versus radioterapia. Con una mediana de seguimiento de 82 meses no se observaron diferencias significativas en proporción de sobrevida global a 3 y 5 años para radioquimioterapia comparado con radioterapia con 69% y 62% versus 66% y 58%, respectivamente (p=0,42).
El GOG 165 (24) fue un estudio prospectivo fase III que randomizó 316 pacientes con cáncer cérvico uterino IIB a IVA a radioterapia y cisplatino 50 mg/m2 semanal por 6 semanas versus radioterapia con infusión de fluoracilo 225 mg/m2 5 días por semana por 6 semanas. El estudio fue cerrado prematuramente cuando el análisis interino planeado indicó que el brazo con infusión de fluoracilo tuvo una mayor proporción de falla de tratamiento y mayor proporción de mortalidad comparado con régimen de cisplatino semanal. Con una mediana de seguimiento de pacientes vivos de 40,4 meses la sobrevida libre de progresión y sobrevida global a 4 años fue de 57% y 64% versus 50% y 55% en el grupo de cisplatino y fluoracilo, respectivamente.
Rose y cols (25) realizaron un análisis de costos de radioquimioterapia concomitante basada en cisplatino de los principales trabajos randomizados. Basado en estimación de sobrevida el incremento de costo de radioquimioterapia por cada año de vida ganado fue de 308 dólares a 3712 dólares, siendo el costo de pacientes hospitalizados substancialmente mayor que ambulatorio.
Green y cols (26) informaron un meta-análisis de radio-qumioterapia concomitante que incluyó 4580 pacientes en etapa IB a IVA, siendo el agente más comúnmente utilizado cisplatino. El beneficio absoluto en sobrevida libre de progresión y sobrevida global fue de 16% y 12%, respectivamente. También se observó beneficio significativo en control local (p<0,0001) y recurrencia a distancia (p=0,0001). El efecto de radioquimioterapia fue mayor en trabajos que randomizaron una mayor proporción de pacientes con etapa I y II (p=0,009).
Lukka y cols (27) informaron un meta-análisis de radioterapia y quimioterapia concomitante basado en cisplatino el cual demostró un efecto significativamente estadístico a favor de radioquimioterapia comparado con el control (RR 0,74) traduciéndose en una reducción absoluta del riesgo de muerte de 11%.
Kirwan y cols (28) realizaron una revisión sistemática de toxicidad aguda y crónica en pacientes tratados con radioquimioterapia concomitante. La radioquimioterapia aumentó la toxicidad aguda hematológica y gastrointestinal, siendo principalmente transitoria. No observaron diferencias estadísticas de toxicidad tardía entre los grupos de tratamiento.
QUIMIOTERAPIA NEOADYUVANTE
A pesar de la evaluación de más de 3000 pacientes en estudios randomizados, los resultados de quimioterapia neoadyuvante continúan siendo controversiales. No se ha demostrado beneficios en estudios randomizados de quimiotera pia neoadyuvante y radioterapia (29-36), observándose incluso disminución de sobrevida en el brazo de quimioterapia neoadyuvante seguido de radioterapia en 2 estudios (29,30). En el caso de quimioterapia neoadyuvante seguido de cirugía comparado con radioterapia exclusiva existen informes prometedores de algunos autores (37), los que han sido criticados por haber tenido un brazo control de radioterapia exclusiva no optimizada.
Benedetti-Panici y cols (37) informaron un estudio multicéntrico randomizado que comparó quimioterapia neoadyuvante seguido de cirugía radical versus radioterapia en 409 pacientes con cáncer cervico uterino etapa IB2 a III. La quimioterapia neoadyuvante consistió en cisplatino (dosis ž240 mg/m2) con un máximo de 2 drogas adicionales en un período de 6 a 8 semanas siendo posteriormente evaluados para cirugía, indicándose radioterapia postoperatoria en pacientes con factores de alto riesgo. En el brazo de radioterapia la mediana de dosis a punto A fue de sólo 70 Gy, con una mediana de tiempo de liberación de 62 días, administrándose en el 27% en más de 100 días, no realizando braquiterapia en el 28% de los pacientes. Un 26% de los pacientes en el brazo de quimioterapia neoadyuvante recibieron radioterapia postoperatoria. Con una mediana de seguimiento de pacientes vivos de 53 meses la sobrevida global y sobrevida libre de progresión de quimioterapia neoadyuvante y radioterapia exclusiva fue de 56% versus 44% (p=0,01) y 55,4% versus 41,3% (p=0,02), respectivamente.
Buda y cols (38), informaron un estudio multicéntrico que randomizó 219 pacientes con etapas IB2 a IVA a quimioterapia neoadyuvante con paclitaxel, cisplatino e ifosfamida (TIP) comparado con cisplatino e ifosfamida (IP). En ambos esquemas se administraron 3 ciclos de quimioterapia, siendo operados aquellos pacientes con respuesta favorable. Las pacientes que lograron respuesta completa o parcial recibieron 2 ciclos de quimioterapia adyuvante. El esquema TIP se asoció a una mayor proporción de toxicidad hematológica grado 3 y 4 (p=0,02). Con una mediana de seguimiento de 43 meses no se observaron diferencias estadísticas en sobrevida entre ambos grupos (p=0,11)
El meta-análisis (39) de quimioterapia neoadyuvante en cáncer cérvico uterino localmente avanzado evaluó los resultados en 2 comparaciones. En la primera comparación quimioterapia neoadyuvante seguido de radioterapia versus radioterapia exclusiva, se obtuvieron datos de 2074 pacientes con un alto nivel de heterogeneidad estadística observando que los trabajos de quimioterapia que utilizaron ciclos 14 días (p=0,046) o con dosis de cisplatino ž25 mg/m2 por semana (p=0,2) tendieron a mostrar ventaja de quimioterapia neoadyuvante en sobrevida. La segunda comparación de quimioterapia neoadyuvante seguido de cirugía comparado con radioterapia exclusiva se obtuvo datos de 872 pacientes observando diferencias en el diseño y resultados de los trabajos con amplios intervalos de confianza entre ellos. En los estudios de quimioterapia neoadyuvante seguido de cirugía se observó una reducción significativa de muerte (p=0,0004), aumento de sobrevida libre de enfermedad (p=0,0001), sobrevida libre de enfermedad locoregional (p=0,0001) y sobrevida libre de metástasis (p=0,00001), lo que se tradujo en un aumento absoluto de sobrevida de un 14%.
QUIMIOTERAPIA ADYUVANTE
El estudio intergrupo (20) prospectivo fase III randomizó 243 pacientes con etapas IA2, IB a IIA tratados con histerectomía radical y linfadenectomía pelviana con factores de alto riesgo a radioterapia pelviana o radioterapia pelviana con 4 ciclos de quimioterapia consistente en cisplatino 70 mg/m2 día 1 y fluoracilo 10000 mg/m2/día por 4 días por ciclo los días 1, 22, 43 y 64, siendo el 3° y 4° ciclo adyuvante. Con una mediana de seguimiento de 42 meses la sobrevida global y sobrevida libre de progresión a 4 años en el grupo de tratamiento combinado comparado con radioterapia fue de 81% versus 71% (p=0,007) y 80% versus 63% (p=0,003), respectivamente. Se observó que mayor número de ciclos de quimioterapia fue asociado favorablemente a sobrevida global y sobrevida libre de progresión (p=0,03).
Wong y cols (22) realizaron un estudio prospectivo fase III que randomizó 220 pacientes con cáncer cérvico uterino gran volumen etapa I a III a radioterapia pelviana estándar o radioquimioterapia con epirubicina concomitante (60 mg/m2) y 5 ciclos de epirubicina adyuvante (90 mg/m2). Con una mediana de seguimiento de 77 meses hubo mejor sobrevida global (p=0,04) y sobrevida libre de enfermedad (p=0,024) y menos metástasis a distancia (p=0,012) en el grupo de radioquimioterapia con quimioterapia adyuvante.
Lee y cols (40) informaron los resultados preliminares de un estudio que randomizó 40 pacientes con cáncer cérvico uterino tratado con histerectomía radical y linfadenectomía con factores de alto riesgo a radioquimioterapia con cisplatino y fluoracilo por 3 ciclos comparado con radioquimioterapia con el mismo esquema por 6 ciclos. No se observaron diferencias significativas en sobrevida global (p=0,29) y sobrevida libre de progresión (p=0,17), registrándose aumento significativo de toxicidad hematológica en el grupo con quimioterapia de consolidación.
Rose y cols (25) informaron un análisis de costo de efectividad de radioquimioterapia concomitante basado en cisplatino. La continuación de quimioterapia más allá de la completación de radioterapia como fue en el estudio intergrupo (4) incrementó substancialmente el costo de tratamiento.
CONCLUSIONES
Esfuerzos para mejorar resultados en cáncer cérvico uterino localmente avanzado han consistido en estrategias que utilizan combinación de 2 o más modalidades de tratamiento como son radioterapia, quimioterapia y cirugía, siendo esta combinación compleja requiriendo experiencia y manejo en equipo.
A pesar de la racionalidad de quimioterapia neoadyuvante su uso continúa siendo controversial debido a que la validez de la mayoría de los estudios puede ser cuestionado por la selección de pacientes, múltiples esquemas de quimioterapia utilizados, toxicidad inaceptable en algunos casos, alta proporción de pacientes que reciben radioterapia postoperatoria y utilización de brazos de control con radioterapia no optimizado sin quimioterapia concomitante.
Actualmente el uso de quimioterapia adyuvante en cáncer cervico uterino es recomendado solamente en estudios clínicos.
En 1999 fueron publicados 5 estudios prospectivos randomizados que evaluaron el rol de radioquimioterapia basados en cisplatino (15-20) en una variedad de estados de la enfermedad incluyendo pacientes con factores de alto riesgo luego de cirugía radical, pacientes con etapa IB2 y pacientes con enfermedad localmente avanzada etapa IIB a IVA, observándose en todos los trabajos un incremento relativo en sobrevida global y sobrevida libre de progresión entre un 30% a un 50%. En base a los resultados de estos 5 estudios el National Cancer Institute realizó un anuncio clínico (41) enfatizando la incorporación de quimioterapia concomitante basada en cisplatino a radioterapia en pacientes que requieran radioterapia. El resultado de un sexto estudio randomizado fue publicado en forma posterior (23) no demostrando beneficio estadístico de radioquimioterapia basada en cisplatino, sin embargo fue el estudio más pequeño de los seis teniendo grandes intervalos de confianza, asociado a que el grupo de radioquimioterapia tuvo menores niveles de hemoglobina durante la radioterapia lo que podría haber afectado la capacidad del estudio para discernir diferencias entre los grupos. Basado en el resultado colectivo de 6 estudios randomizados (15-20,23) asociado a 2 meta-análisis (26,27) actualmente el tratamiento estándar del cáncer cérvico uterino localmente avanzado es radioquimioterapia concomitante basada en cisplatino, siendo el esquema estándar del GOG cisplatino 40 mg/m2 semanal por 6 semanas, por su efectividad asociada al bajo perfil de toxicidad (15). Para obtener mejores resultados se debe prestar especial atención a los detalles de radioterapia incluyendo dosis total, tiempo total de administración (42), corrección de anemia (43,44) y balance entre radioterapia externa y braquiterapia (45). En caso de pacientes en malas condiciones generales asociado a comorbilidad que contraindique quimioterapia el tratamiento de elección es radioterapia exclusiva. Algunas consideraciones se deben realizar en la aplicación de los resultados de los trabajos randomizados de radioquimioterapia en la población general ya que estos protocolos no fueron diseñados para encontrar el régimen óptimo de quimioterapia, ni para encontrar diferencias estadísticas en etapas avanzadas III y IVA, excluyendo pacientes con ganglios para-aórticos comprometidos. El uso de 5 fluoracilo asociado a cisplatino permanece en discusión debido a que ningún trabajo randomizado ha comparado los dos regímenes directamente.
Es importante que continúen las investigaciones en el campo de imágenes como el FDG-PET y fusión de imágenes ayudando a una mejor etapificación, detectando metástasis para-aórticos de pequeño volumen, a un mejor diseño de campos de radioterapia y mejor seguimiento de pacientes. El rol de diferentes esquemas de quimioterapia están siendo estudiados como gemcitabina (46), carboplatino (47,48), mitomicina-C (49) y topotecan (50) entre otros. Se han desarrollado técnicas de radioterapia como intensidad modulada la que tendría un perfil de toxicidad más favorable que radioterapia convencional (51-54), lo que ha permitido incluir volúmenes mayores asociado a cisplatino con toxicidad aguda aceptable (55).
BIBLIOGRAFÍA
- Pisani P, Parkin DM, Bray F, Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. Int J Cancer 1999;83:18-29.
- Parkin DM, Pisani P, Ferlay J. CA Global Cancer Statistics. Cancers Clin 1999;49:33-64.
- No authors listed. Cervical Cancer Mortality Worldwide. J Natl Cancer Inst 2006;98(7):434.
- SEER Cancer Statistics Review, 1973-1996, NCI, 1999.
- No authors listed. Stat bite: Average years of life Lost from Cancer. J Natl Can Inst 2001;93(5):341.
- Ministerio de Salud de Chile. Programa Nacional de Cáncer. Hallado en: www.minsal.cl
- Rojas-Espaillat L, Rose P. Management of locally advanced cervical cancer. Curr Opin Oncol 2005;17:485-92.
- Barrillot I, Horiot JC, Pigneux J, Schraub S, Pourquier H, Daly N, et al. Carcinoma of the intac uterine cervix treated with radiotherapy alone: A French cooperative study: Update and multivariate analysis of prognostic factors. Int J Radiation Oncology Biol Phys 1997;38(5):969-78.
- Perez CA, Grigsby P, Nene S, Camel HM, Galakatos A, Kao MS. Effect of tumor size on the prognosis of carcinoma of the uterine cervix treated with irradiation alone. Cancer 1992;69:2796-806.
- Perez CA, Grigsby P, Chao KS, Mutch D, Lockett MA. Tumor size irradiation dose, and long-term outcome of carcinoma of uterine cervix. Int J Radiation Oncol Biol Phys 1998;41(2):307-17.
- Lanciano RM, Won M, Coia LR, Hanks GE. Pretreatment and treatment factors associated with improved outcome in squamous cell carcinoma of the uterine cervix: a final report of the 1973 and 1978 patterns of care studies. Int J Radiation Oncol Biol Phys 1991;20:667-76.
- Fletcher GH. Clinical dose-response curves of human malignant epithelial tumours. Br J Radiol 1973;46:1-12.
- Hreshchyshyn MM, Aron BS, Boronow RC, et al. Hydroxiurea or placebo combined with radiation to treat stages IIIB and IV cervical cancer confined to the pelvis. Int J Radiat Oncol Biol Phys 1979;5(3): 317-22.
- Symonds RP, Collinwood M, Kirwan J, Humber CE, Tierney JF, Green JA. Concomitant hydroxyurea plus radiotherapy versus radiotherapy for carcinoma of the uterine cervix: a systematic review. Cancer Treat Rev 2004;30(5):405-14.
- Rose P, Bundy B, Watkins E, ThigPen T, Deppe G, Maiman M, et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Eng J Med 1999;340(15):1144-53.
- Whitney C, Sause W, Bundy B, Malfetano J, Hannigan E, Fowler W, et al. Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjuvant to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative para-aortic lymph nodes: A Gynecologic Oncology Group and Southwest Oncology Group Study. J Clin Oncol 1999;17(5):1339-48.
- Keys H, Bundy B, Stehman F, Muderspach L, Chafe W, Suggis III C, et al. Cisplatin, radiation and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Eng J Med 1999;340(15):1154-61.
- Eifel P, Winter K, Morris M, Levenback C, Grigsby P, Cooper J, Rotman M, Gershenson D, Mutch D. Pelvic irradiation with concurrent chemotherapy versus pelvic and para-aortic irradiation for high-risk cervical cancer: An update of Radiation Therapy Oncology Group Trial (RTOG) 90-01. J Clin Oncol 2004;22(5):872-80.
- Morris M, Eifel P, Lu J, Grigsby P, Levenback C, Stevens R, et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Eng J Med 1999;340:1137-43.
- Peters W, Liu P, Barret R, Stock R, Monk B, Berek J, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radiacl surgery in high risk early stage cancer of the cervix. J Clin Oncol 2000;18(8):1606-13.
- Monk B, Wang J, Im S, Stock R, Peters III W, Liu P, et al. Rethinking the use of radiation and chemotherapy after radical hysterectomy: a clinical-pathological analysis of a Gynecologic Oncology Group, Southwest Oncology Group, Radiation Therapy Oncology Group Trial. Gynecol Oncol 2005;96:721-8.
- Wong L, Ngan H, Cheung A, Cheng D, Ng T, Choy DJ. Chemoradiation and adjuvant chemotherapy in cervical cancer. Clin Oncol 1999;17(7):2055-60.
- Pearcey R, Brundage M, Drovin P, Jeffrey J, Lukka H, Maclean G, et al. Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol 2002;20(4):966-72.
- Lanciano R, Calkins A, Bundy B, Pairham G, Lucci III J, Moore D, et al. randomized comparison of weekly cisplatino or protracted venous infusión of fluoracil in combination with pelvic radiation in advanced cervix cancer: A Gynecologic Oncology Group Study. J Clin Oncol 2005; 23(33):8289-95.
- Rose P, Lappas P. Analysis of the cost effectiveness of concurrent cisplatin-based chemoradiation in cervical cancer: implications from five randomized trials. Gynecol Oncol 2000;78(1):3-6.
- Green J, Kirwan J, Tierney J, Symonds P, Collingwood M, Williams C. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta-analysis. Lancet 2001;358(8):781-86.
- Lukka H, Hirte H, Fyles A, Thomas G, Elit L, Johnston M, et al. Concurrent cisplatin-based chemotherapy plus radiotherapy for cervical cancer- a meta-analysis. Clin Oncol 2002;14(3):203-12.
- Kirwan J, Symonds P, Green J, Tierney J, Collingwood M, Williams C. A systematic review of acute and late toxicity of concomitant chemoradiation for cervical cancer. Radiother Oncol 2003;68(3):217-26.
- Tattersall MNH, Lorvidhaya V, Vootiprux, et al. A randomized trial of epirubicina and cisplatin chemotherapy followed by pelvic radiation in locally advanced cervical cancer. J Clin Oncol 1995;13:444-51.
- Souhami L, Gil RA, Allan SE, et al. A randomized trial of chemotherapy followed by pelvic radiotherapy in stage IIIB carcinoma of the cervix. J Clin Oncol 1991;9:970-77.
- Kumar L, Kaushal R, Nandy M, et al. Chemotherapy followed by radiotherapy versus radiotherapy alone in locally advanced cervical: a randomized study. Gynecol Oncol 1994;54:307-15.
- Tattersal MH, Ramirez C, Coppleson M. A randomized trial comparing platinum-based chemotherapy followed by radiotherapy versus radiotherapy alone in patients with locally advanced cervical cancer. Int J Gynecol Oncol 1992;2:244-51.
- Chauvergne J, Rohart J, Heron JF, Lebrun-Jezekova D, Pigneux J, Chenal C, et al. Randomized trial of initial chemotherapy in 151 locally advanced carcinoma of the cervix (T2b-N1, T3b, M0). Bull Cancer 1990;77:1007-24.
- Sundorf K, Trope CG, Hogberg T, et al. A randomized multicenter study of sequential cisplatin and 5 fluoracil and radiotherapy in advanced cervical carcinoma. Stage 3 B and 4 A. Cancer 1996;77:2371-76.
- Leborge F, Leborge JH, Doldan R, et al. Induction chemotherapy and radiotherapy of advanced cancer of the cervix: a pilot study and phase III randomized trial. Int J Radiat Oncol Biol Phy 1997;37:343-49.
- Herod J, Burton A, Buxton J, et al. A randomized, prospective phase III clinical trial of primary bleomycin, ifosfamida and cisplatin (BIP) chemotherapy followed by radiotherapy versus radiotherapy alone in inoperable cancer of the cervix. Ann Oncol 2000;11:1175-81.
- Benedetti-Panici P, Greggi S, Colombo A, Amoroso M, Smaniotti D, Giannarelli D, et al. Neoadjuvant chemotherapy and radical surgery versus exclusive radiotherapy in locally advanced squamous cell cervical cancer: results from the Italian multicenter randomized study. J Clin Oncol 2002;20(1):179-88.
- Buda A, Fossati R, Colombo N, Fei F, Floriani I, Gueli D, Katsaros D, et al. Randomized trial of neoadjuvant chemotherapy comparing paclitaxel, ifosfamide and cisplatin with ifosfamide and cisplatin followed by radical surgery in patients with locally advanced squamous cell cervical carcinoma: the SNAP01 (Studio Neo-Adjuvant Portio). Italian Collaborative Study. J Clin Oncol 2005;23:4137-45.
- Neoadjuvant Chemotherapy for Cervical Cancer Meta-analysis Collaboration. Neoadjuvant chemotherapy for locally advanced cervical cancer: a systematic review and meta-analysis of individual patient data from 21 randomised trials. Eu J Cancer 2003; 39(17):2470-86.
- Lee JW, Lee SJ, Lee SH, Lee JH, Huh SJ, Bae DS. Preliminary results of consolidation chemotherapy following concurrent chemoradiation after radical surgery in high-risk carcinoma of the uterine cervix. Clin Oncol 2005;17(6):412-7.
- Clinical Announcement NCI. US. Department of Health and Human Services, Public Health Service. National Institutes of Health, 1999.
- Fyles A, Keane TJ, Barton M, Simm J. The effect of treatment duration in the local control of cervix cancer. Radiother Oncol 1992; 25:273-9.
- Grogan M, Thomas G, Melamed I, Wong F, Pearcey R, Joseph P, et al. The importance of hemoglobin levels during radiotherapy for carcinoma of the cervix. Cancer 1999;86(8):1528-36.
- Winter III W, Maxwell L, Tian C, Sobel E, Rose G, Thomas G, et al. Association of hemoglobin levels with survival in cervical carcinoma patients treated with concurrent cisplatin and radiotherapy: a Gynecologic Oncology Group Study. Gynecologic Oncology 2004;94:495-501.
- Logsdon M, Eifel P. FIGO III B squamous cell carcinoma of the cervix. An Analysis of prognostic factors emphasizing the balance between external beam and intracavitary radiation therapy. Int J Radiat Oncol Biol Phys 1999;43(4):763-75.
- San Martín R, Suárez E, Olfos P, Escudero P, Rojas L, Larraguibel R, et al. Cáncer cérvico uterino en estadio IB2: Tratamiento con radioquimioterapia concomitante y cirugía. Rev Chil Obstet Ginecol 2003;68(6):447-57.
- Higgins R, Naumann W, Hall J, Haake M. Concurrent carboplatin with pelvic radiation therapy in the primary treatment of cervix cancer. Gynecol Oncol 2003;89:499-503.
- Dubay R, Rose P, O’Malley D, Shalodi A, Ludin A, Selim M. Evaluation of concurrent and adjuvant car boplatin with radiation therapy for locally advanced cervical cancer. Gynecol Oncol 2004;94(1):121-4.
- Lorvidhaya V, Chitapanarux I, Sangruchi S, Lertsanguansinchai P, Kongthanarat Y, Tangkaratt S, et al. Concurrent mitomycin c., 5-fluoracil, and radiotherapy in the treatment of locally advanced carcinoma of the cervix: a randomized trial. Int J Radiat Oncol Biol Phys 2003;55(5):1226-32.
- Long III H, Bundy B, Grendys E, Benda J, McMeekin S, Sorosky J, et al. Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix: A Gynecologic Oncology Group Study. J Clin Oncol 2005;23:4626-33.
- Mundt AJ, Roeske JC, Ljan AE, et al. Initial clinical experience with intensity-modulated whole pelvis radiation therapy in women with gynecologic malignancies. Gynecol Oncol 2001;82:456-63
- Portelance L, Chao KS, Grigsby PW, Bennet H, Low D. Intensity-modulated radiation therapy (IMRT) reduces small bowel, rectum and bladder doses in patients with cervical cancer receiving pelvic and para-aortic irradiation. Int J Radiat Oncol Biol Phys 2001;51:261-6.
- Mundt AJ, Lujan AE, Rotmensh J, et al. Intensity modulated whole pelvic radiotherapy in women with gynecologic malignancies. Int J Radiat Oncol Biol Phys 2002;52:1330-7.
- Brixey CJ, Roeske JC, Lujan AE, et al. Impact of Intensity modulated radiotherapy on acute hematologic toxicity in women with gynecologic malignancies. Int J Radiat Oncol Biol Phys 2002;54:1388-96.
- Gerszten K, Colonello K, Heron DE, Lalonde RJ, Fitian ID, Comerci JT, Selvaraj RN, Varlotto JM. Feasibility of concurrent cisplatin and extended field radiation therapy (EFRT) using intensity-modulated radiotherapy (IMRT) for carcinoma of the cervix. Gynecologic Oncology 2006; 102(2):182-8. Epub 2006 Mar 3.