2018
5
Autores:
M. Parra, N. Lagos, M. Levancini, M. Villarroel, E. Pizarro, P. Vanhauwaert, S. Velasco, M. Fernandez, M. Gambacciani, N. Biglia, A. Cagnacci, S. Caruso, E. Cicinelli, V. De Leo, C. Di Carlo, M. Farris, A. Gambera, S. Guaschino, A Lanzone, AM Paoletti, N.
Tipo de documento:
Guía ClínicaMENOPAUSIA Y TERAPIA HORMONAL DE LA MENOPAUSIA LAS RECOMENDACIONES 2018 DE LA UNIDAD DE ENDOCRINOLOGÍA GINECOLÓGICA DE CLÍNICA ALEMANA DE SANTIAGO -SOCIEDAD ITALIANA DE LA MENOPAUSIA Y LA SOCIEDAD CHILENA DE ENDOCRINOLOGÍA GINECOLÓGICA
Contenido del documento:
RESUMEN
PALABRAS CLAVE:
SUMMARY
In the last decade, the risk benefits ratio of MHT has been evaluated mainly in terms of cardiovascular risk. Present Consensus Statement is largely inspired by the Global Consensus on Menopausal Hormone Therapy in 2013 and 2016 by leading global menopause societies (The American Society for Reproductive Medicine, The Asia Pacific Menopause Federation, The Endocrine Society, The European Menopause and Andropause Society, The International Menopause Society, The International Osteoporosis Foundation and The North American Menopause Society). The aim of these Recommendations is to provide a simple and updated reference on postmenopausal MHT. The term MHT typically includes estrogen replacement therapy (ERT) and estrogen-progestogen therapy (EPT). EPT can be sequential (Seq) when progestogen is added to ERT for 10-14 days a month, or continuous combined (CC) when progestogen is administered continuously every day along with a fixed amount of estrogen. MHT also includes Tibolone and the Tissue Selective Estrogen Complex (TSEC).
KEY WORDS:
INTRODUCCIÓN
En la última década, la relación de riesgos y beneficios de la THM se ha reevaluado principalmente en relación con el riesgo cardiovascular. Este documento de consenso se inspira principalmente en el Consenso Global sobre Terapia Hormonal de la menopausia de 2013 y 2016 por las principales sociedades de menopausia del mundo (Sociedad Estadounidense de Medicina Reproductiva, Federación de Menopausia de Asia Pacífico, Sociedad Endocrina, Sociedad Europea de Menopausia y Andropausia, Sociedad Internacional de Menopausia, Fundación Internacional de Osteoporosis y la Sociedad Norteamericana de Menopausia) y las recomendaciones de la Sociedad Chilena de Endocrinología Ginecológica y Orientaciones Técnicas de la mujer en Climaterio del MINSAL).
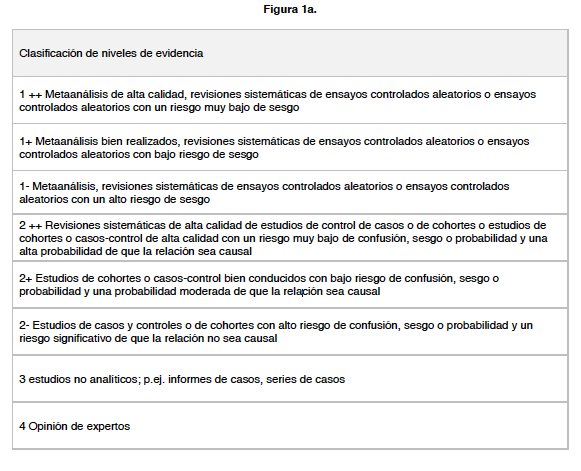
El objetivo de estas Recomendaciones es proporcionar una referencia simple y actualizada sobre la THM posmenopáusica. El término THM típicamente incluye terapia hormonal de la menopausia de estrógeno (ERT) y terapia de estrógeno y progestágeno (EPT). EPT puede ser secuencial (Seq) cuando se agrega progestágeno a ERT durante 10-14 días al mes, o combinado continuo (CC) cuando se administra progestágeno continuamente todos los días junto con una cantidad fija de estrógeno. En el lenguaje cotidiano, la THM también incluye Tibolona y el Complejo Estrogénico Tejido-Selectivo, TSEC. Las definiciones de los tipos de evidencia utilizados en esta guía se detallan en el “Clinical Governance Advice n.º 1 del Royal College of Obstetricians and Gynaecologists” La Figura 1 muestra las definiciones de niveles de evidencia (<1 ++> a <4>) y grados de recomendaciones ([A], [B], [C] o [D]) utilizados al evaluar el valor de los datos y la fortaleza de las recomendaciones en cada sección. Siempre que sea posible, las recomendaciones se basan y se relacionan con la evidencia que las respalda, a menos que no haya pruebas de buena calidad. Los puntos donde se emitió el asesoramiento en ausencia de pruebas sólidas, pero basadas en una amplia experiencia, se anotan como puntos de buenas prácticas.
PRINCIPIOS GENERALES
• La menopausia es el momento en que ocurre la última menstruación espontánea que marca el término de la vida fértil de la mujer, y se establece como diagnóstico retrospectivamente, cuando ha transcurrido un año. El climaterio es la etapa en la vida de la mujer que se inicia con la declinación de la función ovárica y se prolonga hasta la senectud. Esto conlleva un déficit hormonal con o sin sintomatología y/o riesgos variables, en cuyos casos la terapia hormonal de la menopausia es la mejor opción de reposición esteroidal, si no existe contraindicación (Tabla 1).
• La THM debe considerarse parte de un manejo clínico integrado que incluya recomendaciones de estilo de vida, dieta y ejercicio físico. <2+>[B] junto con suspender el consumo de tabaco [A]. (1-6) • Los cambios hormonales que acompañan a la menopausia están asociados con aumentos en la grasa corporal total y grasa abdominal, incluso en mujeres delgadas. [B]
• El aumento absoluto del peso en la edad media de la vida es multifactorial, predominando la edad (0,5 kg por año) y los factores ambientales. La menopausia determina un cambio desfavorable en la distribución adiposa corporal, pero el cambio de peso no es atribuible a ella [B]. Algunos estudios controlados han mostrado que el aumento de peso y la distribución adiposa corporal puede variar según el tipo de THM empleada, en comparación con ausencia de THM. (7,8) Los beneficios en composición corporal se pierden al suspender la THM. (9)
• Mantener una dieta saludable y evitar el exceso de ingesta calórica, combinado con la actividad física, son componentes importantes del control de peso.
• La acumulación de grasa abdominal en la menopausia se mejora por terapia de estrógenos, con una reducción en masa grasa total, sensibilidad mejorada a la insulina y una menor tasa de desarrollo de diabetes tipo 2. [A] (10-17). Es recomendable utilizar una medida estandarizada de la circunferencia de la cintura como la antropometría fundamental de la composición corporal (18).
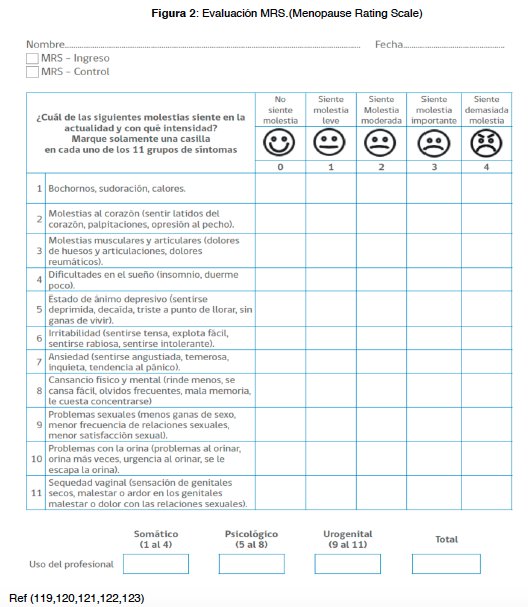
• Las normas publicadas en la actualidad, incluidas las Orientaciones Técnicas de la mujer en Climaterio del MINSAL (18), promueven que la THM no se debe prescribir sin una indicación clara (Tabla 2). Esta es la mejor opción terapéutica para síntomas vasomotores y la sequedad vaginal. Una manera de saber si la paciente tiene o no molestias reales objetivables que alteren su calidad de vida (QoL) es realizar la encuesta de MRS. En ella se presentan un conjunto de síntomas que forman parte del síndrome climatérico y que son susceptibles de ser mejorados. Según estas normas, cuando una mujer presenta puntajes altos se le debe ofrecer un tratamiento. (tabla 3) (tabla 4) (tabla 5) (17,19)
• Varias sociedades, incluida la Sociedad Chilena de Endocrinología Ginecológica, considerando una gran cantidad de nuevas evidencias, que ha arrojado nuevos datos, principalmente sobre los beneficios de la THM iniciada durante la ventana de oportunidad, los riesgos aceptables de ésta y los riesgos de no usarla o suspenderla sin causa justificada (20-25) han promovido en los congresos de la especialidad la ampliación de las indicaciones de terapia hormonal, incluyendo aquellas mujeres con riegos de desarrollar algunas patologías específicas, como osteoporosis, enfermedad coronaria, demencia e incluso a mujeres asintomáticas, que conociendo los beneficios de la THM deseen usarla (26-28).
• La relación riesgo/beneficio de la THM no es absoluta e inequívoca, sino que varía de acuerdo con la selección de las mujeres, el momento de inicio, la dosis y el tipo de THM. (29)
• El médico tratante debe explicar claramente los beneficios y riesgos de la THM, utilizando números absolutos en lugar de porcentajes derivados de riesgos relativos (RR), odds ratio (OR), que a menudo generan incertidumbre o temores infundados al sobre estimar relaciones de riesgo. Lo más adecuado y deseable es que sea a través de material escrito. No es necesario obtener un formulario de consentimiento informado por escrito y firmado por la paciente. (29)
• THM incluye una variedad de compuestos diferentes, estrógenos, progestágenos, combinaciones de estrógenos más progestinas, tibolona y la combinación TSEC que consiste en ECE asociado a un SERM (Bazedoxifeno, por ejemplo). Todos estos compuestos, con diferentes dosis y vías de administración, pueden tener múltiples beneficios, pero pueden tener diferentes perfiles de riesgo (Tabla 6). Las notorias diferencias entre las diversas opciones de THM hacen conveniente evitar referirse a ellas como “efecto de clase”, ya que este concepto podría inducir a que médicos y usuarias piensen que son todas iguales y equivalentes (29). Precisamente las recomendaciones de individualizar la terapia se refieren a conocer en profundidad las características de cada opción, para proponer la que más beneficie al caso individual.
• La THM es el tratamiento más eficaz para el síndrome climatérico, desde los síntomas vasomotores hasta el SGM. Otros síntomas climatéricos como dolor músculo esquelético, trastornos del estado de ánimo, alteraciones del sueño, cambio en la libido, disminución de la QoL que pueden mejorar con la THM. (tabla 3) (29)
• La THM está esencialmente indicada para mujeres sintomáticas menores de 60 años, o dentro de 10 años desde la menopausia, sin contraindicaciones (tabla 6), (figura 1) (29), aunque como se mencionó con anterioridad la condición de asintomática se está reconsiderando y también podría abarcar a mujeres asintomáticas que conociendo sus riegos/beneficios deseen utilizarla para eventual disminución de algunas enfermedades crónicas. (26,27,28)
• La selección de las pacientes candidatas a iniciar THM cuando se encuentran en la perimenopausia o en la etapa de posmenopausia temprana es lo ideal, para mantener los efectos de los estrógenos endógenos que solo un inicio temprano de THM puede garantizar. De hecho, la presencia de algunos síntomas menopáusicos, como los vasomotores, se relaciona con un mayor riesgo de desarrollar enfermedades crónicas, lo que lleva a un uso más apropiado de THM (29)
• La relación riesgo / beneficio es más favorable en mujeres posmenopáusicas jóvenes que comienzan la THM antes de los 60 años o dentro de los 10 años desde la menopausia (Fig.2) (29)
• En general, no existe una formulación terapéutica única que sea ideal para todas las mujeres y todas las edades. Cada producto o combinación dada puede tener características peculiares pueden ser consideradas en el manejo personalizado. Todas las formulaciones disponibles permiten una personalización dinámica, eligiendo tipo de estrógeno y progestina, dosis de cada uno, vía de administración, de acuerdo con las características y preferencias de la paciente para obtener la mejor eficacia, maximizando la seguridad de la prescripción de THM. (29)
• Los estudios observacionales demuestran que la THM transdérmica sistémica no aumenta el riesgo de eventos tromboembólicos o accidente vasculares encefálicos en la población general. (29)
• La THM se puede prescribir en diferentes dosis de acuerdo con las características de la mujer (Tabla 6). Se puede recomendar reducir las dosis con el aumento de la edad o cambiar vía de administración. La dosis más baja recomendada, es aquella que mantenga una buena eficacia en el control de los síntomas de la menopausia en la usuaria, con un menor perfil de riesgo. (29)
• Se recomienda personalizar la THM según los síntomas prevalentes, las características individuales y las investigaciones de laboratorio y/o de imágenes adecuadas, los antecedentes personales y familiares, las preferencias y las expectativas de cada mujer. (29)
• Las mujeres tratadas con THM deberían tener al menos una consulta médica anual para la reevaluación de los síntomas y exámenes apropiados de acuerdo con las características individuales. Actualmente no hay indicación de un control mamográfico más frecuente que el recomendado por las guías de cada país para las mujeres que no utilizan THM. (29)
• No hay razones para establecer limitaciones obligatorias en la duración de la THM. La decisión de continuar, cambiar o detener la THM depende de los objetivos clínicos, las características individuales y la evolución de cada paciente. (23,29)
• La mayoría de las mujeres posmenopáusicas pueden usar THM. Aquellas mujeres que presenten contraindicaciones deben recibir consejería para usar terapias alternativas seguras, eficaces y científicamente validadas. (29) Insuficiencia ovárica prematura Las mujeres con insuficiencia ovárica prematura (IOP) espontánea o iatrogénica, antes de los 40 años, tienen un conocido mayor riesgo de enfermedad cardiovascular, osteoporosis y demencia. [B] Estas mujeres se benefician de la THM incluso usando preparaciones anticonceptivas orales que contienen que contienen estradiol natural o etinil- estradiol, al menos hasta la edad normal de la menopausia natural, a menos que existan contraindicaciones (categorías 3 o 4) para el uso de anticoncepción hormonal combinada (AHC). Aunque no se dispone de datos de los estudios comparativos, es muy probable que las preparaciones anticonceptivas formuladas con estradiol, en reemplazo de etinilestradiol, pueden ofrecer un mejor perfil de seguridad metabólica. <2 +> (30-36)
DOSIS Y COMBINACIONES
• La THM debe prescribirse a la dosis, duración, régimen y la vía de administración apropiados a cada caso individual, comenzando con dosis clasificadas como “bajas” (tabla 6) y en caso necesario, aumentarla hasta lograr controlar suficientemente la sintomatología de cada mujer (Tabla 8). Se ha demostrado claramente que los estrógenos en dosis bajas pueden ejercer efectos beneficiosos en la gran mayoría de las mujeres sintomáticas, manteniendo los efectos de mantención de masa ósea evaluado mediante densitometrías. Sin embargo, no hay datos disponibles sobre riesgo de fractura en pacientes usuarias de dosis bajas. (37). La Tibolona y TSEC también han demostrado un efecto protector de masa ósea.
La Tibolona en dosis de 1,25 mg ha mostrado disminución de fracturas en mujeres mayores (37,38). • En mujeres con útero y menopausia natural, la administración de estrógenos debe combinarse con un progestágeno para prevenir la hiperplasia y cáncer de endometrio. La THMCC tiene un mejor perfil de seguridad endometrial a largo plazo que las preparaciones secuenciales.
• El uso de un DIU medicado con Levonorgestrel (LNG- SIU) es útil para la protección endometrial, aunque no hay datos disponibles de su uso a largo plazo (29)
• La mayoría de las mujeres histerectomizadas deben recibir solo ERT. Algunas mujeres hiterectomizadas con diagnóstico de endometriosis podrían beneficiarse al agregar una progestina. Un estudio controlado ha mostrado que la progesterona micronizada sola, en dosis mayores, hasta 300 mg por noche es eficaz para reducir síntomas vasomotores y mejorar la calidad del sueño. (39) • El estudio WHI demostró que una progestina en particular, la MPA, juega un papel esencial para la protección endometrial, pero tiene efectos negativos sobre el riesgo cardiovascular y aumenta la incidencia de cáncer de mama. Otras progestinas, como la progesterona natural, pueden ser neutros sobre la incidencia del cáncer de mama y el riesgo cardiovascular. (38,40)
• La elección de progestina es fundamental, ya que los efectos colaterales y la intolerancia a ellas son una de las principales causas de la interrupción de la THM. Una historia personal de depresión, síndrome premenstrual, síndrome disfórico premenstrual, aumento de la tensión y la densidad mamaria (marcador del riesgo de cáncer de mama en caso de darse en forma natural, no con el uso de terapia), y presencia de diabetes o síndrome metabólico, hacen recomendable evitar el uso de algunas progestinas o el uso de progestinas sistémicas, en favor del uso de progesterona micronizada, dihidrogesterona u otra progestina sintética que han mostrado mejor seguridad. No se recomienda el uso de acetato de medroxiprogesterona (MPA) oral para THM ya que además de los informes desfavorables en cáncer de mama y tromboembolismo venoso informados en el estudio WHI, hay datos de modificación del perfil lipídico, reducción de la tolerancia a la glucosa y disminución de la sensibilidad a la insulina. (38).
La MPA hoy está en desuso.
• El uso de dosis bajas de ECE asociado con un SERM o la Tibolona, son una alternativa para el uso en pacientes con mastodinia o densidad mamaria aumentada. La tibolona (41) y la combinación TSEC de ECE 0,45 mg / BZA 20 mg no aumentan la densidad mamaria e incluso podrían disminuirla. Se necesitan más estudios para evaluar la posible reducción de la incidencia de cáncer de mama en mujeres tratadas con tibolona y TSEC. (38) • La administración de andrógenos debe reservarse para las mujeres con signos clínicos de insuficiencia androgénica que no responden a la THM convencional (tabla 6). En mujeres ooforectomizadas o con insuficiencia suprarrenal, la terapia de andrógenos puede tener efectos positivos, principalmente en la calidad de vida y la sexualidad. Actualmente no hay preparaciones de andrógenos formalmente aprobadas para tratamientos en mujeres y los preparados para hombres no están aprobados para ser usados en mujeres. (38) Los expertos adaptan preparados para hombres que se recetan “off label”, condición que debe ser informada en caso de usarlos (38).
CONTRAINDICACIONES
Las contraindicaciones de THM se informan en la Tabla 7 (A). Otras afecciones no son contraindicaciones, como cánceres ginecológicos, carcinoma cervical tipo escamoso, y todos los demás cánceres no hormono dependientes (excluyendo sarcomas uterinos, tumores ováricos endometrioides). Otras condiciones como miomas uterinos, endometriosis, diabetes mellitus, hipercolesterolemia, hipertrigliceridemia, hipertensión, obesidad y tabaquismo, no son contraindicaciones absolutas, pero deben conducir a una personalización estricta del tipo, dosis y vía de administración de THM, usando dosis bajas, y prefiriendo la vía de uso transdérmica. (B) (38,42-45)
• Efectos colaterales La incidencia y magnitud de efectos colaterales depende de la dosis, el tipo y la vía de administración de THM (tabla 8)
• Los sangrados uterinos anormales son frecuentes en los primeros meses de tratamiento y pueden inducir un aumento injustificado en procedimientos diagnósticos (ej: histeroscopias, biopsias). Las dosis de estrógeno se correlacionan con náuseas, distensión abdominal, dolor pélvico, edema, aumento del peso corporal. La administración de progestinas puede inducir cefalea, irritabilidad, depresión, síndrome premenstrual / desorden disfórico premenstual (PMS / PMDD). Con la THM secuencial puede producirse inestabilidad del estado de ánimo durante la fase de progestina, principalmente en mujeres con antecedentes personales de PMS / PMDD.
• Los efectos clínicos son diferentes con distintas progestinas en diferentes mujeres y es razonable realizar varios intentos, privilegiando el uso de una progestina neutra o una THMCC, hasta encontrar la adecuada para cada mujer.
EFECTOS A CORTO PLAZO DE LA THM
1.- Síntomas vasomotores La THM es la terapia más eficaz y de primera elección para los síntomas vasomotores y el síndrome genitourinario de la menopausia. Otras alteraciones asociadas a los síntomas vasomotores, como el estado de ánimo, la irritabilidad, el insomnio pueden mejorar durante la THM. La THM personalizada (incluidas posibles dosis bajas de testosterona) puede mejorar la calidad de vida y la sexualidad de las mujeres posmenopáusicas. (38) <1++>.
La decisión de continuar la THM después de los 60 años o iniciar con más de 10 años de ocurrida la menopausia, debe ser el resultado de una evaluación clínica cuidadosa, observando los potenciales riesgos cardiovasculares y tromboembólicos. Considerando que el riesgo tromboembólico aumenta con la edad. (46-49). se considera prudente reducir las dosis a mayor edad, aunque no hay evidencia categórica que permita establecer una dosis óptima para múltiples objetivos. Si se usan estrógenos en mujeres mayores de 65 años, se recomienda el uso de la vía transdérmica para su administración. Con la excepción de la MPA, la elección de otras progestinas no parece tener impacto sobre riesgos trombóticos y se basa en los efectos sobre los diversos receptores esteroidales, que caracterizan a cada una de ellas. Por regla general se recomienda la progesterona micronizada continua oral o vaginal, para la mayoría de los casos. El uso de progestina debe evaluarse cuidadosamente prefiriendo aquellas más similares a la natural, como la progesterona micronizada continua oral o vaginal.
2.- Síndrome genitourinario de la menopausia (GSM) La administración de THM mejora todos los síntomas derivados de la atrofia urogenital. La terapia vaginal de ERT es el tratamiento de elección para el tratamiento del GSM aislado de sintomatología sistémica, o agregada cuando la terapia sistémica no es suficiente para mejorar el GSM. Los distintos preparados vaginales muestran una eficacia similar y no requieren administración de progestina para protección endometrial ya que tanto la dosis como el tipo de estrógeno (estradiol, estriol o promestrieno) no inducen una estimulación endometrial significativa. Un nuevo SERM, el Ospemifeno, está disponible como tratamiento oral para GSM, con efectos similares a los de las preparaciones de estrógenos locales. < 1+> (50,51,52)
3.- Efectos musculo esqueléticos Además del conocido efecto regulador en la remodelación ósea, la THM puede tener efectos positivos en los músculos, el tejido conectivo, los discos intervertebrales, los cartílagos, la artrosis y el dolor periarticular. (38,40)
EFECTOS A LAGO PLAZO DE LA THM
1.- Osteoporosis posmenopáusica La dosis estándar de THM es eficaz en el control de la tasa de recambio óseo, y prevención de la pérdida ósea en mujeres posmenopáusicas. Se ha demostrado que la THM reduce significativamente el riesgo de fracturas de cadera, vertebrales y otras relacionadas con la osteoporosis en mujeres posmenopáusicas. Incluso las dosis más bajas de THM pueden reducir el recambio óseo y prevenir la disminución de la densidad mineral ósea.
La THM preserva la arquitectura y densidad mineral ósea hasta dos años después de suspendida (53) Sin embargo, no hay datos disponibles sobre riesgo de fractura en usuarias de dosis bajas no estándares de THM estrogénica. La THM está indicada para la prevención de la osteoporosis y fracturas en mujeres con menopausia y con POI. Aunque el estudio WHI muestra eficacia en reducción de fracturas cuando se inicia hasta los 79 años, los datos actuales indican que hasta los 60 años o dentro de los 10 años posteriores a la menopausia son márgenes seguros para el inicio de la THM.
El inicio o la continuación de la THM después de los 60 años con la única indicación de prevención de fracturas por osteoporosis debe tener en cuenta el riesgo/ beneficio calculado individualmente y los posibles efectos a largo plazo de la THM en comparación con otros medicamentos aprobados. En pacientes mayores de 60 años no está indicado el inicio de la THM para la prevención única de la osteoporosis. La THM es la única terapia que ha demostrado que ser efectiva en la reducción de la fractura en mujeres posmenopáusicas normales no seleccionadas por su riesgo de fractura. (<1 +>) (54- 60) 2.- Enfermedad cardiovascular La selección del paciente y el inicio precoz de la THM son esenciales para determinar los efectos neutros o positivos de las hormonas en el sistema cardiovascular. Estos dos puntos pueden explicar los resultados contradictorios en diferentes estudios.
La THM disminuye el riesgo de diabetes y ejerce beneficios adicionales sobre otros factores de riesgo cardiovascular, como el perfil lipídico, la presión arterial, el peso corporal y la distribución de grasa corporal y el síndrome metabólico. <1 ->. (61,62,63). La gran mayoría de los estudios clínicos observacionales y aleatorizados demuestran los beneficios potenciales de la THM en la reducción de la enfermedad coronaria, la mortalidad de causa cardiovascular y la mortalidad total, si se inicia en mujeres sintomáticas, sanas, menores de 60 años o dentro de los 10 años de la menopausia (concepto de «ventana de oportunidad»). Este concepto también ha sido cuestionado en cuanto al límite de años y momento de inicio.
El estudio KEEPS (The Kronos early estrogen prevention study (64) sugiere que el mejor momento para el inicio de la THM, con el propósito de reducir índices de daño cardiovascular, debiese estar dentro de los primeros 6 años de ocurrida la menopausia. Por otra parte, estudios recientes han cuestionado el límite de años sugiriendo que podría prolongarse, al demostrar asociación entre la suspensión de la THM y el incremento de riesgo cardiovascular (23) Además, existe nueva evidencia que sugiere que esta “ventana de oportunidad”, para obtener un efecto positivo sobre otras patologías como las demencias, se iniciaría antes de producirse la menopausia (65,66). La THM combinada iniciada a las dosis estándares en mujeres mayores de 65 años o con enfermedad cardiovascular previa, puede aumentar el riesgo cardiovascular. <1 + > (A) ERT parece ser más beneficioso que EPT.
Los estudios observacionales, los ECA y el metaanálisis demuestran que la ERT reduce la mortalidad total y la mortalidad cardíaca en las mujeres que inician la THM con edad inferior a 60 años o en los 10 años posteriores a la menopausia. (A) Los resultados obtenidos con diferentes combinaciones de EPT son más equívocos y dependen del tipo y la dosis de progestina. La progesterona natural o algunas progestinas, como la drospirenona con propiedades antimineralocorticoides, pueden tener beneficios adicionales sobre el riesgo cardiovascular en comparación con otras progestinas sintéticas, destacando que la elección de la progestina es crítica en el efecto final de la THM. <1 ++) (67,68,69) 4.- Capacidad cognitiva. Los estudios observacionales demuestran que la THM en mujeres jóvenes después de la menopausia quirúrgica puede ejercer efectos cognitivos beneficiosos. Los estudios observacionales muestran que la THM se asocia con un menor riesgo de demencia y de enfermedad de Alzheimer. Por el contrario, el inicio tardío de la THM en mujeres mayores de 69 años no mejora los síntomas de la demencia ni disminuye la progresión de la enfermedad. <2+ A 3> (A) (70).
Se ha observado un mayor riesgo de demencia con CE + MPA oral en la dosis estándar en mujeres de edad avanzada. Este efecto no se evidenció utilizando el único ERT con ECE oral. El tiempo de inicio de THM es crítico y una terapia temprana iniciada antes de los 60 años o dentro de los 6-10 años posteriores a la menopausia puede mantener los efectos beneficiosos atribuidos al estrógeno endógeno. Sin embargo, la THM, no cuenta con evidencia para recomendar su inicio con el único propósito de prevenir la demencia. <1 +>(B) (71,72). 5.-Cáncer de mama El grado de asociación entre la THM y el cáncer de mama es controvertido. No se ha demostrado riesgo atribuible en terapias de estrógenos solos, pero si en EPT. En el estudio WHI, la tasa cáncer de mama fue de 30 casos por cada 10.000 años mujer en los grupos placebo; la administración ECE sin oposición progestínica en mujeres histerectomizadas por 7 años no aumentó el riesgo de cáncer de mama (-7 casos por 10.000 años mujer) mientras que para las mujeres que usaron EPT fue de +8 por cada 10.000 años mujer, sobre las tasas observados en grupos placebo. 4>.
Los estudios observacionales europeos muestran que la administración de estradiol solo o en asociación con progesterona micronizada o dihidrogesterona no se asocia con un aumento significativo en el riesgo de cáncer de mama, como con otras progestinas sintéticas. <1 +>. No hay diferencia entre el uso de estrógenos orales versus transdérmicos < 2+> (73,74,75,76,77,78,79) La asociación de ECE con bazedoxifeno (BZA) potencialmente podría reducir o eliminar el riesgo de cáncer de mama, como muestran datos preliminares de estudios in vitro y en animales. Sin embargo, no hay estudios clínicos observacionales disponibles. El riesgo de cáncer de mama observado en mujeres tratadas con EPT declina rápidamente después del suspender la THM, y luego de 5 años el riesgo es similar al de la población no tratada. (B) El cáncer de mama es una contraindicación para la THM.
Sin embargo, las terapias con estrógenos vaginales locales pueden considerarse una opción en mujeres que no responden a terapias no hormonales y que no estén recibiendo terapia concomitante de inhibidores de la aromatasa. (80-83) Un estudio anidado, de 18 años de registros, no mostró mas recurrencias con el uso de estrógenos vaginales en pacientes tratadas con tamoxifeno o inhibidores de aromatasas (84) El Ospemifeno puede ser prescrito después del cáncer de mama, al finalizar todos los tratamientos hormonales o de quimioterapia. No hay datos de seguridad en la literatura sobre el uso de fitoestrógenos en sobrevivientes de cáncer de mama y por lo tanto no está recomendado. (29, 79, 86,87,88) 6.-Cáncer endometrial La ERT sin oposición induce una estimulación endometrial relacionada con la dosis con un mayor riesgo de hiperplasia y cáncer de endometrio, mientras que EPTCC reduce el riesgo de carcinoma endometrial. (A)
Por el contrario, el uso a largo plazo (3-5 años) de EPT secuencial puede inducir un aumento leve pero significativo del cáncer de endometrio. < 1 + a 1++> (89,90,91) Menores dosis THM reducen el estímulo proliferativo sobre el endometrio, reduciendo además la tasa de sangrados. El dispositivo (sistema) intrauterino liberador de levonorgestrel 52 mg, (Mirena®) puede ofrecer beneficios en términos de un menor impacto metabólico. <1 + > (90,91) Sin embargo, las progestinas, incluso el uso de DIU-LNG 52 mg, parecen estar asociadas con un mayor riesgo de cáncer de mama en comparación con el estrógeno solo, que no aumentaría el riesgo. El antecedente de cáncer de endometrio tipo I sensible a hormonas es una contraindicación relativa para la THM, pero puede ser una indicación de uso de progestágenos solos o combinados con estrógenos (92) El uso de THM debe evaluarse caso a caso para pacientes una vez tratadas en estadios precoces (I y II) sin evidencia de enfermedad extrauterina (93) No hay datos de seguridad en la literatura sobre el uso de fitoestrógenos en los sobrevivientes de cáncer de endometrio.
Más recientemente, se ha introducido un régimen TSEC que combina el SERM, bazedoxifeno, con ECE como una alternativa sin progestágenos para THM en mujeres con útero. <1 +> (94-98). 7.- Cáncer colorrectal La THM reduce el riesgo de cáncer colorrectal, con 6 casos por 10.000 años mujer. (B) (99-101). Este efecto ha sido descrito con EPT, pero los datos son inconsistentes con respecto a ERT. (A) <+1 > la THM no debe ser usada para prevenir el cáncer de colon (D). (59,102) 8.-Tromboembolia venosa El riesgo de tromboembolismo venoso inducida por la THM depende de la edad y del IMC (es mínimo hasta antes de los 60 años). El riesgo es mayor en los primeros 6-12 meses de administración de THM. La asociación TSEC de ECE y BZA no ha mostrado aumentar el riesgo tromboembólico en comparación con el placebo (103) pero aún aplican las mismas consideraciones de precaución para las otras THM orales. La terapia oral con estrógenos está contraindicada en pacientes con historia personal de tromboembolismo venoso o trombofilia. [A] (104,105,106,107) Para el antecedente de un episodio de trombosis por causas no persistentes puede considerarse la vía transdérmica como más segura que la vía oral; los estudios observacionales no han encontrado ningún aumento en el riesgo de tromboembolismo venoso con ERT transdérmica (108,109,110). (B) El tipo de progestinas modula el riesgo de tromboembolismo venoso. (111-113) Para evaluar el riesgo tromboembólico son esenciales la historia familiar, personal y el examen físico. (C). No hay indicación para la pesquisa sistemática de trombofilia antes de la prescripción de THM. El estudio selectivo de detección puede tener un rol en pacientes seleccionados, por ejemplo: antecedente de vasculitis o de episodio único de trombosis sin causa persistente. (D) 9.- Eventos arteriales cerebrales El riesgo de accidente vascular encefálico está relacionado con la edad (114) y se estima en 1 caso por cada 1.000 años-mujer. (113,115) No hay un aumento significativo en el riesgo de accidente vascular encefálico en las mujeres sanas o con baja morbilidad que comienzan la THM antes de los 60 años o dentro de los 10 años desde el inicio de la menopausia (ventana de oportunidad). Los datos obtenidos con las actuales dosis y tipos de THM son alentadores. (116,117)
CONCLUSIONES .
Toda mujer en etapa de climaterio debe recibir información sobre la THM, sus potenciales beneficios y riesgos.
• La THM puede prescribirse de no existir contraindicación a mujeres sintomáticas. También puede considerarse su indicación a mujeres asintomáticas que conociendo sus riesgos/beneficios deseen utilizarla • La seguridad de THM depende en gran medida de la cuidadosa selección, aplicación y recomendaciones vigentes de indicación y contraindicación.
• En mujeres sintomáticas antes de la edad de 60 años o dentro de los 10 años del inicio de la menopausia, los beneficios de la THM superan todos los riesgos estudiados. • Las preparaciones de THM con dosis bajas de estrógenos mantienen los efectos beneficiosos sobre los síntomas y la osteoporosis, reduciendo los posibles efectos colaterales y riesgos.
• La progesterona micronizada y algunas progestinas, como la dihidrogesterona y la drospirenona, pueden reducir algunos efectos colaterales, aumentando los beneficios en ciertas mujeres.
• La asociación de ECE y BZA puede contrarrestar el efecto estrogénico sobre el endometrio, la mama y el síndrome premenstrual, manteniendo la eficacia sobre los síntomas y la prevención de la osteoporosis, con un muy buen perfil metabólico, evitando la administración de progestina.
• Para el tratamiento del GSM aislado, el tratamiento de elección es la terapia local con estrógenos vaginales ERT u Ospemifeno oral, de acuerdo a la necesidad de cada mujer.
BIBLIOGRAFÍA
1. Sternfeld B, Wang H, Quesenberry CP Jr, et al. Physical activity and changes in weight and waist circumference in midlife women: findings from the Study of Women’s Health Across the Nation. Am J Epidemiol 2004; 160:912–22
2. Guthrie JR, Dennerstein L, Dudley EC. Weight gain and the menopause: a 5-year prospective study. Climacteric 1999; 2:205–11.
3. Wing RR, Matthews KA, Kuller LH, MeilahnEN, Plantinga PL. Weight gain at the time of menopause. Arch Intern Med 1991; 151:97–102.
4. Jacoby E, Goldstein J, Lopez A, Nunez E, Lopez T. Social class, family, and life-style factors associated with overweight and obesity among adults in Peruvian cities. Prevent Med 2003; 37:396–405.
5. Hajian-Tilaki KO, Heidari B. Prevalence of obesity, central obesity and the associated factors in urban population aged 20-70 years, in the north of Iran: a population-based study and regression approach. Obes Rev 2007;8:3–10
6. Fonken LK, Workman JL, Walton JC, et al. Light at night increases body mass by shifting the time of food intake. Proc Natl AcadSci USA 2010;107:18664–9
7. Espeland MA, Stefanick ML, Kritz-Silverstein D, Fineberg SE, Waclawiw MA, James MK, Greendale GA. Effect of postmenopausal hormone therapy on body weight and waist and hip girths. Postmenopausal Estrogen-Progestin Interventions Study Investigators. J Clin Endocrinol Metab. 1997 May;82(5):1549-56.
8. Leeners B, Geary N, Tobler PN, Asarian L. Ovarian hormones and obesity. Hum Reprod Update. 2017 May 1;23(3):300-321.)
9. Papadakis GE, Hans D, Rodriguez EG, Vollenweider P, Waeber G, Marques-Vidal P, Lamy O. Menopausal Hormone Therapy Is Associated With Reduced Total and Visceral Adiposity: The OsteoLaus Cohort. J Clin Endocrinol Metab. 2018 May 1;103(5):1948- 1957
10. Grindler NM, Santoro NF. Menopause and exercise. Menopause. 2015 Dec;22(12):1351-8
11. Dubnov-Raz G, Pines A, Berry EM. Diet and lifestyle in managing postmenopausal obesity. Climacteric 2007;10(Suppl 2):38–41
12. Yuksel H, Odabasi AR, Demircan S, et al. Effects of oral continuous 17beta-estradiol plus norethisterone acetate replacement therapy on abdominal subcutaneous fat, serum leptin levels and body composition. GynecolEndocrinol 2006; 22:381–7.
13. Davis SR, Walker KZ, Strauss BJ. Effects of estradiol with and without testosterone on body composition and relationships with lipids in postmenopausal women. Menopause 2000; 7:395– 401
14. Chen Z, Bassford T, Green SB, et al. Postmenopausal hormone therapy and body composition – a substudy of the estrogen plus progestin trial of the Women’s Health Initiative. Am J Clin Nutr 2005; 82:651–6.
15. Sorensen MB, Rosenfalck AM, Hojgaard L, Ottesen B. Obesity and sarcopenia after menopause are reversed by sex hormone replacement therapy. Obes Res 2001;9:622–6.
16. O’Sullivan AJ, Crampton LJ, Freund J, Ho KK. The route of estrogen replacement therapy confers divergent effectsm on substrate oxidation and body composition in postmenopausal women. J Clin Invest 1998; 102:1035–40.
17. Dos Reis CM, de Melo NR, Meirelles ES, Vezozzo DP, Halpern A. Body composition, visceral fat distribution and fat oxidation in postmenopausal women using oral or transdermal oestrogen. Maturitas2003;46:59– 68.
18. Orientaciones técnicas para la atención integral de la mujer en edad de climaterio en el nivel primario de la red de salud (APS). Programa Nacional Salud de la Mujer Departamento de Ciclo Vital. División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública. Ministerio de Salud de Chile. Primera Edición: Enero 2014. ISBN: 978-956-348-050-4 http://www.minsal.cl/sites/default/files/files/OTC LIMATERIOinteriorValenteindd04022014.pdf
19. Nelson LM. Clinical practice.Primary ovarian insufficiency. N Engl J Med 2009; 360:606 14.
20. Manson JE, Aragaki AK, Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Chlebowski RT, Howard BV, Thomson CA, Margolis KL, Lewis CE, Stefanick ML, Jackson RD, Johnson KC, Martin LW, Shumaker SA, Espeland MA, Wactawski-Wende J; WHI Investigators. Menopausal Hormone Therapy and Long-term All-Cause and Cause-Specific Mortality: The Women’s Health Initiative Randomized Trials. JAMA. 2017; 12;318(10):927-938.
21. Schierbeck LL, Rejnmark L, Tofteng CL, Stilgren L, Eiken P, Mosekilde L, Køber L, Jensen JE. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial.BMJ. 2012: 9;345:e6409.
22. Canonico M, Oger E, Plu-Bureau G, Conard J, Meyer G, Lévesque H, Trillot N, Barrellier MT, Wahl D, Emmerich J, Scarabin PY; Estrogen and Thromboembolism Risk (ESTHER) Study Group. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation. 2007: 20;115(7):840-5.
23. Mikkola TS, Tuomikoski P, Lyytinen H, Korhonen P, Hoti F, Vattulainen P, Gissler M, Ylikorkala O. Estradiol-based postmenopausal hormone therapy and risk of cardiovascular and all-cause mortality. Menopause. 2015 Sep;22(9):976-83.
24. Howard N. Hodis,Wendy J. Mack, Victor W. Henderson, Donna Shoupe, Matthew J. Budoff,Juliana Hwang-Levine, Yanjie Li, Feng,Laurie Dustin, Naoko Kono, Frank Z. Stanczyk, Robert H. Selzer, and Stanley P. Azen, for the ELITE Research Group* Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol.N Engl J Med. 2016; 374(13):1221-31
25. Mihir M. Sanghvi, Nay Aung, Jackie A. Cooper, Jose ´ Miguel Paiva, Aaron M. Lee, Filip Zemrak, Kenneth Fung, Ross J. Thomson, Elena Lukaschuk, Valentina Carapella, Young Jin Kim, Nicholas C. Harvey, Stefan K. Piechnik, Stefan Neubauer, Steffen E. Petersen. The impact of menopausal hormone therapy (MHT) on cardiac structure and function:Insights from the UK Biobank imaging enhancement studyPLoS ONE 2018, 13(3): e0194015
26. Lopez M. En: Ponencia THM en paciente asintomática. Postura SOCHEG. 12as Jornadas Anuales de Endocrinología ginecológica, Reproducción y Andrología- Santiago de Chile13 y 14 de abril de 2018
27. Vanhauwaert PS. Últimos análisis del WHI y las consecuencias de no dar terapia hormonal de la menopausia. En: Ponencia congreso de la Sociedad Argentina de Endocrinología Ginecológica y reproductiva. XII Congreso Argentino de Endocrinología Ginecológica y Reproductiva 2018. Buenos Aires 22, 23 y 24 de abril de 2018
28. De Pypere H. Is it ethical not to consider HT?. En: Ponencia, Symposium organized by CAMS Societie: A change of Heart (Netherlands and Belgium Menopause Societies). 16 World Congress on Menopause. Vancouver 6-9 Junio 2018
29. Baber RJ, Panay N, Fenton A; IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016 Apr;19(2):109-50.
30. Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol 1986;67:604–6.
31. Ostberg JE, Storry C, Donald AE, et al. A doseresponse study of hormone replacement in young hypogonadal women: effects on intima media thickness and metabolism. Clin Endocrinol 2007;66:557–64.
32. de Kleijn MJ, van der Schouw YT, Verbeek AL, Peeters PH, Banga JD, van der Graaf Y. Endogenous estrogen exposure and cardiovascular mortality risk in postmenopausal women. Am J Epidemiol. 2002 Feb 15;155(4):339-45.
33. Rocca WA, Grossardt BR, Miller VM, et al. Premature menopause or early menopause and risk of ischemic stroke. Menopause 2012;19:272–7.
34. Gallagher JC. Effect of early menopause on bone mineral density and fractures. Menopause 2007;14:567–71.
35. Rocca WA, Bower JH, Maraganore DM, et al. Increased risk of cognitive impairment or dementia in women with underwent oophorectomy before menopause. Neurology 2007;69:1074–83.
36. de Almeida DM, Benetti-Pinto CL, Makuch MY. Sexual function of women with premature ovarian failure. Menopause 2011;18:262–6
37. Brynhildsen J, Hammar M. Low dose transdermal estradiol/norethisterone acetate treatment over 2 years does not cause endometrial proliferation in postmenopausal women. Menopause 2002, 9 (2); 137-144.
38. Gambacciani M, Biglia N, Cagnacci A, Caruso S, Cicinelli E, DE Leo V, DI Carlo C, Farris M, Gambera A, Guaschino S, Lanzone A, Paoletti AM, Russo N, Vicariotto F, Villa P, Volpe A; Menopause and hormone replacement therapy: the 2017 Recommendations of the Italian Menopause Society. Italian Menopause Society (SIM). Minerva Ginecol. 2018 Feb;70(1):27-34.
39. Prior JC. Progesterone for treatment of symptomatic menopausal women. Climacteric. 2018 Aug;21(4):358-365
40. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J; Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA. 2002 Jul 17;288(3):321-33.
41. Valdivia I, Campodónico I, Tapia A, Capetillo M, Espinoza A, Lavín P.Effects of tibolone and continuous combined hormone therapy on mammographic breast density and breast histochemical markers in postmenopausal women. Fertil Steril. 2004 Mar;81(3):617-23.
42. Canonico M, Plu-Bureau G, Lowe GD, ScarabinPY. Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis. BMJ 2008;336:1227–31
43. Scarabin PY, Oger E, Plu-Bureau G; EStrogen and THromboEmbolism Risk Study Group.Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk. Lancet. 2003 Aug 9;362(9382):428-32.
44. Canonico M, Oger E, Plu-Bureau G, et al. Estrogen and Thromboembolism Risk (ESTHER) Study Group. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation 2007;115:840–5.
45. Canonico M, Fournier A, Carcaillon L, et al. Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol2010;30:340–5.
46. Boothby LA, Doering PL, Kipersztok S. Bioidentical hormone therapy: a review. Menopause 2004;11:356–67.
47. MacLennan AH, Sturdee DW. The ‘bioidentical/bioequivalent’ hormone scam. Climacteric 2006;9:1–3.
48. The Endocrine Society: Position Statement: Bioidentical Hormones, October 2006: http://www.endosociety.org.
49. Huntley AL. Compounded or confused? Bioidentical hormones and menopausal health. Menopause Int 2011;17:16–18
50. Rahn DD, Ward RM, Sanses TV, et al. Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen use in postmenopausal women with pelvic floor disorders: systematic review and practice guidelines. Int Urogynecol J 2015;26:3–13
51. Cardozo LD, Bachmann G, McClish D, Fonda D, Birgerson L. Meta-analysis of estrogen therapy in the management of urogenital atrophy in postmenopausal women: Second report of the Hormones and Urogenital Therapy Committee. ObstetGynecol1998;92:722–7.
52. Suckling J, Lethaby A, Kennedy R. Local oestrogen for vaginal atrophy ipostmenopausal women. Cochrane Database Syst Rev 2003;(4):CD001500.
53. Papadakis G, Hans D, Gonzalez-Rodriguez E, Vollenweider P, Waeber G, Marques-Vidal PM, Lamy O. J The Benefit of Menopausal Hormone Therapy on Bone Density and Microarchitecture Persists After its Withdrawal. Clin Endocrinol Metab. 2016 Dec;101(12):5004-5011.)
54. Manson JE, Chlebowski RT, Stefanick ML, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA 2013; 310:1353–68
55. de Villiers TJ, Gass MLS, Haines CJ, et al. Global Consensus Statement on Menopausal Hormone Therapy. Climacteric 2013; 16:203–4.
56. de Villiers TJ, Stevenson JC. The WHI: the effect of hormone replacement therapy on fracture prevention. Climacteric 2012; 15:263–6.
57. Bagger YZ, TankoLB, Alexandersen P, et al. Two to three years of hormone replacement therapy in healthy women have long-term prevention effects on bone mass and osteoporotic fractures: the PERF study. Bone 2004;34:728–31.
58. Ettinger B, EnsrudKE, Wallace R, et al. Effects of ultralowdosetransdermal estradiol on bone mineral density: a randomized clinical trial. ObstetGynecol 2004; 104:443–51.
59. Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P, Mol- Arts M, Kloosterboer L, Mosca L, Christiansen C, Bilezikian J, Kerzberg EM, Johnson S, Zanchetta J, Grobbee DE, Seifert W, Eastell R; LIFT Trial Investigators. The effects of tibolone in older postmenopausal women.N Engl J Med. 2008 Aug 14;359(7):697-708.
60. Lindsay R, Gallagher JC, Kagan R, Pickar JH, Constantine G. Efficacy of tissue-selective estrogen complex of bazedoxifene/ conjugated estrogens for osteoporosis prevention in at-risk postmenopausal women. FertilSteril 2009; 92:1045–52.
61. Maruthur NM, Wang N-Y, Appel LJ. Lifestyle interventions reduce coronary artery disease risk. Results from the PREMIER trial. Circulation 2009; 119:2026–31
62. Lobo RA, Davis SR, de Villiers TJ, et al. Prevention of diseases after menopause. Climacteric 2014; 17:540–56
63. Hodis HN, Collins P, Mack WJ, et al. The timing hypothesis for coronary heart disease prevention with hormone therapy: past, present and future in perspective. Climacteric 2012; 15:217–28.
64. Cintron, Dahima et al. “Effects of Oral versus Transdermal Menopausal Hormone Treatments on Self-Reported Sleep Domains and Their Association with Vasomotor Symptoms in Recently Menopausal Women Enrolled in the Kronos Early Estrogen Prevention Study (KEEPS).” Menopause (New York, N.y.) 25.2 (2018): 145–153. PMC. Web. 2 July 2018.
65. Pauline Maki. “Cognitive problems unraveled”, “Depression in the Menopausal Transition: Role of HT”, “Memory, Menopause, and Hormone Therapy” En: Ponencias 16 World Congress on Menopause. Vancouver 6-9 Junio 2018.
66. Pauline Maki. “Cognitive problems unraveled”, “Depression in the Menopausal Transition: Role of HT”, “Memory, Menopause, and Hormone Therapy” En: Ponencias 16 World Congress on Menopause. Vancouver 6-9 Junio 2018
67. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA 1998; 280:605–13.
68. Manson JE, Chlebowski RT, Stefanick ML, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA 2013; 310:1353–68.
69. Salpeter SR, Walsh JM, Greyber E, Salpeter EE. Brief report: Coronary heart disease events associated with hormone therapy in younger and older women. A meta-analysis. J Gen Intern Med. 2006 Apr;21(4):363-6. Erratum in: J Gen Intern Med. 2008 Oct;23(10):1728.
70. Weber MT, Maki PM, McDermott MP. Cognition and mood in perimenopause: a systematic review and meta-analysis. J Steroid BiochemMolBiol .2014; 142:90–8
71. Gleason CE, Dowling NM, Wharton W, Manson JE, Miller VM, Atwood CS, Brinton EA, Cedars MI, Lobo RA, Merriam GR, Neal-Perry G, Santoro NF, Taylor HS, Black DM, Budoff MJ, Hodis HN, Naftolin F, Harman SM, Asthana S. Effects of Hormone Therapy on Cognition and Mood in Recently Postmenopausal Women: Findings from the Randomized, Controlled KEEPS-Cognitive and Affective Study. PLoS Med. 2015 Jun 2;12(6):e1001833
72. Espeland MA, Shumaker SA, Leng I, et al. Longterm effects on cognitive function of postmenopausal hormone therapy prescribed to women aged 50 to 55 years. JAMA Intern Med 2013; 173:1429–36.
73. Chlebowski RT, Hendrix SL, Langer RD, et al. WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: The Women’s Health Initiative randomized trial. JAMA 2003; 289:3243–53.
74. Anderson GL, Chlebowski RT, Rossouw JE, et al. Prior hormone therapy and breast cancer risk in the Women’s Health Initiative randomized trial of estrogen plus progestin. Maturitas 2006; 55:103–15.
75. Colditz GA, Hankinson SE, Hunter DJ, et al. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N Engl J Med 1995; 332:1589–93
76. Bakken K, Fournier A, Lund E, et al. Menopausal hormone therapy and breast cancer risk: impact of different treatments. The European Prospective Investigation into Cancer and Nutrition. Int J Cancer 2011; 128:144–56.
77. Beral V; Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003; 362:419–27
78. Fournier A, Berrino F, Clavell-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat 2008; 107:103–1.
79. Chlebowski RT, Anderson GL, Gass M, et al. WHI Investigators. Estrogen plus progestin and breast cancer incidence and mortality in postmenopausal women. JAMA 2010; 304:1684–92.
80. Santos I, Clissold S. Urogenital disorders associated with oestrogen deficiency: the role of promestriene as topical oestrogen therapy. Gynecol Endocrinol. 2010 Sep;26(9):644-51.
81. Oyarzún MFG, Castelo-Branco C. Local hormone therapy for genitourinary syndrome of menopause in breast cancer patients: is it safe? Gynecol Endocrinol. 2017 Jun;33(6):418-420
82. Trinkaus M, Chin S, Wolfman W, Simmons C, Clemons M. Should urogenital atrophy in breast cancer survivors be treated with topical estrogens? Oncologist. 2008 Mar;13(3):222-31
83. Moegele M, Buchholz S, Seitz S, Ortmann O. Vaginal estrogen therapy in postmenopausal breast cancer patients treated with aromatase inhibitors. Arch Gynecol Obstet. 2012 May;285(5):1397-402.
84. Le Ray I, Dell’Aniello S, Bonnetain F, Azoulay L, Suissa S. Local estrogen therapy and risk of breast cancer recurrence among hormonetreated patients: a nested case-control study. Breast Cancer Res Treat. 2012 Sep;135(2):603- 9.
85. Goldstein SR, Bachmann GA, Koninckx PR, Lin VH, Portman DJ, Ylikorkala O; Ospemifene Study Group. Ospemifene 12-month safety and efficacy in postmenopausal women with vulvar and vaginal atrophy. Climacteric 2014; 17:173– 82
86. Antoine C, Liebens F, Carly B, Pastijn A, Rozenberg S. Safety of alternative treatments for menopausal symptoms after breast cancer: a qualitative systematic review. Climacteric. 2007 Feb;10(1):23-6. Review.
87. Pinkerton JV, Harvey JA, Pan K, Thompson JR, Ryan KA, Chines AA, Mirkin S. Breast effects of bazedoxifene-conjugated estrogens: a randomized controlled trial. Obstet Gynecol. 2013 May;121(5):959-68.
88. Alipour S, Jafari-Adli S, Eskandari A.Benefits and harms of phytoestrogen consumption in breast cancer survivors. Asian Pac J Cancer Prev. 2015;16(8):3091-396. Review.
89. Simin J, Tamimi R, Lagergren J, Adami HO, Brusselaers N. Menopausal hormone therapy and cancer risk: An overestimated risk? Eur J Cancer. 2017 Oct;84:60-68.
90. Woodruff JD, Pickar JH. Incidence of endometrial hyperplasia in postmenopausal women taking conjugated estrogens (Premarin) with medroxyprogesterone acetate or conjugated estrogens alone. The Menopause StudyGroup. Am J ObstetGynecol1994; 170:1213–23
91. Weiderpass E, Adami HO, Baron JA, et al. Risk of endometrial cancer following estrogen replacement with and without progestins. J Natl Cancer Inst 1999;91:1131–7
92. Arteaga-Gómez AC, Castellanos-Barroso G, Colin-Valenzuela A, García-Vargas J, Márquez- Acosta G, Reyes-Muñoz E. [Hormone therapy effect in postmenopausal women with history of endometrial cancer]. Ginecol Obstet Mex. 2011 Jan;79(1):11-7. Spanish.
93. Barakat RR, Bundy BN, Spirtos NM, Bell J, Mannel RS; Gynecologic Oncology Group Study. Randomized double-blind trial of estrogen replacement therapy versus placebo in stage I or II endometrial cancer: a Gynecologic Oncology Group Study. J Clin Oncol. 2006 Feb 1;24(4):587-92.
94. Stovall DW, UtianWH, Gass ML, et al. The effects of combined raloxifene and oral estrogen on vasomotor symptoms and endometrial safety. Menopause 2007; 14:510–17.
95. Clarke MJ. Tamoxifen for early breast cancer.Cochrane Database Syst Rev 2008; CD000486.
96. Goldstein SR, Scheele WH, Rajagopalan SK, WilkieJL, Walsh BW, Parsons AK. A 12-month comparative study of raloxifene, estrogen, and placebo on the postmenopausal endometrium. ObstetGynecol 2000; 95:95–103.
97. Ronkin S, Northington R, Baracat E, et al. Endometrial effects of bazedoxifene acetate, a novel selective estrogen receptor modulator, in postmenopausal women. ObstetGynecol 2005; 105:1397–404.
98. Constantine GD, Goldstein SR, Archer DF. Endometrial safety of ospemifene: results of the phase 2/3 clinical development program. Menopause 2015; 22:36–43
99. Brenner H, Kloor M, Pox CP. Colorectal cancer. Lancet 2014; 383:1490–502
100. Grodstein F, Martinez ME, Platz EA, et al. Postmenopausal hormone use and risk for colorectal cancer and adenoma. Ann Intern Med 1998; 128:705–12.
101. Grodstein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorectal cancer: a review and meta-analysis. Am J Med 1999; 106:574–82
102. Morois S, Fournier A, Clavel-Chapelon F, et al. Menopausal hormone therapy and risks of colorectal adenomas and cancers in the French E3N prospective cohort: true associations or bias? Eur J Epidemiol 2012; 27:439–52.
103. Komm BS, Thompson JR, MirkinS Cardiovascular safety of conjugated estrogens plus bazedoxifene: meta-analysis of the SMART trials. Climacteric. 2015;18(4):503-11.
104. White RH. The epidemiology of venous thromboembolism. Circulation 2003;107(23 Suppl 1): I4–8.
105. Archer DF, Oger E. Estrogen and progestogen effect on venous thromboembolism in menopausal women. Climacteric 2012;15:235– 40
106. Scarabin PY. Hormone therapy and venous thromboembolism among postmenopausal women. Front Horm Res. 2014;43:21-32
107. Roach RE, Lijfering WM, van HylckamaVlieg A, et al. The risk of venous thrombosis in individuals with a history of superficial vein thrombosis and acquired venous thrombotic risk factors. Blood 2013; 122:4264–9.
108. Bergendal A, Kieler H, Sundström A, Hirschberg AL, Kocoska-Maras L. Risk of venous thromboembolism associated with local and systemic use of hormone therapy in peri- and postmenopausal women and in relation to type and route of administration. Menopause. 2016 Jun;23(6):593-9.
109. Rovinski D, Ramos RB, Fighera TM, Casanova GK, Spritzer PM. Risk of venous thromboembolism events in postmenopausal women using oral versus non-oral hormone therapy: A systematic review and meta-analysis. Thromb Res. 2018 Jun 19;168:83-95.
110. Scarabin PY. Progestogens and venous thromboembolism in menopausal women: an updated oral versus transdermal estrogen metaanalysis. Climacteric. 2018 Aug;21(4):341-345.
111. Cushman M, Kuller LH, Prentice R, et al. Women’s Health Initiative Investigators. Estrogen plus progestin and risk of venous thrombosis. JAMA 2004; 292:1573–80
112. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med 2006; 166:772–80.
113. Manson JE, Chlebowski RT, Stefanick ML, et al. Menopausal hormone therapy and health outcomes during the intervention and extended post stopping phases of the Women’s Health Initiative randomized trials. JAMA 2013; 310:1353–68.
114. Henderson VW, Lobo RA. Hormone therapy and the risk of stroke: perspectives 10 years after the Women’s Health Initiative trials. Climacteric 2012; 15:229–34
115. Boardman HM, Hartley L, Eisinga A, et al. Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev 2015;3:CD002229.
116. Renoux C, Dell’aniello S, Garbe E, et al. Transdermal and oral hormone replacement therapy and the risk of stroke: a nested casecontrol study. BMJ 2010;340:c2519.
117. Lobo RA, Clarkson TB. Different mechanisms for benefit and risk of coronary heart disease and stroke in early postmenopausal women: a hypothetical explanation. Menopause 2011; 18:237–40.
118. Royal College of Obstetricians and Gynaecologists UK Green Top Guidelines. Thirdedition.Clinical Governance Advice No. 1a: Policies and Processes 2015.
119. Schneider HP, HeinemannLA,etal. The Menopause Rating Scale (MRS): comparison with Kupperman index and quality-of-life scale SF-36. Climacteric. 2000 Mar;3(1):50-8.
120. Schneider HP, Heinemann LA, Rosemeier HP, et al.. The Menopause Rating Scale (MRS): reliability of scores of menopausal complaints. Climacteric. 2000 Mar;3(1):59-64.
121. Heinemann LA, Potthoff P, Schneider HP. International versions of the Menopause Rating Scale (MRS). Health Qual Life Outcomes.2003 Jul 30; 1:28.
122. Heinemann K, Ruebig A, Potthoff P, Schneider HP et al. The Menopause Rating Scale (MRS) scale: a methodological review. Health Qual Life Outcomes.2004 Sep 2; 2:45.
123. Heinemann LA, et al. The Menopause Rating Scale (MRS) as outcome measure for hormone treatment? A validation study. Health QualLife Outcomes. 2004 Nov 22; 2:676.
124. Andersson C, Innala E, Bäckström T. Acute intermittent porphyria in women: clinical expression, use and experience of exogenous sex hormones. A population-based study in northern Sweden. J Intern Med. 2003 Aug;254(2):176-83.
125. Bulaj ZJ, Franklin MR, Phillips JD, Miller KL, Bergonia HA, Ajioka RS, Griffen LM, Guinee DJ, Edwards CQ, Kushner JP. Transdermal estrogen replacement therapy in postmenopausal women previously treated for porphyria cutanea tarda. J Lab Clin Med. 2000 Dec;136(6):482-8.
126. Santen RJ, Allred DC, Ardoin SP, Archer DF, Boyd N, Braunstein GD, Burger HG, Colditz GA, Davis SR, Gambacciani M, Gower BA, Henderson VW, Jarjour WN, Karas RH, Kleerekoper M, Lobo RA, Manson JE, Marsden J, Martin KA, Martin L, Pinkerton JV, Rubinow DR, Teede H, Thiboutot DM, Utian WH; Endocrine Society. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2010 Jul;95(7 Suppl 1):s1-s66.