2007
2
Autores:
Carlos Acevedo L.1, a, Fanny López A.1, a, Silvia Sepúlveda B.2, b, Victoria Espinosa F.2, c
Instituciones:
1Escuela de Obstetricia y Puericultura, Facultad de Ciencias Médicas, Universidad de Santiago de Chile, 2Escuela de Medicina, Laboratorio de Investigación Científica Emory Black, Facultad de Ciencias Médicas, Universidad de Santiago de Chile.
aMatrón(a), bIngeniero(a) Ejecución Química, cBioquímico(a).
Tipo de documento:
Trabajos OriginalesActividad de la glutatión reductasa en el embarazo diabético
Contenido del documento:
INTRODUCCIÓN
La diabetes gestacional se presenta como una intolerancia a los carbohidratos cuyo inicio y detección se realiza por primera vez durante el embarazo. Esta condición afecta a 4-5% de embarazadas a nivel mundial (1).
El embarazo es una condición metabólica de tipo oxidativa en que la unidad feto-placentaria se forma a expensas de la madre. Algunos autores sugieren el uso de medidas de marcadores de estrés oxidativo tales como peroxidación de lípidos o medidas de producción de especies reactivas de oxígeno (ROS) para evaluar su implicancias clínicas y la integridad y funcionalidad de dicha unidad (2,3).
En nuestro organismo existen diferentes mecanismos para evitar la extensión del daño causada por los radicales libres, éstos incluyen a péptidos con grupos tiol, como el glutatión (GSH). La concentración intracelular de GSH se controla por la acción de la glutatión sintetasa, la peroxidasa y la reductasa. La última enzima es la que recicla el glutatión oxidado (GSSG) a su especie bio-activa GSH. La actividad de la glutatión reductasa, una enzima dependiente del cofactor FAD (flavina adenina dinucléotido), es medida a través del test CAGRE (coeficiente de activación de la enzima glutatión reductasa eritrocitaria), utilizado también como un marcador de desnutrición o hipovitaminosis B2, por la relación existente entre la riboflavina y el FAD. Esta prueba relaciona la actividad de la glutation reductasa de glóbulos rojos en ausencia de FAD y su activación por la adición de dicho cofactor. Además, la medida de esta actividad enzimática podría ser útil en la detección del estrés oxidativo eritrocitario de mujeres embarazadas normales y sobre todo en los embarazos patológicos, en los que aumenta la posibilidad de aborto o en los que se produce un funcionamiento defectuoso de la unidad feto-placentaria, como en la diabetes gestacional (4,5).
En las mujeres con diabetes gestacional, una alta concentración de radicales libres podría causar la destrucción de las células beta del páncreas y también alteraciones morfológicas en el crecimiento fetal. El estrés oxidativo ha sido claramente asociado a la diabetes mellitus de tipo 2, donde se presentan disminuidas las defensas antioxidantes, por una parte con la existencia de actividades menores de superóxido dismutasa SOD, catalasas y glutatión peroxidasa y por otra, porque los altos niveles de glucosa o fructosa podrían inhibir a la glutatión reductasa, conduciendo a un aumento en la concentración de ROS (5-7). Sin embargo, existe limitada información respecto al aumento del estrés oxidativo en la patogénesis y mantención de la diabetes mellitus gestacional (MDG). Se ha encontrado que los niveles de los marcadores de estrés oxidativo están elevados en la placenta obtenida de mujeres con diabetes gestacional, mostrando un desbalance entre la producción de radicales y las acciones antioxidantes celulares, incluido los niveles de glutatión (6-8).
El objetivo de este estudio es determinar la actividad de la glutatión reductasa y la distribución de la prueba de CAGRE en embarazadas normales y diabéticas, en relación a la edad, el estado nutricional y los antecedentes de enfermedades familiares.
MATERIAL Y MÉTODOS
Estudio transversal de casos y controles que incluyó a 60 embarazadas del Hospital Barros Luco-Trudeau, con 24 o más semanas de gestación y al menos con un embarazo previo, sin ningún tratamiento con drogas ni patologías diagnosticadas. El grupo control estuvo compuesto por 30 embarazadas sanas y el grupo de casos por 30 embarazadas con diagnóstico de diabetes gestacional. Las variables estudiadas fueron edad materna, antecedentes mórbidos personales y familiares presentes y/o pasados, hematocrito y edad gestacional al momento del estudio, las que fueron obtenidas de las fichas clínicas de las embarazadas. El estado nutricional materno fue inferido a través de la curva de índice de masa corporal. Se calculó el valor del test CAGRE en ambos grupos. Para estudiar las variables, éstas fueron clasificadas de acuerdo con su nivel de medición y tamaño de la muestra. Se determinaron medidas de tendencia central y se utilizaron las pruebas de ANOVA y T de Student con un nivel de significancia p0,05.
Cálculo del valor del test CAGRE: Se determina en base a la diferencia de absorbancia de la muestra a los 10 minutos del ensayo versus el tiempo cero ((D Abs) para ambas muestras (tubo A y tubo B) y de acuerdo al siguiente cuociente:
CAGRE = (D Abs. muestra con FAD) / ((D Abs. muestra sin FAD)
El protocolo utilizado en este estudio fue aprobado por la Escuela de Obstetricia y Puericultura de la Facultad de Ciencias Médicas de la Facultad de Ciencias Médicas USACH y por el Servicio de Obstetricia del Hospital Barros Luco-Trudeau. Después de la aceptación del estudio (consentimiento informado), se obtuvo una gota de sangre capilar (10µL) por punción del dedo índice de las embarazadas de ambos grupos.
Los 10 mL de sangre se colocaron en un tubo de ensayo (tubo A) conteniendo 5 ml de buffer hemolítico pH 6,9 (EDTA 1mM, digitonina 0,03mM, KCl 200mM y K2HPO4 60mM). De esta solución se extrajo 1 mL, el que fue colocado en un segundo tubo (tubo B), el que contenía 10 uL de FAD 1mM (9). Ambas muestras se mantuvieron en hielo y protegidas de la luz por un tiempo no mayor a 3 horas, hasta la determinación espectrofotométrica de la actividad glutatión reductasa con y sin suplemento de FAD a 340 nm, durante 10 min, según protocolos descritos previamente (9,10). Los reactivos utilizados NADPH, GSSG, FAD, EDTA, K2HPO4 y digitonina se adquirieron de Sigma-Aldrich (St Louis, MO).
RESULTADOS
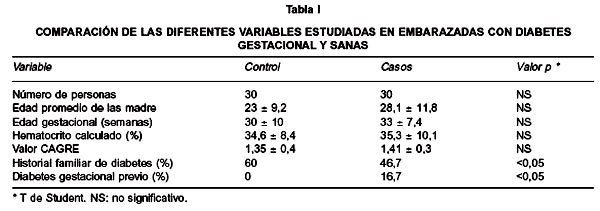
Al comparar algunas de las variables analizadas, de las embarazadas incluidas en los grupos control y casos (Tabla I), se observa que no existe diferencia estadísticamente significativa entre ambos grupos de acuerdo con la edad, la edad gestacional al momento del estudio, el hematocrito calculado y el valor promedio que presentaron del test CAGRE. Hubo diferencia estadísticamente significativa en el porcentaje de la población que presentó historial familiar de diabetes, siendo mayor en el grupo control (60%) que en el de casos (46,7%), estos últimos, además informaron otras patologías.
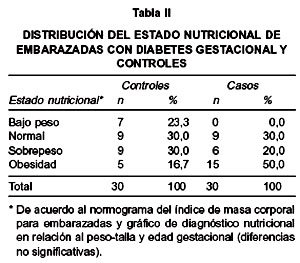
Al analizar, la distribución del estado nutricional asociado al índice de masa corporal de las embarazadas (Tabla II), se encontró que en el grupo de casos prevalecían las mujeres obesas, mientras que las embarazadas del grupo control presentaban en su mayoría peso normal o solamente sobrepeso ligero, diferencia no significativa.
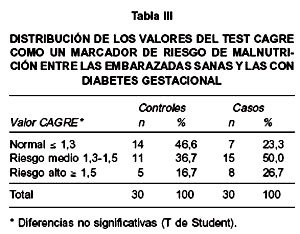
Al utilizar los valores del test CAGRE como un marcador de nutrición o de niveles tisulares de riboflavina (vitamina B2) en las embarazadas control y casos (Tabla III), observamos que la tendencia en el grupo control es presentar valores normales del test CAGRE o en algunos casos un riesgo medio de malnutrición, mientras que en el grupo de los casos fue de mediano a alto riesgo de hipovitaminosis B2, diferencia no significativa.
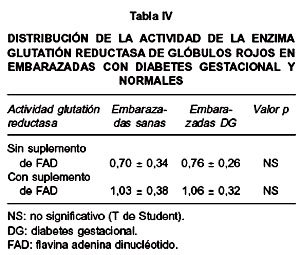
Cuando se analizó la actividad de la enzima glutatión reductasa eritrocitaria (Tabla IV), se observó que dicha actividad en las embarazadas con diabetes gestacional era menor que la detectada en el grupo control, sin que la diferencia fuera estadísticamente significativa. Ambos grupos presentaron algún grado de riesgo de desnutrición de acuerdo con las diferentes categorías en que se subdividen los valores del test CAGRE (valores mayores de uno), el suplemento de las muestras sanguíneas con FAD causó un incremento en la actividad enzimática en ambos grupos sin diferencia estadística.
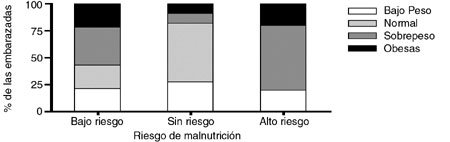
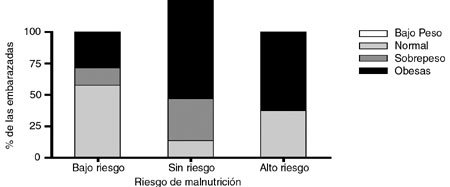
Cuando se relacionó la variable valor del test CAGRE en función del estado nutricional materno clasificado de acuerdo al índice de masa corporal, (Figura 1), se observó que las mayores frecuencias de mujeres en el grupo control correspondieron a aquellas con valor normal de IMC y CAGRE normal, seguidas de aquellas con sobrepeso y ligero riesgo de malnutrición. Por otra parte, en el grupo de casos, la mayor frecuencia observada correspondió a las madres con sobrepeso-obesas y con valores normales o altos de CAGRE. El análisis estadístico de la información presente en las Figuras 1A y 1B indicó que no existe diferencia estadísticamente significativa entre las distribuciones por categorías de riesgo nutricional entre embarazadas controles y aquellas con diabetes gestacional, de igual manera la distribución de los valores del test CAGRE entre ambas poblaciones no presentó diferencia estadísticamente significativa.
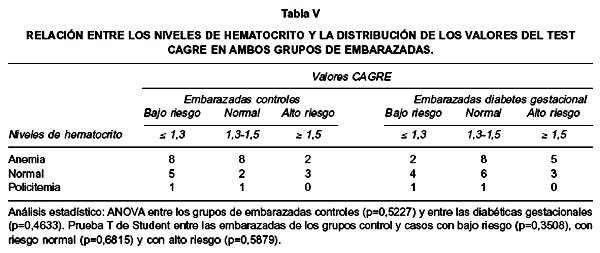
Cuando se realizó un análisis similar entre las variables hematocrito materno y valor del test CAGRE (Tabla V), se observó en ambos grupos que la mayoría de las mujeres eran anémicas. En el grupo de los controles el 60% presentaba esta anomalía y sus valores de CAGRE se distribuían principalmente entre la condición normal y de bajo riesgo. En el grupo de los casos el 53,3% de las madres estaban anémicas, pero la distribución de los valores de CAGRE era mayor entre los valores normales y de alto riesgo. No hubo diferencia estadísticamente significativa entre los grupos de embarazadas controles; ni entre las embarazadas con diabetes gestacional, distribuidos de acuerdo al valor de test CAGRE y en relación con sus niveles de hematocrito (ANOVA). No hubo diferencia estadísticamente significativa entre las embarazadas de los grupos control y casos con diferentes grados de nutrición en relación con su hematocrito (T de Student).
DISCUSIÓN
De acuerdo con la definición operacional del test CAGRE, ambos grupos poseen moderado riesgo de desnutrición, siendo esto más evidente en el grupo de los casos, sin que se alcance una diferencia estadísticamente significativa entre las embarazadas sanas y aquellas con diabetes gestacional.
Estudios anteriormente publicados, señalaban que el coeficiente de activación de la enzima glutatión reductasa de glóbulos rojos mostraba un incremento durante el embarazo normal debido a la deficiencia del consumo de riboflavina y la hemodilución, hecho que fue comprobado en nuestro estudio (11,12). Adicionalmente, nosotros determinamos un ligeramente mayor valor de test CAGRE entre las embarazadas con diabetes gestacional, lo cual indica una mayor necesidad por vitamina B2 y un mayor riesgo de malnutrición en estas madres.
Los resultados de nuestro estudio y aquellos reportados en literatura, sugieren una disminución de la actividad de la glutatión peroxidasa en la sangre materna, produciendo una disminución en la conversión del GSH a glutatión oxidado (GSSG). Parte de este último es reducido en los glóbulos rojos por acción de la glutatión reductasa (GR) y transportado fuera de las células, removido de la circulación principalmente en el riñón conduciendo a menores niveles de glutatión en la sangre asociados a la inhibición de la enzima glutatión sintetasa. La combinación del aumento en la producción de especies oxidantes y una disminución de las defensas antioxidantes contribuye al aumento del estrés oxidativo en los eritrocitos en condiciones de diabetes mellitus y esto es probablemente la causa de partos problemáticos en embarazos en los que se desarrolla diabetes gestacional (desarrollo de preeclampsia-eclampsia), asociados a una disminución en la concentración de GSH y de la actividad de la glutatión peroxidasa (13-16). La ligera disminución de la actividad de la glutatión reductasa observada en nuestras pacientes con diabetes gestacional podría producir una disminución en la cantidad intracelular de GSH necesaria para proteger a las células del estrés oxidativo.
Nuestros estudios muestran que las mujeres embarazadas que desarrollaron diabetes gestacional eran de mayor edad y tenían un índice de masa corporal mas elevado que las madres del grupo control. Todas estas características se asemejan a aquellas publicadas anteriormente, que refieren un mayor riesgo de desarrollar diabetes gestacional, en embarazadas con antecedentes familiares de diabetes, con mayor edad, de baja estatura y en multíparas (14,17,18). De acuerdo con nuestros resultados no existe asociación estadística entre la existencia de antecedentes familiares de diabetes y la adquisición de diabetes gestacional, pese a que nuestro grupo control presentó un mayor porcentaje de antecedentes familiares de diabetes. Por otra parte, un 16,7% de las pacientes con diabetes gestacional informó haber tenido dicha patología en embarazos previos, mientras que en el grupo de controles no se presentaron tales antecedentes.
Cuando se analiza la distribución de las embarazadas con y sin diabetes gestacional de acuerdo con su IMC y se relaciona con el riesgo de malnutrición inferido de la medida del valor de CAGRE, se observa en primer lugar que las embarazadas con diabetes gestacional tienden a tener un mayor IMC y no se presentaron pacientes clasificadas en el rango de bajo peso, además entre las con IMC normal, se detectó un mayor riesgo de padecer malnutrición en aquellas que tenían diabetes gestacional. En el rango de obesas en ambos grupos, aproximadamente un tercio de la población presentó altos valores del test CAGRE, indicadores de una hipovitaminosis B2; por lo tanto, la obesidad durante el embarazo podría ser un factor de riesgo de malnutrición y de estrés oxidativo asociado a una disminución de la actividad de las enzimas FAD dependientes (13-16).
En relación con el hematocrito, la mayoría de las embarazadas del grupo control y casos tenían anemia (60% y 53,3% respectivamente) lo que se explica debido a la hemodilución que se produce durante el embarazo. Algunos estudios han reportado que no existe relación entre los niveles de hematocrito y el riesgo de desarrollar diabetes gestacional, indicando que la prevalencia de ésta es menor entre las madres anémicas y se relaciona con un aumento en el consumo de alimentos que incluyen hierro (19,20). Por otra parte, hay una aparente relación directa entre la falta de riboflavina determinada a través del test CAGRE con la prevalencia de anemia (19). En nuestro estudio, no fue posible establecer una relación entre el hematocrito, el valor de test CAGRE y el desarrollo de diabetes gestacional debido a que los niveles de hematocrito eran bajos en las embarazadas de ambos grupos y además porque los valores del test CAGRE determinados en ambos grupos eran igualmente altos, lo que indicaba una hipovitaminosis B2.
Las variables que fueron revisadas en nuestro trabajo y asociadas con los signos de diabetes gestacional (sobrepeso, antecedentes personales de diabetes gestacional y edad de la embarazada) se relacionaron con mayores valores del test CAGRE lo que indica un mayor estado de malnutrición materna y al mismo tiempo evidencia un mayor riesgo de estrés oxidativo. Por otra parte, la disminución del hematocrito, marcador de hemodilución característico del embarazo, se modificó en igual magnitud en ambos grupos de embarazadas.
CONCLUSIÓN
De acuerdo con los resultados del estudio, las diferencias observadas en la actividad de la glutatión reductasa entre ambos grupos de embarazadas, no permiten afirmar que la diabetes gestacional se asocie a una menor actividad de la misma. Independiente de lo anterior, sugerimos la suplementación dietaria de vitamina B2 para todas las embarazadas, puesto que los valores de test CAGRE en ambos grupos mostraron un déficit nutricional de consideración.
BIBLIOGRAFÍA
- Jovanovic L, Pettitt D. Gestational Diabetes Mellitus. JAMA 2001;286: 2516-19.
- Toescu V, Nuttall S, Martin U, Kendall M, Dunne F. Oxidative stress and normal pregnancy. Clin Endocrinol 2002;57:609-13.
- Lurie S, Mamet Y. Red blood cell survival and kinetics during pregnancy. Eur J Obstet Gynecol Reprod Biol 2000;93:185-92.
- Knapen M, Zusterzeel P, Peters W, Steegers E. Glutathione and glutathione-related enzymes in reproduction. A review. Eur J Obstet Gynecol Reprod Biol 1999;82:171-84.
- West I. Radicals and oxidative stress in diabetes. Diabet Med 2000;17:171-80.
- Coughlan M, Vervaart P, Permezel M, Georgiou H, Rice G. Altered Placental Oxidative Stress Status in Gestational Diabetes Mellitus. Placenta 2004;25:78-84.
- Peuchant E, Brun J, Rigalleau V, Dubourg L, Thomas M., Daniel J, et al. Oxidative and anti-oxidative status in pregnant women with either gestational or type 1 diabetes. Clin Biochem 2004;37:293-8.
- Kamath U, Rao G, Raghothama C, Rai L, Rao P. Erythrocyte indicators of oxidative stress in gestational diabetes. Acta Pædiatr 1998;87:676-9.
- Becker K, Krebs B, Schirmer R. Protein-chemical standardization of the erythrocyte glutathione reductase activation test (EGRAC test). Application to hypothyroidism. Int J Vitam Nutr Res 1991;61:180-7.
- Lopez N, Gonzalez O, Hidalgo P. Erythrocyte glutathione reductase in pregnant women with hemoglobin AA and AS. Sangre (Barc) 1999;44:195-8.
- Tovar A, Torres N, Halhali A, Bourges H. Riboflavin and pyridoxine status in a group of pregnant mexican women. Arch Med Res 1996;27:195-200.
- Perego M, Briozzo G, Durante C, Grandi C, Sola H, Luchtenberg G, et al. Estudio bioquímico-nutricional en la gestación temprana en la Maternidad Sardá de Buenos Aires. Acta Bioquím Clín Latinoam 2005; 39(2):187-96.
- Xiong X, Saunders L, Wang F, Demianczuk N. Gestational diabetes mellitus: prevalence, risk factors, maternal and infant outcomes. Int J Gynecol Obstet 2001;75:221-8.
- Rajdl D, Racek J, Steinerova A, Novotny Z, Stozicky F, Trefil L, Siala K. Markers of oxidative stress in diabetic mothers and their infants during delivery. Physiol Res 2005;54(4):429-36. Epub 2004 Dic. 9.
- Herrera J. Evaluación del riesgo obstétrico en el cuidado prenatal. Colombia Médica 2002;33:21-5.
- Di Cianni G, Volpe L, Lencioni C, Miccoli R, Cuccuru I, Ghio A, et al. Prevalence and risk factors for gestational diabetes assessed by universal screening. Diabetes Res Clin Pract 2003;62:131-7.
- Harrison T, Hindorff L, Kim H, Wines R, Bowen D, McGrath B, Edwards K. Family history of diabetes as a potential public health tool. Am J Prev Med 2003; 24:152-9.
- Lao T, Ho L. Impact of iron deficiency anemia on prevalence of gestational diabetes mellitus. Diabetes Care 2004;27:650-6.
- Lao T, Chan L, Tam K, Ho L. Maternal hemoglobin and risk of gestational diabetes mellitus in Chinese women. Obstet Gynecol 2002;99:807-12.
- Chiplonkar S, Agte V, Mengale S. Relative importance of micronutrient deficiencies in iron deficiency anemia. Nutr Res 2003;23:1355-67.