2020
6
Autores:
Sochog
Instituciones:
Christhian Rivera1, Cristián Pomés2, Verónica Díaz 3, Paula Espinoza 4, Milena Zamboni2.
1Residente Obstetricia y Ginecología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
2División de Obstetricia y Ginecología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
3Médico Cirujano Servicio Salud Metropolitano Sur Oriente.
4Interna Medicina, Facultad de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia: Christhian Rivera, carivera8@uc.cl
Tipo de documento:
Artículo de RevisiónActualización del enfrentamiento y manejo de localizaciones poco frecuentes del embarazo ectópico
Contenido del documento:
INTRODUCCIÓN
El embarazo ectópico (EE) se define como una condición potencialmente mortal, que ocurre cuando el blastocito se implanta en un sitio diferente al endometrio de la cavidad uterina, siendo una de las emergencias obstétricas que se presenta más comúnmente durante el primer trimestre de embarazo1,2.
Dado lo anterior, cuando una paciente en edad fértil con posibilidad de estar embarazada consulta por amenorrea/metrorragia y dolor abdominal, hay que descartar la presencia de embarazo, midiendo los niveles de β–hCG en sangre. El nivel más bajo de β-hCG en el cual un saco gestacional intrauterino debiera ser siempre detectado en el ultrasonido (US) transvaginal se sitúa entre 1500-2000 mUI/ml, lo que se conoce como zona de discriminación. En una toma única, un valor superior es diagnóstico de EE en el 86% de los casos, por lo que es necesaria su medición seriada. Cuando el valor de β-hCG es mayor a 3500, y no se encuentran imágenes categóricas de embarazo ectópico, se sugiere utilizar este valor como zona de discriminación, ya que tiene un 99% de probabilidad de visualizar una imagen de gestación intrauterina57,58.
El 97% de los EE se produce en las tubas uterinas, sin embargo la implantación se puede dar en otros sitios anatómicos menos frecuentes: 1,5% cornual/intersticial, 1,3% abdominal, 0,15% ovárico, 0,15% cervical y 0,15% cicatriz de cesárea1,3,4.
Hoy en día existe escasa información que abarque de forma completa los distintos tipos de EE no tubarios, por lo que el objetivo de esta publicación es hacer una revisión y resumen, entregando una actualización del enfrentamiento y manejo de estas localizaciones menos frecuentes.
MÉTODO
Se realizó una revisión de la literatura disponible en base de datos PubMed y Cochrane, utilizando los términos Mesh: “Ectopic Pregnancy” más “Cornual, interstitial, abdominal, ovarian, ovary, cervical y cesarean section scar”, con filtro de años entre 2000 y 2020, con los términos utilizados en el título o resumen. Por otro lado, se revisó las bases de datos en español Epistemónikos y Scielo con los mismos términos y filtros mencionados. También se realizó una búsqueda dirigida de estudios relevantes mencionados en los trabajos y las últimas publicaciones de sociedades científicas.
EMBARAZO ECTÓPICO EN CICATRIZ DE CESÁREA
El embarazo en una cicatriz de cesárea (ECC). Ocurre en menos del 1% de los EE, con una incidencia de 1 por cada 1800 a 2216 embarazos4,8. Se estima que en pacientes con más de 1 cicatriz de cesárea anterior, existirá un 6% de probabilidad que los siguientes embarazos ocurran dentro de ésta8.
El ECC se define como un saco gestacional que se implanta en un defecto del miometrio, ubicado en el lugar donde se realizó la histerotomía de un parto previo por cesárea4,9. No obstante, puede ocurrir después de cualquier trauma al miometrio, siendo factores de riesgo: cicatriz de cesárea anterior, legrado uterino previo, miomectomía, extracción manual de placenta, adenomiosis, fertilización in vitro, síndrome de asherman, enfermedades sistémicas que producen flujo sanguíneo deficiente, enfermedades de tejido conectivo, infecciones de la herida postoperatoria, embarazos en intervalos cortos (<1 año) y cierre inadecuado de la herida7,8,9.
El ECC puede extenderse desde el exterior de la cicatriz, invadiendo estructuras adyacentes, o puede crecer hacia el interior de la cavidad uterina. Esto último se asocia a un aumento del riesgo de placenta acreta de 3 a 5 veces8,50. Por lo tanto, es una patología potencialmente peligrosa, con riesgo de ruptura uterina y hemorragia masiva8,50.
- Enfrentamiento diagnóstico:
Las presentaciones clínicas de ECC observadas son: asintomática (37%), sangrado vaginal indoloro (39%), dolor abdominal difuso (9%) y otras7,8,51. Dado la ambigüedad y variabilidad de éstas, es importante diferenciar el ECC de patologías tales como: aborto espontáneo en evolución, embarazo cervical, o incluso embarazo intrauterino; ya que el manejo y los resultados son diferentes, pudiendo resultar en una complicación mayor si no es pesquizado, con necesidad incluso de realizar una histerectomía de emergencia7,9.
Para realizar el diagnóstico, lo primero es confirmar la presencia de un embarazo, midiendo la concentración de β-hCG en sangre. Luego, se debe realizar una US transvaginal y observar la presencia de los siguientes criterios diagnósticos de ECC: útero y canal cervical vacío, saco gestacional y/o placenta en el sitio de la histerotomía, tejido miometrial delgado (<1-3 mm) o ausente entre la vejiga y el saco gestacional, área vascular marcada en la cicatriz de cesárea anterior, presencia de un embrión / polo fetal / saco vitelino con o sin actividad cardíaca9,10,11,12.
Se han descrito dos tipos de ECC, dependiendo de la profundidad de la implantación. En el tipo 1 (endógeno), el saco gestacional crece hacia el espacio cérvico-ístmico. En el tipo 2 (exógeno), crece hacia la vejiga y la pared abdominal11. Conocer el tipo de EEC permite determinar el manejo de esta patología.
- Manejo del ECC
Se recomienda interrumpir un ECC durante el primer trimestre, con el fin de evitar complicaciones tales como: hemorragia masiva, rotura uterina, anomalías de placentación, invasión de órganos circundantes, coagulación intravascular diseminada, shock hipovolémico y muerte. Ademas permitiría, en algunos casos, preservar la fertilidad futura de la paciente8,10.
Dado la baja frecuencia del EEC, no existen guías universales ni consenso en cuanto al tratamiento de elección50,51.
- Manejo Expectante:
Existe poca información sobre la historia natural del ECC, debido a la pronta interrupción tras el diagnóstico. Se ha reportado que 80% de las pacientes requieren posteriormente manejo médico o quirúrgico8. Además, más del 50% de las pacientes presenta alguna complicación secundaria. Este riesgo aumenta a medida que el embarazo avanza10,11,13.
Este tratamiento no debe ser recomendado de primera línea. Sólo puede ser utilizado cuando la paciente desea continuar su embarazo pese a haber sido informada sobre los graves riesgos maternos.
Los criterios de inclusión para manejo expectante son: paciente altamente confiable, ECC tipo 1, asintomática, edad gestacional menor a 5 semanas, sin presencia de latidos cardiofetales, y β-hCG en descenso8,13,51.
Si, por deseo materno informado, la paciente decide continuar con el embarazo, se debe considerar esta opción solo en ECC tipo 1 y realizar controles de imagen regulares. Aún se desconoce el mínimo grosor de miometrio anterior al ECC que puede garantizar continuar la gestación sin riesgo de rotura uterina. Por lo anterior, parece prudente planificar una cesárea electiva en la semana 28-30, con alta probabilidad de requerir una histerectomía de emergencia (50% a esa edad gestacional) y transfusión sanguínea8,11,13. Queda a criterio de la institución esta decisión, según común acuerdo por el grupo de especialistas de perinatología y neonatología y las condiciones del centro que puedan garantizar la sobrevida del neonato.
Manejo Médico:
El tratamiento médico puede realizarse con medicamentos locales intrasaculares sistémicos, o la combinación de ambos14,50. El medicamento de primera línea más utilizado es metotrexato (MTX) sistémico, debido a la experiencia en el uso en EE tubario7,14. Se recomienda utilizarlo en embarazos con menos de 8 semanas de gestación y con un grosor miometrial menor a 2 mm entre el embarazo y la vejiga8. En dosis similares al manejo habitual de EE (Tablas 1 y 2), siguiendo las mismas pautas de contraindicaciones absolutas y relativas al MTX (Tabla 3), con un tiempo medio de resolución de 40 días en promedio9,14.
Se ha reportado una tasa de éxito de sólo un 8,7% al ser utilizado como primera línea, con una tasa de complicaciones de 62,1% y una tasa de histerectomía posterior de aproximadamente un 4%10. Secundario al tejido fibroso de la cicatriz que rodea al saco gestacional, disminuye la absorción y eficacia de este medicamento, y puede pasar mucho tiempo antes que ejerza sus efectos, existiendo la posibilidad que esto nunca ocurra, perdiéndose tiempo valioso que puede terminar con complicaciones más graves10,11. Por lo tanto, no se recomienda el uso de MTX sistémico como primera línea en ECC. A pesar de lo anterior, se ha demostrado que cuando el tratamiento con MTX es exitoso, es posible lograr un futuro embarazo de término sin complicaciones10.
Algunos reportes internacionales han demostrado mejorar los resultados del manejo médico del ECC al administrar MTX de forma sistémica y local simultánemente, ya que esta última logra mayores concentraciones intrasaculares, lo que genera feticidio, y secundariamente una mejor respuesta al tratamiento sistémico. Ambas vías no son excluyentes entre sí6,51.
Existen otras opciones de medicamentos para ser administrados de forma local, pero con limitada información sobre su uso. Estas opciones también poseen un rol feticida e incluyen: cloruro de potasio, gefitinib, etanol, glucosa hiperosmolar, vasopresina y mifepristona, no existen estudios de calidad que comparen estos métodos7. Todos estos agentes se pueden administrar de forma individual o combinados, guíado o no por US. Su uso no es excluyente del uso de MTX sistémico. Se asocian a una alta tasa de falla (44 a 91%) si se usan como primera línea, requiriendo intervenciones adicionales quirúrgicas7.
- Embolización de las Arterias Uterinas (EAU):
La EAU tiene como objetivo lograr la estasis completa del flujo sanguíneo al útero7.
Distintas series han reportado que este procedimiento por sí solo tiene una tasa de complicación entre 46,9 a 80%, requiriendo un tratamiento complementario en 82% de los casos. Al combinar el uso de MTX sistémico, en conjunto con EAU se observa una mayor tasa de éxito, cercana al 80%8,9.
El uso de EAU debe limitarse a casos con sangrado significativo y/o un alto índice de sospecha de malformación arteriovenosa7. No se recomienda como primera línea cuando se usa como tratamiento único, debido al potencial de altas tasas de fracaso, complicaciones, y el impacto negativo que puede ocasionar en la fertilidad futura7,10.
- Manejo Quirúrgico:
Las opciones quirúrgicas se asocian a mayores tasas de éxito comparado con cualquier otro tratamiento, sin embargo, aún no se ha demostrado que reduzcan el riesgo de recurrencia11. Dentro de los criterios para decidir el método a utilizar, es importante considerar las habilidades del cirujano, las características del paciente y el deseo de fertilidad futura, siendo la laparoscopía el abordaje de elección7,11,15.
El legrado uterino está contraindicado en ECC debido a que el tejido trofoblástico se encuentra fuera de la cavidad uterina expuesta y puede llevar a potencial ruptura de la cicatriz uterina y disrupción miometrial con hemorragia grave50.
La histeroscopía es un procedimiento mínimamente invasivo que permite la visualización directa del saco gestacional y la posterior coagulación de la vasculatura relacionada al sitio de implantación para evitar cualquier sangrado profuso. Otras ventajas de este procedimiento por sobre el uso de MTX sistémico y la EAU es que evita la toxicidad de éstos, presentando un menor tiempo de resolución y rápido retorno de la fertilidad10. Está indicada principalmente en ECC tipo 1, y se ha reportado una tasa de éxito aproximada del 40 a 90%, con una tasa de complicaciones de 15 a 20%, menor a los otros tipos de tratamientos7,10,15. Debido al riesgo de trofoblasto residual posterior, múltiples revisiones han informado requerimiento de procedimientos adicionales, incluyendo histerectomía, con una menor tasa de complicaciones al combinarlos (2 a 18,4% aproximadamente)7,10. No existe descrita una técnica única utilizada, dificultando establecer una recomendación al respecto7,15.
La histerotomía por laparoscopía es un abordaje seguro y eficaz. Se realiza una resección en cuña y se extrae de forma completa el EE con la cicatriz de cesárea anterior, lo que permite evitar un extenso seguimiento posterior. Finalmente se realiza una reconstrucción del defecto del miometrio, y así se evita cualquier probable recurrencia51. Éste es el enfoque más adecuado en individuos con ECC tipo 2 o cuando se sospecha rotura uterina7,10. Diferentes revisiones sistemáticas han reportado hasta un 97% de éxito con una resolución rápida de β-hCG y mínimas complicaciones11,16. Además, otros estudios a largo plazo han demostrado mayor tasa de embarazos posteriores y una menor recurrencia de ECC, al compararlo con la laparotomía, por lo que se promueve como uno de los enfoques principales para el manejo del ECC7,20.
Existen pocos reportes que utilicen la laparotomía como primera línea dado que es un procedimiento invasivo con sus respectivos riesgos potenciales. El Colegio Americano de Obstetras y Ginecólogos (ACOG) afirma que un abordaje abdominal tiene una estancia hospitalaria alargada, mayor tiempo operatorio, riesgo de lesiones en la vejiga/ureter, pérdida sanguínea intraoperatoria, complicaciones de la herida operatoria y un retorno más lento a la actividad normal7. Dado lo anterior, es importante considerar un cirujano entrenado y preferir este abordaje sólo cuando el espesor miometrial entre el ECC y la vejiga es > 2 mm7. Se puede realizar una escisión en cuña miometrial o una histerectomía completa. Se ha reportado una tasa de éxito de 97%7.
EMBRAZO ECTÓPICO OVÁRICO
El embarazo ectópico ovárico ocurre en 1 de cada 2100 a 7000 embarazos20,43. Dentro de sus factores de riesgo se incluyen: enfermedad inflamatoria pélvica previa, uso de dispositivo intrauterino (DIU), uso de tecnologías de reproducción asistida, y endometriosis20,43.
La endometriosis, es un factor de riesgo específico de embarazo ovárico, pudiendo generar dos tipos: intra o extrafolicular, siendo este último el más común8. Los embarazos ováricos extrafoliculares se subclasifican en: intersticial, cortical, superficial y yuxtafolicular. Las etiologías sugeridas incluyen: interferencia en la liberación del óvulo del folículo roto, mal funcionamiento de las trompas, y engrosamiento inflamatorio de la túnica albugínea. Sin embargo, se han reportado EE ováricos en pacientes que carecen de trompas8.
Los EE ováricos son altamente vascularizado, por lo que se observa que hasta en un tercio de las pacientes su manifestacion inicial es mediante shock hemodinámico secundario a ruptura de éste8.
- Enfrentamiento diagnóstico
Realizar el diagnóstico específico de EE ovárico es difícil. La presentación clínica más frecuente incluye dolor abdominal y metrorragia escasa, síntomas poco específicos y comunes a otras patologías8. En 1878, Spiegelber describió cuatro criterios para establecer el diagnóstico de un EE ovárico: trompas completamente normales y separadas del ovario, saco gestacional localizado anatómicamente en el ovario, ovario y saco gestacional conectados al útero mediante el ligamento ovárico, y confirmación histológica de tejido placentario mezclado con la corteza ovárica17,20,43.
Hoy en día, el diagnóstico generalmente se realiza con un test de embarazo positivo, asociado a una US transvaginal que no observa la presencia de una gestación intrauterina. No existen criterios ultrasonográficos específicos establecidos, sin embargo, es frecuente observar el EE dentro del ovario, asemejando un ovario quístico de paredes gruesas con alta vascularización. También se puede observar adherido al ovario, asemejando un quiste con un anillo externo ecogénico amplio. Es menos frecuente evidenciar un saco vitelino o embrión. Además, el contenido del saco tiende a aparecer más tardío con respecto a la edad gestacional8,21. Es importante tener presente la sospecha clinica de esta patología, debido a que tanto por clínica como ecográficamente es difícil diferenciarlo entre un cuerpo lúteo, cuerpo lúteo hemorrágico, o un EE tubario adherido al ovario8,17.
La sociedad Americana de Medicina Reproductiva recomienda que el dignóstico definitivo del EE ovárico debe ser con una laparoscopía exploratoria, y confirmado posteriormente con histología6,8,20.
- Manejo del EE ovárico
- Manejo Expectante:
Los EE ováricos son altamente vascularizados, y si se permite que éstos progresen, eventualmente ocurrirá la ruptura del saco gestacional, provocando una hemorragia intraperitoneal masiva8,20. Por lo tanto, no se recomienda manejo expectante.
- Manejo Médico
La laparoscopía exploratoria es la clave para realizar el diagnóstico de un EE ovárico, con lo que no sería factible aplicar un manejo médico previo43. Debido al diagnóstico cada vez más precoz de EE ovárico, existen algunos reportes de uso exitoso de MTX, con indicaciones y contraindicaciones similares a las utilizadas en EE tubario (Tabla 3). Sin embargo, este éxito generalmente se debe al uso de procedimientos laparoscópicos previos, en donde el EE podría haber sido eliminado o destruído17,20.
Dado el riesgo de hemorragia intraperitoneal masiva secundaria a la ruptura del saco gestacional, el manejo médico no se recomienda como primera línea, ya que la alta probabilidad de falla (hasta 70%) de este método permite la progresión del EE ovárico20. Solo se usa si, posterior al tratamiento quirúrgico, hay persistencia de trofoblasto con aumento de sus niveles de β-hCG, o si la paciente tiene alto riesgo quirúrgico y cumple los siguientes criterios: tamaño < 35 mm, ausencia de saco vitelino, LCF ausentes y niveles de β-hCG <3000-5000 UI6,8,17.
- Manejo Quirúrgico:
El manejo quirúrgico es de elección. Se prefiere el abordaje laparoscópico, y la realización de una resección en cuña ovárica, lo cual remueve el EE, preservando el tejido ovárico sano8,17,20. Esto es particularmente importante si la paciente desea preservar su fertilidad futura20. Series internacionales reportan pacientes manejadas con cirugía conservadora de manera exitosa (>90%), y embarazo posterior exitoso8,20. Se sugiere realizar seguimiento de β-hCG hasta negativización de ésta44,45. La ooforectomía laparoscópica se reserva para embarazos con gestación avanzada20.
En una paciente hemodinámicamente inestable es necesaria una laparotomía exploratoria de urgencia, procediendo a la extracción del EE mediante ooforectomía o salpingooforectomía8.
EMBARAZO ECTÓPICO ABDOMINAL
El EE abdominal se presentan entre un 1,4% de éstos, con una incidencia de 1 por cada 10.000 partos19,20,52. Se produce la implantación en distintos sitios del abdomen, incluído el epiplón, hígado, bazo, intestino, grandes vasos, fondo de saco pélvico, ligamento ancho y paredes pélvicas laterales8,19.
Los factores de riesgo son similares al EE tubario: proceso inflamatorio pélvico previo, endometriosis y fertilización asistida, entre otros8. Se clasifican en primarios, cuando el extremo de la fimbria no “recoge” el folículo ovulado, y en secundarios, cuando ocurre aborto tubario a través de la fimbria y este se implanta en la cavidad peritoneal19,20.
La supervivencia del embarazo se relaciona con el sitio de implantación, dado que frecuentemente involucra grandes vasos y órganos vitales, los que pueden romperse y producir importantes hemorragias. Por lo que la mortalidad materna es alta (7,7 veces mayor a EE tubario y 90 veces mayor que el intrauterino)52, con riesgo de complicaciones, tales como hemorragia grave, coagulación intravascular diseminada, obstrucción intestinal y fístulas8,21. Es frecuente que estos casos se compliquen, dado el hallazgo de un feto con vida a una edad gestacional avanzada8,52.
- Enfrentamiento Diagnóstico
Los síntomas de presentación más comunes incluyen dolor abdominal, movimientos fetales dolorosos, sangrado vaginal, nauseas y vómitos8,52. Al examen físico, el útero no será palpable.
El diagnóstico se puede realizar mediante una imagen de rayos X abdominal, US o laparoscopía exploratoria. La tomografía computada y resonancia magnética son útiles para confirmar el diagnóstico, y distinguir las relaciones anatómicas, conexiones vasculares potenciales y evaluación del sitio placentario8,52.
Los criterios ecográficos para establecer el diagnóstico son: ausencia de un saco gestacional intrauterino, ausencia de trompa dilatada o imagen anexial compleja, saco gestacional rodeado de asas intestinales y separado de ellas por peritoneo con movilidad amplia similar a la fluctuación del saco, particularmente evidente al presionar el fondo de saco con el transductor8,19,20.
- Manejo del EE abdominal
- Manejo expectante:
Existen reportes de casos que han demostrado que cuando el diagnóstico se realiza posterior a las 24 semanas de gestación, y el feto está vivo, se puede dejar evolucionar hasta las 34-36 semanas, permitiendo que el feto sobreviva. Esto se prefiere en pacientes primigestas, sin embargo, la madre debe ser advertida y aconsejada sobre los riesgos asociados8.
- Manejo Médico:
Se han descrito casos de EE abdominal temprano tratado de forma exitosa con MTX sistémico. Sin embargo, muchas veces el diagnóstico se realiza de forma tardía, cuando las complicaciones maternas son mayores y ya no es posible aplicar este manejo8,52. Debido a que no existe suficiente evidencia que avale manejo médico en EE abdominal, no se recomienda como primera línea20.
- Manejo Quirúrgico:
El tratamiento quirúrgico es de elección. Se recomienda interrumpir el embarazo al momento del diagnóstico, debido a que en cualquier momento puede ocurrir muerte materna o fetal. Se debe efectuar laparoscopía en embarazos precoces. En cambio, en embarazos avanzados, la laparotomía es de elección8,52.
Uno de los problemas asociados a interrumpir un embarazo abdominal después del primer trimestre es el riesgo de sangrado incontrolable desde el lecho placentario. Debido a ésto, se recomienda abandonar la placenta in situ, asociando tratamiento adyuvante con MTX y/o embolización arterial selectiva, para acelerar su involución8,19,20.
EMBARAZO HETEROTÓPICO
Se define como un embarazo intrauterino y uno o más EE simultáneos. La ubicación más común del EE es por lo general la tuba uterina5,23,25. Es una patología infrecuente en la población normal, con una incidencia de 1:30.000 cuando ocurre de forma espontánea22,25,26. Por otro lado, aproximadamente casi un 1% de los embarazos secundarios a reproducción asistida resultan en un embarazo heterotópico5,6,22.
Actualmente sigue siendo desconocida su etiología. Los mayores factores de riesgo son: patología inflamatoria pélvica previa, cirugía tubaria previa, historia familiar de gestaciones múltiples, endometriosis, patología tubaria previa, niveles de hormonas femeninas elevados, uso de inductores de la ovulación, y uso de tecnologías de reproducción asistida. Sin embargo, algunas pacientes pueden no contar con ninguno de estos factores de riesgo26,27,41,53.
- Enfrentamiento Diagnóstico
Generalmente el diagnóstico de un embarazo heterotópico es tardío, dado la visualización temprana de una gestación intrauterina viable. Este retraso, puede aumentar el riesgo de complicaciones maternas, tales como: rotura de trompas, shock hipovolémico y necesidad de transfusión sanguínea. Éstas pueden perjudicar el embarazo intrauterino. Debido a lo anterior, es crucial sospecharlo para poder realizar el diagnóstico de forma temprana5,6,25,53.
Las manifestaciones clínicas son poco específicas. Hasta 50% de las pacientes pueden ser asintomáticas. También pueden presentar dolor abdominal, sangrado vaginal y spotting, síntomas que pueden estar presente en un embarazo intrauterino normal, o en otras complicaciones obstétrica25,26,27,41.
Las concentraciones de β-hCG para establecer un embarazo heterotópico, no son interpretables dado la coexistencia del EE con un embarazo intrauterino27,53. Debe sospecharse en mujeres con antecedente de reproducción asistida, niveles persistentemente elevados de β-hCG posterior a un aborto y embarazos intrauterinos con dolor pélvico persistente25,26.
La US permite diagnosticar el embarazo heterotópico cuando se observa la coexistencia de un embarazo intrauterino con un EE24,27,53. Sin embargo, la sensibilidad de la US transvaginal oscila entre un 26,3% a 92,4%26,27. Dado lo anterior, se estima que entre 58,93% a 73,75% de los casos de embarazo heterotópico son confirmados al momento de la cirugía27.
En pacientes que utilizan técnicas de fertilización asistida, se recomienda que a las 4 a 6 semanas posteriores al procedimiento se realice una US transvaginal de rutina para excluir la presencia de un embarazo heterotópico27.
- Manejo del Embarazo Heterotópico
El manejo del embarazo heterotópico es aún controversial. La mayoría de las pacientes fueron sometidas a reproducción asistida y por ende, presentan un importante deseo de preservar el embarazo intrauterino viable. Por lo tanto, el objetivo del tratamiento es intentar preservar el embarazo intrauterino, resolviendo el EE25,26,27. Se ha demostrado que cuando se trata de forma satisfactoria el EE, la tasa de supervivencia del embarazo intrauterino puede ser de 63,3% aproximadamente27.
- Manejo Expectante:
En pacientes hemodinámicamente estables, con un EE no viable y asintomáticas, puede considerarse el manejo expectante. La principal ventaja es que evita todas las potenciales complicaciones de una cirugía27. El riesgo de que el EE crezca y se rompa es similar a la reportada en EE tubario único (40%), siendo el método con peores resultados maternos27. Además, aproximadamente un 25-30% de estos embarazos pueden evolucionar en un aborto espontáneo del embarazo intrauterino5,27,41. Por lo tanto es importante mantener un seguimiento estricto y controles regulares con US seriadas. En caso de que presente cualquier sospecha de rotura o crecimiento del EE, se debe considerar manejo quirúrgico27.
- Manejo Médico:
Existe evidencia significativa sobre la teratogenicidad del MTX, pudiendo provocar un aborto del embarazo intrauterino viable. Por lo tanto, el uso de MTX tiene contraindicación absoluta en embarazos heterotópicos5,6,27,53.
La administración local de cloruro de potasio, como de glucosa hiperosmolar han reportado una tasa de aborto del embarazo intrauterino de hasta un 50%25. Dado su rol feticida, como centro no lo recomendamos.
- Aspiración del EE
La aspiración del EE guiada por US transabdominal, es un procedimiento mínimamente invasivo. Ha sido utilizado por años, y ha demostrado ser efectivo y seguro, evitando las complicaciones inherentes de una cirugia25,26,27. La dificultad de este procedimiento depende de la ubicación del EE, y solo debe ser realizado si el saco gestacional se puede visualizar de forma clara27.
Existen reportes de casos con rotura del EE posterior al procedimiento, por lo que se recomienda realizar US seriadas y mantener a la paciente en observación estricta hasta que el saco gestacional se estabilice27. Si se evidencia crecimiento del EE, se puede repetir el procedimiento o cambiar a un manejo quirúrgico27.
- Manejo Quirúrgico:
La literatura internacional sugiere un abordaje laparoscópico en pacientes con sospecha de EE simultáneo a un embarazo intrauterino, dado la mínima manipulación uterina. La salpingectomía vía laparoscópica es el abordaje de primera línea recomendado en EE heterotópico tanto asintomático como EE roto6,26,27.
El manejo quirúrgico tiene la ventaja de lograr una remoción completa del EE. La tasa de abortos del embarazo intrauterino reportada es hasta un 31,25%5,27. Existe un riesgo bajo de hemorragia durante la cirugía, con la necesidad de realizar una histerectomía en <1% de los casos2.
EMBARAZO ECTÓPICO INTERSTICIAL/CORNUAL
Estos embarazos comprenden entre el 2 a 3% de todos los EE, con una mortalidad 2 a 3 veces mayor que otros tipos de embarazos extrauterinos20,42.
Los términos EE intersticial y cornual se pueden usar como sinónimos, pero algunos autores los diferencian según el lugar de implantación del saco gestacional. En el EE intersticial, la implantación ocurre en la unión entre la zona intersticial de las tubas uterinas y el miometrio uterino, lateral al ligamento redondo, mientras que el término cornual se reserva para cuando ocurre en una de las porciones latero superiores del útero, los cuernos8,20,42,54. En esta revisión se hablarán de ambos como sinónimos.
Esta zona posee un miometrio grueso y gran irrigación sanguínea proveniente de ramas de las arterias uterinas y ováricas. Puede dilatarse asintomáticamente hasta llegar a embarazos de 16 a 18 semanas, siendo susceptible a rotura54. Esta complicación alcanza una frecuencia de 50% en el primer trimestre y 87% posteriormente, con consecuencias catastróficas, ya que el hemoperitoneo puede resultar mortal si el diagnóstico no se hace oportunamente8,42,54.
El principal factor de riesgo es una salpingectomía ipsilateral previa, dado que el “muñón” residual de la trompa puede ser el lugar donde se produzca el desarrollo de este EE8,20.
- Enfrentamiento diagnóstico
Estas patologías son difíciles de diagnosticar tanto por clínica como ecográficamente, por lo que tiene una alta tasa de complicaciones y mortalidad materna, siendo responsable del 20% de todas las muertes causadas por EE8,19.
Los síntomas de presentación pueden incluir amenorrea y spotting, con o sin dolor abdominal. El diagnóstico depende de la US transvaginal combinada con la evaluación laparoscópica8,19.
Los signos ecográficos sugerentes, incluyen cavidad uterina vacía, saco coriónico separado, al menos 1 cm del borde lateral de la cavidad uterina, capa delgada de miometrio (< 5 mm) que rodea el saco gestacional8,19,20,42,54.
- Manejo del EE intersticial/ Cornual
- Manejo Expectante
Existen pocos estudios que avalen el manejo expectante en pacientes con embarazo intersticial, dado el riesgo de rotura uterina. Es factible considerar este manejo en pacientes con deseo de fertilidad futura y que cumplan las siguientes caracterísicas: hemodinámicamente estables, niveles de β-hCG menor a 4000 UI/L y que vayan en disminución, y tamaño del embarazo menor a 4 cm6,8,20. Se ha reportado un riesgo de falla de un 40-50%8.
- Manejo Médico
El manejo médico puede ser local o sistémico con MTX, etopósido, o inyecciones intrasaculares con cloruro de potasio. El uso de MTX sistémico en dosis única o múltiples, ha reportado un éxito de 83-91%, sin embargo aun faltan estudios con mayor cantidad de pacientes para establecer los criterios de inclusión para su uso6,8.
- Embolización arterias uterinas:
Un estudio reciente ha combinado la infusión de MTX en la arteria uterina y embolización de ésta, con el uso de MTX sistémico, reportando un 96% de éxito con un tiempo medio de resolución de la β-hCG de 52 días. Entre las pacientes con deseo de paridad, e intentos de una nueva concepción después de un año de tratamiento, se evidencia una tasa de 83% de embarazo posterior8,46.
- Manejo Quirúrgico:
El tratamiento quirúrgico es de elección20. En el caso de una paciente hemodinámicamente estable, sin evidencia de EE roto, y tamaño de 3,5 cm o menos, se recomienda una cornuostomía o salpingostomía vía laparoscópica. Los embarazos que miden más de 3-4 cm requieren una resección cornual (en cuña) y salpingectomía para prevenir recurrencia6,8,54. Se ha reportado que en los embarazos futuros tienen mayor riesgo de rotura uterina, sin embargo no se ha descrito la vía de parto recomendada para éstos8. En nuestro centro, dado la presencia de una cicatriz miometrial, recomendamos una cesárea electiva.
En caso de una paciente inestable, con alteración hemodinámica, o sospecha de EE roto, se requiere una laparotomía de urgencia. Puede ser necesario realizar una histerectomía de emergencia en caso de sangrado incontrolable6,8.
EMBARAZO ECTÓPICO CERVICAL
El Embarazo Cervical (EC) es una patología con una frecuencia de 0,15-0,3% de los casos1. Se implanta en la mucosa cervical, por debajo el orificio cervical interno (OCI)29,30. Debido a su ubicación, produce riesgo de penetración del trofoblasto a través de la pared cervical y hacia los vasos uterinos8. Dentro de los factores de riesgo se encuentran: legrado uterino previo, aborto inducido, síndrome de Asherman, tumor intrauterino, presencia de DIU, fertilización in vitro, exposición a dietilestilbestrol, leiomiomatosis y anormalidades estructurales29,30.
- Enfrentamiento diagnóstico:
Las paciente pueden ser sintomáticas o asintomáticas al momento del diagnóstico. Un tercio se presentan con sangrado vaginal profuso y dolor29,31. En la especuloscopía se observa un cuello cerrado, aunque se puede observar el orificio cervical externo (OCE) abierto, con membranas fetales o lesión quística, correspondiente a trofoblasto29,31.
Los criterios clínicos diagnósticos de EC son: sangrado vaginal, cérvix aumentado de tamaño en proporción igual o mayor al cuerpo uterino (útero en reloj de arena), estructuras embrionarias fírmemente unidas al endocérvix, OCI cerrado, OCE parcialmente abierto, ecos intrauterinos amorfos difusos, y ausencia de embarazo intrauterino en la US32,33,34,35.
Es importante distinguirlo de un aborto incompleto o espontáneo en evolución. El EC tiene contorno regular del saco gestacional, LCF (+) en el 60% de los casos, ausencia de “signo de deslizamiento” (movimiento del saco gestacional secundario a la presión del transductor), y presencia de flujo sanguíneo peritrofoblástico en el Doppler color; lo que no se observa en un saco no viable33,35.
- Manejo del EC
- Manejo Expectante:
No se recomienda manejo expectante ya que el EC se puede romper, causando una hemorragia grave que puede ser potencialmente mortal8. En caso de considerarlo, se indica en pacientes con deseos de fertilidad futura, embarazo menor de 12 semanas, LCF ausentes y valores de β-hCG en descenso.
- Manejo Médico:
En pacientes hemodinámicamente estables, el manejo médico con MTX es de elección, siguiendo los mismos protocolos de uso establecidos en EE (Tablas 1 y 2). Se ha reportado una eficacia entre 60-90% y preservación de la fertilidad sobre 90% de los casos tratados con MTX durante el primer trimestre(31,37). Se recomienda uso de MTX con LCF ausentes, sin embargo se reportan casos de éxito en EC con LCF presentes31,34,37.
El Cloruro de Potasio en inyecciones intraamnióticas es otra opción de manejo médico. Generalmente se utiliza como complemento del manejo con MTX en EC con LCF presentes6,34,39.
- Embolización arterias uterinas:
Sus ventajas sobre otras modalidades de tratamiento incluyen menor estadía hospitalaria, menor tiempo de seguimiento, menos controles ambulatorios y prevención de hemorragias. Sin embargo, es importante asesorar a la paciente sobre la eventual disminución de la fertilidad por la pérdida de la reserva ovárica y la posible aparición de complicaciones obstétricas en futuros embarazos47.
Estudios recientes han combinado la infusión de MTX en la arteria uterina y embolización de ésta, con el uso de MTX sistémico, reportando un 96% de éxito con negativización de β-hCG en 52 días promedio6,8.
- Manejo Quirúrgico:
La principal complicación es la hemorragia grave, por lo tanto es fundamental el manejo hemostático8.
Series internacionales han demostrado el uso exitoso del legrado uterino en EC de primer trimestre29. El legrado uterino por si solo conlleva un 40% de riesgo de histerectomía debido al riesgo de hemorragia masiva que esto implica35,47. Como método de contención del sangrado se puede utilizar el cerclaje cervical de forma profiláctica. Se coloca una sutura utilizando la técnica de McDonald, dejándola lista para ser atada en caso de ser necesario29. Posterior al legrado uterino, se retira el cerclaje y se infla el balón de una sonda foley de 30 ml en el canal cervical para tamponar la zona por 24 horas, para prevenir hemorragias post procedimiento29. Esto permite eliminar los riesgos maternos del uso de MTX y evitar la necesidad de seguimiento posterior, además de eliminar la necesidad de embolización de arteria uterina29.
Como alternativa al legrado uterino, ha demostrado ser efectiva la resección histeroscópica del EC. Es un procedimiento mínimamente invasivo que permite la visulización directa del saco gestacional y la posterior coagulación de la vasculatura relacionada al sitio de implantación para evitar cualquier sangrado profuso55,56. Otras ventajas de este procedimiento por sobre el uso de MTX sistémico y la EAU es que evita la toxicidad de éstos, presentando un menor tiempo de resolución y rápido retorno de la fertilidad10.
La histerectomía total es el tratamiento de elección para pacientes con EC diagnosticados durante el segundo trimestre, inestabilidad hemodinámica, sangrado vaginal masivo, patología uterina asociada, y paridad cumplida29,47.
El principal problema del manejo quirúrgico es el potencial efecto perjudicial en la fertilidad futura, por lo que se utiliza en caso de fracaso de tratamiento médico8,29,34. En caso de que la paciente presente compromiso hemodinámico, se debe realizar una histerectomía de urgencia31,36,37,38.
CONCLUSIONES
Los EE no tubarios son una condición poco frecuente, asociadas a una alta morbimortalidad materna. Son difícil de diagnosticar debido a que la mayoría de las veces las pacientes presentan una clínica poco específica, similar a la de otras patologías obstétricas más frecuentes, por lo que muchas veces se diagnostican de forma tardía.
Para realizar el diagnóstico, hay que considerar la clínica, factores de riesgo y antecedentes gineco-obstétricos previos de las pacientes. Considerar siempre estas patologías cuando una paciente se presente con shock hipovolémico. Es necesario medir los niveles de β-hCG en sangre y complementar con una US transvaginal. Sin embargo, muchas veces el diagnóstico se realiza con una laparoscopía diagnóstica.
Actualmente no existe un consenso sobre el tratamiento óptimo de los EE no tubarios. Hay que tener en cuenta la ubicación, edad gestacional, estabilidad hemodinámica, antecedentes, y deseos de fertilidad futura de la paciente.
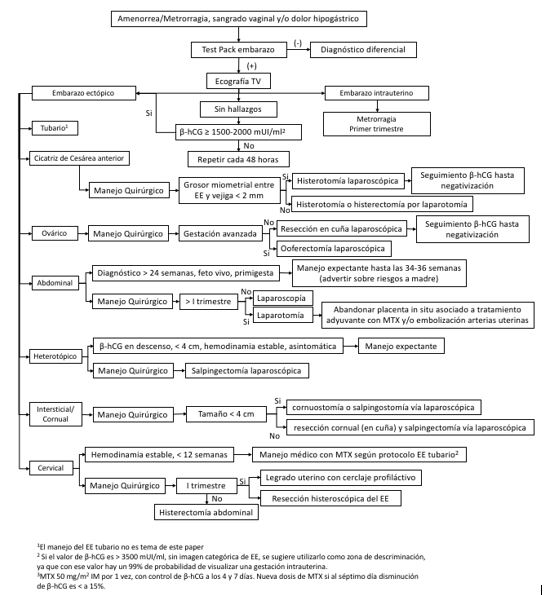
En la Figura 1 se observa un algoritmo que incluye el manejo de elección en cada tipo de EE. Tanto en el ECC, EE ovárico, EE abdominal y el EE intersticial/cornual, el manejo quirúrgico vía laparoscópica es de elección. No se recomienda el uso de MTX como primera línea, dado su alta asociación a complicaciones y necesidad de histerectomía. En caso de una paciente que se presente con inestabilidad hemodinámica o sospecha de EE roto, es necesaria una laparotomía.
En el embarazo heterotópico, el uso de MTX, tiene contraindicación absoluta. La salpingectomía vía laparoscópica es el abordaje de primera línea recomendado.
En EC hemodinámicamente estables, el manejo médico con MTX es de elección. En caso de LCF (+) también ha demostrado ser exitosa la inyección intrasacular de cloruro de potasio en conjunto con MTX sistémico o la combinacion entre MTX y embolización. El manejo quirúrgico se reserva en caso de fracaso de tratamiento médico, con compromiso hemodinámico. Se debería realizar histerectomía de urgencia.
REFERENCIAS
1 Cuello M, Miranda V, Ralph C. Embarazo Ectópico. Ginecología General y Salud de la Mujer. 1ª ed. Santiago: Ediciones UC, 2017; pags 259-269.
2 Martínez A, Quintero L, García C, Fernández A. Embarazo ectópico cervical: diagnóstico preciso y enoque de manejo médico. Reporte de caso. Universitas Médica 2018; 59(1). http://doi.org/10.11144/Javeriana.umed59-1.ecto.
3 Ortolá S, Serrano J, Ortega A. Embarazo Ectópico sobre cicatriz de cesárea. Prog Obstet Ginecol 2018;61(3):261-263.
4 Glenn T, Bembre J, Findley A, Yaklic J, Bhagavath B, Gagneux P, et al. Cesarean Scar Ectopic Pregnancy: Current Management Strategies. Obstetrical and gynecological Survey 2018;73(5):293-302.
5 Clayton H, Schieve L, Peterson H, Jamieson D, Reynolds M, Wright V. Ectopic Pregnancy risk with assisted reproductive technology procedures. Obstet Gynecol 2006; 107(3):595-604.
6 American Society for Reproductive medicine. Medical treatment of ectopic pregnancy: a committee opinion. Fertil Steril 2013; 100(3):638-644.
7 Glenn T, Bembry J, Findley A, Yaklic J, Bhagavath B, Gagneux P, et al. Cesarean Scar Ectopic Pregnancy: Current Management Stratgies. Obstetrical and Gynecological Survey 2018; 73(5):293-302.
8 Parker V, Srinivas M. Non-tubal ectopic pregnancy. Arch Gynecol Obstet 2016;294:19-27.
9 Timor-Tritsch I, Monteagudo A, Santos R, Tsymbal T, Pineda G, Arslam A. The diagnosis, treatment, and follow-up of cesarean scar pregnancy. American Journal of Obstetrics & Gynecology 2012;207:44.e1-e13.
10 Kanat-Pektas M, Bodur S, Dundar O, Bakir V. Systematic review: What is the best first-line approach for cesarean section ectopic pregnancy?. Taiwanese Journal of Obstetrics & Gynecology 2016;55:263-269.
11 Maheux-Lacroix S, Li F, Bujold E, Nesbitt-Hawes E, Deans R, Abbot J. Cesarean Scar Pregnancies: a Systematic Review of Treatment Options. Journal of Minimally Invasive Gynecology 2017;24:915-925.
12 Koplay M, Utku Dogan N, Sivri M, Erdogan H, Dogan S, Celik C. Ectopic Pregnancy in a Cesarean Section Scar: Successful Management Using Vaccum Aspiration under Laparoscopic Supervision: Mini Review of Current Literature. Case Reports in Surgery 2016;2016:7460687
13 Liu H, Leng J, Shi H, Lang J. Expectant treatment of cesarean scar pregnancy: two case reports and glimpse at the natural courses. Arch Gynecol Obstet 2010; 282:455-458.
14 Cheung V. Local Methotrexate Injection as the First-line Treatment por Cesarean Scar Pregnancy: Review of the Literature. Journal of Minimally Invasive Gynecology 2015; 22:753-758.
15 Propst A, Liberman R, Harlow B, Ginsburg E. Complications of Hysteroscopic Surgery: Predicting Patients at Risk. Obstetrics & Gynecology 2000; 96(4):517-520.
16 Petersen K, Hoffmann E, Larsen C, Nielsen H. Cesarean scar pregnancy: a systematic review of treatment studies. Fertil Steril 2016; 105:958-965.
17 Su Wen-Hsiang, Cheung Sai-Ming, Chang Sheng-Ping, Chang Wen-Hsun, Cheng Ming-Huei. Is ovarian Pregnancy a Medical Illness? Methotrexate Treatment Failure and Rescue by Laparoscopic Removal. Taiwan J Obstet Gynecol 2008; 47(4): 471-473.
18 Panelli D, Phillips C, Brady P. Incidence, diagnosis and management of tubal and nontubal ectopic pregnancies: a review. Fertility Research and Practice 2015; 1:15.
19 Shen L, Fu J, Huang W, Zhu H, Wang Q, Yang S, et al. Interventions for non-tubal ectopic pregnancy. Cochrane Database of Systematic Reviews 2014; 7:CD011174.
20 Chetty M, Elson J. Treating non-tubal ectopic pregnancy. Best Practice & Research Clinical Obstetrics and Gynaecology 2009; 23: 529-538.
21 Rahman MS, Al-Suleiman SA, Rahman J, Al-Sibai MH. Advanced abdominal pregnancy—observations in 10 cases. Obstet Gynecol 1982;59(3):366-372.
22 Chin H, Chen F, Wang C, Shui L, Liu Y, Soong Y. Heterotopic pregnancy after in vitro fertilization – embryo transfer. International Journal of Gynecology and Obstetrics 2004; 86: 411-416.
23 Bowditch J. Heterotopic Pregnancy After Natural Conception Exhibiting the Ultrasound Signs of Antegrade and Retrograde Tubal Bleeding. Aust NZ J Obstet Gynaecol 1994; 34(5): 614.
24 De Voe R, Pratt J. Simultaneous intrauterin and extrauterine pregnancy. Am J Obst & Gynec 1948; 56(6): 1119-1126.
25 Aziz M, Arronte J. A case of spontaneous heterotopic pregnancy in natural conception complicated with hemoperitoneum. Heliyon 2020; 6:e03373.
26 Farnaghi S, Kothari A. Heterotopic pregnancy: a report of two cases. AJUM 2013; 16(1): 30-36.
27 Li J, Kong L, Yang J, Niu G, Fan Li, Huang J, et al. Management of Heterotopic Pregnanvy. Medicine 2016; 95(5):e2570.
28 Kirk E, Condous G, Haider Z, Syed A, Ojha K, Bourne T. The conservative management of cervical ectopic pregnancies. Ultrasound Obstet Gynecol 2006; 27: 430-437.
29 Fylstra DL. Cervical pregnancy: 13 cases treated with suction curettage and balloon tamponade. Am J Obstet Gynecol 2014(6);210:581.e1-5.
30 Borges R, Moya L, Galloso Y, Moré A, González C. Embarazo ectópico cervical. Revista cubana de obstetricia y ginecología 2019; 45(1): 74-85.
31 Cervical Pregnancy, 2019. Tulandi T. Hallado en: https://www-uptodate-com.pucdechile.idm.oclc.org/contents/cervical-pregnancy?search=Cervical%20pregnancy&source=search_result&selectedTitle=1~124&usage_type=default&display_rank=1. Acceso el 23 de Febrero de 2020.
32 Martínez R, Quintero L, García C, Fernández De Castro A. Embarazo ectópico cervical: diagnóstico preciso y enoque de manejo médico. Reporte de caso. Universitas Médica 2018; 59(1). http://doi.org/10.11144/Javeriana.umed59-1.ecto.
33 Raskin MM. Diagnosis of cervical pregnancy by ultrasound: a case report. Am J Obstet Gynecol 1978;130:234-5.
34 Timor-Tritsch IE, Monteagurdo A, Mandeville EO, Peisner DB, Anaya GP, Pirronw EC. Successful management of a viable cervical pregnancy by local injection of methotrexate, guided by transvaginal ultrasonography. Am J Obstet Gynecol 1994;170:737-9.
35 Arozamena B, Muñoz A, Merino A. Caso Clínico: Embarazo ectópico cervical, presentación de un caso clínico. Rev Chil Obstet Ginecol 2017; 82(6): 610-613.
36 Troncoso F, Cardone X, Rondini C,Troncoso C. Embarazo Ectópico Cervical. Diagnóstico y Tratamiento conservador con cerclaje cervical. Rev. Chil Obstet Ginecol 2005; 70(4): 257-260.
37 Murji A, Garbedian K. Conservative Management of Cervical, Ectopic Pregnancy. J Obstet Gynaecol Canada 2015; 37(11):1016–1020.
38 Frías Z, Pantoja M, Fernández M, Vico FJ, Pantoja FJ. Manejo de la gestación ectópica cervcal. Tratamiento médico con pauta multidosis de metotrexato intramuscular; a propósito de un caso. Clin Invest Gin Obst. 2018. http://doi.org/10.1016/j.gine.2018.02002.
39 Zeki A, Serdar M, Mustafa E, Sahin Y. Conservative management of cervical ectopyc pregnancy: Single-center experience. J Obstet Gynaecol Res 2017; 43(8):1299-1304.
40 Togas Tulandi, Robert L, Barbieri, Review Cervical Pregnancy J Obstet Gynaecol Canada 2012;34(4):359–362
41 Tal J, Haddad S, Gordon N, Timot-Tritsch I. Heterotopic pregnancy after ovulation induction and assisted reproductive technologies: a literature review from 1971 to 1993. Fertility and Sterility 1996; 66(1): 1-12.
42 Bertin F, Montecinos M, Torres P, Pinto P. Embarazo ectópico cornual, diagnóstico y tratamiento: reporte de dos casos y revisión de la literatura. Rev chil obstet ginecol 2019; 84(1): 55-63.
43 Shamma, FN, Schwartz, LB. Primary ovarian pregnancy successfully treated with methotrexate. Am J Obstet Gynecol 1992; 167:1307
44 Seinera P, Di Gregorio A, Arisio R, Decko A, Crana F. Ovarian pregnancy and operative laparoscopy: report of eight cases. Human Reproduction 1997; 12(3): 608-610.
45 Alkatout I, Honemeyer U, Strauss A, Tinelli A, Malvasi A, Jonat W, et al. Clinical diagnosis and Treatment of Ectopic Pregnancy. Obstetrical and Gynecological Survey 2013; 68(8): 571-581.
46 Krissi H, Hiersch L, Stolovitch N, Nitke S, Wiznitzer A, Peled Y. Outcome, complications and future fertility in women treatd with uterine artery embolization and methotrexate for non-tubal ectopic pregnancy. Eur J Obstet Gynecol Reprod Biol 2014; 182: 172-176.
47 Honsi M, Herath R, Rashid M. Diagnostic and Therapeutic Dilemmas of Cervical Ectopic Pregnancy. Obstetrical and Gynecological Survey 2014; 69 (5): 261-276.
48 Scott JW, Diggory PL, Edelman PJ. Management of cervical pregnancy with circumsuture and intracervical obturator. Br Med J. 1978;1:825–826
49 Mashiach S, Admon D, Oelsner G, et al. Cervical Shirodkar cerclage may be the treatment modality of choice for cervical pregnancy. Hum Reprod. 2002;17:493–496.
50 Yáñez R, Martínez P, Ibáñez Y, Benavides C, Vega A. Embarazo ectópico ístimico-cervical en cicatriz de cesárea previa. Rev Chil Obstet Ginecol 2007; 72(3): 186-189.
51 Giovani C, Agudelo C. Cirugía laparoscópica e histeroscópica para embarazo ectópico sobreinfectado en cicatriz de cesárea previa: presentación de un caso. Rev Chil Obstet Ginecol 2016; 81(4): 324-329.
52 Vargas-Hernández V, Hernández M, Ventura V, Tovar J. Embarazo ectópico abdominal, presentación de un caso y revisión de la literatura. Rev Chil Obstet Ginecol 2017; 82(3): 338-344.
53 Kaplan F, Espinoza O, Scheppeler M, Cabrera D. Embarazo heterotópico: Una patología emergente. Rev Chil Obstet Ginecol 2002; 67(5): 402-404.
54 Bertin F, Montecinos M, Torres P, Pinto P. Embarazo ectópico cornual, siagnóstico y tratamiento: reporte de dos casos y revisión de la litertura. Rev Chil Obstet Ginecol 2019;48(1): 55-63.
55 Kim J, Nam K, Kim T, Lee H, Lee K. Hysteroscopic Management of Cervical Pregnancy with Intrauterine Irrigation with H2O2. Journal of Minimally Invasive Gynecology 2008;15(5): 627-630.
56 Scutiero G, Nappi L, Matteo M, Balzano S, Macarini L, Greco P. Cervical pregnancy treated by uterine artery embolization combined with office hysteroscopy. European Journal of Obstetrics & Gynecology and Reproductive Biology 2013;166:104-106.
57 Doubilet P, Benson C. Further Evidence Against the Reliability of the Human Chorionic Gonadotropin Discriminatory Level. J Ultrasound Med 2011; 30:1637-1642
58 Ko J, Cheung V. Time to Revisit de Human Chorionic Gonadotropin Discriminatory Level in the Management of Pregnancy of Unknown Location. J Ultrasound Med 2014; 33:465-471.
TABLAS Y FIGURA
Tabla 1. Protocolo de tratamiento con MTX en dosis única según American Society for Reproductive Medicine6, modificado al español.
| Día de tratamiento | Evaluación de laboratorio | Intervención |
| Previo al tratamiento | bHCG, RCC con diferencial, pruebas hepáticas, creatinina, Grupo sanguíneo y Rh | Descartar aborto espontáneo
Rhogam si es Rh negativo |
| 1 | bHCG | MTX 50 mg/m2 IM |
| 4 | bHCG | |
| 7 | bHCG | MTX 50 mg/m2 IM si bHCG disminuye <15% entre días 4 y 7 |
| Nota: RCC = recuento celular completo; MTX = metrotrexato; IM = intramuscular | ||
Tabla 2. Protocolo de tratamiento con MTX en dosis múltiple según American Society for Reproductive Medicine6, modificado al español.
| Día de tratamiento | Evaluación de laboratorio | Intervención |
| Previo al tratamiento | bHCG, RCC con diferencial, pruebas hepáticas, creatinina, Grupo sanguíneo y Rh | Descartar aborto espontáneo
Rhogam si es Rh negativo |
| 1 | bHCG | MTX 1 mg/kg IM |
| 2 | LEU 0,1 mg/kg IM | |
| 3 | bHCG | MTX 1 mg/kg IM si disminuye <15% entre día 1 y 3. Si > 15%, suspender tratamiento y vigilar. |
| 4 | LEU 0,1 mg/kg IM | |
| 5 | bHCG | MTX 1 mg/kg IM si disminuye <15% entre día 3 y 5. Si > 15%, suspender tratamiento y vigilar. |
| 6 | LEU 0,1 mg/kg IM | |
| 7 | bHCG | MTX 1 mg/kg IM si disminuye <15% entre día 5 y 7. Si > 15%, suspender tratamiento y vigilar. |
| 8 | LEU 0,1 mg/kg IM | |
| Nota: vigilar cada 7 días (hasta bHCG < 5UI/ml). Pruebas de laboratorio de screening deben ser repetidas semanalmente desde la última dosis de MTX. RCC = recuento celular completo; MTX = metrotrexato; IM = intramuscular; LEU = leucovorina. | ||
Tabla 3. Contraindicaciones al uso de MTX según American Society for Reproductive Medicine6, modificado al español.
| Contraindicaciones Absolutas | Containdicaciones Relativas |
| – Embarazo intrauterino
– Evidencia de inmunodeficiencia – Anemia moderada o grave, leucopenia, o trompocitopenia – Sensibilidad a MTX – Enfermedad pulmonar activa – Úlcera Péptica activa – Disfunción hepática clínica importante – Disfunción renal clínica importante – Lactancia – Embarazo ectópico roto – Paciente hemodinámicamente inestable |
– LCF (+) detectados en US transvaginal
– Concentración inicial elevada de b-hCG (>5000 mUI/ml) – Embarazo ectópico > 4 cm en US transvaginal – Paciente que se rehusa a aceptar transfusiones sanguíneas – Paciente no capaz de mantener seguimiento. |
| Nota: MTX = metotrexato, LCF = laticos cardio fetales, US = ultrasonografía | |
Figura 1: Algoritmo de tratamiento de todos los EE no tubarios