2018
4
Autores:
Zoraida Frías Sánchez, Manuel Pantoja Garrido, Sara Rojo Novo, Julián Jiménez Gallardo, Francisco Márquez Maraver, Alfredo Polo Velasco, Álvaro Gutiérrez Domingo
Tipo de documento:
Casos ClínicosADENOCARCINOMA SINCRÓNICO DE ALTO GRADO DE ENDOMETRIO Y OVARIO; A PROPÓSITO DE UN CASO CLÍNICO
Contenido del documento:
RESUMEN
El cáncer sincrónico endometrial y ovárico (SEOC) representa alrededor de un 5-10% de las neoplasias de endometrio y ovario. Cuando no existe extensión locorregional y presentan un patrón histológico de bajo grado, actúan como si fueran dos tumores primarios independientes, en lugar de comportarse como un cáncer en estadio avanzado. Los mecanismos para diferenciar si su origen es metastásico o por el contrario, son tumores primarios independientes conlleva una gran dificultad y ha generado una importante controversia dentro del estudio de este tipo de neoplasias. En este artículo, exponemos el caso clínico de una paciente de 46 años que presenta un tumor sincrónico de endometrio y ovario en estadio IA, desconocido hasta el estudio histológico de la pieza quirúrgica.
PALABRAS CLAVE: Cáncer ovario, Cáncer endometrio, Cánceres sincrónicos, Seroso papilar, Células claras
SUMMARY
Endometrial and ovarian synchronous cancer (SEOC) accounts for about 5-10% of endometrial and ovarian neoplasms. When there is no local extension and they present a low-grade histological pattern, they act as if they were two independent primary tumours, instead of behaving as an advanced stage cancer. Therefore, the differentiation of its origin (metastatic or independent primary tumours) is fraught with difficulty and has generated a significant controversy in the study of this type of neoplasms. In this article, we present the clinical case of a 46-year-old patient presenting a synchronous tumor of the endometrium and ovary in IA stage, unknown until the histological study of the surgical sample.
KEY WORDS: Ovarian cancer, Endometrial cancer, Synchronous cancers, Papillary serous, Clear-cell.
Durante el año 2017, el cáncer de endometrio se ha mantenido como el tumor maligno ginecológico más frecuente en EEUU, estimándose una incidencia de 61000 casos nuevos anuales1. La presencia simultánea de una neoplasia de endometrio y de ovario se define como cáncer sincrónico de endometrio y ovario (SEOC), y se observa en un 3-5% aproximadamente, de todos los cánceres endometriales diagnosticados1,2. Por lo tanto, es una patología controvertida desde el punto de vista clínico, diagnóstico, terapéutico y, sobre todo, pronóstico2. Uno de los obstáculos fundamentales está relacionado con su clasificación histológica ya que, en numerosas ocasiones, presentan el mismo subtipo histopatológico, dificultando su diferenciación de la enfermedad metastásica1,2. La clínica y el diagnóstico no difieren de las neoplasias únicas, sin embargo, el pronóstico puede verse alterado en comparación con tumores malignos aislados. Así pues, el efecto pronóstico ha sido y es, objeto de debate en la literatura científica, por lo que es imprescindible continuar reportando todos los casos que existan de esta rara patología, ya que nos aportan una visión cada vez más nítida sobre el manejo de dicha entidad clínica. A continuación, exponemos el caso de una mujer diagnosticada de dos tumores malignos ginecológicos independientes y sincrónicos, de endometrio y ovario de alto grado.
CASO CLÍNICO
Presentamos el caso de una mujer de 46 años de edad, que acudió a consultas externas de ginecología del Hospital Virgen Macarena de Sevilla, tras haber sido estudiada en un centro privado, por metrorragias abundantes de 6 meses de evolución. Como único antecedente oncológico familiar, su hermano había padecido años atrás un cáncer vesical; no tenía otra historia familiar de cáncer ginecológico ni de mama. Entre sus antecedentes personales, no presentaba alergias medicamentosas y no padecía ningún tipo de enfermedad ni intervención quirúrgica reseñable. Su índice de masa corporal era de 29,36 y, utilizaba como método anticonceptivo el preservativo. Desde el punto de vista gineco-obstétrico, presentaba como antecedente dos embarazos que finalizaron mediante parto vaginal. La paciente refería una historia de metrorragias abundantes, invalidantes para su actividad laboral, de más de 6 meses de evolución, que no remitieron con el tratamiento médico domiciliario. El tratamiento que estaba realizando desde hacía 8 meses, había sido norestisterona 10 mgr durante 20 días al mes, asociado a una pauta de ácido tranexámico 3 veces al día, utilizado ocasionalmente. Pese a que se planteó la inserción de un dispositivo intrauterino liberador de levonorgestrel, la paciente lo rechazó por motivos personales, por los que se usaba sólo tratamiento oral alternando la norestisterona y la progesterona en comprimidos.
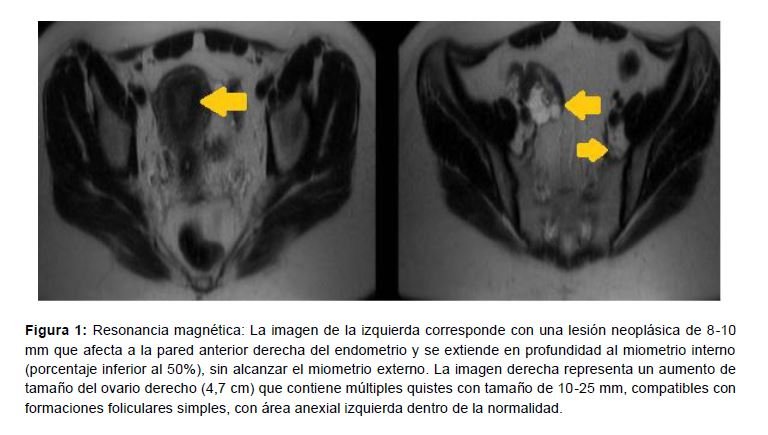
Había sido estudiada en el ámbito médico privado, donde se le realizó un legrado uterino fraccionado para obtener una biopsia endometrial que analizar histológicamente. El informe anatomopatológico del mismo informaba de una muestra compatible con adenocarcinoma de endometrio seroso papilar de alto grado. Así pues, una vez valorada la paciente en la consulta de Ginecología Oncológica, se complementó la biopsia con una exploración genital, en la que no se observaron hallazgos dignos de mención, y una ecografía transvaginal, en la que no parecía existir invasión tumoral miometrial, con una medida endometrial de 0,5 cm. En el área anexial derecha se observó una formación multifolicular, de predominio quístico que, en su conjunto, medía unos 4,5 cm, sin evidenciarse focos sólidos internos ni papilas, alrededor del cual se visualizó una escasa cantidad de líquido libre en pelvis. El anexo izquierdo no presentaba alteraciones visibles. La sospecha ecográfica de dicho quiste impresionaba de benignidad, no obstante, se solicitó una resonancia magnética como prueba complementaria. En dicha prueba se informaba de: “lesión neoplásica de 8-10 mm que afecta a la pared anterior derecha del endometrio y se extiende en profundidad al miometrio interno (porcentaje inferior al 50%), sin alcanzar el miometrio externo. No se afecta cérvix uterino ni se observan adenopatías pélvicas. Existe además un discreto aumento del tamaño de ovario derecho (4,7 cm) que contiene múltiples quistes con tamaño entre 10-25 mm, compatibles con folículos, asociado a una mínima cantidad de líquido peritoneal pélvico, dentro de los límites fisiológicos” (Figura 1).
Con el diagnóstico de adenocarcinoma de endometrio seroso papilar de alto grado, el equipo de Ginecología Oncológica consideró como tratamiento la cirugía de estadiaje (realizada a los 23 días del estudio de imagen), que consistió en una exploración minuciosa de la cavidad abdominopélvica con lavado peritoneal e histerectomía total con doble anexectomía, omentectomía, linfadenectomía pélvica y aortocava, vía laparoscópica. La linfadenectomía pélvica bilateral se realizó desde los vasos ilíacos comunes hasta la fosa obturatriz, arteria umbilical obliterada y vasos iliacos externos, mientras que la linfadenectomía aortocava se extendió desde los vasos ilíacos comunes hasta la vena renal izquierda, obteniendo un total de 8 ganglios pélvicos y 8 ganglios aortocavos, todos ellos negativos. Se tomó, además, citología del lavado peritoneal, cuyo estudió descartó la presencia de células neoplásicas. La biopsia de las diferentes piezas quirúrgicas se envió de forma diferida, ya que el quiste anexial derecho no presentaba características macroscópicas de malignidad, por lo que no se optó por realizar biopsia intraoperatoria.
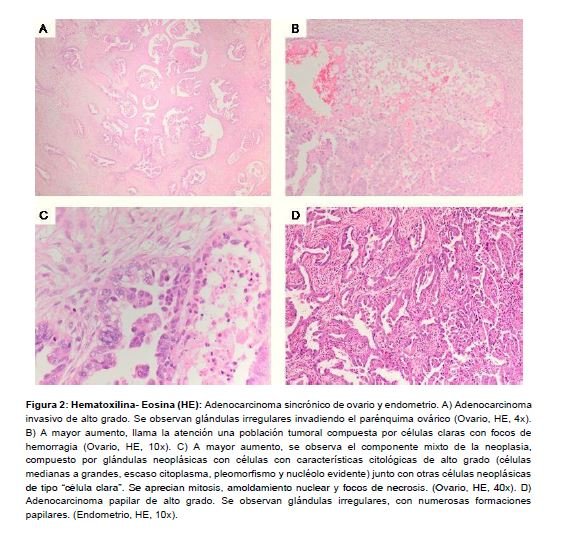
La intervención se realizó sin complicaciones, destacando como hallazgo intraoperatorio, la presencia de un quiste único anexial derecho de 5 cm, sin signos macroscópicos de malignidad, visualizado previamente tanto en ecografía transvaginal como en la resonancia magnética como una formación multifolicular. La evolución postoperatoria fue muy favorable, recibiendo el alta hospitalaria a los 3 días de la intervención, con un estado general excelente. El análisis histológico de la pieza quirúrgica evidenció la presencia de un adenocarcinoma de alto grado seroso papilar de endometrio, con invasión superficial del miometrio (menor del 50%), sin afectación parametrial; mientras que el estudio del anexo derecho objetivó la existencia de un adenocarcinoma de alto grado mixto de células claras y seroso de ovario (con predominio de este último), que no alcanzaba la cápsula ovárica (Figura 2). El resto de piezas quirúrgicas, se encontraban libres de enfermedad neoplásica. No existían alteraciones histológicas en el epiplon ni en las trompas de Falopio (ni focos de displasia ni de carcinoma intraepitelial seroso tubárico (STIC)). Posteriormente, se reunió el comité multidisciplinar de tumores ginecológicos para estudiar el caso, confirmando el Servicio de Anatomía Patológica que se trataba de dos tumores independientes, sincrónicos, de endometrio y ovario estadio IA según la clasificación de la Federación Internacional de Obstetricia y Ginecología (FIGO). Se decidió, pues, realizar tratamiento adyuvante con quimioterapia sistémica, siguiendo un plan terapéutico de cuatro ciclos de Paclitaxel y Carboplatino, más radioterapia pélvica posterior. La decisión del tratamiento quimioterápico fue multidisciplinar, basándose en el tipo histológico de alto grado de ambos tumores sincrónicos, y en la edad de la paciente, siguiendo la oncoguía actualizada por la Sociedad Española de Ginecología y Obstetricia (SEGO) No se realizó ningún estudio molecular ni genético pese a su edad, dado que la paciente no presentaba antecedentes de cáncer heredofamiliar ginecológico.
Tras el mismo, la paciente presentó una respuesta positiva al tratamiento, con un seguimiento posterior normal. Actualmente, lleva 5 años en un periodo libre de enfermedad, en revisión por el equipo multidisciplinar, sin sospechas ni evidencias de recidivas.
DISCUSIÓN
Las neoplasias sincrónicas aglutinan un conjunto de tumores que se presentan de forma simultánea en la misma región anatómica, con diferencias histopatológicas que permiten definirlos como dos tumores malignos independientes2. El desarrollo de neoplasias sincrónicas en el tracto genital femenino supone alrededor del 2% de los cánceres ginecológicos, de los cuales en torno a un 50-70% son de endometrio y ovario2,3. La edad media de aparición es inferior a los 50 años, siendo más frecuente en la franja de 41 a 523, como en el caso de nuestra paciente, que fue diagnosticada con 46 años de edad. La coexistencia de dos o más tumores simultáneos en un mismo tracto, en este caso, genital femenino, obliga a realizar una clara diferenciación entre varias opciones: 1) si se trata de un cáncer endometrial con metástasis ováricas, 2) si se trata de un cáncer de ovario con metástasis endometriales, o 3) si se tratan de dos tumores independientes y sincrónicos, de endometrio y ovario1,2,3. Para eso, Ulbright y Roth, en el año 1985 establecen unos criterios histopatológicos que son, posteriormente completados por Scully et al. en el año 19982,3,4,5,6. En estos estudios, se describen las características histopatológicas que se deben objetivar, para diferenciar al carcinoma endometrioide de ovario del carcinoma endometrioide de endometrio, considerando que el tipo histológico endometrioide representa más del 70% de los casos de tumores sincrónicos7. Estas diferencias son, para el cáncer endometrial: ausencia de invasión o afectación superficial del miometrio, ausencia de invasión vascular linfática, ausencia de extensión parametrial y presencia de hiperplasia atípica; mientras que para el cáncer de ovario, deben darse las siguientes premisas: unilateralidad, afectación contralateral de la superficie ovárica, localización hiliar, ausencia de extensión capsular o extracapsular, y presencia de endometriosis2,3,4,5,6.
Los últimos datos publicados sobre la prevalencia de esta infrecuente patología, se resumen en el estudio de Williams et al. que identificó 1709 casos de SEOC en una cohorte de 56986 pacientes, lo que supone una prevalencia del 3% (ya mencionada anteriormente)8. Mientras que el cáncer de endometrio es el más frecuente de los tumores ginecológicos malignos, el cáncer de ovario es el más letal, ya que el diagnóstico se obtiene, en la mayoría de los casos (más del 75% de casos), en estadios avanzados1,9. Los tumores sincrónicos pueden comportarse como dos neoplasias independientes, si no presentan extensión locorregional y son de bajo grado histológico, aunque son difícilmente diferenciables de las llamadas “pseudometástasis”. Este término se ha utilizado para definir aquella diseminación restringida y de buen pronóstico, que presentan los tumores sincrónicos de endometrio y ovario10. Se ha postulado que las células tumorales implicadas pueden diseminarse (probablemente por vía transtubárica), hasta las áreas anexiales, pero no tienen la capacidad de hacerlo más allá del propio ovario, ya que para la colonización tumoral, requieren del microsistema que éste le proporciona. De esta hipótesis se traduce que el riesgo de que la paciente padezca un síndrome de Lynch en el caso de presentar un tumor sincrónico, no es mayor del que presentaría si fuera un carcinoma endometrial único (alrededor de un 7%)10. Otro de los escenarios posibles es la coexistencia de carcinomas serosos de alto grado (como en nuestro caso), que afectan tanto al endometrio como al ovario y que se comportan como neoplasias clonales, siendo difícil determinar el origen primario del tumor. En un estudio realizado por Euscher et al. se compara el inmunofenotipo de los carcinomas serosos endometriales con los de localización extrauterina, tanto combinados como de forma independientemente. Se objetivó que la expresión del WT1 (gen supresor tumoral responsable del tumor de Wilms), en carcinomas serosos de alto grado con afectación endometrial y extrauterina, era indistinguible de la del cáncer de endometrio aislado. Sin embargo, este difería de la del carcinoma seroso de alto grado que involucraba sólo localizaciones extrauterinas, mostrando esta última, una positividad para el gen WT1 más fuerte, aunque difusa. Este hecho puede respaldar la teoría de que el tumor endometrial es realmente la neoplasia primaria y la afectación ovárica es simplemente enfermedad metastásica10,11,12. Este fenómeno, conocido como “pseudometástasis”, se ha descrito en múltiples trabajos, reiterando el hecho de que las propias células tumorales carecen de la posibilidad de apoptosis, recolonizando microambientes exclusivos sin capacidad para metastatizar a distancia. Existen ejemplos similares en lesiones de bajo grado histológico, como los carcinomas uroteliales cervicales y vulvares asociados al VPH (Virus del Papiloma Humano)12. En estos casos, la diseminación tumoral más allá de la localización primaria no se asocia con metástasis a distancia en la mayoría de las pacientes y, lo más importante, continúa relacionada con la posibilidad de resecabilidad quirúrgica y de pronóstico favorable a largo plazo. Este escenario de diseminación clínicamente indolente es lo suficientemente común como para justificar una valoración cautelosa, ya que es importante no sobretratar a las pacientes cuando la extirpación quirúrgica de focos específicos metastásicos o pseudometastásicos, puede conducir a la curación12. Así pues, se ha visto que la evidencia científica disponible no explica con claridad la fisiopatología de los tumores sincrónicos, por lo que existe la hipótesis de que en la mayoría de los casos están relacionados con metástasis o pseudometástasis10,11,13. Si se encuentran confinados a la pelvis y los valoramos como tumores independientes, los SEOC podrían corresponder según la FIGO a un estadio III endometrial y II ovárico, variando el pronóstico en función del grado histológico y de si están limitados o no, al útero y al ovario13.
Cuando una paciente es diagnosticada de neoplasias múltiples (simultáneos o no), o bien se trata de una mujer joven, hay que pensar en la posibilidad de que sea portadora de un síndrome hereditario9,10. Los dos síndromes de cáncer familiar más comunes, que incluyen enfermedades malignas ginecológicas son el síndrome de Lynch y el síndrome hereditario de cáncer de ovario y mama. El síndrome de Lynch, aunque lleva el nombre de Henry Lynch por su trabajo pionero en patologías de alta susceptibilidad al cáncer hereditario, fue descrito por primera vez por Alfred Scott Warthin, de la Universidad de Michigan, mientras que el síndrome de cáncer de mama y ovario hereditario fue descrito curiosamente, por primera vez por el propio Lynch. Ambos síndromes son el resultado de mutaciones en la línea germinal en genes implicados en la reparación del ADN; las enzimas de reparación del desajuste del ADN en el síndrome de Lynch, y los genes BRCA1 y BRCA2 en el síndrome de cáncer de mama y ovario hereditario (CMOH). Afectan a 1 de cada 400 personas en Estados Unidos y Canadá, y se asocian con un mayor riesgo de desarrollo de cáncer del tracto genital femenino. Así pues, alrededor del 4% de los carcinomas endometriales están asociados con el síndrome de Lynch, mientras que el 15-20% de los carcinomas serosos de alto grado de ovario o trompa de Falopio están vinculados con el CMOH10.
Volviendo a los tumores sincrónicos, la clínica y el diagnóstico no difieren de la que presentan los tumores únicos, siendo en la mayoría de las ocasiones predominante la sintomatología derivada de uno de ellos, diagnosticando posteriormente la neoplasia sincrónica de forma accidental, en el estudio histológico postoperatorio13. En el caso que exponemos, la sintomatología predominante fue la del carcinoma endometrial, cursando con metrorragias incontrolables y presentando una biopsia prequirúrgica que confirmaba el diagnóstico; mientras que el hallazgo del carcinoma de ovario fue un hecho casual, dentro del estudio histológico posterior. En cuanto al tratamiento, existe una evidente controversia en este tema ya que el punto clave consiste en diferenciar si se trata de tumores independientes o “pseudometástasis”. Algunos autores consideran que la cirugía es suficiente para el subtipo endometrioide grado I, añadiendo terapias adyuvantes en otros subtipos histológicos o en casos de tumores de alto grado3. El tratamiento quirúrgico se considera ampliamente aceptado como pilar principal del manejo terapéutico de este tipo de neoplasias, siendo las terapias adyuvantes (quimioterapia y/o radioterapia), opciones más controvertidas en este campo. Existen estudios que no demuestran diferencias significativas en términos de supervivencia entre la población con cirugía exclusiva y la población con cirugía-adyuvancia14. Se han propuesto algunas teorías que defienden la idea de que el tratamiento coadyuvante podría darse a pacientes mayores, postmenopáusicas, con tumores de alto grado histológico, metástasis en el omento o tumor residual postquirúrgico14. Uno de los factores principales a tener en cuenta para la administración de tratamiento postoperatorio adyuvante, es el riesgo de recidiva de cada tumor y el componente de afectación miometrial/parametrial en el cáncer endometrial avanzando. En caso de requerir quimioterapia, la pauta más utilizada es la combinación de carboplatino y paclitaxel14. En el caso de nuestra paciente, recibió tanto pauta de quimioterapia con carboplatino y paclitaxel, como radioterapia, ya que presentaba ambos carcinomas de alto grado.
Actualmente se están analizando nuevos campos de estudio molecular que puedan ayudar al diagnóstico y ajuste terapéutico, haciéndolo más personalizado en función de las relaciones clonales de los tumores. Esta hipótesis se sustenta en el cambio de paradigma reciente sobre la relación entre ambas neoplasias, ya que hasta no hace mucho se creían no relacionadas clonalmente. Esta creencia común ha sido desafiada por dos estudios independientes que investigaron la asociación clonal entre carcinomas de ovario y endometrio diagnosticados sincrónicamente con secuenciación masiva paralela, encontrando que la mayoría de los SEOC estudiados (95%), correspondían a tumores primarios únicos con metástasis en otra localización anatómica13,14. Así pues, existen metodologías que se están utilizando para concretar el origen genético de los tumores sincrónicos y, así, poder mejorar su tratamiento. El pronóstico generalmente es bueno en caso de tumores sincrónicos, de tipo endometrioide y de bajo grado. Algunos factores pronósticos importantes son la edad, el estadio de la enfermedad, la histología, el grado tumoral y la presencia de enfermedad residual tras la cirugía14,15. La paciente de nuestro caso clínico ha tenido una evolución excelente y, actualmente, se encuentra en remisión completa y sin signos de recidiva en los controles multidisciplinares posteriores, sin haber podido definir ningún síndrome genético asociado, ni mutación objetivable en su caso.
CONCLUSIONES
Cuando se objetiva la existencia de dos o más tumores en pacientes jóvenes, hay que diferenciar con cautela el origen de los mismos (metástasis o tumores primarios), ya que puede afectar de forma directa al tratamiento y al pronóstico de la paciente. La evidencia científica no aclara la fisiopatología de dichos tumores, por lo que la posibilidad de que su origen real sea una metástasis o “pseudometástasis”, es un tema controvertido actualmente. No obstante, debemos valorar la existencia de esta infrecuente patología en pacientes jóvenes, y estudiar la posibilidad de que presenten o sean portadoras de algún síndrome genético hereditario.
BIBLIOGRAFÍA
1. Matsuo K, Machida H, Frimer M, Marcus JZ, Pejovic T, Roman LD, Wright JD. Prognosis of women with stage I endometrioid endometrial cancer and synchronous stage I endometrioid ovarian cancer. Gynecol Oncol. 2017;147(3):558-564.
2. Sandoval Martínez D, García Ayala E, Mayorga Anaya H. Neoplasia primaria sincrónica de endometrio y ovario: a propósito de un caso. Rev Chil Obstet Ginecol. 2011;76(2):113-117.
3. León Romero H, Borges A, Ramírez M. Carcinoma de endometrio y carcinoma de ovario endometrioide sincrónico. A propósito de un caso. Rev Venez Oncol 2014;26(3):232-234.
4. Scully RE, Young RH, Clement PB. Tumors of the ovary, mal developed gonads, fallopian tube, and broad ligament. Atlas of tumor pathology. Bethesda, MD: Armed Forces Institute of Pathology; 1998
5. Singh N. Synchronous tumors of the female genital tract. Histopathology. 2010; 56:277-85.
6. Ulbright TM, Roth LM. Metastatic and independent cancers of the endometrium and ovary: a clinicopathologic study of 34 cases. Hum Pathol.1985; 16;28-34.
7. Dogan A, Schultheis B, Rezniczek GA, Hilal Z, Cetin C, Häusler G, Tempfer CB. Synchronous Endometrial and Ovarian Cancer in Young Women: Case Report and Review of the Literature. Anticancer Res. 2017;37(3):969-978.
8. Williams MG, Bandera EV, Demissie K and Rodríguez-Rodríguez L. Synchronous primary ovarian and endometrial cancers: a population-based assessment of survival. Obstet Gynecol. 2009;113(4):783-789.
9. Narin MA, Karalok A, Basaran D, Ureyen I, Turkmen O, Turan T, Tulunay G. Does synchronous endometrioid endometrial cancer have any prognostic effect on Stage I endometrioid ovarian cancer? Eur J Obstet Gynecol Reprod Biol. 2016;200:113–116.
10. Gilks CB, Kommoss F. Synchronous tumours of the female reproductive tract. Pathology. 2018;50(2):214-221.
11. Euscher ED, Malpica A, Deavers MT, Silva EG. Differential expression of WT-1 in serous carcinomas in the peritoneum with or without associated serous carcinoma in endometrial polyps. Am J Surg Pathol. 2005;29:1074–8.
12. Anglesio MS, Wang YK, Maassen M, Horlings HM, Bashashati A, Senz J et al. Synchronous Endometrial and Ovarian Carcinomas: Evidence of Clonality. J Natl Cancer Inst. 2016 Feb 1;108(6):djv428.
13. Chao A, Wu RC, Jung SM, Lee YS, Chen SJ, Lu YL et al. Implication of genomic characterization in synchronous endometrial and ovarian cancers of endometrioid histology. Gynecol Oncol. 2016;143(1):60-67.
14. Bese T, Sal V, Kahramanoglu I, Tokgozoglu N, Demirkiran F, Turan H, Ilvan S, Arvas M. Synchronous Primary Cancers of the Endometrium and Ovary With the Same Histopathologic Type Versus Endometrial Cancer With Ovarian Metastasis. Int J Gynecol Cancer. 2016;26(2):394-406.
15. Valtcheva N, Lang FM, Noske A, Samartzis EP, Schmidt AM, Bellini E, Fink D, Moch H, Rechsteiner M, Dedes KJ, Wild PJ.Tracking the origin of simultaneous endometrial and ovarian cancer by next generation sequencing–a case report. BMC Cancer. 2017;17(1):66.