2006
5
Autores:
María José del Río V.1, a, Juan Pablo Ramírez M.1, a, Manuel E. Cortés2, b, Gerardo Marti O.3, c, Ana Godoy R.4, d
Instituciones:
1Escuela de Medicina, Pontificia Universidad Católica de Chile, 2Unidad de Reproducción y Desarrollo, Departamento de Ciencias Fisiológicas, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile, 3Escuela de Ingeniería, Facultad de Ingeniería, Pontificia Universidad Católica de Chile, 4Unidad de Reproducción y Desarrollo, Departamento de Ciencias Fisiológicas, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile y Fundación Médica San Cristóbal.
aLicenciado(a) en Medicina, bTesista de Ciencias Biológicas, cLicenciado en Ciencias de la Ingeniería, dBioquímico(a).
Tipo de documento:
Trabajos OriginalesAnálisis de resistencia insulínica, tolerancia a la glucosa y testosterona en mujeres jóvenes con Síndrome de ovario poliquístico agrupadas por índice de masa corporal
Contenido del documento:
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP) es un desorden endocrino-metabólico definido como una disfunción ovulatoria causada por hiperandrogenismo y/o hiperandrogenemia. Es una alteración común en mujeres en edad fértil, con una prevalencia entre 5 y 10% (1-5). Aunque es considerada una patología propia de la edad reproductiva, se sabe que algunas manifestaciones también pueden surgir en etapas tempranas de la vida, incluso durante el período intrauterino (6-9).
En el SOP, la disfunción ovulatoria se manifiesta por ciclos irregulares o anovulatorios, aspecto poliquístico de los ovarios en su examen ecográfico, cambios en el estado emocional y disminución del potencial fértil (10,11). Debido a la hiperandrogenemia puede aparecer acné, aumento del vello o hirsutismo, cabello y piel grasa, tendencias compulsivas, cambios antropométricos y alopecia androgénica (12).
La presencia de problemas metabólicos en mujeres con hiperandrogenismo se conoce desde 1921, cuando Achard y Thiers realizaron la primera descripción de la relación entre excesos de andrógenos en mujeres y alteraciones en el metabolismo de carbohidratos en su clásico estudio «diabetes de las mujeres barbudas» (13). A comienzos de la década del 80 Burghen y cols. (14) comunicaron una correlación significativa entre los niveles de andrógenos y los de insulina en pacientes con SOP, encontrándose algunos años más tarde resistencia a la insulina (RI) y SOP en mujeres tanto obesas como normales (15). Algunos estudios han demostrado que al menos 50% del total de pacientes con SOP presenta obesidad (1,16,17), siendo ésta predominantemente de tipo andrógena o central, manifestándose por un índice cintura/cadera aumentado (>0,85). Este tipo de obesidad se ha asociado con hiperandrogenemia, RI, baja tolerancia a la glucosa (BTG) y dislipidemia (18-21). Además, se ha observado una fuerte asociación entre SOP y alteraciones metabólicas; aproximadamente » 40% de las pacientes presenta BTG (15), 50% presentaría RI (2,22), y hasta un 10 a 15% presentará diabetes mellitus tipo II hacia la cuarta década de vida (23,24).
El objetivo del presente trabajo fue analizar en pacientes con SOP la relación existente entre testosterona, obesidad y alteraciones del metabolismo glucídico.
MATERIALES Y MÉTODOS
Se estudió una población de 60 pacientes que consultaron en la Fundación Médica San Cristóbal, a las cuales se les diagnosticó SOP según el Consenso de Rotterdam (25). Según éste, es diagnóstico de SOP dos de los tres siguientes criterios: 1) oligo o anovulación, 2) hiperandrogenismo con o sin hiperandrogenemia; y 3) aspecto de ovarios poliquísticos en el examen ultrasonográfico. Se excluyeron las pacientes que presentasen otras patologías que expliquen el cuadro clínico, como hiperplasia suprarrenal congénita, hiperprolactinemia, hipotiroidismo, síndrome de Cushing y tumores secretores de andrógenos (25), y a aquéllas que en los últimos seis meses hayan ingerido fármacos que afectasen los niveles de hormonas sexuales o el metabolismo de carbohidratos.
En la primera consulta se les calculó el IMC (peso/talla2). Luego se les tomó una muestra de sangre, con la que se midió la concentración de testosterona total (nmol/L). El metabolismo glucídico se estudió mediante el test de tolerancia oral a la glucosa e insulina (TTOG-I), con una carga inicial de 75 g de glucosa, midiendo glicemia e insulina basal a los 30, 60, 90 y 120 min.
Se consideró una respuesta glicémica normal cuando la glicemia basal fue <100 mg/dL, a los 120 min <140 mg/dL y ningún valor >160 mg/dL (26). La respuesta insulínica se consideró normal con insulina basal <15 µUI/mL, a los 120 min <60 µUI/mL y ningún valor >100 µUI/mL. El estudio fue aprobado por el Comité de Ética de la Facultad de Ciencias Biológicas de la Pontificia Universidad Católica de Chile y por el Comité de Ética de la Fundación Médica San Cristóbal.
La testosterona total fue medida mediante el método inmunoenzimático (BioMeriéux®). La glicemia fue medida a través del método de glucosa oxidasa-peroxidasa (Wiener®) y la insulina con el método de quimioluminiscencia (DPC, Immulite 2000®).
Se analizaron las siguientes variables: distribución de la edad, distribución del IMC, relación entre IMC y niveles plasmáticos de testosterona total, relación entre los niveles de testosterona total y respuesta al TTOG-I, y relación entre IMC y respuesta al TTOG-I.
Se caracterizó cada una de las variables a estudiar a través de las distintas medidas para variables numéricas. Luego se realizó un análisis bivariado entre testosterona total y cada una de las otras variables (IMC, glicemia basal e insulina basal). Para esto se realizó un ANDEVA y se obtuvo el coeficiente de correlación (r) entre las variables. El análisis se efectuó con un intervalo de confianza del 95%.
RESULTADOS
La media (± DE) de edad de la población fue 20 años ± 4,11 (rango: 14 a 32 años). La media (± DE) de testosterona total fue 2,2 nmol/L ± 0,82.
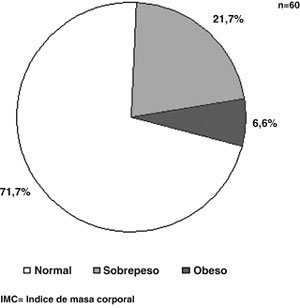
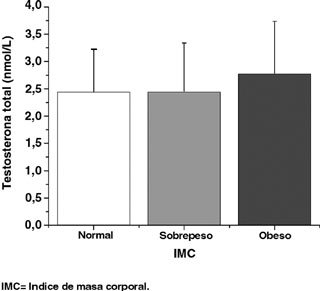
Distribución del IMC y relación de éste con niveles de testosterona: 71,7% (n= 43) de las pacientes presentó peso normal (IMC <25 kg/m2), 21,7% (n= 13) presentó sobrepeso (25 kg/m2 ³IMC 29,9 kg/m2) y 6,6% (n= 4) eran obesas (IMC ³30kg/m2) (Figura 1). Las medias de testosterona total para los distintos grupos fueron 2,20 nmol/L para IMC normal, 2,20 nmol/L para IMC sobrepeso y 2,75 nmol/L para IMC obeso, existiendo entre ellos diferencia no significativa, p= 0,56 (Figura 2).
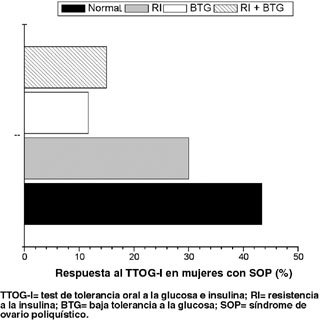
Respuesta al TTOG-I y su relación con los niveles de testosterona: En cuanto al TTOG-I, un 43,3% tuvo una respuesta glicémica e insulínica normal (media de testosterona =2,2 nmol/L), 30% presentó RI (media de testosterona =2,19 nmol/L), 11,7% mostró BTG (media de testosterona = 2,36 nmol/L) y un 15% presentó ambas alteraciones (media de testosterona =2,08 nmol/L) (Figura 3). En total, 56,7% mostró una respuesta alterada al TTOG-I (media de testosterona =2,2 nmol/L).
Relación entre IMC y respuesta al TTOG-I: La media de IMC para el grupo con un TTOG-I de respuesta normal fue 22,3 kg/m2 y para el grupo con respuesta alterada fue 23,1 kg/m2, diferencias no significativas, p= 0,17.
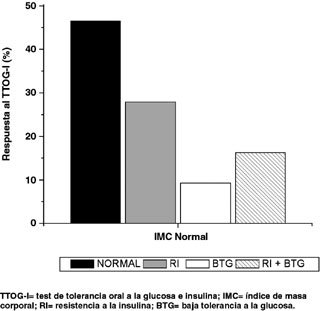
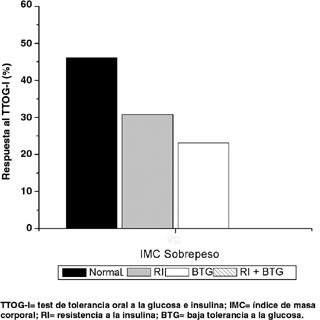
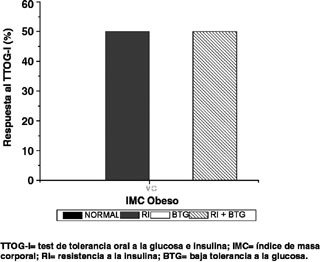
Según IMC, la distribución de respuesta para el TTOG-I fue similar para el grupo IMC normal (46,5% normal, 27,9% con RI, 9,3% con BTG, 16,3% para ambas alteraciones) (Figura 4) e IMC sobrepeso (46,1% normal, 30,8% con RI, 23,1% con BTG, 0% para ambas alteraciones) (Figura 5), contra el grupo IMC obesas, en que el 100% presentó alguna alteración metabólica (50% con RI, 50% con ambas alteraciones) (Figura 6).
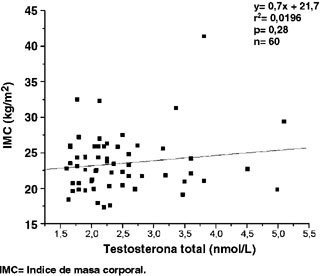
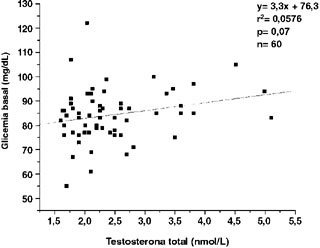
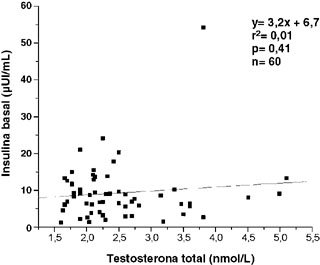
En cuanto a la correlación entre testosterona y las distintas variables, los resultados fueron los siguientes: para testosterona e IMC, r= 0,14, p= 0,28 (Figura 7); para testosterona y glicemia basal, r= 0,24, p= 0,07 (Figura 8); para testosterona y glicemia a 120 min, r= 0,22, p= 0,10; para testosterona e insulina basal, r = 0,10, p= 0,41 (Figura 9); y para testosterona e insulina a 120 min, r= 0,16, p= 0,23. Según los valores para r y el valor p tras ANDEVA, éstas serían consideradas variables sin correlación entre sí (Figuras 7, 8 y 9).
DISCUSIÓN
El presente trabajo demostró que la mayoría (71,7%) de las mujeres en estudio se encontraban en su peso normal, siendo un 6,6% obesas. El porcentaje de pacientes obesas es menor al visto en otros estudios donde la obesidad fluctúa entre 38,4 a 87,5% (16,27,28). Esto se podría explicar por ser una población de mujeres jóvenes, de nivel socioeconómico (NSE) medio-alto, las cuales tendrían acceso u optarían más por una alimentación equilibrada y una mayor actividad física (16). Se debe considerar que al ser un NSE determinado, podría existir un sesgo étnico (18,21). Otro factor podría ser el menor tiempo de exposición a los trastornos endocrino-metabólicos asociados al SOP, es decir, menor tiempo de RI, hiperandrogenismo y alteración en el perfil lipídico, al ser ésta, como ya se ha dicho, una población joven.
Las alteraciones en la respuesta a la insulina están presentes en un 56,7% de las pacientes (RI y/o RI + BTG), concordante con el 50% descrito en otras series (2,22), a pesar de ser una población joven, con un bajo porcentaje de obesidad.
Lo anterior refuerza el hecho que esta alteración junto a una BTG, deben ser consideradas en estas pacientes, siendo ambas predisponentes a diabetes mellitus tipo II (24). Es importante destacar que la proporción de alteraciones metabólicas no se diferencian en los grupos con IMC normal y sobrepeso. A partir de lo anterior, proponemos que las alteraciones metabólicas son propias del SOP, sin ser totalmente determinadas por el IMC.
Sin embargo, en las pacientes con SOP obesas existiría una acción sinérgica, donde todas presentaron alteraciones en RI y/o BTG, por lo que estas pacientes constituyen un grupo de alto riesgo para desarrollar trastornos cardiovasculares (23,27), diabetes mellitus tipo II (24,29), enfermedad coronaria y dislipidemia (17,30). En este grupo de pacientes existe una tendencia a presentar niveles de testosterona total más altos, lo cual podría contribuir en la génesis de la obesidad encontrada en estas pacientes. Se debe destacar el hecho que la hiperandrogenemia aumenta la grasa abdominal (tejido adiposo central), la cual tiene una alta actividad lipolítica (31,32), aumentando los ácidos grasos libres en la circulación (33). Lo anterior, asociado a un mal manejo nutricional y sedentarismo, predispondría a la obesidad. También podría ser la obesidad el origen de una mayor producción de testosterona total.
Está descrito que el aumento en la fosforilación de los residuos de serina tanto en el citocromo P450c17 como en el receptor de insulina podría explicar, mediante un mismo mecanismo, el hiperandrogenismo y la RI observada en el SOP (34). Si bien, la diferencia en los niveles de testosterona en los distintos grupos no resultó ser estadísticamente significativa, esto podría explicarse por el bajo tamaño muestral de los grupos y, en particular, de las obesas. Cabe destacar que los mayores niveles de testosterona total no son completamente atribuibles a la mayor proporción de RI y BTG, dado que en el análisis por separado de RI y BTG con testosterona total no se encontró una correlación importante.
El análisis realizado en este estudio sugiere la existencia de distintas poblaciones para SOP; una con alteraciones endocrino-metabólicas y otra sin éstas. El ahondar en este hecho podría contribuir en el enfoque terapéutico de este síndrome, aún controversial entre los médicos (35).
CONCLUSIÓN
En el presente trabajo se demostró que un 56,7% de las pacientes con SOP evaluadas presentan una alteración en la respuesta a la insulina (RI y RI + BTG), de las cuales un 6,6% se consideraron obesas según IMC. Nuestros resultados también demuestran que las determinaciones de testosterona total e insulinemia basal son variables independientes en las pacientes con SOP.
Un 71,7% de las pacientes se encontraban en su peso normal, lo cual nos hace sospechar la presencia de alteraciones metabólicas en pacientes con SOP, independientes de su IMC. Debe destacarse también que no se encontró correlación importante entre testosterona total e IMC, lo cual sugiere que la obesidad, en estas pacientes, no es consecuencia directa del hiperandrogenismo y, por lo tanto, un adecuado manejo del estilo de vida para prevenir la asociación futura entre obesidad y SOP será de vital importancia y debe ser promovido (10,16).
Finalmente, en el grupo de pacientes con SOP y obesas de acuerdo a su IMC, se encontró una alteración metabólica paralela a la hiperandrogenemia en todos los casos, lo cual refuerza conocimientos anteriores de cómo estas dos condiciones se potenciarían entre sí (10,36).
El seguimiento futuro de estas pacientes permitirá determinar si el subgrupo con SOP, con peso normal y sin alteraciones metabólicas, desarrolle RI y cuál será su riesgo de presentar diabetes mellitus tipo II. La heterogeneidad del grupo de pacientes que actualmente son diagnosticadas con SOP hace necesario estudios posteriores para dilucidar diferentes subgrupos cuyo pronóstico y tratamiento probablemente serán diferentes. Un diagnóstico temprano del SOP puede ser obtenido mediante el autorreconocimiento de la fertilidad por parte de la mujer (11), el cual no sólo puede ayudar a mejorar los problemas de fertilidad, sino que también puede ayudar en el diagnóstico y tratamiento de otras patologías tales como trastornos endocrino-metabólicos (11,37). El ahondar en el conocimiento de esta alteración tan frecuente en la mujer joven permitirá dar a estas pacientes una calidad de vida adecuada.
Agradecimientos. Agradecemos al Prof. Dr. Gareth I. Owen del Departamento de Ciencias Fisiológicas PUC, por la revisión de la versión en inglés; y al Dr. Jorge L. Alvarado del Departamento de Ecología PUC, por sus comentarios sobre el manuscrito.
BIBLIOGRAFÍA
- Franks S. Polycystic ovary syndrome. N Engl J Med 1995;333(13): 853-61.
- Dunaif A. Insulin resistance and the polycystic ovary syndrome: mechanism and implications for pathogenesis. Endocr Rev 1997;18(6):774-800.
- Morin-Papunen L. Insulin resistance in polycystic ovary syndrome. Oulu, Finlandia: Acta Universitatis Ouluensis D Medica 605, 2000; 89 págs. Hallado en: http://herkules.oulu.fi/isbn95142 . Acceso el 2 de junio de 2006.
- Benítez R, Sir T, Palomino A, Ángel B, Maliqueo M, Pérez F, et al. Prevalencia familiar de patologías metabólicas en pacientes con síndrome de ovario poliquístico. Rev Méd Chile 2001;129(7): 707-12.
- Biro FM. Body morphology and its impacts on adolescent and pediatric gynecology, with a special emphasis on polycystic ovary syndrome. Curr Opin Obstet Gynecol 2003;15(15):347-51.
- Ibáñez L, Potau N, Francois I, De Zegher F. Precocious pubarche, hyperinsulinism, and ovarian hyperandrogenism in girl: relation to reduced fetal growth. J Clin Endocrinol Metab 1998;83(10):3558-62.
- Ibáñez L, Potau N, de Zegher F. Ovarian hyporesponsiveness to follicle stimulating hormone in adolescent girls born small for gestational age. J Clin Endocrinol Metab 2000;85(7):2624-6.
- Eriksson JG, Forsen T, Tuomilehto J, Jaddoe VW, Osmond C, Barker DJ. Effects of size at birth and childhood growth on the insulin resistance syndrome in elderly individuals. Diabetologia 2002;45(3):342-8.
- Ibáñez L, Potau N, Ferrer A, Rodríguez-Hierro F, Marcos MV, De Zegher F. Anovulation in eumenorrheic, nonobese adolescent girls born small for gestational age: insulin sensitization induces ovulation, increases lean body mass, and reduces abdominal fat excess, dyslipidemia, and subclinical hyperandrogenism. J Clin Endocrinol Metab 2002; 87(12):5702-5.
- Vigil P, Steinberger E, del Río MJ, Cortés ME. Síndrome de Ovario Poliquístico. En: Guzmán E, (ed). Selección de Temas en Ginecoobstetricia. Santiago de Chile: Editorial Publimpacto, 2005; 833-42.
- Vigil P. La Fertilidad de la Pareja Humana. 3ª ed. Santiago de Chile: Ediciones Universidad Católica de Chile, 2004; 100-4.
- Vigil P, Rodríguez-Rigau LJ, Palacios X, Kauak S, Morales P. Diagnosis of menstrual disorders in adolescence. En: Frajese G, Steinberger E, Rodríguez-Rigau LJ, (eds). Reproductive Medicine. New York: Raven Press, 1993; 149-54.
- Achard C, Thiers J. Le virilisme pilaire et son association à l’insuffisance glycolytique (diabète des femme á barbe). Bull Acad Natl Med 1921;86:51-83.
- Burghen GA, Givens JR, Kitabchi AE. Correlation of hyperandrogenism with hyperinsulinism in polycystic ovarian disease. J Clin Endocrinol Metab 1980; 50(1):113-6.
- Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Diabetes 1989;38(9):1165-74.
- Hoeger K. Obesity and weight loss in Polycystic Ovary Syndrome. Obstet Gynecol Clin North Am 2001;28(1):85-97.
- Cattrall FR, Healy DL. Long-term metabolic, cardiovascular and neoplastic risks with polycystic ovary syndrome. Best Pract Res Clin Obstet Gynaecol 2004;18(5):803-12.
- Azziz R, Ehrmann D, Legro RS, Whitcomb RW, Hanley R, Fereshetian AG, et al. Troglitazone improves ovulation and hirsutism in the polycystic ovary syndrome: a multicenter, double blind, placebo-controlled trial. J Clin Endocrinol Metab 2001;86(4): 1626-32.
- Franks S. Polycystic ovary syndrome: a changing perspective. Clin Endocrinol (Oxf) 1989;31(1):87-120.
- Conway GS, Honour JW, Jacobs HS. Heterogeneity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. Clin Endocrinol (Oxf) 1989;30(4):459-70.
- Carmina E, Legro RS, Stamets K, Lowell J, Lobo RA. Difference in body weight between American and Italian women with polycystic ovary syndrome: influence of the diet. Hum Reprod 2003;18(11):2289-93.
- Cataldo NA, Abbasi F, McLaughlin TL, Basina M, Fechner PY, Giudice LC, et al. Metabolic and ovarian effects of rosiglitazone treatment for 12 weeks in insulin-resistant women with polycystic ovary syndrome. Hum Reprod 2006;21(1):109-20.
- Dahlgren E, Johansson S, Lindstedt G, Knutsson F, Oden A, Janson PO, et al. Women with polycystic ovary syndrome wedge resected in 1956-1965: a long term follow-up focusing on natural history and circulating hormones. Fertil Steril 1992;57(3):505-13.
- Ehrmann DA, Barnes RB, Rosenfield RL, Cavaghan MK, Imperial J. Prevalence of impaired glucose tolerance and diabetes in women with polycystic ovary syndrome. Diabetes Care 1999;22(1):141-6.
- The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risk related to polycystic ovary syndrome. Fertil Steril 2004;81(1):19-25.
- American Diabetes Association. Standards of medical care in Diabetes-2006. Diabetes Care 2006:29:S4-S42.
- Balen AH, Conway GS, Kaltsas G, Techatrasak K, Manning PJ, West C, et al. Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Hum Reprod 1995;10(8):2107-11.
- Legro RS. The genetics of obesity. Lessons for polycystic ovary syndrome. Ann N Y Acad Sci 2000;900:193-202.
- Legro RS, Kunselman AR, Dodson WC, Dunaif A. Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a prospective, controlled study in 254 affected women. J Clin Endocrinol Metab 1999;84(1):165-9.
- Talbott E, Guzick D, Clerici A, Berga S, Detre K, Weimer K, et al. Coronary heart disease risk factors in women with polycystic ovary syndrome. Arterioscler Thromb Vasc Biol 1995;15(7):821-6.
- Vague J. The degree of masculine differentiation of obesities: a factor determining predisposition to diabetes, atherosclerosis, gout, and uric calculous disease. Am J Clin Nutr 1956;4(1):20-34.
- Bouchard C, Despres JP, Mauriege P. Genetic and nongenetic determinants of regional fat distribution. Endocr Rev 1993;14(1):72-93.
- Evans DJ, Hoffmann RG, Kalkhoff RK, Kissebah AH. Relationship of body fat topography to insulin sensitivity and metabolic profiles in premenopausal women. Metabolism 1984;33(1):68-75.
- Zhang LH, Rodríguez H, Ohno S, Miller WL. Serine phosphorylation of human P450c17 increases 17,20-lyase activity: implications for adrenarche and the polycystic ovary syndrome. Proc Natl Acad Sci USA 1997; 92(23):10619-23.
- Guttmann-Bauman I. Approach to adolescent polycystic ovary syndrome (PCOS) in the pediatric endocrine community in the USA. J Pediatr Endocrinol Metab 2005;18(5):499-506.
- Dunaif A, Thomas A. Current concepts in the polycystic ovary syndrome. Annu Rev Med 2001;52:401-19.
- Vigil P, Ceric F, Cortés ME, Klaus H. Usefulness of monitoring fertility from menarche. J Pediatr Adolesc Gynecol 2006;19(3):173-9.