2011
2
Autores:
Instituciones:
Pablo Ortega F., Jorymar Leal M., Daysi Amaya C., Lidia Mejías C.
Tipo de documento:
Trabajos OriginalesDEFICIENCIA DE VITAMINA A EN ADOLESCENTES NO GESTANTES Y GESTANTES DE MARACAIBO, VENEZUELA
Contenido del documento:
RESUMEN
Antecedentes: La deficiencia de vitamina A (DVA) es un problema nutricional de salud pública en el mundo. Durante el embarazo se ha asociado con incremento en la morbilidad y mortalidad materno-infantil. Objetivo: Determinar en adolescentes no gestantes y gestantes venezolanas, el estado nutricional de la vitamina A (ENVA). Método: Se realizó un estudio transversal, descriptivo y controlado, en 235 adolescentes mujeres (edad: 16,76 ± 1,48 años); 75 no gestantes y 160 gestantes. El ENVA fue evaluado según valores de retinol sérico (RS) por cromatografía líquida de alta eficacia (HPLC) y citología de impresión conjuntival (CIC).Resultados: En gestantes y no gestantes la prevalencia de CIC anormal (37,5% vs 48%; p>0,05) y afectación del ENVA (41,24% vs 13,34%; p=0,0001) fue alta; significativamente mayor durante el segundo y tercer trimestre de gestación (p<0,0002). Las gestantes mostraron una disminución significativa de los valores promedio RS (p<0,0001), una correlación inversa no significativa con la edad gestacional y 4,56 veces mayor probabilidad de presentar afectación del ENVA (OR=4,56; IC95%: 2,0-10,23) que las no gestantes. Conclusión: La alta prevalencia de DVA observada en este trabajo, representa un problema de salud pública en adolescentes venezolanas, por lo que este grupo vulnerable requiere intervención inmediata.
PALABRAS CLAVE: Vitamina A, embarazo adolescente, retinol sérico, citología de impresión conjuntival
SUMMARY
Background: Vitamin A deficiency (VAD) is a public health nutrition problem in the developing world. VAD had been associated with increased risk of maternal and childhood mortality and morbidity. Objective: To determine vitamin A status (VAS) between non pregnant and pregnant adolescents from Maracaibo-Venezuela. Methods: A cross-sectional and descriptive study was conducted in 235 female adolescents (16.76 ± 1.48y old); non pregnant (n=75) and pregnant (n=160). Vitamin A status was assessed by using serum retinol concentrations (SRC) and conjuctival impression cytology (CIC). SRC were measured by high-performance liquid chromatography and CIC. Results: In pregnant and non pregnant adolescents the prevalence of CIC abnormal (37.50% vs 48%) and non normal VAS (41.24% vs 13.34%; p=0.0001) were high, predominantly in the second and third trimester of pregnancy (p<0.0002). Pregnant adolescents showed significative reduction of the mean SRC values (p<0.0001), while gestational age had a negative and no significant relationship with SRC. The odds ratio for pregnant adolescents with non normal VAS was 4.56 (95%IC: 2.0-10.23), resulting significantly more frecuent non normal VAS in pregnant adolescents than non pregnant adolescents. Conclusions: The high prevalence of VAD found in this work, is a public health problem in venezuelan female adolescents and this vulnerable group require immediate interventions.
KEY WORDS: Vitamin A deficiency, adolescent pregnancy, serum retinol, conjuctival impression cytology.
INTRODUCCIÓN
El embarazo en adolescentes constituye un problema social, económico y de salud pública de magnitud considerable a nivel mundial, sobre todo en los países en desarrollo (1-3), resultando Venezuela el país sudamericano en vías de desarrollo que muestra la mayor prevalencia de nacimiento producto de madres adolescentes (20,5%) (4,5), por lo que representa el segundo gran problema de salud sexual y reproductiva a nivel nacional, siendo el primero la alta cifra de mortalidad materna por causas prevenibles (6).
El embarazo precoz es considerado por la Organización Mundial de la Salud (OMS) como una situación de alto riesgo obstétrico, debido a la alta incidencia de complicaciones maternas y fetales (7-12). Además, el embarazo en la adolescencia conlleva a riesgos de tipo nutricional, debido a que sobre las necesidades nutricionales inherentes a la adolescente, aún en proceso de crecimiento biológico, se imponen las necesidades nutricionales de su producto en gestación, cambios que pueden ser agravados por la desnutrición, la deficiencia de micronutrientes y la anemia, ocasionadas por pérdidas o trastornos de mal absorción, ingesta inadecuada y la falta de conocimiento acerca de una nutrición prenatal apropiada (13,14).
Diversos estudios han señalado la importancia de la alimentación materna en el adecuado desarrollo tanto del embrión como del feto y del recién nacido (15). La vitamina A, término genérico empleado para designar cualquier compuesto que posea las propiedades biológicas del retinol, es un importante micronutriente involucrado en la regulación de la proliferación, crecimiento y diferenciación celular y por lo tanto, esencial para el normal desarrollo del embarazo (15).
La deficiencia de vitamina A (DVA) es un problema de salud pública en el mundo, que durante el embarazo se ha asociado con incremento en la morbilidad y mortalidad materna e infantil (16,17). Estudios en humanos y animales gestantes con concentraciones anormales de retinol sérico, han descrito la aparición de anormalidades obstétricas como malformaciones fetales, retardo del crecimiento intrauterino y abortos espontáneos durante la gestación (16,17). En estudios de mujeres gestantes con bajos niveles séricos de vitamina A se han reportado un mayor riesgo de infecciones puerperales y genitourinarias (18), pre-eclampsia (19), bajo peso neonatal o parto prematuro (20). Otras investigaciones señalan que la DVA representa un factor de riego para el síndrome de distrés respiratorio y un factor agravante a la condición de prematuridad (21,22).
Existen diversos métodos para la determinación del estado de la vitamina A en individuos y comunidades (23). La cuantificación del retinol sérico es el criterio de referencia estándar para definir deficiencia de vitamina A (24); sin embargo, como resultado de los cambios fisiológicos normales que tienen lugar durante el embarazo, los niveles séricos de retinol en las embarazadas caen por debajo de las concentraciones previas al embarazo, por lo que, aunque no se conocen los puntos de corte en gestantes, se considera que niveles inferiores a 30µg/dL detectan deficiencia de este micronutriente durante el embarazo (25). Por otro lado, la citología de impresión conjuntival (CIC), ha sido propuesta como método alternativo a la determinación del retinol sérico, en presencia de otras condiciones clínicas como procesos infecciosos e inflamatorios (26), así como en condición de embarazo (25). De bajo costo y sensible para detectar cambios histológicos secundarios a la deficiencia funcional temprana de la vitamina A, la cual puede afectar a una gran proporción de individuos aparentemente normales (27-29).
A pesar de que las embarazadas adolescentes conforman uno de los grupos riesgo de presentar deficiencia de vitamina A, son escasos los estudios que determinen la prevalencia de DVA en esta población. El objetivo de la investigación, fue determinar en una muestra de adolescentes gestantes de baja condición socio-económica de la ciudad de Maracaibo, Venezuela, el estado nutricional de la vitamina A según los valores de retinol sérico y la citología de impresión conjuntival.
PACIENTES Y MÉTODOS
Estudio transversal, descriptivo y controlado en adolescentes mujeres de Maracaibo, Venezuela. El estudio cumplió con las normas internacionales de investigación en humanos, por lo que fue aprobado por CONDES-LUZ y FONACIT (Nº 2000001904). Los padres o representantes legales de las adolescentes, una vez informados del objeto, beneficio y riesgos de la investigación, dieron su consentimiento verbal y escrito para su inclusión en el proyecto de investigación.
Fueron establecidos dos grupos de adolescentes: NO GESTANTES, quienes acudían a las Unidades de Educación Secundaria Luis Urdaneta y Gonzaga, en el Municipio Maracaibo y GESTANTES, quienes asistían a la Consulta prenatal del Servicio de Ginecología y Obstetricia del Hospital Central de Maracaibo, Dr. Urquinaona. Fueron considerados como criterios de inclusión adolescentes de sexo femenino, no gestantes según la fecha de última menstruación, y gestantes aparentemente sanas, libres de infección al examen físico y con proteína C reactiva negativa. Las adolescentes con antecedentes y/o síntomas de procesos infecciosos recientes fueron excluidas.
Para la determinación del tamaño de la muestra del grupo NO GESTANTE se utilizó la expresión: n =N Z2σ2/(E2 – 1) N + N Z2 σ2. Fue seleccionado un error máximo permisible de 10%. Obteniendo un tamaño de muestra de n=75 adolescentes no gestantes seleccionadas por el método aleatorio simple. En el grupo GESTANTES se utilizó la expresión: n= Z2PQ/E2. Fue seleccionado un error máximo permisible de 5%. Obteniendo un tamaño de muestra de n=160 adolescentes gestantes, seleccionadas por el método aleatorio simple.
El nivel socioeconómico fue evaluado utilizando el método de Graffar, modificado y adaptado para Venezuela por Méndez-Castellano y Méndez (30). La evaluación clínica y obstétrica fue realizada por médicos a través de un cuidadoso examen físico. Además se realizó el examen oftalmológico para detectar signos de deficiencia de vitamina A (24).
La muestra de sangre se tomó por punción venosa periférica teniendo en cuenta que hubiesen transcurrido por lo menos seis horas desde la última comida. La sangre se colectó en tubos sin anticoagulantes (protegido contra la luz con papel aluminizado), para la obtención de suero, el cual fue utilizado para la cuantificación del retinol sérico, por cromatografía líquida de alta eficacia (HPLC) según el método de Bieri y cols (31). Los resultados fueron expresados en µg/dL. De acuerdo a los patrones internacionales se considera: DVA=retinol sérico <20µg/dL; riesgo de DVA (RDVA)=20-30µg/dL; vitamina A normal=retinol >30 µg/dL (23,24). Se consideró afectación del estado nutricional de la vitamina A=riesgo de DVA + DVA (retinol sérico ≤30µg/dL).
Para evaluar el estado funcional de la vitamina A, se aplicó la técnica de CIC, de acuerdo al Manual de Instrucciones del International Center for Epidemiologic and Preventive Ophthalmology (ICEPO) (32). La evaluación del estado de la vitamina A se logró al observar la presencia o no de manchas de mucina y de células caliciformes que contienen moco (PAS positivos), además de alteraciones de la apariencia de las células epiteliales superficiales, las cuales aparecen disgregadas y alargadas, esto permitió establecer los criterios de normalidad o anormalidad del epitelio conjuntival. Un resultado de CIC normal indica un adecuado estado nutricional de vitamina A; mientras que una CIC anormal es indicativa de deficiencia de vitamina A.
Para el análisis estadístico se utilizó el sistemas SAS/STAT (versión 8.1; SAS Inst. Inc, Cary, Nc, USA.2000). Se utilizó la prueba de Chi cuadrado (X2) con un nivel de significancia de 5%, para determinar asociación entre gestación y DVA. Para comparar los grupos y determinar afectación de las gestantes según la edad gestacional, se aplicó el análisis de la varianza (ANOVA) seguida de la prueba de comparación múltiple de Dunnett. Se tomó el 95% como índice de confiabilidad estadística y se consideró significativo un valor p<0,05.
RESULTADOS
Se estudiaron 235 adolescentes femeninas (edad: 16,76 ± 1,48 años). Setenta y cinco adolescentes no gestantes (edad: 15,99 ± 1,21 años) y 160 adolescentes gestantes (edad: 17,12 ± 1,46 años), aparentemente sanas según evaluación clínica, no observándose signos clínico-oftalmológicos sugestivos de DVA. El 85,4% de las adolescentes no gestantes y el 96,90% de las gestantes se encontraban ubicadas en los estratos socioeconómicos de pobreza.
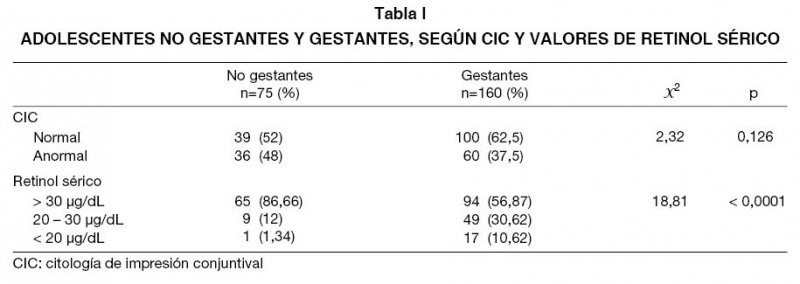
La prevalencia de CIC anormal en la población de no gestantes fue 48% y en las gestantes 37,5%, diferencia no significativa (Tabla I). Con respecto a los valores séricos de retinol, la prevalencia de afectación del estado nutricional de la vitamina A fue mayor en las adolescentes gestantes (41,24%) al compararlo con las no gestantes (13,34%), resultando esta diferencia estadísticamente significativa (X2=18,19; p=0,0001). Las adolescentes gestantes mostraron 4,5 veces mayor probabilidad de presentar afectación del estado nutricional de la vitamina A que las adolescentes no gestantes (Odds Ratio: 4,56; IC95%: 2,0-10,23; p=0,00002).
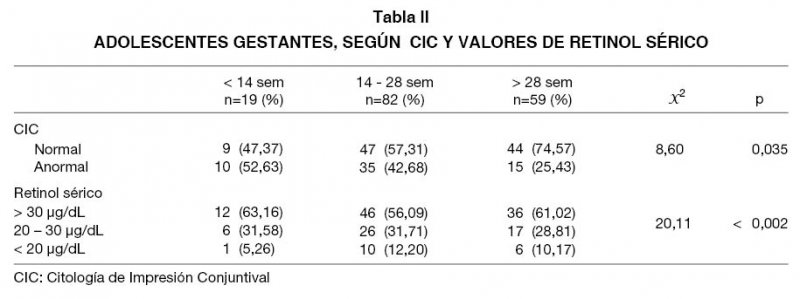
La mayor prevalencia de CIC anormal fue detectada en adolescentes durante el segundo trimestre de gestación (58,33%), resultado no significativo. Sin embargo, la prevalencia de afectación del estado nutricional de la vitamina A fue significativamente mayor en las adolescentes gestantes durante el segundo y tercer trimestre de gestación (p<0,0002) (Tabla II).
Además, en las adolescentes gestantes hay una disminución significativa de los valores promedio de retinol sérico al comparar con las no gestantes (p<0,0001) (Tabla III). Es importante resaltar, que a medida que avanza el embarazo, los valores promedio totales de retinol sérico mostraron una tendencia a la disminución, aunque no significativa, resultando esta disminución mayor en el III y II trimestre de gestación. Además, los valores séricos de retinol mostraron una correlación inversa, no significativa con la edad gestacional.
DISCUSIÓN
La Organización Mundial de la Salud considera que en la comunidad una prevalencia de CIC anormal ≥20% refleja la presencia de deficiencia de vitamina A como un problema de salud pública (29). En el presente estudio la prevalencia de CIC anormal, indicativa de DVA, en gestantes fue 37,50%; significativamente más prevalente durante el I y II trimestre (p=0,035), superior a la reportada por De la Campa y cols (1,4%) (33). En las no gestantes, la prevalencia fue 48%, superior a la reportada por Páez y cols (34), en un grupo de escolares de una zona urbana de Valencia, Venezuela. En Venezuela, la prevalencia de DVA es variable, se han reportado cifras que van desde 0,5% hasta 60%, dependiendo de la condición socioeconómica, el grupo etáreo, la región geográfica y el método de detección de la vitamina A (34-37). En el Estado Zulia, la prevalencia de DVA subclínica se ubica entre 21,78% y 35,46% en niños de condición socioeconómica marginal (38-40).
Los resultados de la presente investigación muestran que en adolescentes gestantes la prevalencia de afectación del estado nutricional de la vitamina A (riesgo de DVA=30,62% + DVA=10,62%) fue 41,24%, significativamente mayor que la detectada en no gestantes (p<0,0001), siendo más prevalente la DVA durante el segundo (12,20%) y tercer trimestre (10,17%) (p<0,002); superior a la prevalencia citada en gestantes por Rondó y cols (41) en Brasil y por Biswas y cols (42) en la India, pero contrario a lo señalado en Venezuela por Barón y cols (43) y en México por Casanueva y cols (44), quienes no observaron afectación del estado de la vitamina A en gestantes. Sin embargo, la prevalencia de DVA en gestantes durante el III trimestre fue inferior a las reportadas por Radhika y cols (17); Vinutha y cols (45), Ortega cols (46) y Martínez y cols (47). Es importante destacar que, según las recomendaciones de la OMS y el Grupo Consultivo Internacional para vitamina A, una prevalencia de DVA entre 10% y 20% refleja la presencia un problema moderado de salud pública (48).
Además, en adolescentes no gestantes la prevalencia observada de DVA (1,34%) fue superior a la reportada por Páez y cols (34), pero inferior a las reportadas por otros autores en Latinoamérica y el mundo (Tabla IV). Sin embargo, la prevalencia de RDVA (12,0%) fue inferior a las registradas por Páez y cols. (34) y por Carías y cols. (56).
Asimismo, los valores promedio de retinol sérico, resultaron significativamente más bajos en gestantes al comparar con las no gestantes (p<0,0001); mostrando además las gestantes una probabilidad 4,56 veces mayor de presentar afectación del estado nutricional de la vitamina A que aquellas adolescentes no gestantes (p<0,00002). Resultados similares fueron reportados en Bangladesh por Lee y cols (57), quienes observaron que más del 51% de las gestantes mostraban niveles séricos de retinol <30µg/dL. Cabe destacar que, los niveles promedios de retinol disminuyeron a medida que avanzaba el embarazo, mostrando una correlación inversa con la edad gestacional, aunque no significativa; resultados similares fueron observados por Meram y cols (58), Barón y cols (43), Casanueva y cols (44), Basu y cols (59) y por Chen y cols (60). Sin embargo, Jiang y cols (61), mostraron en un grupo de mujeres procedentes de una zona rural de Nepal que la prevalencia de deficiencia de micronutrientes fue más común en el primer trimestre de embarazo.
Estudios en humanos y animales señalan que los requerimientos de vitamina A no son uniformes durante todo el periodo gestacional. En ratas, los periodos de mayor necesidad fetal son los primeros meses del embarazo, por lo que bajas concentraciones de vitamina A durante este periodo se ha asociado con reabsorción, abortos y anomalías congénitas, por lo que las consecuencias más graves se producen en la etapa temprana de la gestación cuando se está llevando a cabo la organogénesis (62,63). Sin embargo, estudios en humanos señalan que, durante el embarazo normal tanto el metabolismo de la vitamina A y como consecuencia su concentración sanguínea, son afectadas durante la gestación, siendo el II y III trimestre los más afectados, debido al incremento en la transferencia transplacentaria de cantidades importantes de vitamina A de la madre al feto, la expansión del volumen plasmático y la disminución de la concentración de la proteína ligadora de retinol (RBP) (64). De allí que, durante la gestación se ha observado una tendencia a la disminución de los niveles séricos de retinol, predisponiendo a la aparición de hipovitaminosis A, especialmente en el último trimestre del embarazo (43,65).
CONCLUSIÓN
La alta prevalencia de DVA observada en este trabajo, representa un problema de salud pública en adolescentes venezolanas, no gestantes y gestantes, por lo que este grupo vulnerable requiere atención integral y vigilancia nutricional estricta durante la adolescencia con especial cuidado en la adolescente gestante.
BIBLIOGRAFÍA
1. World Health Organization. En: Adolescent Pregnancy. Issues in Adolescent Health and Development. 2004. Disponible en: http://whqlibdoc.who.int/publications/2004/9241591455_eng.pdf. Revisado: 13-05-2010.
2. World Health Organization. Adolescent pregnancy – Unmet needs and undone deeds. A review of the literature and programmes. Issues in Adolescent Health and Development. 2007. Disponible en: http://whqlibdoc.who.int/publications/2007/9789241595650_eng.pdf. Revisado: 13-05-2010.
3. Donoso E. Embarazo adolescente: un problema país (Editorial). Rev Chil Obstet Ginecol 2008;73(5):291-2.
4. Organización Panamericana de la Salud. Centro Latinoamericano de Perinatología. Salud de la Mujer y Reproductiva. El embarazo adolescente. Disponible en: http://www.clap.ops-oms.org/web_2005/estadisticas 20de 20 la 20region/textos /e35 206- 20Embaraz 20Adolescente.htm. Revisado: 13-05-2010.
5. United Nations Population Division. World Population Prospects: The 2008 Revision. Population Database. Disponible en: http://esa.un.org/unpp/index.asp?panel=2. Revisado: 13-05-2010.
6. Fondo de Población de las Naciones Unidas (FNUAP). Venezuela. ENPOFAM’98 – Encuesta Nacional de Población y Familia 1998. Disponible en: http://venezuela.unfpa.org/doumentos/Informe%20enpofam.pdf. Revisado: 13-05-2010.
7. Conde-Agudelo A, Belizán JM, Lammers C. Maternal-perinatal morbidity and mortality associated with adolescents pregnancy in Latin America: cross-sectional study. Am J Obstet Gynecol 2005;192(2):342-9.
8. González F, Brito M, Maneiro P. El embarazo en adolescentes: Un problema de alto riesgo. Rev Obstet Ginecol Venez 1997;57:13-7.
9. Sandoval J. Morbilidad obstétrica en adolescentes. En: Sandoval J, González E, editores. Salud sexual y reproductiva en la adolescencia. 3a edición. Caracas: Mediterráneo; 2003. p.451.
10. López J, Bracho C, Valderrama I, Silva R, Arenas C. La adolescente embarazada. Morbilidad materna y fetal. Rev Obstet Ginecol Venez 1992;52(1):17-22.
11. Salazar V, Paiva A, Saputelli E, Cano A, Salazar F, Riveras J, et al. Embarazo en adolescentes: ¿Es de alto riesgo obstétrico? Med Intern 2002;18(2):136-46.
12. Manrique R, Rivero A, Ortunio M, Rivas M, Cardozo R, Guevara H. Parto pretérmino en adolescents. Rev Obstet Ginecol Venez 2008;68(3):144-9.
13. Ladipo OA. Nutrition in pregnancy: mineral and vitamin supplements. Am J Clin Nutr 2000;72(1 Suppl):280S-290S.
14. Sáez Cantero V. Embarazo y adolescencia: resultados perinatales. Rev Cubana Obstet Ginecol [revista en la Internet]. 2005; 31(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2005000200001&lng=es. Revisado: 13-05-2010.
15. Espinosa V, Boldoy V, Villalobos A, Sepúlveda S. Relación entre los niveles de ácido todo trans-retinoico en sangre de cordón umbilical y medidas antropométricas del recién nacido. Rev Chil Obstet Ginecol 2007;72(4):210-6.
16. Underwood BA. Maternal vitamin A status and its importance in infancy and early childhood. Am J Clin Nutr 1994;59(2 Suppl):517S-522S.
17. Radhika MS, Bhaskaram P, Balakrishna N, Ramalakshmi BA, Devi S, Kumar BS. Effects of vitamin A deficiency during pregnancy on maternal and child health. BJOG 2002;109(6):689-93.
18. Faisel H, Pittrof R. Vitamin A and causes of maternal mortality: association and biological plausibility. Public Health Nutr 2000;3(3):321-7.
19. Yanik FF, Amanvermez R, Yanik A, Celik C, Kökçü A. Pre-eclampsia associated with increased lipid peroxidation and decreased serum vitamin E levels. Int J Gynaecol Obstet 1999;64(1):27-33.
20. Agarwal K, Dabke AT, Phuljhele NL, Khandwal OP. Factors affecting serum vitamin A levels in matched maternal-cord pairs. Indian J Pediatr 2008;75(5):443-6.
21. Checkley W, West KP Jr, Wise RA, Baldwin MR, Wu L, LeClerq SC, Christian P, Katz J, Tielsch JM, Khatry S, Sommer A. Maternal vitamin A supplementation and lung function in offspring. N Engl J Med 2010;362(19):1784-94.
22. Chailley-Heu B, Chelly N, Lelièvre-Pégorier M, Barlier-Mur A, Merlet-Bénichou C, Bourbon JR. Mild vitamin A deficiency delays fetal lung maturation in the rat. Am J Respir Cell Mol Biol 1999;21:89-96.
23. Tanumihardjo SA. Assessing vitamin A status: past, present and future. J Nutr 2004;134(1):290S-293S.
24. Sommer A, Davidson FR, Annecy Accords. Assessment and control of vitamin A deficiency: the Annecy Accords. J Nutr 2002;132(Suppl 9):S2845-S2850.
25. Sivakumar B, Panth M, Shatrugna V, Raman L. Vitamin A requirements assessed by plasma response to supplementation during pregnancy. Int J Vit Nutr Res 1997;67:232-6.
26. Filteau SM. Vitamin A and the acute-phase response. Nutrition 1999;15(4):326-8.
27. Fuchs G, Ausayakhun S, Ruckphaopunt S, Tansuhaj A, Suskind R. Relationship between vitamin A deficiency, malnutrition, and conjunctival impression cytology. Am J Clin Nutr 1994:60:293-8.
28. Stoltzfus R, Miller K, Hakimi M, and Rasmussen K. Conjunctival impression cytology as an indicator of vitamin A status in lactating Indonesian women. Am J Clin Nutr 1993;58:167-73.
29. Congdon NG, West KP. Physiologic indicators of vitamin a status. J. Nutr 2002;132:2889S-2894S
30. Méndez-Castellano H, De Méndez MC. Sociedad y estratificación social. Método Graffar-Méndez Castellano. FUNDACREDESA 1994; Caracas. pp 7-35.
31. Bieri JG, Tolliver TJ, Catignani G. Simultaneous determination of -tocopherol and retinol in plasma or red cells by high pressure liquid chromatography. Am J Clin Nutr 1979;32:2143-9.
32. Wittpenn J, West K, Keenum D, Farazdaghi M, Humpherey J, Howard G, et al. Training manual assessment of vitamin A status by impression cytology. ICEPO, Dana Center for Preventive Ophthalmology 1988;1-25.
33. De la Campa JD, Moreira Díaz E, Valdés Roque AI. Vitamina A en gestantes evaluadas mediante encuesta dietética e impresión citológica conjuntival. Rev Cubana Med Gen Integr 1996;12(3):234-41.
34. Páez MC, Díaz N, Solano L, Del Real SI. Estado de vitamina A y su relación con antecedentes infecciosos en escolares venezolanos. An Venez Nutr 2008;21(1):5-13.
35. Landaeta Jiménez, M. Alimentación y nutrición en la Venezuela de 2000. An Venez Nutr 2000;13(2):143-50.
36. Solano L, Meertens L, Peña E, Argüello F. Deficiencia de micronutrientes. Situación actual. An Venez Nutr 1998;11(1):48-54.
37. Jaffe W, Entrena A. La situación de la vitamina A en Venezuela. An Venez Nutr 1993;6:19-24.
38. Amaya-Castellanos D, Viloria-Castejón H, Ortega P, Gómez G, Urrieta JR, Lobo P, Estévez J. Deficiencia de vitamina A y estado nutricional antropométrico en niños marginales urbanos y rurales en el Estado Zulia, Venezuela. Invest Clin 2002;43:89-105.
39. Castejón HV, Ortega P, Amaya D, Gómez G, Leal J, Castejón OJ. Co-existence of anemia, vitamin A deficiency and growth retardation among children 24-84 months old in Maracaibo, Venezuela. Nutr Neurosc 2004;7:113-9.
40. Castejón HV, Ortega P, Díaz M, Amaya D, Gómez G, Ramos M, et al. Prevalencia de deficiencia subclínica de vitamina A y desnutrición infantil en niños marginales de Maracaibo-Venezuela. Arch Latino Nutr 2001;51:25-32.
41. Rondó PH, Villar BS, Tomkins AM. Vitamin A status of pregnant women assessed by a biochemical indicator and a simplified Food Frequency Questionnaire. Arch Latinoam Nutr 1999;49(4):322-5.
42. Biswas AB, Mitra NK, Chakraborty I, Basu S, Kumar S. Evaluation of vitamin A status during pregnancy. J Indian Med Assoc 2000;98(9):525-9.
43. Barón MA, Solano L, Llovera D, Peña E. Estado de vitamina A en adolescentes embarazadas de bajo estrato socioeconómico. Arch Latinoam Nutr 2003;53(4):364-8.
44. Casanueva E, Valdés-Ramos R, Pfeffer F, Ricalde-Moreno A, García-Villegas E, Meza C. Retinol sérico en mujeres mexicanas urbanas durante el periodo perinatal. Salud Publica Mex 1999;41:317-21.
45. Vinutha B, Mehta M, Shanbag P. Vitamin A status of pregnant women and effect of post partum vitamin A supplementation. Indian Pediatr 2000;37(11):1188-93.
46. Ortega RM, Andrés P, Martínez RM, López-Sobaler AM. Vitamin A status during the third trimester of pregnancy in spanish women: influence on concentrations of vitamin A in breast milk. Am J Clin Nutr 1997;66(3):564-8.
47. Martínez RM, Ortega RM, Andrés P. Vitamin A concentration in maternal milk: the effect of intake and serum levels of vitamin A during the third trimester of pregnancy. Med Clin (Barc) 1997;109(15):573-6.
48. WHO. Global prevalence of vitamin A deficiency in populations at risk 1995–2005. WHO Global Database on Vitamin A Deficiency. Geneva, World Health Organization, 2009.
49. Hevia P. Informe Vitamina A. Proyecto Harinas. Informe mimeografiado para UNICEF. Laboratorio de Nutrición Universidad Simón Bolívar 1998; 20 p.
50. Papale JF, García MN, Torres M, Berné Y, Dellan G, Rodríguez D, et al. Anemia, deficiencias de hierro y de vitamina A y helmintiasis en una población rural del estado Lara. An Venez Nutr 2008;21(2):70-6.
51. Alvarez M, Uzcátegui R, López C, Baracaldo C, Castro L, Ballesteros N. Plasma retinol concentration according to pubertal maturation in school children and adolescents of Medellin, Colombia. Eur J Clin Nutr 2004; 58:456-61.
52. Bianculli C, Carmuega E, Armatta A, Machain C, Berner E, Castro J, et al. Factores de riesgo para la salud y la situación nutricional de los adolescentes urbanos en Argentina. Adolesc Latinoam 1998;1:92-104.
53. Monge-Rojas R, Barrantes M, Holst I, Núñez-Rivas H, Alfaro T, Rodríguez S, et al. Biochemical indicators of nutritional status and dietary intake in Costa Rica Cabecar Indian Adolescents. Food Nutr Bull 2005;26:3-16.
54. Graebner I, Saito C, de Souza E. Avaliação bioquímica de vitamina A em escolares de uma comunidade rural. J. Pediatr (Rio J.) 2007;83(3):247-52.
55. Woodruff BA, Blanck HM, Slutsker L, Cookson ST, Larson MK, Duffield A, et al. Anaemia, iron status and vitamin A deficiency among adolescent refugees in Kenya and Nepal. Public Health Nutr 2006;9(1):26-34.
56. Carías D, Cioccia AM, Gutiérrez M, Hevia P, Pérez A. Indicadores bioquímicos del estado nutricional en adolescentes pre-universitarios de Caracas. An Venez Nutr 2009;22(1):12-9.
57. Lee V, Ahmed F, Wada S, Ahmed T, Ahmed AS, Parvin Banu C, Akhter N. Extent of vitamin A deficiency among rural pregnant women in Bangladesh. Public Health Nutr 2008;11(12):1326-31.
58. Meram I, Bozkurt AI, Kilincer S, Ozcirpici B, Ozgur S. Vitamin A and beta-carotene levels during pregnancy in Gaziantep, Turkey. Acta Médica (Hradec Kralove) 2004;47(3):189-93.
59. Basu TK, Wein EE, Gangopadhyay KC, Wolever TMS, Godel JC. Plasma vitamin A (retinol) and retinol-binding protein in newborns and their mothers. Nutr Res 1994;14:1297-303.
60. Chen HW, Lii CK, Ou CC, Wong YC, Kuo BJ, Liu CH. Plasma vitamin A and E and red blood cell fatty acid profile in newborns and their mothers. Eur J Clin Nutr 1996;50:556-9.
61. Jiang T, Christian P, Khatry SK, Wu L, West KP Jr. Micronutrient deficiencies in early pregnancy are common, concurrent, and vary by season among rural Nepali pregnant women. J Nutr 2005;135(5):1106-12.
62. Antipatis C, Grant G, Ashworth CJ. Moderate maternal vitamin A deficiency affects perinatal organ growth and development in rats. Br J Nutr 2000; 84(1):125-32.
63. Cedillo NS, Dellán JE, Toro MJ. Estado nutricional de las adolescentes embarazadas: relación con el crecimiento fetal. Rev Obstet Ginecol Venez 2006;66(4):233-40.
64. Sapin V, Alexandre MC, Chaïb S, Bournazeau JA, Sauvant P, Borel P, et al. Effect of vitamin A status at the end of term pregnancy on the saturation of retinol binding protein with retinol. Am J Clin Nutr 2000;71(2):537-43.
65. West KP Jr. Extent of vitamin A deficiency among preschool children and women of reproductive age. J Nutr 2002;132(9 Suppl):2857S-2866S.