2006
3
Autores:
Ricardo Cornejo U.1, a
Instituciones:
1Departamento de Ciencias Básicas, Facultad de Medicina, Universidad de La Frontera, Temuco.
aBiólogo Celular, PhD.
Tipo de documento:
Trabajos OriginalesDrástica disminución de beta 1 integrina caracteriza la transformación celular del epitelio mamario
Contenido del documento:
INTRODUCCIÓN
Las células HC11 constituyen una línea de epitelio mamario normal derivada del linaje COMMA 1D obtenida de glándula mamaria de ratas BALB/c en mitad de preñez, disponiéndose en contacto estrecho y formando un epitelio cúbico en monocapa. Estas células retienen las características propias del crecimiento y la diferenciación normal in vivo de la glándula y producen b caseína, la principal proteína de la leche (1).
Cuando estas células son transfectadas con el oncogén ras, se genera el mecanismo biológico de la transformación celular, caracterizado por inducir alteraciones genéticas cuya traducción provocará mudanzas drásticas tanto en su morfología (2) como en los aspectos fisiológicos de estas células, incluida la inhibición en la síntesis de b caseína (3).
En este contexto, contando con un anticuerpo anti cadena β1 integrina, se comparó en los tipos celulares tanto normales como transformados, de modo cuantitativo, la expresión de integrinas (4), glicoproteínas heterodímeros transmembrana constituidas por subunidades Alfa y Beta, unidas no covalentemente (5), habiéndose descrito alrededor de 15 cadenas Alfa y 10 Beta, donde diferentes cadenas Alfa pueden relacionarse con una misma cadena Beta y viceversa, generándose de este modo, un gran número de receptores con diferente afinidad por sus ligandos (6,7).
De igual modo, las integrinas corresponden a una familia de moléculas receptoras de la superficie celular que interactúan con el citoesqueleto (7); con proteínas de la MEC y mediando la adhesión célula-célula (8), e involucradas en proliferación, migración e invasión celular (9). En esta familia de integrinas, β1 se constituye en la molécula fundamental que aparece modulando la adhesión con las principales proteínas de la MEC: colágeno, laminina y fibronectina (10).
MATERIAL Y MÉTODO
Microscopia electrónica de transmisión (Técnica de inmuno-oro, realizada por el Dr. Paulo Joazeiro; Sao Paulo, Brasil). Monocapas de células epiteliales mamarias de rata normales y transformadas fueron lavadas en las propias cámaras de cultivo con BSA 1%, suero normal de cabra al 30% y azida sódica 0,2% disuelto en PBS 0,1 M pH 7,4 durante 5 minutos a temperatura ambiente. La reacción fue iniciada incubándose las monocapas con el anticuerpo primario anti cadena β1 integrina preparado en diluciones 1:50; 1:100 y 1:200 en la misma solución de PBS descrita anteriormente durante 30 minutos a temperatura ambiente, considerándose como control aquellas incubadas con dilución 1:50. Luego de 3 lavados con PBS, fue adicionado 200 ul del anticuerpo secundario marcado con oro coloidal (anti IgG conejo conjugada con partículas de oro de 10 nm de diámetro) durante 45 minutos a temperatura ambiente. Posteriormente los cultivos fueron lavados con PBS y las monocapas fijadas en solución de glutaraldehido 2% en tampón fosfato de sodio y potasio 0,15 M pH 7,2 por 30 minutos a temperatura ambiente. En las propias cámaras el material fue lavado en solución que contenía 6 g de NaCl y 73 g de sacarosa disueltos en 1 litro de agua destilada. Fijada con tetróxido de osmio 1% por 60 minutos y post-fijado en acetato de uranilo 0,5% disuelto en la solución de lavado durante 18 horas. Posteriormente lavado y deshidratado en concentraciones crecientes de acetona (30 a 100%) e incluido en Araldita 6005. Se obtuvieron cortes ultrafinos de aproximadamente 60 nm de grosor, los que fueron tratados con acetato de uranilo 2%, durante 40 minutos y citrato de plomo 0,5%, por 10 minutos. Las muestras fueron estudiadas y fotografiadas en un microscopio electrónico Phillips EM 400.
Método estererológico. A partir de los bloques para microscopía electrónica, fueron obtenidos cortes ultrafinos, en los cuales se micrografiaron cada uno de los tipos celulares, con aumento de 18.000X. Para la evaluación de las fracciones volumétricas correspondiente a las β1 integrinas, fue sobrepuesto un retículo de puntos, en las micrografías electrónicas y se procedió al conteo diferencial de los puntos que incidían sobre los perfiles de ellas, calculándose la fracción volumétrica que un determinado componente ocupa, mediante la siguiente ecuación:
Fv= Pi / Pt
Donde:
Fv = fracción volumétrica del componente específico.
Pi = puntos incidentes sobre el componente en estudio.
Pt = puntos totales incidentes en la estructura general.
RESULTADOS
A partir de las múltiples micrografías electrónicas obtenidas, pertenecientes a las células mamarias tanto normales como transformados, se realizaron sobre ellas los análisis morfométricos correspondientes, determinado únicamente la variación de las fracciones volumétricas de β1 integrinas asociadas con su marcación especifica bajo la forma de partículas de oro coloidal de 10 nm de diámetro, que se expresan con el devenir de la transformación celular y que ultraestructuralmente aparecen claramente visibles en las Figuras 1 y 2.
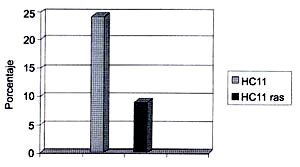
El resultado cuantitativo de la evaluación morfométrica queda expresado en la Figura 3, la cual describe que la célula mamaria normal (HC11) presenta una fracción volumétrica de β1 integrina que alcanza a un 24 %. Se muestra además que en las células transformadas (HC11 ras) en contraposición con las primeras, la fracción volumétrica correspondiente a β1 integrina experimenta una drástica disminución alcanzando solamente a un 9%.
DISCUSIÓN
Ha sido ampliamente demostrado que células de epitelio mamario de ratas, mantenidas en cultio, requieren para su curso normal de crecimiento y desarrollo, presentar adhesión con su membrana basal subyacente (11), mientras que, por el contrario, el primer indicio de transformación celular es la independencia con los mecanismos de adhesión celular lo cual se traduce en modificaciones fisiológicas en proliferación y sobrevivencia (12).
Este resultado, mostrando que células mamarias normales expresan mayor volumen de b1 integrina, y siendo estas mediante sus correspondientes mecanismos adhesivos de modular procesos normales de crecimiento y sobrevida celular, es semejante al descrito por Howlett y cols (13), en el cual, como en este trabajo, describen que la transformación a malignidad en carcinomas de glándula mamaria significa pérdida en la expresión de b1 integrina. Del mismo modo, experimentaciones con células de adenocarcinoma de glándula mamaria describe que β1 integrinas aparecen disminuídas con respecto a las encontradas en células normales de epitelio mamario (10). En este contexto también ha sido demostrado que células pertenecientes a glándula mamaria de rata mutantes en β1 integrina muestran alvéolos desorganizados debido a alteraciones en la adhesión célula-membrana basal (14).
De acuerdo a la cuantificación morfométrica determinando específicamente los valores correspondientes a las fracciones volumétricas de β1 integrinas, en células mamarias mantenidas en cultivo tanto normales como transformadas, encontrando que dichas fracciones son extremadamente diferentes, produciéndose una disminución drástica equivalente a un 30% de β1 integrina en HC11 ras, indica que en el desarrollo del proceso de transformación existe un evidente cambio en la expresión génica de las células transformadas, que se traducirá fisiológicamente en pérdida de capacidad de adhesión de estas células tanto a proteínas de su MEC, a su membrana basal como a otras células de su entorno.
Similar conclusión se plantea en estudios observando el desarrollo de melanomas donde se producen cambios en la expresión de integrinas, en las funciones intracelulares del control de integrinas y la probabilidad de percibir señales que permitan uniones con ligandos, generando, de este modo, que las células transformadas pierdan capacidad de unirse a su medio ambiente, modulando diferentes fenotipos, tales como los estacionarios, migratorios o invasivos (15).
Finalmente, fue demostrado usando un modelo biológico de células de rata en las cuales la función de β1 integrina han sido previamente desorganizadas, que la expresión de esta integrina es crítica para la iniciación de la tumorigenicidad mamaria y el mantenimiento de la capacidad proliferativa de la célula tumoral tardía, constituyéndose en un indicio directo que β1 integrina juega un rol fundamental tanto el inicio como en la mantención del crecimiento de las células mamarias transformadas (16).
Este trabajo, si bien plantea como en otros similares, el rol determinante de β1 integrina en el desencadenamiento hacia malignidad celular, posee además la particularidad de mostrar desde el punto de vista morfológico y ultraestructural las moléculas de adhesión situadas en la región externa de la membrana plasmática y, por ende, susceptible de ser evaluada morfométricamente.
Agradecimientos. El autor de este trabajo agradece al Dr. Paulo Joazeiro, de la Facultad de Medicina de la Universidad de Sao Paulo, Brasil, por el desarrollo de la técnica de inmuno-oro. A la Dra Regina Moreno A. por el auxilio con el Summary y a Vivian Cullen F. por la transcripción de este trabajo.
BIBLIOGRAFÍA
- Ball RK, Friis RR, Schoenenberger CA, Dopler W, Groner B. Prolactin regulation of beta-casein gene expression and a cytosolic 120 kD protein in a cloned mouse mammary epithelial cell line. EMBO J 1998;7:2089-95.
- Cornejo R. Análisis morfométrico y ultraestructural de componentes asociados a síntesis proteica en células mamarias normales y transformadas. Int J Morphol 2004;22:221-4.
- Hynes NE, Caitriona M, Stiefel U, Taverna D, Ball R, Happ B, Schmmith-Ney M, Groner B. The v-raf and Ha-ras oncogenes inhibit transcription from the beta-casein gene promoter by suppression of a mammary gland specif transcription factor. In: Hormonal carcinogesis. Li JJ (ed). Berlín, Springer Verlag 1993; 164-71.
- Cornejo R. Expresión de integrinas en células mamarias normales y transformadas. Rev Chil Anat 1995;13:155-8.
- Aplin AE, Howe A, Alahari SK, Juliano RL. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, inmunoglobulin-cell adhesion molecules, and selectins. Phamacol Rev 1998;50:197-263.
- Cornejo R, Rocha R, de Jourdan V, Maurelia L. Integrinas: Mediadores de interacción entre células y matriz extracelular. Rev Chil Cs Med Biol 1994;4: 63-6.
- Schwartz MA, Schaller MD, Ginsberg MH. Integrins: emerging paradigms of signal transduction. Annu Rev Cell Dev Biol 1995;11:549-99.
- Akiyama SK, Agata K, Yamada K. Cell surface receptors for extracellular components. Biochim Biophys Acta 1990;1031:91-110.
- Hynes RO. Integrins, a familiy of the cell surface receptors. Cell 1987;48:549-55.
- Riley AN, Rice C, Quinn M. Role of integrin receptors for fibronectin, collagen and laminin in the regulation of ovarian functions in response to a matrix microenvironment. Clin Exp Metastasis 2005;22: 391-402.
- Zutter MM, Sun H, Santoro SA. Altered integrin expression and the malignant phenotype: the contribution of multiple integrated integrin receptors. J Mammary Gland Biol Neoplasia 1998;3:191-200.
- Streuli CH, Gilmore AP. Adhesion-mediated signaling in the regulation of mammary epithelial cell survival. J Mammary Gland Biol Neoplasia 1999;4:183-91.
- Howlett AR, Bailey N, Damsky C, Petersen OW, Bisell MJ. Cellular growth and survival are mediated by β1 integrins in normal human breast epithelium but not in breast carcinoma. J Cell Sci 1995;108: 1945-57.
- Frisch SM, Ruoslahti E. Integrins and anoikis. Curr Opin Cell Biol 1997;9:701-6.
- Zhang LN, Naylor MJ, Schatzmann F, Maurer F, Wintermantel T, Schuetz G, Mueller U, Streuli CH, Hynes NE. Beta 1 integrins regulate mammary gland proliferation and maintain the integrity of mammary alveoli. EMBO J 2005;24:1924-53.
- Kuphal S, Bauer R, Bosserhoff AK. Integrin signaling in malignant melanoma. Cancer Metastasis Rev 2005;24:195-222.
- White DE, Kurpios NA, Hassell JA, Blaess S, Muller WJ. Targeted disruption of beta1-integrin in a transgenic mouse model of human breast cancer reveals an essential role in mammary tumor induction. Cancer Cell 2004;6:159-70.