2019
4
Autores:
Jorly Mejia-Montilla 1, Nadia Reyna-Villasmil 2, Eduardo Reyna-Villasmil 3, Lorena Domínguez-Brito 4, Carmen Naranjo-Rodríguez 5, Delia Noriega-Verdugo 6, Pamela Ruiz-Polit 7, Vanessa Vargas-Olalla 8 y Christian Villavicencio-Yanos 9.
Instituciones:
1) Doctora en Medicina Clínica. Licenciada en Nutrición y Dietética. Docente de la Catedra de Dietoterapia. Facultad de Medicina. La Universidad del Zulia. Maracaibo. Estado Zulia. VENEZUELA.
2) Doctora en Tecnología de Alimentos. Licenciada en Nutrición y Dietética. Docente de la Catedra de Bioquímica. Facultad de Medicina. La Universidad del Zulia. Maracaibo. Estado Zulia. VENEZUELA.
3) Doctor en Medicina Clínica. Especialista en Ginecología y Obstetricia Servicio de Obstetricia y Ginecología. Hospital Central “Dr. Urquinaona”. Maracaibo. Estado Zulia. VENEZUELA.
4) Magister en Nutrición Clínica. Docente de la Universidad Estatal de Milagro. Milagro, ECUADOR.
5) Magister en Nutrición Clínica. Docente de la Universidad Estatal de Milagro. Milagro, ECUADOR.
6) Doctora en Química y Farmacia. Docente de la Universidad Estatal de Milagro. Milagro, ECUADOR.
7) Master en Nutrición y Dietética. Docente Universidad Estatal de Milagro. Milagro, ECUADOR.
8) Especialista en Alimentación y Nutrición para la Promoción de la Salud. Docente de la Universidad Estatal de Milagro. Milagro, ECUADOR. 9) Ingeniero químico. Docente Instituto Tecnológico Superior “Simón Bolívar”. Guayaquil, ECUADOR.
Correspondencia a:
Dr. Eduardo Reyna-Villasmil. Hospital Central “Dr. Urquinaona” Final Av. El Milagro.
Maracaibo, Estado Zulia. VENEZUELA.
Teléfono: 58162605233.
E-mail: sippenbauch@gmail.com
Tipo de documento:
Artículo de investigaciónEfectos del aceite de linaza sobre las concentraciones de resistina plasmática en mujeres con síndrome de ovarios poliquísticos.
Contenido del documento:
RESUMEN
OBJETIVO: Determinar el efecto del aceite de linaza sobre las concentraciones plasmáticas de resistina en mujeres con diagnóstico de síndrome de ovarios poliquísticos.
METODOS: se realizó un estudio en 195 mujeres con diagnóstico de SOPQ que fueron tratadas con aceite de linaza por 12 semanas (n = 97; grupo A) y controles tratados con placebo (n = 98, grupo B). Se compararon las características generales, concentraciones hormonales, perfil lipídico y resistina.
RESULTADOS: No se encontraron diferencias significativas entre ambos grupos con relación a las características generales (p = ns). Tampoco se encontraron diferencias significativas en las concentraciones de hormonales, glicemia y HOMA entre los grupos (p = ns). Las mujeres del grupo A y B no mostraron diferencias estadísticamente significativas en la ingesta total, ingesta de carbohidratos, proteínas y grasas totales entre los valores al inicio y al final del estudio (p = ns). Las mujeres del grupo A presentaron disminución concentraciones de colesterol total lipoproteínas de baja densidad y triglicéridos (p < 0,0001). Los valores promedio de resistina mostraron disminución significativa luego del tratamiento (p < 0,0001). No se encontraron diferencias estadísticamente significativas en los valores promedio de las diferentes variables en las mujeres del grupo B (p = ns).
CONCLUSION: El aceite de linaza produjo disminución significativa en las concentraciones plasmáticas de resistina en mujeres con síndrome de ovarios poliquísticos luego de 12 semanas de consumo.
PALABRAS CLAVE: Aceite de linaza; Resistina; Síndrome de ovarios poliquísticos, Suplementación. ABSTRACT
OBJECTIVE: To determine effects of flaxseed oil over plasma concentrations of resistin in women with diagnosis of polycystic ovary syndrome.
METHODS: A research was performed in 195 women with diagnosis of polycystic ovary syndrome who were treated with flaxseed oil for 12 weeks (n = 97; group A) and controls treated with placebo (n = 98, group B). Overall characteristics, hormonal, metabolic, lipid profile and resistin concentrations were compared. RESULTS: There were no significant differences between the two groups in relation to the general characteristics (p = ns). There were also no significant differences in hormonal, glycemia and HOMA concentrations between the groups (p = ns). The women in group A and B did not show statistically significant differences in total calories intake, carbohydrate, protein and total fat intake between initial and final values of study (p = ns). Women in group A had decreased concentrations of total cholesterol, low-density lipoprotein and triglycerides (p < 0.0001). Mean values of plasma resistin showed a significant reduction after treatment (p < 0.0001). No statistically significant differences were found in the mean values of the different variables in women of group B (p = ns). CONCLUSION: Flaxseed oil produced a significant decrease in plasma resistin concentrations in women with polycystic ovary syndrome after 12 weeks of consumption.
KEYWORDS: Flaxseed oil; Resistin; Polycystic ovary syndrome.
INTRODUCCION
El síndrome de ovarios poliquísticos (SOPQ) es uno de las endocrinopatías más comunes que afectan a las mujeres en edades reproductivas. Esta caracterizado por oligo/anovulación, ovarios poliquísticos e hiperandrogenismo clínico/bioquímico. Estas mujeres presentan insulinorresistencia, que, junto con los cambios en las concentraciones de andrógenos, están asociados con desordenes reproductivos, metabólicos y psicológicos1. Todo esto
representa un papel importante en el fenotipo metabólico a través de la secreción de diferentes proteínas y citokinas pro-inflamatorias2.
El tejido adiposo es un órgano endocrino activo que puede producir una gran cantidad de péptidos bioactivos involucrados en la regulación de la homeostasis de energía, reproducción, acción de la insulina, función de las células beta, metabolismo lipídico, disfunción endotelial y enfermedades metabólicas. Además, parecen ser el factor que conecta las alteraciones metabólicas con el síndrome,
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
265
ya que la secreción de estas tiene un papel fundamental en la patogénesis del SOPQ y el síndrome afecta el perfil de secreción de las adipocinas3.
La resistina es una proteína rica en cisteína secretada como un polipéptido de 94 aminoácidos. En animales es secretada por los adipocitos blancos maduros y sus concentraciones circulantes se incrementan en las formas genéticas de la obesidad inducidas por la dieta4. En los humanos es secretada principalmente por leucocitos mononucleares en sangre periférica, macrófagos, células esplénicas – médula ósea y células estromales del tejido adiposo en lugar de adipocitos. Se ha postulado inicialmente que la resistina es un factor de riesgo para la insulinorresistencia, ya que modula la acción de la insulina, energía, glucosa y homeostasis de los lípidos5. Sin embargo, los datos disponibles posteriores sobre esta citoquina han revelado resultados contradictorios tanto en humanos como en roedores6. Las adipocinas pueden ser los elementos que conectan la obesidad y el SOPQ. Además, las alteraciones en la secreción de estas sustancias tienen un papel en la patogénesis del síndrome 1.
El aceite de linaza se obtiene de las semillas de la planta de lino y contiene ácidos grasos omega-3 y omega-6, que son necesarios para la salud humana. También contiene el ácido graso esencial ácido alfa- linolénico, que posteriormente se convierte en ácido eicosapentaenoico y ácido docosahexaenoico, que es el ácido graso omega-3 que se encuentra en el aceite de pescado7. Los efectos benéficos de los ácidos grasos del aceite de linaza sobre la insulinorresistencia, inflamación y estrés oxidativo han sido reportados previamente en algunos estudios8. Los estudios experimentales de los efectos del aceite de linaza en las concentraciones de adipocinas, y en especial de la resistina, en diferentes patologías han suministrado observaciones contradictorias y en mujeres con diagnóstico de SOPQ son escasos. El objetivo de la investigación fue determinar el efecto del aceite de linaza sobre las concentraciones plasmáticas de resistina en mujeres con diagnóstico de síndrome de ovarios poliquísticos.
MATERIALES Y METODOS
Este estudio clínico prospectivo se realizó en mujeres con diagnóstico de SOPQ que asistieron a la consulta de Ginecología, Medicina Interna y Endocrinología del Hospital Central “Dr. Urquinaona”, Maracaibo, Venezuela, en el periodo de enero del 2011 a mayo
de 2017. Todas las participantes fueron evaluadas clínicamente (examen general y ginecológico, incluyendo ecografía transvaginal).
Para realizar el diagnóstico de SOPQ se utilizaron los criterios establecidas por el grupo de consenso para su diagnóstico9: oligomenorrea (intervalo mayor o igual a 35 días) o amenorrea (ausencia de sangrado vaginal por 6 meses), hirsutismo, aumento de la relación hormona luteinizante / hormona foliculoestimulante, concentraciones séricas elevadas de testosterona, presencia de múltiples quistes ováricos (más de 10 quistes pequeños de 2-8 milímetros de diámetro) dispuestos en forma periférica y dispersos a lo largo del núcleo denso de estroma (apariencia de collar de quistes foliculares) en la ecografía transvaginal, que fue realizada por dos médicos del Departamento de Diagnóstico por Imágenes del hospital e independientes a la investigación. Además, de estos hallazgos también se excluyeron otros síndromes similares como: disfunción suprarrenal, síndrome de Cushing, hiperplasia adrenal congénita, tumores productores de andrógenos, hiperprolactinemia e hipotiroidismo no tratado o patología tiroidea.
Se excluyeron del estudio las participantes que utilizaron anticonceptivos orales, medicamentos antiandrogénicos, sensibilizadores de insulina o cualquier otro medicamento o suplemento que afectara el peso, sensibilidad a la insulina o función normal del eje hipotálamo-hipófisis-gonadal durante los tres meses previos al estudio. También fueron excluidas aquellas mujeres con antecedentes de diabetes mellitus, deficiencia de 21 hidroxilasa, enfermedad renal, hepática y/o gastrointestinal, hábito tabáquico o consumo de más de 2 bebidas alcohólicas por semana, si no cumplían los protocolos del estudio o no podían consumir más del 80% del tratamiento.
Todas las mujeres seleccionadas estuvieron de acuerdo en participar en la investigación y se obtuvo un consentimiento informado por escrito de cada participante. El protocolo del estudio está basado en las normas éticas del Hospital Central “Dr. Urquinaona” – La Universidad del Zulia y la Declaración de Helsinki de 1975, revisada en 1989. El Comité de Ética e Investigación del hospital aprobó la realización del estudio.
El tamaño de la muestra se calculó sobre la base de la revisión de investigaciones previas10, que demostraron una variación alrededor del 15% de las concentraciones de resistina después del tratamiento con suplementación de ácidos grasos Omega-3. Para alcanzar una meta similar, con un alfa de 0,05 y poder
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
266
del 90%, 125 participantes fueron consideradas necesarias en cada grupo para alcanzar resultados similares.
Para la asignación al azar se utilizó una lista de números aleatorios generada por computadora. Los sobres opacos, sellados y numerados que contenían las asignaciones a cada grupo, guardados por una persona independiente, que desconocía a los objetivos del estudio. Cada sobre numerado contenía un papel blanco de 5 x 5 centímetros con la asignación a cada grupo: grupo A (casos – tratamiento con aceite de linaza) o grupo B (controles – suplementación con placebo). Ninguno de los investigadores conocía cual grupo de mujeres tomaban aceite de linaza o placebo hasta después del final del estudio.
Ambos grupos recibieron cápsulas de aceite de linaza o placebo dos veces al día cada día durante 12 semanas. Cada cápsula contenía 1000 mg de aceite de linaza (Vita Day Products, EE.UU.) y cada capsula de placebo incluía 500 mg de parafina. La apariencia de las capsulas y los envases eran similares. El análisis de las cápsulas se presenta en la tabla 1. Los registros escritos que presentaban los códigos y el grupo de intervención respectivo fueron abiertos sólo después que se realizaron todos los análisis.
El peso (Kg) se midió dos veces hasta el 0.1 Kilogramos más cercano, sin zapatos. La talla (m) se midió dos veces hasta 0.5 centímetros más cercano, sin zapatos. El índice de masa corporal fue calculado con la formula peso/(talla)2 en kilogramos por metro cuadrado. La circunferencia de la cintura fue cuantificada en la posición de pie en el punto medio entre el borde superior de la cresta ilíaca y el borde inferior de la última costilla a través de la cinta graduada en centímetros. La circunferencia de la cadera fue medida en la posición de pie, la mayor distancia entre los trocánteres mayores. La relación cintura-cadera se calculó como la circunferencia de la cintura en centímetros dividida por la circunferencia de la cadera en centímetros.
Se utilizó un cuestionario de salud y estilo de vida para evaluar el patrón de consumo de tabaco y alcohol, así como la duración de los ciclos menstruales. También se recolectaron los datos para un cuestionario de actividad física. Un nutricionista capacitado realizó recordatorios de alimentos de las últimas 72 horas, uno al principio y otro al final del estudio para analizar la dieta. La ingesta de nutrientes y los datos dietéticos se calcularon a nivel grupal e incluyeron la ingesta total de energía, de carbohidratos, proteínas y grasa total en gramos y porcentajes, analizando la composición de macronutrientes con el uso del
Programa de Procesamiento de Alimentos y Análisis de Nutrición (Esha Research, EE.UU.). El cumplimiento de la suplementación se evaluó por la práctica convencional de «conteo de píldoras» y se consideró el cumplimiento adecuado como la ingesta superior al 70% de las capsulas prescritas durante el periodo del estudio. Otra nutricionista, que desconocía la asignación a cada grupo, fue responsable de contar las cápsulas devueltas y de suministrar nuevas cápsulas. Cada participante fue consultada semanalmente por vía telefónica y asistía mensualmente a la consulta para evaluar el cumplimento y tolerancia del tratamiento y se les solicitó que mantuvieran sus hábitos habituales de dieta y estilo de vida.
Las muestras de sangre venosa se tomaron entre 8 y 11 de la mañana, con las participantes en ayuno al inicio y luego de 12 semanas de tratamiento. Se realizó una prueba estándar de tolerancia oral a la glucosa de 75 gramos y la respuesta insulínica a la carga oral de glucosa después de 10-12 h de ayuno entre 8:30 y 10:30 de la mañana. El resultado de la tolerancia a la glucosa se evaluó utilizando los criterios de la Asociación Americana de Diabetes11. Todas las muestras fueron almacenadas a -70oC hasta el momento de la determinación.
Las concentraciones de resistina plasmática fueron medidas utilizando una prueba de ELISA disponible comercialmente (B-Bridge International, EE.UU.). Los coeficientes de variación intra- e inter- ensayo fueron de 6.8 y 7.3%, respectivamente. Todas las hormonas fueron medidas por métodos basados en inmunoensayo de electroquimioluminiscencia utilizando el autoanalizados Elecsys 2010 (Boehringer Mannheim, Mannheim, Alemania) con reactivos dedicados específicos. Los coeficientes de variación intra- e inter-ensayo para cada hormona fueron los siguientes: hormona foliculoestimulante (1.7% y 4.7%), hormona luteinizante (1.1% y 3.1%), prolactina (2.9% y 4.1%), hormona tiroestimulante (4.2% y 5.2%), (2.1% y 4.5%), testosterona (2.4% y 3.8%) e insulina (3.0% y 4.7%) y androstenediona (4.1% y 5.2%) respectivamente. Las concentraciones de sulfato de dehidroepiandrosterona (coeficientes de variación intra- e inter-ensayo 7.5% y 5.5%, respectivamente) y androstenediona (coeficientes de variación intra- e inter-ensayo 6.8% y 7.2%, respectivamente) fueron medidas con pruebas de inmunoensayo enzimático (Diagnostic Systems Laboratories, EE.UU.). La 17-hidroxiprogesterona fue medida utilizando una prueba de anticuerpo doble (ICN Pharmaceuticals, EE.UU; coeficientes de
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
267
variación intra- e inter-ensayo 5.1% y 7.6%, respectivamente).
Los valores de glucosa se determinaron por método enzimático. Las mediciones se realizaron utilizando autoanalizador (Hitachi 912, Boehringer Mannheim, Alemania) con reactivos específicos. La resistencia a la insulina en estado de ayuno fue evaluada utilizando el modelo de homeostasis (HOMA-IR) y se calculó con la siguiente fórmula: insulina en ayunas (UI/mL) en ayunas de glucosa plasmática (mmol/L) dividida por 22.512. Las altas puntuaciones de HOMA-IR fueron interpretadas como insulinorresistencia. El área bajo la curva de insulina y glicemia se calculó de acuerdo a la fórmula que le corresponde a cada figura geométrica, que representa el incremento de las concentraciones plasmáticas postprandiales por encima de las concentraciones basales13.
Las concentraciones séricas de colesterol total (CT), lipoproteínas de alta densidad (HDL-C), lipoproteínas de baja densidad (LDL-C) y triglicéridos (Tg) fueron medidas utilizando el analizador automático Abbott Aeroset (Abbott Diagnostics, EE.UU.). Los valores de apolipoproteína A (Apo-A) y apolipoproteína B (Apo-B) fueron determinadas por ensayo nefelométrico utilizando un equipo Array 360 (Beckman Coulter, EE.UU.). El coeficiente de variación intra-ensayo e inter-ensayo para todas las pruebas fue menor del 10%.
Las variables se presentan como promedio +/- desviación estándar. Después de la confirmación de la distribución normal utilizando la prueba de Kolmogorov-Smirnov, se utilizó la prueba t para muestras relacionadas para comparar los valores antes y después del tratamiento en ambos grupos de mujeres. El porcentaje de cambios en las variables después de la intervención se determinó mediante la fórmula: [(valores finales – valores iniciales) / valores iniciales] × 100. Todos los análisis se realizaron utilizando el paquete estadístico para las ciencias sociales SPSS, versión 19.0 (SPSS Inc., EE.UU.). La significancia estadística se estableció en p < 0.05.
RESULTADOS
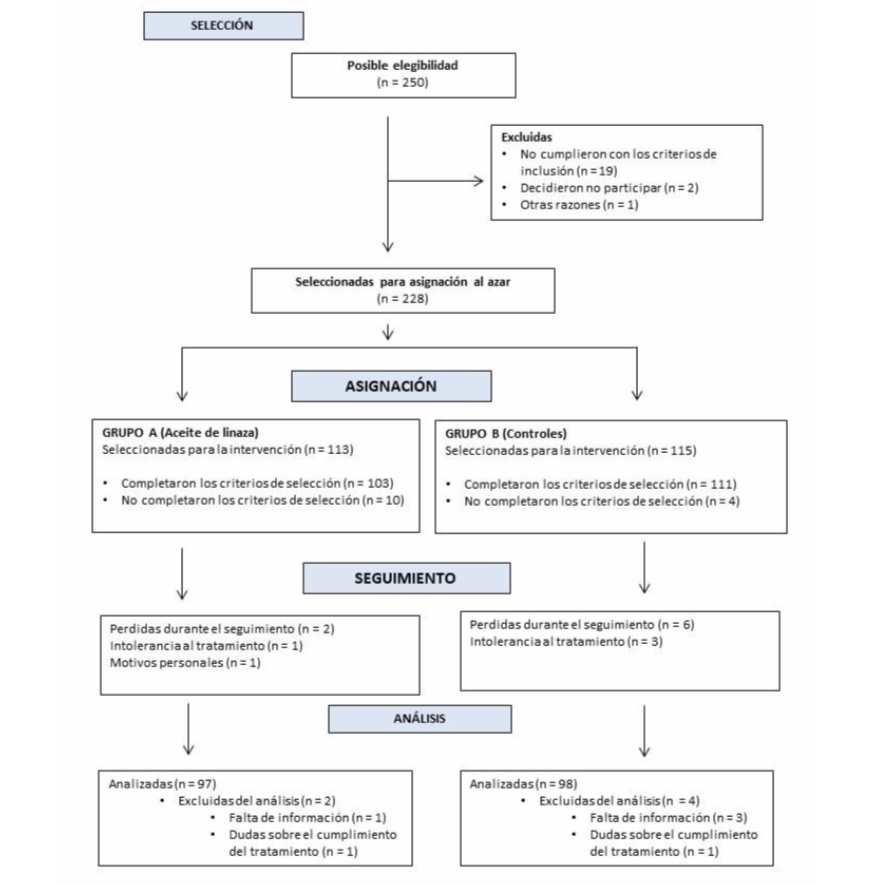
Se seleccionaron 250 mujeres con diagnóstico de SOPQ. Se excluyeron 55 participantes del análisis final(28enelgrupoAy27enelgrupoB)debidoa que no completaron la etapa de seguimiento en la investigación, dejaron de tomar las capsulas y/o no se logró realizar tomas las determinaciones de las variables en estudio (figura 1). Por lo que las mujeres
incluidas en el análisis final fueron 195 que fueron tratadas con aceite de linaza por 12 semanas (n = 97; grupo A) y controles (n = 98, grupo B). La edad promedio de 23,5 +/- 3,6 años, índice de masa corporal de 26,2 +/- 2,9 Kg/m2 y relación cintura/cadera de 0,80 +/- 0,06.
Las características generales de cada grupo de estudio se presentan en la tabla 2. No se encontraron diferencias estadísticamente significativas entre ambos grupos de mujeres con relación a la edad de la paciente, índice de masa corporal y relación cintura/cadera (p = ns). Tampoco se encontraron diferencias significativas en las concentraciones de hormonas sexuales, hormonas tiroideas y prolactina entre las participantes del grupo A y B (p = ns). De igual forma, no se observaron diferencias significativas en las concentraciones de insulina en ayunas, HOMA-IR, área bajo la curva de insulina y glucosa entre ambos grupos de estudio (p = ns).
En la tabla 3 se muestran los valores de la ingesta dietética en ambos grupos al inicio y al final del estudio. Las mujeres del grupo A y B no mostraron diferencias estadísticamente significativas en la ingesta total, ingesta total de carbohidratos, proteínas y grasas totales entre los valores al inicio y al final del estudio (p = ns). Tampoco se observaron diferencias estadísticamente significativas en ninguna de las variables estudiadas entre los dos grupos de ingesta dietética al final del estudio (p = ns).
Con relación a las variables de insulinorresistencia, perfil lipídico y resistina (tabla 4), se observó que las mujeres tratadas con aceite de linaza por 12 semanas presentaron disminución en los valores de insulina en ayunas (aproximadamente 12%), HOMA-IR (superior al 8%), área bajo la curva de insulina (aproximadamente 10%) y área bajo la curva de glucosa (superior al 10%). Todas estas diferencias fueron consideradas estadísticamente significativas (p < 0,05). Las mujeres del grupo A también presentaron disminución aproximadamente de 15% en las concentraciones de CT (p < 0,0001). Esto fue acompañado de una reducción del 23% en las concentraciones de LDL-C (p < 0,0001) y de 25% de las concentraciones de TG (p < 0,0001). También se observó aumento significativo de 4% en las concentraciones de HDL-C (p < 0,0097) y de 7% en las concentraciones de Apo-B (p < 0,0001). Las concentraciones de Apo-A no mostraron modificaciones significativas en sus valores (p = 0,2353). Los valores promedio de resistina mostraron disminución (aproximadamente 22%) comparado con
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
268
los valores iniciales (valor final 4,6 +/- 0,5 ng/mL comparado con valor inicial 5,9 +/- 0,4 ng/mL; p < 0,0001). No se encontraron diferencias estadísticamente significativas en los valores promedio de las diferentes variables en las mujeres del grupo control (p = ns).
En las pacientes del grupo A no se observó correlación entre los valores iniciales de resistina y los valores de insulina en ayunas, HOMA-IR, área bajo la curva de insulina y glucosa (p = ns). No obstante al analizar la correlación entre los valores de resistina finales, se observaron correlación moderada, negativa y significativa con los valores de área bajo la curva de glucosa (r = -0,360; p < 0,05) y correlaciones débiles, negativas y significativas con el área bajo la curva de insulina (r = -0,266; p < 0,05) y valores de insulina en ayunas (r = -0,180; p < 0,05).
DISCUSIÓN
La inflamación contribuye a las complicaciones metabólicas de las mujeres en edad reproductiva. El estado inflamatorio crónico de bajo grado en las mujeres con el síndrome puede deberse a diferentes factores, como la resistencia a la insulina, el estado de los andrógenos y el índice de masa corporal14. La suplementación de ácidos grasos Omega-3 han demostrado que puede revertir las diferentes alteraciones metabólicas observadas en el SOPQ. Estos incluyen disminución de la adiposidad abdominal, inflamación crónica de bajo grado y dislipidemia postpandrial15. Los resultados de la investigación demuestran que las mujeres con diagnóstico de SOPQ que fueron tratadas con aceite de linaza, una fuente importante de ácidos grasos omega-3, presentan disminución significativa de las concentraciones plasmáticas de resistina luego de 12 semanas de consumo, lo cual puede ser considerado benéfico en este grupo de mujeres.
Las adipocitokinas y citokinas pro- inflamatorias actúan de manera autócrina, parácrina y endocrina16. Sus concentraciones podrían proporcionar información importante para la comprensión de diferentes condiciones patológicas. Las complicaciones médicas asociadas al SOPQ son muy similares y, a menudo, confusas. La resistina es una citokina derivada de adipocitos y monocitos que modula las acciones de la insulina, energía, glucosa y homeostasis de los lípidos17,18. Se postuló inicialmente como un factor de riesgo para la insulinorresistencia, pero datos posteriores han revelado evidencias contradictorias en humanos y
roedores19. Se ha demostrado un incremento de hasta el 40% en las concentraciones séricas promedio de resistina y su correlación positiva con el índice de masa corporal y concentraciones de testosterona en mujeres con SOPQ20.
Existen informes sobre la acción sinérgica resistina – insulina que resulta en aumento de la producción ovárica de andrógenos a través del aumento de la expresión y actividad del ARN mensajero de la 17-alfa-hidroxilasa en las células de la teca ovárica. Aunque se ha reportado que las concentraciones de ARN mensajero son el doble de altas en los adipocitos de mujeres con SOPQ comparado con las mujeres controles, la resistina producida por los adipocitos no parece tener un papel clave en el cuerpo, ya que estos no son la mayor fuente de resistina circulante21. En un estudio de los promotores de resistina, no se encontró evidencia de asociación de las variaciones de gen promotor de la resistina y los fenotipos del SOPQ22. Por el contrario, la asociación del polimorfismo del gen de la resistina con el índice de masa corporal en las mujeres con SOPQ podría estar relacionada con la obesidad en esta condición23.
Las mujeres con SOPQ son susceptibles a trastornos metabólicos, como hiperinsulinemia, inflamación y estrés oxidativo. Existen algunos intentos de evaluar los efectos de la administración de ácidos grasos omega-3 provenientes del aceite de linaza sobre diferentes parámetros metabólicos, pero los resultados han sido controversiales 7,8. La disminución de las concentraciones de resistina inducida por el aceite de linaza observadas en este estudio pueden ejercer acciones potencialmente benéficas, a través de sus efectos hipolipemiantes, inflamación asociada o no a la obesidad, efectos sobre los receptores de glucosa, regulación de la actividad del factor nuclear NF-ΚB y disminución del estrés oxidativo observadas en las mujeres con diagnóstico de SOPQ. Los resultados de esta investigación son similares a observaciones previas en varios estudios de suplementación de Omega-3 de diferentes orígenes tanto en diabéticos como en sujetos sanos en los cuales se han demostrado cambios significativos en las concentraciones de adipocitokinas durante diferentes periodos de uso de los suplementos24,25.
En la literatura la variabilidad de los efectos de los ácidos grasos Omega-3 sobre la homeostasis de la glucosa ha sido atribuida a las diferencias en la dosis de suplementación, grupos de sujetos seleccionados y enfermedades subyacentes. Sin embargo, los efectos sobre el perfil lipídico son
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
269
bastante consistentes a pesar de que las condiciones de los diferentes estudios son variables25. Las modificaciones observadas en el metabolismo de los lípidos pueden ser directamente y especificas del tipo; mientras que sus efectos sobre la homeostasis de la glucosa pueden ser mucho más complejos.
En esta investigación se observó una disminución de las concentraciones de insulina en las mujeres tratadas con aceite de linaza, lo cual es similar a los efectos previamente reportado sobre la insulinorresistencia en diferentes sub-poblaciones26. No obstante, se ha demostrado que la resistina afecta el metabolismo de la glucosa y los lípidos, produciendo insulinorresistencia27. Los efectos del aceite de linaza y los ácidos grasos Omega-3 sobre los parámetros de insulinorresistencia no son claros. Informes en diferentes grupos de sujetos no demostraron un efecto positivo significativo de la suplementación de Omega-3 en el control de la glicemia28. Sin embargo, otro estudio demostró que la suplementación de altas dosis por más de 18 meses fue efectiva en la reducción de la glicemia29. La suplementación de ácidos grasos omega-3 del aceite de pescado a dosis de 4 g/día durante 8 semanas tenía efectos positivos sobre las concentraciones séricas de glucosa e insulina en ayunas y el HOMA- IR en mujeres con SOPQ30. Los resultados de este estudio demostraron que el aceite de linaza 3 produce modificaciones sobre los valores de insulina, HOMA- IR y área bajo la curva de glicemia e insulina en mujeres con SOPQ después de 12 semanas de uso, lo cual suministra nueva evidencia para el uso de este tipo de tratamiento en este grupo de mujeres. Se ha propuesto que la mejoría en la sensibilidad a la insulina por los ácidos grasos omega-3 puede estar mediada por la reducción de la activación del factor de transcripción nuclear kappa B y supresión de mediadores proinflamatorios, que a su vez disminuye la insulinorresistencia31.
En esta investigación, el uso de aceite de linaza llevó a disminuciones significativas en las concentraciones de CT, Tg, LDL-C y Apo-B, acompañado de aumento en las concentraciones de LDL-C. Esto es similar a lo reportado previamente, en las que se observaron disminuciones significativas en las concentraciones de Tg en las mujeres con SOPQ que recibieron suplementación con aceite de pescado, pero esos estudios no demostraron cambios significativos en las concentraciones séricas de CT, LDL-C y HDL-C32. En forma adicional, la disminución de las concentraciones de Tg ha sido reportada por otras investigaciones33. Un estudio previo demostró
que la suplementación de ácidos grasos omega-3 produjo disminución significativa de las concentraciones de Tg, junto al aumento de los valores de HDL-C34. El efecto de los ácidos grasos de Omega-3 de diferente origen sobre las concentraciones de Tg es dosis dependiente33. Es posible que la dosis y duración del tratamiento con aceite de linaza en esta investigación fueran suficientes para producir las mejoras significativas observadas después de la intervención en este grupo de mujeres.
Aunque los efectos benéficos de los ácidos grasos Omega-3 sobre los marcadores de inflamación crónica y concentraciones de adipocinas son aún desconocidos. Los hallazgos de esta investigación demuestran que la suplementación de aceite de linaza, una fuente rica en estos ácidos grasos, conlleva a disminución de las concentraciones de resistina y modificaciones del perfil lipídico, que junto a los cambios de las concentraciones de otras citokinas proinflamatorias puede ayudar al control de los cambios metabólicos y hormonales observados en el SOPQ. Son necesarias más investigaciones para comprender los mecanismos asociados entre el consumo de aceites ricos en Omega-3 y la secreción / expresión de resistina.
Este estudio presenta varias limitaciones. La presente investigación se realizó en mujeres con diagnóstico de SOPQ sin obesidad. Esto puede llevar a sub o sobre-estimación de los cambios en las concentraciones plasmáticas de resistina y debido a que los efectos del aceite de linaza son dependientes de la dosis pueden no ser aplicables a otros tipos de suplementos o diferentes periodos de suplementación. Tampoco se evaluaron las concentraciones de los marcadores de inflamación como interleucina-6 y factor de necrosis tumoral alfa, ni la expresión génica relacionada con la resistina. Este estudio tiene una muestra relativamente pequeña, lo cual es resultado de los criterios de exclusión. Finalmente, aunque se evaluó la ingesta calórica en las mujeres, no se evaluó los cambios de la actividad física en las participantes durante la duración del estudio. Se necesitan estudios posteriores con mayor duración del tratamiento para confirmar la validez de los hallazgos.
CONCLUSIONES Y RECOMENDACIONES
Sobre la base de los hallazgos de la investigación, se puede concluir que el aceite de linaza produjo disminución significativa en las concentraciones
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276 270
plasmáticas de resistina en mujeres con síndrome de ovarios poliquísticos luego de 12 semanas de consumo.
REFERENCIAS.
11. Seaquist ER, Anderson J, Childs B, Cryer P, Dagogo-Jack S, Fish L. Hypoglycemia and diabetes: a report of a workgroup of the American Diabetes Association and the Endocrine Society. J Clin Endocrinol Metab. 2013; 98(5): 1845-59.
12. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985; 28(7): 412-9.
13. Aziz A. The glycemic index: methodological aspects related to the interpretation of health effects and to regulatory labeling. J AOAC Int. 2009; 92(3): 879-87.
14. Ganie MA, Hassan S, Nisar S, Shamas N, Rashid A, Ahmed I, et al. High-sensitivity C-reactive protein (hs-CRP) levels and its relationship with components of polycystic ovary syndrome in Indian adolescent women with polycystic ovary syndrome (PCOS). Gynecol Endocrinol. 2014; 30(11): 781-4.
15. Lim SS, Norman RJ, Davies MJ, Moran LJ. The effect of obesity on polycystic ovary syndrome: a systematic review and meta-analysis. Obes Rev. 2013; 14(2): 95-109.
16. Cinar N, Gurlek A. Association between novel adipocytokines adiponectin, vaspin, visfatin, and thyroid: An experimental and clinical update. Endocr Connect. 2013; 2(4): R30-8.
17. Abate N, Sallam HS, Rizzo M, Nikolic D, Obradovic M, Bjelogrlic P, et al. Resistin: an inflammatory cytokine. Role in cardiovascular diseases, diabetes and the metabolic syndrome. Curr Pharm Des. 2014; 20(31): 4961-9.
18. Patel L, Buckels AC, Kinghorn IJ, Murdock PR, Holbrook JD, Plumpton C, et al. Resistin is expressed in human macrophages and directly regulated by PPAR gamma activators. Biochem Biophys Res Commun. 2003; 300(2): 472-6.
19. Sahebkar A, Giorgini P, Ludovici V, Pedone C, Ferretti G, Bacchetti T, et al. Impact of statin therapy on plasma resistin and visfatin concentrations: A systematic review and meta- analysis of controlled clinical trials. Pharmacol Res. 2016; 111: 827-837.
20. Munir I, Yen HW, Baruth T, Tarkowski R, Azziz R, Magoffin DA, et al. Resistin stimulation of 17alpha- hydroxylase activity in ovarian theca cells in vitro: relevance to polycystic ovary syndrome. J Clin Endocrinol Metab. 2005; 90(8): 4852-7.
1.
2.
3.
4.
5. 6.
7.
8.
9.
Behboudi-Gandevani S, Ramezani Tehrani F, Rostami Dovom M, Farahmand M, Bahri Khomami M, Noroozzadeh M, et al. Insulin resistance in obesity and polycystic ovary syndrome: systematic review and meta-analysis of observational studies. Gynecol Endocrinol. 2016; 32(5): 343-53.
Çakıroğlu Y, Vural F, Vural B. The inflammatory markers in polycystic ovary syndrome: association with obesity and IVF outcomes. J Endocrinol Invest. 2016; 39(8): 899-907.
Durmus U, Duran C, Ecirli S. Visceral adiposity index levels in overweight and/or obese, and non- obese patients with polycystic ovary syndrome and its relationship with metabolic and inflammatory parameters. J Endocrinol Invest. 2017; 40(5): 487- 497.
Saeedi Borujeni MJ, Esfandiary E, Taheripak G, Codoñer-Franch P, Alonso-Iglesias E, Mirzaei H. Molecular aspects of diabetes mellitus: Resistin, microRNA, and exosome. J Cell Biochem. 2018; 119(2): 1257-1272.
Wiesner DL, Klein BS. The balance between immunity and inflammation. Science. 2017; 357(6355): 973-974.
Lau CH, Muniandy S. Adiponectin and resistin gene polymorphisms in association with their respective adipokine levels. Ann Hum Genet. 2011; 75(3): 370-82.
Parikh M, Netticadan T, Pierce GN. Flaxseed: its bioactive components and their cardiovascular benefits. Am J Physiol Heart Circ Physiol. 2018; 314(2): H146-H159.
Nasri K, Hantoushzadeh S, Aghadavod E, Taghizadeh M, Asemi Z. The Effects of Omega-3 Fatty Acids Supplementation on Gene Expression Involved in the Insulin and Lipid Signaling Pathway in Patients with Polycystic Ovary Syndrome. Horm Metab Res. 2017; 49(6): 446-451.
Dewailly D. Diagnostic criteria for PCOS: Is there a need for a rethink? Best Pract Res Clin Obstet Gynaecol. 2016; 37: 5-11.
10. Mostowik M, Gajos G, Zalewski J, Nessler J, Undas A. Omega-3 polyunsaturated fatty acids increase plasma adiponectin to leptin ratio in stable coronary artery disease. Cardiovasc Drugs Ther. 2013; 27(4): 289-95.
REV CHIL OBSTET GINECOL 2019; 84(4): 263 – 276
271
21. Seow KM, Juan CC, Hsu YP, Ho LT, Wang YY, Hwang JL. Serum and follicular resistin levels in women with polycystic ovarian syndrome during IVF-stimulated cycles. Hum Reprod. 2005; 20(1): 117-21.
22. Urbanek M, Du Y, Silander K, Collins FS, Steppan CM, Strauss JF, et al. Variation in resistin gene promoter not associated with polycystic ovary syndrome. Diabetes. 2003; 52(1): 214-7.
23. Xita N, Georgiou I, Tsatsoulis A, Kourtis A, Kukuvitis A, Panidis D. A polymorphism in the resistin gene promoter is associated with body mass index in women with polycystic ovary syndrome. Fertil Steril. 2004; 82(5): 1466-7.
24. Al-Hamodi Z, Al-Habori M, Al-Meeri A, Saif-Ali R. Association of adipokines, leptin/adiponectin ratio and C-reactive protein with obesity and type 2 diabetes mellitus. Diabetol Metab Syndr. 2014; 6(1): 99
25. Zhu W, Dong C, Du H, Zhang H, Chen J, Hu X, et al. Effects of fish oil on serum lipid profile in dialysis patients: a systematic review and meta-analysis of randomized controlled trials. Lipids Health Dis. 2014; 13: 127.
26. Ramel A, Martinéz A, Kiely M, Morais G, Bandarra NM, Thorsdottir I. Beneficial effects of long-chain n-3 fatty acids included in an energy-restricted diet on insulin resistance in overweight and obese European young adults. Diabetologia. 2008; 51(7): 1261-8.
27. Shibata R, Ouchi N, Ohashi K, Murohara T. The role of adipokines in cardiovascular disease. J Cardiol. 2017; 70(4): 329-334
28. Mansoori A, Sotoudeh G, Djalali M, Eshraghian MR, Keramatipour M, Nasli-Esfahani E, et al. Effect of DHA-rich fish oil on PPARγ target genes related to lipid metabolism in type 2 diabetes: A
randomized, double-blind, placebo-controlled
clinical trial. J Clin Lipidol. 2015; 9(6): 770-777. 29. Derosa G, Cicero AF, D’Angelo A, Borghi C, Maffioli P. Effects of n-3 pufas on fasting plasma glucose and insulin resistance in patients with impaired fasting glucose or impaired glucose
tolerance. Biofactors. 2016; 42(3): 316-22.
30. Mohammadi E, Rafraf M, Farzadi L, Asghari- Jafarabadi M, Sabour S. Effects of omega-3 fatty acids supplementation on serum adiponectin levels and some metabolic risk factors in women with polycystic ovary syndrome. Asia Pac J Clin
Nutr. 2012; 21(4): 511-8.
31. Romanatto T, Fiamoncini J, Wang B, Curi R, Kang
JX. Elevated tissue omega-3 fatty acid status prevents age-related glucose intolerance in fat-1 transgenic mice. Biochim Biophys Acta. 2014; 1842(2): 186-91.
32. Vargas ML, Almario RU, Buchan W, Kim K, Karakas SE. Metabolic and endocrine effects of long-chain versus essential omega-3 polyunsaturated fatty acids in polycystic ovary syndrome. Metabolism. 2011; 60(12): 1711-8.
33. Siscovick DS, Barringer TA, Fretts AM, Wu JH, Lichtenstein AH, Costello RB, et al. Omega-3 Polyunsaturated Fatty Acid (Fish Oil) Supplementation and the Prevention of Clinical Cardiovascular Disease: A Science Advisory From the American Heart Association. Circulation. 2017; 135(15): e867-e884
34. Grundt H, Nilsen DW, Hetland Ø, Mansoor MA. Clinical outcome and atherothrombogenic risk profile after prolonged wash-out following long- term treatment with high doses of n-3 PUFAs in patients with an acute myocardial infarction. Clin Nutr. 2004; 23(4): 491-500.
TABLA 1.
Composición de ácidos grasos de las capsulas de linaza y de placebo.
272
C16:0
C16:1
C17:0
C17:1
C18:0
C18:1n9
C18:2n6
C18:3n3
C20:0
C20:1n9
C20:5n3
C21:5n3
C22:5n3
C22: 6n3
Ácidos grasos saturados Ácidos grasos monoinsaturados
Ácidos grasos poliinsaturados Omega-3
Capsulas de linaza
(g / 100 g como ácidos grasos) 0,96
0,35
0,14
—
4,66
8,88
2,00
0,77
0,50
—
35,36
1,70
4,95
24,31
7,02
15,21
77,77 67,08
Capsulas de placebo
(g / g como ácidos grasos) 13,86
1,44
0,07
0,11
2,73
66,64
11,42
0,69
0,43
0.26
—
—
—
—
17,26
70,63
12,11 0,69
TABLA 2.
CARACTERÍSTICAS GENERALES DE CADA GRUPO.
273
|
X +/- DE |
GRUPO A Aceite de linaza (n = 97) |
GRUPO B Controles n = 98 |
p |
|
Edad, años |
23,6 +/- 3,4 |
23,3 +/- 3,9 |
0,5678 |
|
Índice de masa corporal, kg/m2 |
26,4 +/- 3,0 |
26,0 +/- 2,7 |
0,3289 |
|
Índice cintura/cadera |
0,80 +/- 0,06 |
0,81 +/- 0,05 |
0,2075 |
|
Hormona foliculoestimulante mUI/L |
5,4 +/- 1,3 |
5,6 +/- 1,2 |
0,2656 |
|
Hormona luteinizante, mUI/L |
10,7 +/- 4,2 |
10,0 +/- 4,0 |
0,2348 |
|
Relación LH/FSH |
2,1 +/- 0,9 |
1,9 +/- 0,9 |
0,2540 |
|
Estradiol, pg/mL |
56,9 +/- 30,1 |
54,5 +/- 28,9 |
0,5707 |
|
Progesterona, ng/mL |
0,83 +/- 0,21 |
0,78 +/- 0,22 |
0,1062 |
|
Testosterona total, |
0,89 +/- 0,11 |
0,91 +/- 0,12 |
0,2267 |
|
Testosterona libre, pg/mL |
3,3 +/- 0,9 |
3,3 +/- 0,9 |
0,2775 |
|
Androstenediona, ng/mL |
3,1 +/- 0,8 |
3,3 +/- 0,8 |
0,0825 |
|
Sulfato de dehidroepiandrosterona, picog/dL |
314,9 +/- 74,5 |
313,2 +/- 65,1 |
0,8654 |
|
Prolactina, ng/mL |
15,6 +/- 4,6 |
16,7 +/- 5,0 |
0,1116 |
|
Hormona tiroestimulante, mUI/L |
2,9 +/- 0,4 |
2,8 +/- 0,5 |
0,1249 |
|
Insulina en ayunas, picoUI/mL |
18,7 +/- 4,2 |
19,4 +/- 3,9 |
0,2292 |
|
HOMA-IR |
3,5 +/- 0,9 |
3,6 +/- 0,9 |
0,4388 |
|
Área bajo la curva de insulina, picoUI/mL/min |
9894 +/- 575 |
9975 +/- 577 |
0,3247 |
|
Área bajo la curva de glucosa, mg/dL/min |
16489 +/- 1189 |
16438 +/- 1290 |
0,1081 |
TABLA 3.
INGESTA DIETÉTICA DE CADA GRUPO AL INCIO Y AL FINAL DEL ESTUDIO.
274
|
X +/- DE |
GRUPO A Aceite de linaza (n = 97) |
p’ |
GRUPO B Controles n = 98 |
p’ |
||
|
Inicial |
Final |
Inicial |
Final |
|||
|
Ingesta total, kcal, día |
1979 +/- 207 |
2010 +/- 216 |
0,3088 |
1951 +/- 231 |
2045 +/- 236 |
0,0745 |
|
Carbohidratos, g/día |
223 +/- 35 |
222 +/- 39 |
0,8511 |
217 +/- 34 |
228 +/- 38 |
0,0822 |
|
Proteínas, g/día |
63 +/- 13 |
60 +/-12 |
0,0965 |
63 +/- 13 |
61 +/- 12 |
0,2645 |
|
Grasas totales, g/día |
64 +/- 12 |
63 +/- 11 |
0,5459 |
63 +/- 12 |
62 +/- 11 |
0,5438 |
‘ Comparación de valores iniciales y finales.
TABLA 4.
PARÁMETROS CLÍNICOS Y DE LABORATORIO EN CADA GRUPO DE PACIENTE AL INICIO Y AL FINAL DEL ESTUDIO.
275
|
X +/- DE |
GRUPO A Aceite de linaza (n = 97) |
p’ |
GRUPO B Controles n = 98 |
p’ |
||
|
Inicial |
Final |
Inicial |
Final |
|||
|
Índice de masa corporal, kg/m2 |
26,4 +/- 3,0 |
25,7 +/-3,1 |
0,1117 |
26,0 +/- 2,7 |
26,2 +/- 2,8 |
0,6113 |
|
Índice cintura/cadera |
0,80 +/- 0,06 |
0,81 +/- 0,07 |
0,2867 |
0,81 +/- 0,05 |
0,80 +/- 0,06 |
0,2065 |
Insulina en picoUI/mL
HOMA-IR
Área bajo la insulina, picoUI/mL/min
Área bajo la glucosa, mg/dL/min
ayunas,
curva de
curva de
18,7 +/- 4,2
3,6 +/- 0,8
9894 +/- 575
16489 +/- 1189
16,5 +/- 3,4
3,3 +/- 0,9
8822 +/- 531
14882 +/- 1049
0,0001
0,0213 0,0001
0,0001
19,4 +/- 4,2
3,6 +/- 0,9
9975 +/- 577
16489 +/- 1189
19,6 +/- 4,3
3,7 +/- 0,7
9838 +/- 554
16438 +/- 1166
0,7435
0,3888 0,0933
0,7633
|
CT, mg/dL |
180,1 +/- 22,1 |
154,6 +/- 17,6 |
0,0001 |
180,5 +/- 21,0 |
176,1 +/- 20,8 |
0,1334 |
|
LDL-C, mg/dL |
109,3 +/- |
84,7 +/- |
0,0001 |
111,7 +/- |
110,4 +/- |
0,5225 |
|
HDL-C, mg/dL |
12,1 50,4 +/- 5,5 |
11,2 52,7 +/- 6,7 |
0,0097 |
12,9 48,5 +/- 6,0 |
15,4 47,8 +/- 5,6 |
0,3995 |
|
TG, mg/dL |
106,7 +/- 24,7 |
86,3 +/- 18,9 |
0,0001 |
104,1 +/- 22,4 |
102,6 +/- 22,9 |
0,6435 |
|
Apo-A, mg/dL |
121,1 +/- 19,2 |
118,0 +/- 17,0 |
0,2353 |
121,9 +/- 17,4 |
119,1 +/- 15,6 |
0,2370 |
|
Apo-B, mg/dL |
87,7 +/- 13,1 |
94,5 +/- 12,6 |
0,0003 |
88,6 +/- 12,8 |
86,2 +/- 12,9 |
0,1926 |
|
Resistina, ng/mL |
5,9 +/- 0,4 |
4,6 +/- 0,5 |
0,0001 |
6,0 +/- 0,4 |
5,7 +/- 0,3 |
0,2448 |
‘ Comparación de valores iniciales y finales.
CT: Colesterol total; LDL-C: Lipoproteínas de baja densidad; HDL-C: Lipoproteínas de alta densidad; TG: Triglicéridos; Apo-A; Apolipoproteína; Apo-B: Apolipoproteína B.