2011
3
Autores:
Instituciones:
María De la Calle Fernández Miranda, María Calomarde R., Carlos Iglesias S., Alberto Fernández G., Roberto Rodríguez G1, Fernando Magdaleno D.1, Félix Omeñaca T., Antonio González G.
Tipo de documento:
Casos ClínicosEMBARAZO CON ACROMEGALIA MATERNA ASOCIADA A CRECIMIENTO INTRAUTERINO FETAL RETARDADO
Contenido del documento:
RESUMEN
La acromegalia es el exceso de secreción de hormona de crecimiento (HC). Esta alteración está relacionada con esterilidad y con complicaciones maternas durante el embarazo por aumento de la secreción de la HC. Presentamos el caso de una gestante diagnosticada de acromegalia persistente a pesar de haber sido operada vía transesfenoidal y tratada con cabergolina. Durante la gestación, la paciente no presentó complicaciones metabólicas ni tensionales, observándose un progresivo descenso de los niveles del factor de crecimiento insulínico-1 (IGF-I). El feto tuvo un crecimiento acorde con la amenorrea hasta la semana 31 en la que hizo una restricción del crecimiento con oligoamnios y alteración en el doppler en la semana 37. Se finalizó la gestación realizando una cesárea naciendo un recién nacido de 2400 gramos sin complicaciones neonatales. Aunque el curso del embarazo de las gestantes con acromegalia transcurre generalmente sin complicaciones, presentamos el primer caso descrito de un crecimiento intrauterino retardado en una paciente con acromegalia.
PALABRAS CLAVE: Acromegalia, embarazo, crecimiento intrauterino retardado
SUMMARY
Pregnancy in acromegalic patients is an infrequent event, due to perturbed gonadotroph function. On the other hand, pregnancy may cause an enlargement of the adenoma or an increase of growth hormone (GH) secretion. We report the case of a pregnant acromegalic woman who had been previously operated by transphenoidal approach and treated with cabergolin. A progressive decrease of insuline-like growth factor-1 (IGF1) level during pregnancy without tumoral syndrome or visual troubles was shown during pregnancy. Neither metabolic complication nor hypertension were detected. Ultrasound performed at 31th week showed a decrease of the fetal growth. At 37th week, an intrauterine growth restriction and oligohydramnios was diagnosed. It was performed a cesarean section and it was delivered a healthy 2700 grams male newborn. Our report suggests that pregnancy could not influence negatively in acromegalic patient but may be associated with intrauterine growth restriction.
KEY WORDS: Acromegaly, pregnancy, intrauterine growth restriction
INTRODUCCIÓN
La acromegalia se produce por la liberación excesiva de hormona de crecimiento (HC) después de haberse completado el crecimiento normal del esqueleto y otros órganos del cuerpo (1). La causa del aumento de la liberación de esta hormona es generalmente un tumor benigno de la hipófisis, denominado adenoma. Esta glándula, que se localiza justo debajo del cerebro, controla la producción y liberación de varias hormonas diferentes, incluyendo la HC y produciendo la denominada acromegalia (2,3). Esta patología se presenta en aproximadamente en 6 de cada 100.000 adultos de edad media, produciendo crecimiento anormal de los huesos de la cara, mandíbula, manos, pies y cráneo, así como de algunas vísceras (3). Cuando la producción excesiva de la HC aparece en niños o adolescentes, antes de finalizar el crecimiento, se produce el llamado gigantismo acromegálico.
La acromegalia se asocia muy raramente con el embarazo, ya que las mujeres portadoras de un adenoma productor de HC suelen tener amenorrea e infertilidad, debido al trastorno hipofisario que produce hiperprolactinemia y alteración de la función gonadotropa, o por el efecto masa que conlleva una destrucción de las células secretoras de gonadotropinas (4-8).
El embarazo de pacientes acromegálicas suele ser bien tolerado tanto por las madres como por los fetos. Sin embargo, en ocasiones pueden aparecer complicaciones maternas como la diabetes gestacional, debido a que la HC es un potente antagonista de la insulina, la hipertensión arterial o el infarto de miocardio (6-8). Por otro lado, también existe la posibilidad de que el tumor aumente de tamaño debido al efecto de los estrógenos, produciendo pérdida de visión (8,9).
Las complicaciones fetales son escasas pero hay casos descritos de crecimiento intrauterino retardado (CIR) (10). Presentamos el primer caso descrito en una revista de lengua española de una gestante con acromegalia sin complicaciones maternas, pero con complicaciones fetales.
Caso clínico
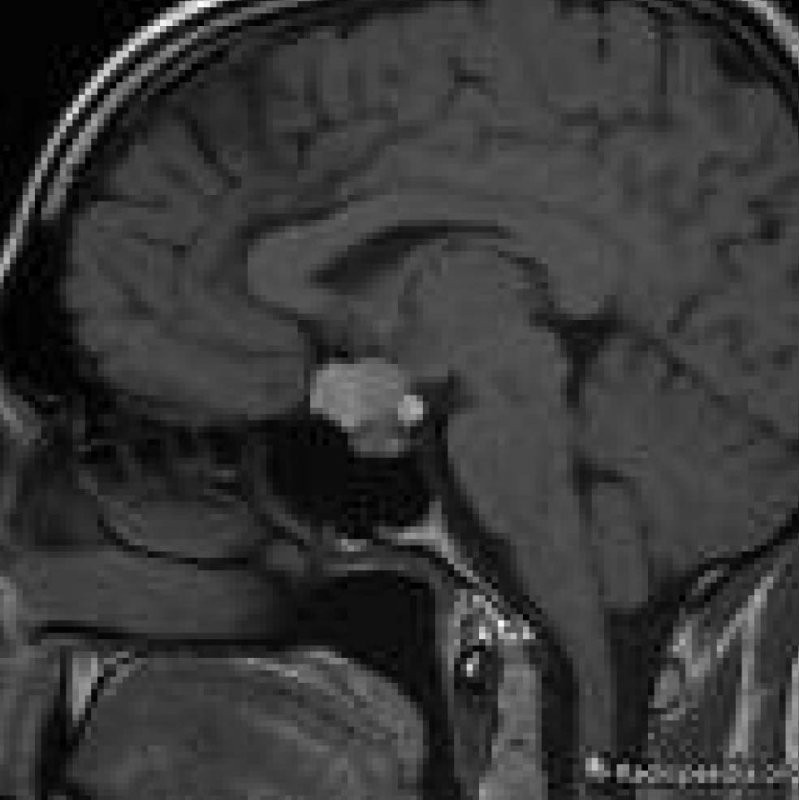
Paciente de 33 años de edad que acude al ginecólogo por amenorrea secundaria y galactorrea. Los niveles de prolactina son de 87,08 ng/ml. La resonancia magnética (RM) cerebral confirma la presencia de un macroadenoma de hipófisis (Figura 1). Se inicia tratamiento con cabergolina, un agonista de la dopamina, y posteriormente es operada mediante cirugía transesfenoidal. La anatomía patológica lo cataloga como “tumor mixto no funcionante/productor de hormona de crecimiento”.
Tras la cirugía la paciente reinicia el tratamiento con cabergolina. Los meses siguientes la paciente se mantiene con tensiones arteriales, peso, frecuencia cardiaca, glucemia, hormonas adrenales y tiroideas dentro de los niveles de la normalidad. Al mes de la cirugía comienza con menstruaciones regulares mensualmente.
La RM al año de la cirugía objetiva una lesión selar de 16x18x12 adyacente al cuerpo cavernoso con invasión del seno cavernoso derecho sin compresión de vías ópticas. Ante la persistencia de la acromegalia, la paciente continúa en tratamiento con cabergolina. Cuatro meses más tarde, se embaraza de forma espontánea y suprime el tratamiento con cabergolina en el primer trimestre de gestación.
La gestante es remitida a las consultas de alto riesgo de nuestro hospital para control del embarazo. La serología es negativa para toxoplasmosis, sífilis, hepatitis B, hepatitis C y virus de la inmunodeficiencia humana. Presenta inmunización para la rubéola. Su grupo sanguíneo es A Rh positivo.
Durante el curso del embarazo, se objetiva una normalización en los niveles de factor de crecimiento insulínico-1 (IGF-1) y de la hormona del crecimiento (HC). Las tensiones arteriales son normales y no existen datos de intolerancia hidrocarbonada o dislipemia, ni de hipopituitarismo. El ecocardiograma materna no presentó alteraciones.
En cuanto al control ecográfico, el feto presenta biometrías acordes con la amenorrea en las semanas 20 y 26. En la semana 31, se objetiva una biometría fetal de una semana menor con líquido amniótico normal y estudio doppler normal. En la semana 35, la ecografía evidencia una biometría acorde a dos semanas menor, oligoamnios y doppler normal. En la semana 37 la biometría fetal corresponde a cuatro semanas menor que la amenorrea, la placenta es un grado III y presenta oligoamnios con ausencia de diástole en arteria umbilical (Figura 2).
Se decide ingresar a la gestante para finalización de la gestación por retardo del crecimiento fetal. Tras inducción con prostaglandinas en fondo de saco vaginal y posteriormente con oxitocina intravenosa, se realiza una cesárea por fracaso de inducción. Nace un varón de 2400 gramos, Apgar 9/10 y pH arterial de cordón de 7,24 sin ninguna complicación posnatal.
La paciente comienza con lactancia materna tras la cesárea. Las tensiones arteriales en el puerperio son normales y no se detecta intolerancia hidrocarbonada o dislipemia. Tras la lactancia materna se realiza una RM craneal con diagnóstico de resto tumoral estable y se reinicia el tratamiento con cabergolina. El desarrollo del niño los dos primeros años de vida ha sido absolutamente normal.
DISCUSIÓN
Los tumores pituitarios son responsables en muchos casos de esterilidad femenina, debido a la hiperprolactinemia concomitante y al exceso de andrógenos provocado por la hipersecreción de HC (4-8). El potencial reproductivo podrá preservarse si la masa tumoral o el tratamiento ablativo del mismo no han destruido previamente la estirpe de gonadotropinas. Así, existen series descritas de pacientes que se embarazaron espontáneamente a pesar de la presencia de un tumor de hipófisis, como es el caso de nuestra paciente.
En la serie de 7 mujeres con acromegalia activa, presentada por Cozzi y cols (7), todas ellas se embarazaron espontáneamente; 5 tras cuatro meses sin medicación, mientras que en las dos restantes durante el tratamiento con análogos de la somatostatina (7). Caron y cols (8), observan que en 46 mujeres con hipersecreción de HC, cinco embarazos se consiguen tras tratamiento de fertilidad y 41 espontáneamente. De estas gestaciones, 25 lo hacen durante la ingesta de análogos de la dopamina, 14 en tratamiento con análogos de la somatostatina y 2 tras haber suspendido la medicación (8). En nuestro caso, la paciente se embarazó mientras estaba en tratamiento con cabergolina. Por tanto, el pronóstico de la fertilidad en estas mujeres es variable, aunque la gran mayoría pueden conseguir un embarazo de forma espontánea mientras estén en tratamiento médico que frene la secreción de hormona de crecimiento y la acromegalia esté controlada. Por el contrario, en aquellas mujeres con acromegalia activa o incontrolada, la fertilidad disminuirá y deberán optar por técnicas de reproducción asistida.
Los tratamientos más utilizados en las pacientes con acromegalia son los análogos de la dopamina y la somatostatina (1,7,8,10-14). Se ha publicado, que si el embarazo ha comenzado estando la paciente en tratamiento médico, éste puede mantenerse hasta el final de la gestación sin ningún problema (1,11-15). Sin embargo, la actitud más generalizada es la de suspender el tratamiento de supresores de HC tras la confirmación del embarazo (1,7,8), tal y como se hizo en nuestro caso. Además, mientras la bromocriptina se considera un fármaco seguro durante el embarazo debido a su amplio uso en pacientes afectadas con prolactinoma (11,12), los datos sobre la seguridad de la somatostatina siguen siendo escasos, a pesar de haberse convertido en los últimos años en el pilar del tratamiento de la acromegalia. Se sabe que la somatostatina atraviesa la barrera placentaria y que sus receptores se expresan durante la vida fetal, pudiendo interferir en la supresión de factores de crecimiento fetal, cruciales para el desarrollo del feto (10,16,17). Sin embargo, se ha comprobado que en el recién nacido, los receptores de los análogos de la somatostatina no son funcionantes (18) y el octeotride, un análogo de la somatostatina, no se une a los receptores placentarios (19). En los casos descritos en los que se empleó octeotride durante todo el embarazo o durante el segundo y tercer trimestre, el desarrollo de los fetos fue normal, no describiéndose malformaciones y tan sólo un caso de retraso de crecimiento que tuvo un desarrollo posnatal normal (10,14,15,20).
En nuestro caso, a pesar de la supresión del análogo de la somatostatina, el feto tuvo un retraso de crecimiento, por lo que cabe pensar que la causa no fuese yatrogénica, sino por una insuficiencia placentaria. Por tanto, aunque los resultados fetales descritos son favorables, no existe información suficiente para recomendar el uso rutinario del octeotride u otros análogos de la somatostatina o dopamina en todas las gestantes con acromegalia.
Ahora cabría preguntarse: ¿cómo afecta la acromegalia al embarazo? El curso de la gestación en las pacientes con acromegalia suele transcurrir con normalidad tanto para la madre como para el feto, llegando a término sin complicaciones (1,7,8,21). Sin embargo, Caron y cols (8), describen cuatro casos de diabetes gestacional y cinco de hipertensión asociada al embarazo. Debido a que la HC es un potente antagonista de la insulina, las gestantes con acromegalia son más propensas a desarrollar una diabetes gestacional. En nuestro caso, la gestante no se complicó con diabetes ni hipertensión. Sin embargo, a pesar de los buenos resultados fetales publicados en la literatura (1,7,8), el embarazo de nuestra paciente se complicó con un crecimiento intrauterino retardado con alteración hemodinámica y doppler patológico. Al no haber encontrado ningún caso similar descrito, podríamos pensar que este retraso del crecimiento es independiente de la acromegalia materna y responde a una insuficiencia placentaria intrínseca.
Pero nos surge otra pregunta: ¿cómo afecta el embarazo a la secreción de HC y al tamaño de tumor en gestantes con acromegalia? Durante el embarazo normal, la secreción de HC no sólo se realiza desde la hipófisis, sino también desde la placenta, difiriendo ambas hormonas en 13 aminoácidos y realizándose la secreción de HC placentaria de forma continua en lugar de pulsátil (7). A medida que avanza el embarazo, la HC placentaria va reemplazando a la HC hipofisaria, llegando ésta a ser prácticamente indetectable en la circulación al final de la gestación (7). Además, el incremento de la HC placentaria provoca un aumento de los niveles de IGF-I, observados en gestaciones normales (22). En gestantes con acromegalia, la hipersecreción pituitaria de HC se mantiene autónoma, produciendo niveles aumentados de ambos tipos de HC (hipofisaria y placentaria) durante todo el embarazo y niveles más aumentados de IGF-I que en gestantes normales (15). En nuestro caso, los niveles de IGF-I y de HC disminuyeron, sin distinguir el tipo de HC placentaria o hipofisaria, tal y como ocurrió en otros casos descritos (7,21). Esto puede explicarse con la hipótesis de que la secreción pituitaria de HC no es del todo autónoma y la secreción placentaria de HC puede ejercer un efecto feedback negativo sobre ella. En la mayoría de las series, los niveles de HC disminuyen y los de IGF-I permanecen normales todo el embarazo incluso sin tratamiento (7,8).
Respecto al tamaño tumoral, hay que recordar que la glándula pituitaria crece durante el embarazo normal debido a la hiperplasia de las células lactotrofas, llegando a aumentar su tamaño un 45% durante el primer trimestre (23). Teóricamente, el aumento de los niveles de estrógenos durante el embarazo, puede provocar un aumento del tumor hipofisario, habiéndose descrito hemorragias e infartos en adenomas secretores de HC (1). Sin embargo, los casos descritos de pérdida de visión o aumento considerable del tamaño tumoral, son aquellos que comenzaron la gestación con un macroadenoma o niveles muy altos de HC (7-9,15,21,24).
Por último, aunque la lactancia materna puede suponer una complicación teórica para las pacientes con acromegalia, no se recomienda suprimirla, a no ser que exista un macroadenoma (7,8). Nuestra paciente, aunque presentaba restos tumorales inició la lactancia materna tras la cesárea.
CONCLUSIÓN
El embarazo en pacientes con acromegalia transcurre sin complicaciones tanto para la madre como para el feto incluso en ausencia de tratamiento, salvo en lo casos de macroadenomas. La complicación fetal descrita en nuestro caso parece ser independiente de la acromegalia. Debe promoverse una estrecha colaboración entre endocrinólogos, obstetras y neonatólogos en el control de gestantes con acromegalia.
BIBLIOGRAFÍA
1. Herman-Bonert V, Seliverstov M, Melmed S. Pregnancy in acromegaly: successful therapeutic outcome. J Clin Endocrinol Metab 1998;83:727-31.
2. Frohman L. Pituitary tumors in pregnancy. Endocrinologist 2001;11:399-406.
3. Molitch ME. Pituitary tumors and pregnancy. Growth Horm IGF Res 2003;13:S38-44.
4. Kretz S, Ledoyen S, Kahal Z, Vesco L, Bernheim R, Keravel Y, Kujas M, Brugieres M, Perlemuter L. Pregnancy after in vitro fertilization in an acromegalic woman. Fertil Steril 1998;70(Suppl 1):214.
5. Esfandiari N, Gotlieb L, Casper RF. Live birth of healthy triplets after in vitro fertilization and embryo transfer in an acromegalic woman with elevated growth hormone. Fertil Steril 2005;83:1041.
6. Caron P, Bertherat J, Borson-Chazot F, Brue T, Cortet-Rudelli C, Chanson P. Outcome of 43 pregnancies in acromegalic women. Proceedings of 87th Annual Meeting of Endocrine Society, 2005; P3-552.
7. Cozzi R, Attanasio R, Barausse M. Pregnancy in acromegaly: a one-center experience. Eur J Endocrinol 2006;155:279-84.
8. Caron P, Broussaud S, Bertherat J, Borson-Chazot F, Brue T, Cortet-Rudelli C, Chanson P. Acromegaly and pregnancy: a retrospective multicenter study of 59 pregnancies in 46 women. J Clin Endocrinol Metab 2010;95:4680-7.
9. Guven S, Durukan T, Berker M, Basaran A, Saygan-Karamursel B, Palaoglu S. A case report of acromegaly in pregnancy: concomitant transsphenoidal adenomectomy and cesarean section. J Matern Fetal Neonatal Med 2006;19:69-71.
10. Fassnacht M, Capeller B, Arlt W, Steck T, Allolio B. Octeotride LAR treatment throughout pregnancy in an acromegalic woman. Clin Endocrinol 2001;55:411-5.
11. Luboshitzky R, Dickstein G, Barzilai D. Bromocriptine-induced pregnancy in an acromegalic patient. JAMA1980;244: 584-6.
12. Turkalj I, Barun P, Krupp P. Surveillance of bromocriptine in pregnancy. JAMA 1982;247:1589-91.
13. Miyakawa I, Taniyama K, Koike H, Mori N, Nagamine M, Kuribayashi T, Araki S. Successful pregnancy in an acromegalic patient during 2-Br-alpha-ergocryptine (CB-154) therapy. Acta Endocrinol 1982;101:333-8.
14. de Menis E, Billeci D, Marton E, Gussoni G. Uneventful pregnancy in an acromegalic patient treated with slow-release lanreotide: a case report. J Clin Endocrinol Metab 1998;83:727-31.
15. Neal JM. Successful pregnancy in a woman with acromegaly treated with octeotride. Endocr Pract 2000;6:148-50.
16. Caron P, Gerbeau C, Pradayrol L. Maternal-fetal transfer of octeotride. N Engl J Med 1995; 333:601-2.
17. Epelbaum J. Multiple somatostatin functions along brain development and aging. J Endocrino Invest 1997;20:11.
18. Caron P, Bennet A, Lorenzini F, Gerbeau C, Igout A, Fauvel J, et al. Normal pregnancy in a woman with nesidioblastosis treated with somatostatin analog octeotride. In Programm and Abstracts of the 81st Annual Meeting of the Endocrine Society 1999, San Diego.
19. Caron P, Buscail L, Beckers A, Esteve JP, Igput A, Hennen G et al. Expression of somatostatin receptor SST4 in human placenta and absence of octeotride effect on human placental growth hormone concentration during pregnancy. J Clin Endocrinol Metab 1997;82:3771-6.
20. Mikhail N. Octeotride treatment of acromegaly during pregnancy. Mayo Clin Proc 2002;77:297-8.
21. Lau. SL, Mc Grath S, Evain-Brion D, Smith R. Clinical And biochemical improvement in acromegaly during pregnancy . J Endocrinol Invest 2008;31:255-61.
22. Alsat E, Guibourdenche J, Luton D, Frankenne F, Evain-Brion D. Human placental growth hormone. Am J Obstet Gynecol 1997;177:1526-34.
23. González J, Elizondo G, Saldivar D, Nanez H, Todd L, Villareal J. Pituitary gland growth during normal pregnancy: an in vivo study using magnetic resonante Imaging. Am J Med 1988;85:217-20.
24. Shimatsu A, Usui T, Tagami T, Kuzuya H, Takahashi J. Suppressed levels of growth hormone and insulin-like growth factor-1 during successful pregnancy in persistent acromegaly. Endocrine J 2010;57:551-3.