2007
3
Autores:
Jairo García G.1, Ximena Ardía L.1, John Fidel Cano F.1, Verónica Isaza A.1, Ana Cristina Tovar A.1, Arístides Valencia R.1, Fernando Moreno M.1
Instituciones:
1Instituto de Ciencias de la Salud (CES). Medellín, Colombia.
Tipo de documento:
Trabajos OriginalesExpresión de azúcares endometriales y del oviducto durante el ciclo reproductivo de la coneja
Contenido del documento:
INTRODUCCIÓN
Para una adecuada implantación es necesario que haya receptividad del útero al blastocisto, y que el trofoblasto se interrelacione con el endo-metrio. Esta parte del proceso es crítica para que el embarazo pueda llevarse a término y es considerada como una secuencia de interacciones físicas y bioquímicas entre el útero y el embrión. Esta correspondencia entre trofoblasto y endometrio es iniciada gracias a la interdigitación de microvilli y a la aposición de membranas celulares entre el trofo-ectodermo del blastocisto y el epitelio uterino (1).
Se han postulado numerosas hipótesis acerca de los diversos factores que pueden servir como señales que inician o perpetúan el contacto e incorporación del embrión al útero, el cual debe poseer a su vez un ambiente apropiado para la supervivencia de este individuo. Estas señales consisten en el aumento de los niveles de estró-genos, los cuales influyen en la modulación de agentes pro-inflamatorios en el endometrio adyacente, tales como el aumento del factor del complemento C3 en la fase proliferativa (2); también, en la regulación positiva de las moléculas de adhesión celular (CAM) en el epitelio glandular por parte de la progesterona y en el epitelio luminal por parte de los estrógenos (3,4). Así mismo, se ha encontrado que la progesterona está implicada en la modulación directa de glicoproteínas, como la mucina Muc1, distribuida en las células epiteliales (5). Además de los estrógenos y la progesterona también se han implicado como factores moduladores las prostaglandinas (1), el factor temprano del embarazo (6), algunas integrinas (1,7), y carbohidratos de superficie como parte del glicocalix, específicamente glicoproteínas de superficie celular implicadas en reconocimiento, adhesión, fusión y diferenciación celular (8).
Las manifestaciones físicas del ciclo en la coneja son discretas y variables, excepto en la coloración de la vulva (de rojo a blanco con rosa intermedio), que define el comportamiento ante el macho con cierta precisión. Si está roja, la receptividad para el macho se acerca al 100% (período de celo), mientras que cuando es blanca sólo alcanza un 20,6% (9). Si la hembra acepta el macho, se asume que está en fase estral (período de celo), momento apto para la gestación. Así mismo, se ha demostrado que las conejas que se aparean cuando la vulva está roja ovulan en un porcentaje del 84,6%, y quedan gestantes 95,6% de estas. Comparando estos datos con los que se dan con la vulva blanca, donde menos del 5% ovulan, y un porcentaje aún menor quedan gestantes (9).
Se puede deducir que todo el aparato genital de la coneja está preparado en el período de celo para recibir el embrión, y que esta preparación podría incluir la presencia o ausencia de determinados carbohidratos de superficie. Con este estudio, intentamos conocer la variación de los azúcares endometriales en el momento del celo; y determinar cuáles son específicamente estos azúcares. Estos resultados permitirán sentar las bases para identificar el papel de los azúcares en la mayor receptividad del útero al ataque del blastocisto.
MATERIAL Y MÉTODO
Se usaron 15 conejas de raza Ruso-Califor-niano de cinco libras de peso, criadas en cautiverio. De éstas, 5 tenían vulva roja, 5 rosa y 5 blanca, lo cual fue determinado por tres examinadores diferentes. Posteriormente, las conejas fueron sacrificadas para la extracción en bloque del útero, del cual se disecaron y marcaron las diferentes zonas a estudiar como oviducto, útero distal, útero medio y cuello uterino.
Las muestras se fijaron en preparación de Carnoy durante tres horas y se procesaron para su estudio. Los bloques fueron seccionados y a los cortes resultantes se les agregó en forma secuencial lectina específica biotilinada por 1 hora, posteriormente, se hizo una solución con 12 μ de neutravidina, 12 de peroxidasa biotilinada, y 2,4 mi de PBS, y se dejó una hora sobre las muestras, por último se reveló la presencia de lectina con una solución de ácido etil carbamida (AEC). Las lectinas (Sigma) que se utilizaron fueron: eritrina cristagalli (ECL) específica para el disacá-rido galactosa (β1-4 N-acetil glucosalina; dolichos biforus agglutinin (DBA) específica para el disacá-rido N-acetilgalactosamina β 1-3N-acetilgalactosa-mina; ulex europaeus aglutinin-1 (UEA-1) específica para L-fucosa; pisum sativum agglutinin (PSA) el cual se une los azúcares manosa/α glucosa; y artocarpus integrifolia (Jacalin) la cual une a p-galactosa.
Para confirmar la especificidad de la lectina por el azúcar respectivo, algunas secciones histológicas adyacentes se incubaron con una mezcla de la lectina biotinilada (5 μgr/dl) con el azúcar inhibitorio apropiado 0,1 M. La mezcla lectina biotinilada más el azúcar se preparó dos horas antes de usarse. Los azúcares inhibitorios que se utilizaron fueron los siguientes: galactosa para ECL y jacalina; N acetil galactosamina para DBA; mañosa y glucosa para PSA; y fucosa para UEA-1 (10).
El material que se obtuvo se analizó al microscopio de luz por tres observadores diferentes. El grado de tinción de carbohidratos se evaluó de acuerdo a una escala subjetiva desde ninguna reacción (0 cruces), trazas (una cruz +); moderada (dos cruces ++) y máxima tinción (tres cruces +++). Se aplicó esta escala para cada una de las lectinas analizadas, en todas las partes estudiadas. Una vez establecidos estos valores, se reagruparon en dos grupos principales: el primero, de alta reacción que incorpora los grupos de tinción moderada y máxima (++, +++); el segundo de baja reacción reúne los de tinción mínima (0, +).
Finalmente se realizaron comparaciones entre las muestras, para lograr establecer diferencias entre los perfiles glicosídicos de las muestras estudiadas.
RESULTADOS
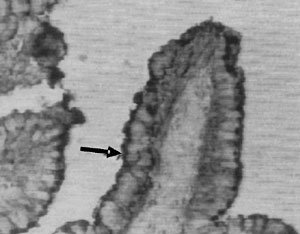
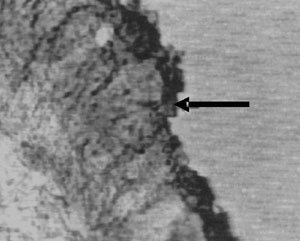
A nivel macroscópico se encontró diferencia entre los úteros y oviductos de las conejas con vulva blanca, rosa y roja. La primera tenían un útero largo, delgado, cauchoso y blanco; mientras que la de vulva roja tenían un útero edematoso, grueso, acortado y rojizo (Figuras 1 y 2).
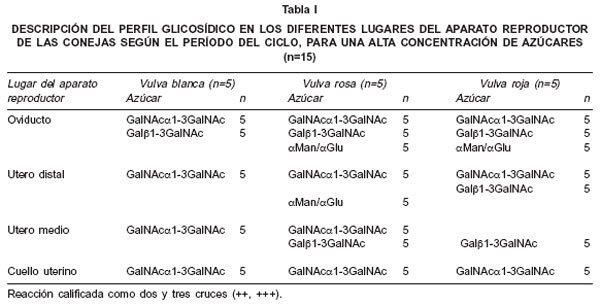
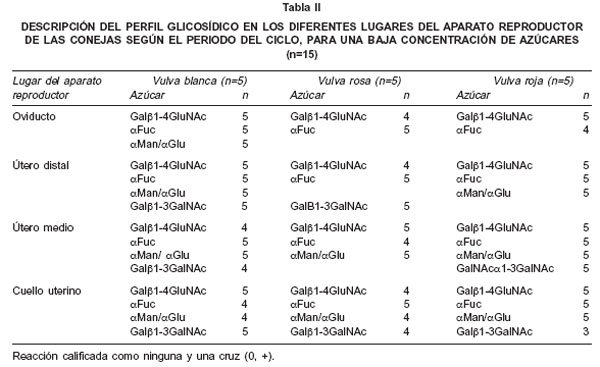
Los resultados, según el grado de reacción alto (++, +++) o bajo-ausente (0, +) para cada lectina están expresados en las Tablas I y II. Como se puede observar en las dos tablas, el grado de tinción de la lectina DBA (galNAcα1-3galNAc) permanece alto en todos los sitios y períodos del ciclo reproductivo, sin diferencias entre éstos, sólo siendo desplazado por la jabalina (galf>1-3galNAc) durante el período de vulva roja, en el útero medio. Otro hallazgo interesante, es la presencia de tinción moderada con la lectina PSA (aman/a gluc) y la jacalina (galf>1-3galNAc) en el oviducto, en los períodos de vulva rosa y roja, acompañando la reacción de la DBA. En cuanto a las lectinas ECL (gal(31-4glcNAc) y UEA 1 (αL-fucosa), presentaron baja expresividad en todos los sitios y períodos.
DISCUSIÓN
La investigación realizada, tiene su importancia en la evaluación del perfil glicosídico tanto en los diferentes sitios del aparato reproductor como en los diferentes períodos del ciclo, lo cual nos permite determinar con mayor certeza y con menos distractores, la presencia o ausencia de los azúcares de superficie durante el ciclo estral y el proceso de implantación.
Algunos estudios en hámsteres han demostrado la variación de los residuos glicosídicos según el período del ciclo, reportando el aumento de las glicosiltransferasas en el período de peri-implanta-ción (11); al mismo tiempo, en conejas, se han encontrado aumentados determinados tipos de azúcares en el mismo período (12). Nuestros resultados están acorde con esos hallazgos, pues muestran que la expresión de ciertos residuos glicosídicos: galactosa f>1-3-N-acetil galactosamina (Jacalina), amanosa/a glucosa (PSA) y el disacá-rido N-acetilgalactosamina α 1-3N-acetilgalactosa-mina son dependientes del período del ciclo en que se encuentra la coneja. Otros azúcares permanecen constantes en poca cantidad, como la a-L Fucosa (UEA-1) y la galactosa f>1-4-N-acetilgluco-samina (ECL).
Igualmente estudios anteriores han reportado predominio de N-acetil galactosamina y galactosa en la época de peri-implantación (13,14). Nuestro estudio muestra el predominio de la N-acetilgalactosamina α 1-3N-acetilgalactosamina (DBA) en todos los períodos, exceptuando el de vulva roja a nivel del útero medio lo que ratifica la importancia de su desaparición por sus propiedades de antiadhesividad del blastocisto al endometrio cuando este disacárido hace parte de las mucinas (15). Además es importante el predominio de la galactosa p1-3N-acetil galactosamina sobre la N acetil-galactosamina α1-3 N acetilgalactosamina durante el período de vulva roja en el útero medio, los cuales representan la época de más fertilidad y la zona de mayor receptividad, respectivamente. Esto apoya la importancia de la f> galactosa en la implantación descrita por otros autores (16).
Por otro lado, los residuos de a-L-fucosa y galactosap1-4 N-acetil glucosamina presentan una expresión muy baja en las muestras, lo cual está de acuerdo con trabajos previos (14), sin embargo nuestro estudio no muestra variaciones en relación con los distintos períodos del ciclo. Esto puede deberse al carácter cualitativo del estudio, que no nos permite detectar cambios mínimos. Al parecer, los cambios descritos en otros estudios acerca de la galactosaf 1-4 N-acetil glucosamina se debe a la presencia de residuos de ácido siálico, que cubren normalmente la cadena glicopro-téica en su parte superior, evitando la interacción de las mismas con la lectina ECL y las «sustancias» externas (16,17).
Por último, se encontró una alta reacción para a manosa/a glucosa(PSA) en el oviducto y en el útero distal en los períodos de vulva rosa y roja, lo cual puede representar cierta importancia de estos azúcares en la conducción del embrión implantado a su destino.
En conclusión, siendo la presencia o ausencia de los carbohidratos uno de los factores que influencian la implantación, es posible que la alteración de estos azúcares sea en parte responsable de la incapacidad de algunas mujeres para llevar el embarazo a término. Esta hipótesis, puede ser desarrollada en futuras investigaciones que lleven a dilucidar el papel de los azúcares en el proceso reproductivo humano.
BIBLIOGRAFÍA
- Minas V, Loutradis D, Makrigiannakis A. Factors controlling blastocyst implantation. Reprod Biomed Online 2005;10(2):205-16
- Hasty L, Lambris J, Lessev B, Pruksananonda K, Lyttle C. Hormonal regulation of complement and receptors throughout the menstrual cycle. Am J Obstet Gynecol 1994;170:168-75.
- Svalander P, Odion P, Nilsson B, Obrink B. Expression of Cell CAM-105 in the apical surface of rat uterine epithelium is controlled by ovarian steroid hormones. J Reprod Fértil 1990;88(1):213-21.
- Lai T, Shih I, Vlahos N, Liang CH, Wallach E, Zhao Y. Differential expression of L-selectin ligand in the endometrium during the menstrual cycle. Fértil Steril 2005;l83(1):1297-302.
- Hoffman L, Olson G, Carson D, Chilton B. Progesterone and implanting blastocysts regulate Mud expression in rabbit uterine epithelium. Endocrinology 1998;139(1):266-71.
- Heap R. Role of embryonic signal in the establishment of pregnancy. Br Med Bull (Cambridge) 1989; 35:129-35.
- Srinivasan K, Dwivedi A, Jain S, Mehrotra P. Demonstration of uterine receptivity in vitro by co-culture of rat epithelial cells and blastocyst. Cell Tissue Res 2006;325(1):135-41.
- Lai T, Zhao Y, Shih I, Ho Ch, Bankowski B, Vlahos N. Expression of L-selectin ligands in human endometrium during the implantation window after controlled ovarian stimulation for oocyte donation. Fértil Steril 2006;85(3):761-3.
- Alvariño MR. Control de la reproducción en la Coneja. Madrid, España: Mundi-Prensa 1993; 17-9.
- García J, Guerrero A, Lemus R, Fuenzalida M, Lemus D. Análisis histoquímico de células neoplá-sicas mediante lectinas conjugadas con peroxidasa de rábano. Rev Méd Chile 1995; 13(2): 177-82.
- Tulsiani D, Chayko C, Orgebin-Crist M, Araki Y. Temporal surge of glycosyltrnsferase activities in the genital tract of the hamster during the estrous cycle. Biol Reprod 1996;54(5): 1032-7.
- Olson G, Wintrev V, Matrisian P, Melner M, Hoffman L. Specific expression of haptoglobin mRNA in implantation-stage rabbit uterine epithelium. J Endo-crinol 1997;152(1):69-80.
- Yang Z, Le S, Chen D, Yasukawa K, Harper M. Expression patterns of leukaemia inhibitory factor receptor (LIFR) and the gp130 receptor component in rabbit uterus during early pregnancy. J Reprod Fértil 1995;103(2):249-55.
- Anderson T, Olson G, Hoffman L. Stage-specific alterations in the apical membrane glycoproteins of endometrial epithelial cells related to implantation in rabbits. Biol Reprod 1986;34(4):701-20.
- Hoffman L, Olson G, Carson D, Chilton B. Progesterone and implanting blastocysts regulate Mud expression in rabbit uterine epithelium. Endocrinology 1998; 139(1 ):266-71.
- Weitlauf HM. Biology of implantation. In: Knobil E, Neill JD (eds). The Physiology of Reproduction, 2a ed. New York: Raven Press Ltd, 1994;391-440.
- Griffth C, Sanders E. Changes in glycoconjugate expression during early chick embryo development: A lectin-binding study. Anat Rec 1991;231(2):238-50.