2020
5
Autores:
Sochog
Instituciones:
Rodríguez G., Luis; MD 1, Díaz C., Linder; MD 2, Vaccaro C., Humberto; MD 1, Amor L., Fernando; MD1, Yamamoto C., Masami; MD3, Olid M., Maria I.; MD4, Alcázar Z., Juan Luis; MD, PhD5.
1 Centro Ecográfico Ultrasonic Panorámico, Santiago, Chile.
2 Centro de Ultrasonografía AGB, Clínica Sanatorio Alemán, Concepción, Chile.
3 Departamento de Obstetricia y Ginecología, Clínica Universidad de los Andes, Santiago, Chile.
4 Departamento de Obstetricia y Ginecología, Hospital Mérida, Mérida, España.
5 Departamento de Obstetricia y Ginecología, Clínica Universidad de Navarra; Pamplona, España.
Correspondencia
Nombre: Luis Armando Rodríguez Guzmán
Email: larodriguezg@hotmail.com
Tipo de documento:
Trabajos OriginalesGIRADS: método de clasificación de masas anexiales, revisión sistemática y metanálisis. 10 años de experiencia
Contenido del documento:
INTRODUCCIÓN
Las masas anexiales son un problema común en Ginecología. Afortunadamente, la mayoría de ellos son benignas. Se estima que aproximadamente el 10 % de las mujeres tendrán en su vida una patología anexial, de las cuales la gran mayoría se resuelve espontáneamente. Por otra parte, el mayor porcentaje de las lesiones que se operan son benignas, en estas se reporta una incidencia de cáncer de un 11.7 % 4. En esta patología, el cáncer de ovario es la neoplasia maligna ginecológica más letal. En el año 2008 se estimó que se diagnosticaron 225.500 cánceres de ovario en todo el mundo con aproximadamente 140.200 muertes por esta causa, con una incidencia y mortalidad mayor en países desarrollados respecto de los países en desarrollo 1,2. La tasa de letalidad por cáncer de ovario ha ido en aumento mundialmente y en Chile se observó que la tasa de letalidad por cáncer de ovario aumentó del 3.4 al 4.9 por 100.000 desde el año 1997 al año 2010 3. La discriminación precisa entre masas anexiales benignas y malignas es esencial para un manejo clínico adecuado, orientado especialmente a evitar los falsos positivos. Las lesiones clasificadas como benignas se deben observar o tratar mediante técnicas mínimamente invasivas5,6. Las masas anexiales clasificadas como malignas deben remitirse a las unidades de oncología ginecológica para una cirugía adecuada7.
La ecografía endocavitaria y/o transabdominal se considera la técnica de imagen de primera línea para evaluar las masas anexiales 8 . La impresión subjetiva de un examinador experto, que utiliza el llamado enfoque de reconocimiento de patrones (pattern recognition), se ha demostrado como el mejor método para discriminar entre masas anexiales benignas y malignas 9. Sin embargo, este examinador no es quién habitualmente decide con respecto al manejo del paciente. Es por esto que la comunicación entre los involucrados debe ser clara y estructurada para evitar errores de interpretación 10,11.
En el año 2009 se desarrolló el Sistema de Generación de Informes de Imágenes Ginecológicas (GIRADS) para clasificar las masas anexiales y facilitar la comunicación entre los ecografistas y los médicos tratantes 12. Desde entonces, se han publicado varios estudios que abordan el rendimiento diagnóstico de este sistema de clasificación.
OBJETIVO
El objetivo de este estudio es realizar una revisión sistemática y un metanálisis del rendimiento del sistema GIRADS para clasificar las masas anexiales a diez años de su publicación.
MÉTODOS
Protocolo y registro: Este metanálisis se realizó utilizando las recomendaciones de la Declaración PRISMA (http://www.prisma-statement.org/), así como siguiendo las pautas de la Evidencia de Síntesis de las Pruebas de Precisión Diagnósticas (SEDATE) 13 .El protocolo no fue registrado.
Se anuló la aprobación de la Junta de Revisión Institucional debido a la naturaleza y el diseño del estudio.
Fuentes de datos y búsquedas: Se examinaron tres bases de datos electrónicas, PubMed / MEDLINE, Web of Science y Google Scholar para identificar estudios potencialmente elegibles publicados entre enero de 2009 y diciembre de 2019. La estrategia de búsqueda incluyó los siguientes términos «masas anexiales», «cáncer de ovario», «ultrasonido transvaginal», ”ultrasonido ginecológico”, «GIRADS» y/o Gynecologic Imaging Reporting and Data System. No se estableció un límite de idioma.
Se identificaron estudios potencialmente elegibles aplicando los siguientes criterios:
- Estudio de cohorte prospectivo o retrospectivo que incluye pacientes diagnosticados con al menos una masa anexial, lesión que se clasificó utilizando el sistema GIRADS después de la evaluación de ultrasonido transvaginal, transrectal o transabdominal como prueba índice.
- Informe del diagnóstico histológico de la masa anexial después de la extirpación quirúrgica o la resolución espontánea después de la exploración de seguimiento ecográfico como estándar de referencia.
- Presencia de datos informados que permitirían construir una tabla de 2×2 para estimar el rendimiento diagnóstico del sistema GIRADS.
Para evitar la inclusión de cohortes duplicadas, se examinó el período de estudio de cohortes informadas por los mismos autores. Si las fechas se superponían, se eligió el último estudio publicado. Se realizó búsqueda adicional en la lista de referencias de los estudios seleccionados para la lectura de texto completo. En caso de datos insuficientes, se contactó a los autores. Se registraron los aspectos relacionados con pacientes, intervención, comparación, variable de resultados, estudio (PICOS) utilizados para la inclusión y exclusión de estudios.
Los resultados de precisión diagnóstica de los estudios finalmente seleccionados fueron recuperados de forma independiente.
Evaluación del riesgo de sesgo en estudios individuales: La evaluación de la calidad de los estudios incluidos en el metanálisis se realizó utilizando la herramienta proporcionada por la “Evaluación de la Calidad de los Estudios de Precisión Diagnóstica-2” (QUADAS-2) 14. El formato QUADAS-2 incluye cuatro dominios: 1) selección de pacientes, 2) prueba de índice, 3) estándar de referencia y 4) flujo y sincronización. Para cada dominio, el riesgo de sesgo y las preocupaciones sobre la aplicabilidad (este último no se aplica al dominio del flujo y el tiempo) se analizaron y calificaron como riesgo bajo, alto o poco claro. La evaluación de calidad se utilizó para proporcionar una evaluación general de los estudios e investigar posibles fuentes de heterogeneidad.
La evaluación de la calidad de cada trabajo se basó en la descripición del diseño del estudio, así como los criterios de inclusión y exclusión para el dominio de selección de pacientes; si el estudio informó sobre cómo se realizó e interpretó la prueba de índice para el dominio de prueba de índice; cuál era el estándar de referencia utilizado para el dominio estándar de referencia; y descripción del tiempo transcurrido desde la evaluación de la prueba de índice hasta el resultado estándar de referencia para el dominio de flujo y temporización.
Análisis estadístico
Se extrajo información sobre el rendimiento de diagnóstico del sistema GIRADS. Dado que GIRADS clasifica las masas anexiales en cinco grupos: GIRADS 1 (definitivamente benigno), GIRADS 2 (muy probablemente benigno), GIRADS 3 (probablemente benigno), GIRADS 4 (probablemente maligno) y GIRADS 5 (muy probablemente maligno), se utilizó la siguiente clasificación de dicotomía para construir tablas 2×2: los casos GIRADS 1,2 y 3 se consideraron benignos y los casos GIRADS 4 y 5 se consideraron malignos.
Se usó un modelo de efectos aleatorios para estimar la sensibilidad, la especificidad, LR (+), LR (−) y Odds ratio diagnóstica (DOR) agrupadas. LRs se utilizan para caracterizar la utilidad clínica de una prueba y estimar la probabilidad de enfermedad posterior a la prueba 15.
Utilizando la prevalencia media de malignidad ovárica (probabilidad previa a la prueba), las probabilidades posteriores a la prueba se calcularon utilizando LR (+) y (-) y se trazaron en el nomograma de Fagan.
La heterogeneidad para la sensibilidad y la especificidad se evaluó mediante el estadístico Q de Cochran y el índice I2 16 . Un valor p <0.1 indica heterogeneidad. Se consideraría que los valores de I2 de 25%, 50% y 75% indican heterogeneidad baja, moderada y alta, respectivamente 16. Se trazaron graficas forest plot de sensibilidad y especificidad de todos los estudios. Se utilizó la metaregresión si existía heterogeneidad para evaluar las covariables que podrían explicar esta heterogeneidad. Las covariables analizadas fueron las siguientes: año de publicación, tamaño simple, diseño del estudio (prospectivo / retrospectivo), descripción de la prueba índice (descrita / no descrita), prueba de referencia (histología para todos los casos incluidos / sin histología para todos los casos incluidos), prevalencia de malignidad ovárica, edad media de las pacientes y número de observadores (único / múltiple).
Las curvas resumen de las características operativas del receptor (sROC) se trazaron para ilustrar la relación entre sensibilidad y especificidad. Finalmente, el sesgo de publicación se evaluó utilizando el método de Deeks 17.
Todos los análisis se realizaron con los comandos MIDAS y METANDI en STATA versión 12.0 para Windows (Stata Corporation, College Station, TX, EE. UU.). Un valor de p <0.05 se consideró estadísticamente significativo.
RESULTADOS
Resultados de la búsqueda
La búsqueda electrónica proporcionó 15 citas que reunían todos los criterios de selección. Se excluyeron 2 registros por no cumplir todos los criterios, especialmente el de la categorización según GIRADS 19,24, quedando así 13 citas. Se leyó el texto completo de todos estos artículos 12,18-31. No se encontraron estudios adicionales de las referencias citadas en estos 15 estudios. En la figura 1 se muestra un diagrama de flujo que resume la búsqueda bibliográfica.
Característica de los estudios incluidos.
Se incluyeron trece estudios publicados entre enero de 2009 y diciembre de 2019, que informan 4473 masas anexiales en 4023 mujeres incluidos en los análisis finales para este trabajo. De estas 4473 masas anexiales, 878 resultaron malignas. No se informan masas indeterminadas en ningún estudio. La prevalencia media de malignidad ovárica fue del 23 % y la prevalencia agrupada fue de 19.6%, que oscila entre el 6,8% y el 41,8% (Tabla 1). Todos los estudios informaron las características clínicas de la cohorte. La edad media de los pacientes se informó en los 13 estudios, con edades promedio comprendidas entre 37.5 y 47.2 años. La tabla 2 muestra las características PICOS de los estudios incluidos.
Calidad metodológica de los estudios incluidos.
La evaluación QUADAS-2 del riesgo de sesgo y las preocupaciones con respecto a la aplicabilidad de los estudios seleccionados se muestra gráficamente en la figura 2.
El diseño del estudio se estableció claramente como prospectivo en ocho estudios 12,18,20,23,26,27,29,30 y retrospectivo en otros cinco estudios 21,22,25,28,31. En el dominio de selección de pacientes hubo cinco estudios que consideraron solo los casos que se resolvieron quirúrgicamente y no las lesiones funcionales categorizadas como GIRADS 2 20,21,22,26,28.
Con respecto al dominio «prueba de índice», los trece estudios describieron adecuadamente el método de texto de índice, así como también cómo se realizó (impresión subjetiva del examinador) y cómo se interpretó (clasificación GIRADS).
Para el dominio «estándar de referencia», todos los estudios se consideraron de bajo riesgo, ya que identificaron correctamente la condición objetivo por el estándar de referencia, ya sea histología definitiva después de la extirpación quirúrgica o seguimiento ecográfico con resolución espontánea o con tratamiento no quirúrgico de la masa.
Con respecto al dominio «flujo y tiempo», el tiempo transcurrido entre la prueba de índice y el estándar de referencia no estaba claro en todos los estudios.
Con respecto a la aplicabilidad, se consideró que todos los estudios tenían pocas preocupaciones con respecto a la prueba índice y los dominios estándar de referencia. Por la misma razón mencionada anteriormente con respecto al riesgo de sesgo, se consideró que cuatro estudios tenían una gran preocupación con respecto al dominio de selección de pacientes 20,21,22,25.
Rendimiento diagnóstico del sistema GIRADS para clasificar masas anexiales
En la tabla 3 se muestra como se distribuyen las distintas categorías de GIRADS en cada trabajo incorporado. Se incluyen el 100% de las lesiones estudiadas. Al analizar la distribución de cánceres en cada categoría se observa que en GIRADS 1-2 no hay cánceres, en GIRADS 3 un 1.9 %, en GIRADS 4 un 53.7% y en GIRADS 5 un 90 %. Por otra parte, si se analiza que porcentaje del total de cánceres corresponde a cada categoría, se observa que a GIRADS 3 corresponde el 4.4 %, a GIRADS 4 el 35 % y a GIRADS 5 el 60.6 %. Respecto de la prevalencia, si se promedian las prevalencias de cada trabajo esta es del 23%, pero si se considera el conjunto de lesiones estudiadas, la prevalencia agrupada es de 19.63 %. (Tabla 3).
La sensibilidad, especificidad, LR (+) y LR (-) agrupadas y el DOR del sistema GIRADS para clasificar las masas anexiales fueron de 96.8% (IC 95%: 94% –98%), 91.2 % (IC 95%: 85% –94%), 11.0 (IC 95% = 6.9–13.4) y 0.035 (IC 95% = 0.02–0.09), y 209 (IC 95%: 99-444), respectivamente.
Se encontró heterogeneidad significativa para la sensibilidad (I2 = 72.2%; Cochran Q = 43.15; p <0.001) y para la especificidad (I2 = 95.9%; Cochran Q = 294.02; p <0.001). El forest plot se muestra en la figura 3.
La meta-regresión mostró que la prevalencia de malignidad ovárica, el uso de múltiples observadores e incluyendo masas con resolución espontánea explicaron la heterogeneidad observada en la especificidad. Mientras que múltiples observadores e incluyendo masas con resolución espontánea explicaron la heterogeneidad observada en la sensibilidad.
Las curvas ROC para el rendimiento diagnóstico del sistema GIRADS en clasificar masas anexiales se muestra en la figura 4. Área bajo la curva 0.98 (IC: 0.97-0.99).
El nomograma de Fagan muestra que un GIRADS 4-5 aumenta la probabilidad previa a la prueba de malignidad ovárica, de 22.6% a 76.0%; mientras que un GIRADS 1-3 disminuye la probabilidad previa a la prueba, de 22.6% a 1.0% (figura 5).
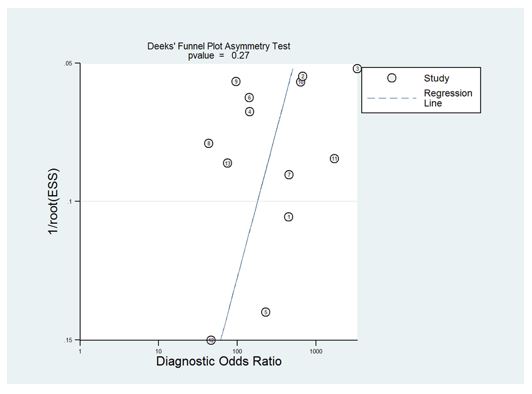
No se observó sesgo de publicación (figura 6).
DISCUSIÓN
En el presente estudio, se ha realizado una revisión sistemática y metanálisis del sistema de clasificación GIRADS, con un universo de 4473 masas anexiales incluyendo 878 cánceres. La sensibilidad y especificidad agrupadas del sistema GIRADS para el diagnóstico del cáncer anexial fue del 96,8 % y el 91.2 %, respectivamente. Estas cifras indican que este sistema es un buen método para clasificar las masas anexiales. La distribución de cánceres por categoría está de acuerdo con lo reportado desde que se describió GIRADS en el año 2009 y 2011.
Tanto la sensibilidad como la especificidad fueron similares en la mayoría de los estudios analizados. De hecho, el IC del 95% para ambas es relativamente estrecho, no obstante que estos estudios se realizaron en Europa, Asia, África, América del Norte y América del Sur. Considerando lo anterior el método GIRADS es potencialmente aplicable en cualquier población.
Se observa una heterogenicidad significativa para la sensibilidad y especificidad. Esto implica que los estudios podrían no ser comparables. En el análisis de metaregresión se encuentran como factores asociados a esta heterogeneidad, el número de examinadores y tipo de test de referencia (solo histología versus histología y seguimiento hasta la resolución).
El objetivo principal de GIRADS es informar y facilitar la comunicación entre el ecografista y el médico tratante. De los trece estudios analizados, solo dos abordaron este tema. En ambos estudios (uno con 15 y otro con 20 médicos tratantes) 18,23, todos los médicos tratantes encontraron este sistema muy útil para el proceso de toma de decisiones sobre el manejo de sus pacientes, que es el objetivo principal de GIRADS.
Un problema recurrente en la evaluación de las masas anexiales por ultrasonido es la variabilidad y la calidad de los informes 32. El consenso del grupo IOTA estableció los términos y definiciones para la descripción de los hallazgos ultrasonográficos 33 . Este fue un paso significativo para utilizar un «lenguaje común». Sin embargo, el cómo informar no se resolvió 34 .
GIRADS no es una forma para interpretar el hallazgo ecográfico, sino un sistema estructurado de informe para mejorar la comunicación entre los médicos tratantes y los ecografistas, proponiendo un diagnóstico etiológico y/o un riesgo estimado de malignidad para orientar el manejo clínico12. Se basa en la caracterización subjetiva por un examinador experto, que hasta la fecha, es la forma más eficiente para discriminar entre masas anexiales benignas y malignas 9 . Por lo tanto, el sistema GIRADS no es un método alternativo a IOTA para clasificar las lesiones anexiales.
IOTA ha desarrollado varios algoritmos de clasificación para masas ováricas, como los modelos logísticos LR1 y LR2 35, Reglas simples 36, y el modelo ADNEX 37 . La mayoría de ellos proporcionan una estimación del riesgo de malignidad 35, 37,38 .
Debe considerarse que en el análisis de las cifras de los diversos sistemas de IOTA en un 20 a 25 % de lesiones estos modelos no se pueden aplicar y deben ser enviados a un experto para su informe definitivo 39,40,41,42.
Recientemente, el Colegio Americano de Radiólogos ha propuesto un Sistema de Datos de Informe Anexial Ovárico (O-RADS) 43. Este sistema, O-RADS, describe un léxico estandarizado para lesiones ováricas y anexiales basado en la terminología IOTA y el objetivo final será aplicarlo a una clasificación de estratificación de riesgo para el seguimiento y manejo clínico. Las cifras que acompañan la publicación O-RADS indican una probabilidad de malignidad de hasta 10, bajo 50 y sobre 50 % para las categorías 3, 4 y 5 respectivamente. Cabe hacer notar que estos valores son una extrapolación de trabajos anteriores, sin casuística propia, por lo tanto, sin validación interna o externa actual. En GIRADS, estos porcentajes fueron de 2%, 54% y 90% para las categorías 3,4 y 5 (tabla 3).
El sistema IOTA, que es la base de la propuesta de O-RADS, fue concebido para que operadores de poca experiencia obtuvieran resultados diagnósticos semejantes a los de expertos. Futuros trabajos deberán confirmar o no esta hipótesis una vez que se disponga de casuística y seguimiento suficiente. Además, O-RADS incorpora la Resonancia Nuclear Magnética como elemento de segunda línea en caso de duda, esquema difícilmente aplicable en forma masiva en muchas realidades incluyendo la nuestra. Aun así, los autores, en la discusión, califican como decepcionante la especificidad del sistema propuesto 43,44. La baja especificidad, se repite en otros trabajos y es una limitación que a menudo, se pasa por alto. Sin embargo, esta se traduce en un aumento de los falsos positivos, intervenciones innecesarias y eventuales complicaciones 45,46, lo que se traduce en un perjuicio más que en un beneficio para las pacientes.
La principal conclusión de este metanálisis es que, en poblaciones diversas, operadores con diferencias socio culturales importantes, obtienen resultados comparables con una alta precisión diagnostica en toda la patología anexial.
Debe tenerse presente que GIRADS está concebido para ser utilizado por personal con conocimiento y experiencia en el tema.
Declaración conflictos de Interés
Este trabajo de investigación se ha realizado con un esfuerzo personal del grupo, sin apoyo, reconocimiento ni financiamiento de la industria farmacéutica, de empresas de ultrasonografía, del Estado, de ONGs, de universidades o de cualquier otra institución en especial. Tres autores han participado en algunos de los trabajos revisados en este Metaanálisis. Esta situación no inferfirió en la revisión objetiva de las publicaciones incluidas, por lo que declaramos no tener conflictos de interés.
REFERENCIAS
- Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics [published correction appears in CA Cancer J Clin. 2011 Mar-Apr;61(2):134]. CA Cancer J Clin. 2011;61(2):69–90. doi:10.3322/caac.20107.
- Lowe, Kimberly A. et al. An international assessment of ovarian cancer incidence and mortalityGynecologic Oncology, Volume 130, Issue 1, 107 – 114 doi.org/10.1016/j.ygyno.2013.03.026
- Cuello M. GES en cáncer de ovario epitelial: un avance sanitario necesario, pero no exento de riesgos y dificultades futuras. Rev Chil Obstet Ginecol 2013; 78(3): 161 – 166.
- Cuello M et al. Distribución de la patología anexial en mujer chilena: experiencia de la Universidad Católica de Chile. Rev Chilena Obstet Ginecol 2004; 69(6): 429-440
- Alcázar JL, Olartecoechea B, Guerriero S, Jurado M. Expectant management of adnexal masses in selected premenopausal women: a prospective observational study. Ultrasound Obstet Gynecol. 2013;41(5):582–588. doi:10.1002/uog.12369
- Canis M, Rabischong B, Houlle C, et al. Laparoscopic management of adnexal masses: a gold standard? Curr Opin Obstet Gynecol. 2002;14(4):423–428. doi:10.1097/00001703-200208000-00010
- Vernooij, Flora et al.The outcomes of ovarian cancer treatment are better when provided by gynecologic oncologists and in specialized hospitals: A systematic review Gynecologic Oncology, 2007,Volume 105, Issue 3, 801 – 812 https://doi.org/10.1016/j.ygyno.2007.02.030
- American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins—Gynecology. Practice Bulletin No. 174: Evaluation and Management of Adnexal Masses. Obstet Gynecol. 2016;128(5):e210–e226. doi:10.1097/AOG.0000000000001768
- Meys EM, Kaijser J, Kruitwagen RF, et al. Subjective assessment versus ultrasound models to diagnose ovarian cancer: A systematic review and meta-analysis. Eur J Cancer. 2016;58:17-29. https://doi.org/10.1016/j.ejca.2016.01.007
- Le T, Fayadh RA, Menard C, Hicks-Boucher W, Faught W, Hopkins L, Fung-Kee-Fung M. Variations in ultrasound reporting on patients referred for investigation of ovarian masses. J Obstet Gynaecol Can. 2008;30:902-6. https://doi.org/10.1016/S1701-2163(16)32970-X
- Brown DL, Dudiak KM, Laing FC. Adnexal masses: US characterization and reporting. Radiology. 2010;254(2):342–354. doi:10.1148/radiol.09090552
- Amor F, Vaccaro H, Alcázar JL, León M, Craig JM, Martinez J. Gynecologic imaging reporting and data system: a new proposal for classifying adnexal masses on the basis of sonographic findings. J Ultrasound Med. 2009;28(3):285–291. doi:10.7863/jum.2009.28.3.285.
- Sotiriadis A, Papatheodorou SI, Martins WP. Synthesizing Evidence from Diagnostic Accuracy TEsts: the SEDATE guideline. Ultrasound Obstet Gynecol. 2016;47(3):386–395. doi:10.1002/uog.15762
- Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8):529–536. doi:10.7326/0003-4819-155-8-201110180-00009
- European Network for Health Technology Assessment (EUnetHTA). Methodological guideline on “Meta-analysis of diagnostic test accuracy studies”. January 1, 2014/ EUnetHTA Joint Action 2 (2012-15), JA2-WP7, Outputs
- Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327(7414):557–560. doi: https://doi.org/10.1136/bmj.327.7414.557
- Deeks JJ, Macaskill P, Irwig L. The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed. J Clin Epidemiol. 2005;58(9):882–893.
doi: 10.1016/j.jclinepi.2005.01.016
- Amor F, Alcázar JL, Vaccaro H, León M, Iturra A. GI-RADS reporting system for ultrasound evaluation of adnexal masses in clinical practice: a prospective multicenter study. Ultrasound Obstet Gynecol. 2011;38(4):450–455. doi:10.1002/uog.9012
- Moszynski R, Szubert S, Szpurek D, Michalak S, Sajdak S. Role of osteopontin in differential diagnosis of ovarian tumors. J Obstet Gynaecol Res. 2013;39(11):1518–1525. doi:10.1111/jog.12097
- Qiuyue C, Guorong L. The applicational value of GI-RADS ultrasonographic stratification in diagnosing adnexal masses. Chinese J Ultrasound Med. 2013; 29: 527-30.
- Rams N, Muñoz R, Soler C, Parra J. Results of the Gynecologic Imaging Reporting and Data System classification in adnexal masses. Prog Obstet Gynecol. 2015; 58(3): 125-129. doi.org/10.1016/j.pog.2014.11.020
- Fernández RO, Rama AP, Llanos Llanos MC, Mendoza AM, Linde FM and Díaz AN . Clinical Application of the Gynecologic Imaging Reporting and Data System (Gi-Rads) for the Evaluation of Adnexal Masses. SM J Gynecol Obstet. 2015; 1(2): 1009.
- Díaz L, Zambrano B, Adami FJ, Alcázar JL. External Validation of Gynecological Imaging and Reporting Data System for Sonographic Evaluation of Adnexal Masses. Donald School J Ultrasound Obstet Gynecol. 2017;11:135-40. DOI: 10.5005/jp-journals-10009-1514
- Koneczny J, Czekierdowski A, Florczak M, Poziemski P, Stachowicz N, Borowski D. The use of sonographic subjective tumor assessment, IOTA logistic regression model 1, IOTA Simple Rules and GI-RADS system in the preoperative prediction of malignancy in women with adnexal masses. Ginekol Pol. 2017; 88:647-653. https://doi.org/10.5603/gp.a2017.0116
- Zhang T, Li F, Liu J, Zhang S. Diagnostic performance of the Gynecology Imaging Reporting and Data System for malignant adnexal masses. Int J Gynaecol Obstet. 2017;137:325-31. https://doi.org/10.1002/ijgo.12153
- Migda M, Bartosz M, Migda MS, Kierszk M, Katarzyna G, Maleńczyk M. Diagnostic value of the gynecology imaging reporting and data system (GI-RADS) with the ovarian malignancy marker CA-125 in preoperative adnexal tumor assessment. J Ovarian Res. 2018; 11:92. https://doi.org/10.1186/s13048-018-0465-1
- Basha MAA, Refaat R, Ibrahim SA, Madkour NM, Awad AM, Mohamed EM, El Sammak AA, Zaitoun MMA, Dawoud HA, Khamis MEM, Mohamed HAE, El-Maghraby AM, Abdalla AAEM, Assy MM, Nada MG, Obaya AA, Abdelbary EH. Gynecology Imaging Reporting and Data System (GI-RADS): diagnostic performance and interreviewer agreement. Eur Radiol. 2019 Apr 16. doi: 10.1007/s00330-019-06181-0.
- Zheng H, Tie Y, Wang X, Yang Y, Wei X, Zhao X. Assessment of the diagnostic value of using serum CA125 and GI-RADS system in the evaluation of adnexal masses. Medicine (Baltimore). 2019;98(7):e14577. doi:10.1097/MD.0000000000014577
- Khalaf, L.M.R., Desoky, H.H.M., Seifeldein, G.S. et al. The diagnostic efficacy of Gynecology Imaging Reporting and Data System (GI-RADS): single-center prospective cross-sectional study. Egypt J Radiol Nucl Med 50, 61 (2019).
doi.org/10.1186/s43055-019-0071-2
- Behnamfar F, Adibi A, Khadra H, Moradi M. Diagnostic accuracy of gynecology imaging reporting and data system in evaluation of adnexal lesions. J Res Med Sci 2019; 24:57.
- Sonnemann MSI, Torres HVE. Diagnostic performance of the GI-RADS classification system for anexial masses. Rev Sanid Milit Mex. 2019;73(1):41-45.
- Le T, Fayadh RA, Menard C, Hicks-Boucher W, Faught W, Hopkins L, Fung-Kee-Fung M. Variations in ultrasound reporting on patients referred for investigation of ovarian masses. J Obstet Gynaecol Can. 2008; 30:902-906. https://doi.org/10.1016/s1701-2163(16)32970-x
- Timmerman D, Valentin L, Bourne TH, Collins WP, Verrelst H, Vergote I; International Ovarian Tumor Analysis (IOTA) Group. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol. 2000; 16:500-5. org/10.1046/j.1469-0705.2000.00287.x
- Brown DL, Dudiak KM, Laing FC. Adnexal masses: US characterization and reporting. Radiology. 2010; 254:342-54 https://doi.org/10.1148/radiol.09090552
- Timmerman D, Testa AC, Bourne T, et al. Logistic regression model to distinguish between the benign and malignant adnexal mass before surgery: a multicenter study by the International Ovarian Tumor Analysis Group. J Clin Oncol. 2005;23(34):8794–8801. doi:10.1200/JCO.2005.01.7632
- Timmerman D, Testa AC, Bourne T, et al. Simple ultrasound-based rules for the diagnosis of ovarian cancer. Ultrasound Obstet Gynecol. 2008;31(6):681–690. doi:10.1002/uog.5365
- Van Calster B, Van Hoorde K, Valentin L, et al. Evaluating the risk of ovarian cancer before surgery using the ADNEX model to differentiate between benign, borderline, early and advanced stage invasive, and secondary metastatic tumours: prospective multicentre diagnostic study. BMJ. 2014;349: g5920. Published 2014 Oct 15. doi:10.1136/bmj. g5920.
- Timmerman D, Van Calster B, Testa A, et al. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis group. Am J Obstet Gynecol. 2016;214(4):424–437. doi: 10.1016/j.ajog.2016.01.007
- Tinnangwattana D, Vichak-Ururote L, Tontivuthikul P, Charoenratana C, Lerthiranwong T, Tongsong T. IOTA Simple Rules in Differentiating between Benign and Malignant Adnexal Masses by Non-expert Examiners. Asian Pac J Cancer Prev. 2015;16(9):3835–3838. doi:10.7314/apjcp.2015.16.9.3835
- Meys E, Rutten I, Kruitwagen R, et al. Simple Rules, Not So Simple: The Use of International Ovarian Tumor Analysis (IOTA) Terminology and Simple Rules in Inexperienced Hands in a Prospective Multicenter Cohort Study. Simple Rules“ – nicht so einfach: Anwendung der „International Ovarian Tumor Analysis“(IOTA)- Terminologie und der „Simple Rules“ in unerfahrenen Händen in einer prospektiven multizentrischen Kohortenstudie. Ultraschall Med. 2017;38(6):633–641. doi:10.1055/s-0043-113819
- Knafel A, Banas T, Nocun A, Wiechec M, Jach R, Ludwin A, Kabzinska-Turek M, Pietrus M, Pitynski K. The Prospective External Validation of International Ovarian Tumor Analysis (IOTA) Simple Rules in the Hands of Level I and II Examiners.
Ultraschall Med. 2016; 37:516-523. doi:10.1055/s-0034-1398773
- Ning CP, Ji X, Wang HQ, et al. Association between the sonographer’s experience and diagnostic performance of IOTA simple rules. World Journal of Surgical Oncology. 2018 Sep;16(1):179. DOI: 10.1186/s12957-018-1479-2.
- Andreotti RF, Timmerman D, Benacerraf BR, et al. Ovarian-Adnexal Reporting Lexicon for Ultrasound: A White Paper of the ACR Ovarian-Adnexal Reporting and Data System Committee [published correction appears in J Am Coll Radiol. 2019 Mar;16(3):403-406]. J Am Coll Radiol. 2018;15(10):1415–1429. doi: 10.1016/j.jacr.2018.07.004.
- Andreotti RF, Timmerman, D et al. O-RADS US Risk Stratification and Management System: A Consensus Guideline from the ACR Ovarian-Adnexal Reporting and Data System Committee. Radiology 2020; 294:168–185. doi.org/10.1148/radiol.2019191150
- Buys SS, Partridge E, Black A, et al. Effect of Screening on Ovarian Cancer Mortality: The Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. 2011;305(22):2295–2303. doi:10.1001/jama.2011.766
- Menon U, Gentry-Maharaj A et al., Sensitivity and specificity of multimodal and ultrasound
screening for ovarian cancer, and stage
distribution of detected cancers: results of the
prevalence screen of the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS).
Lancet Oncol 2009; 10: 327–40. DOI:10.1016/S1470- 2045(09)70026-9 .
TABLAS Y FIGURAS
Figura 1. Diagrama de flujo del proceso de selección de los 15 estudios seleccionados para este metaanálisis.
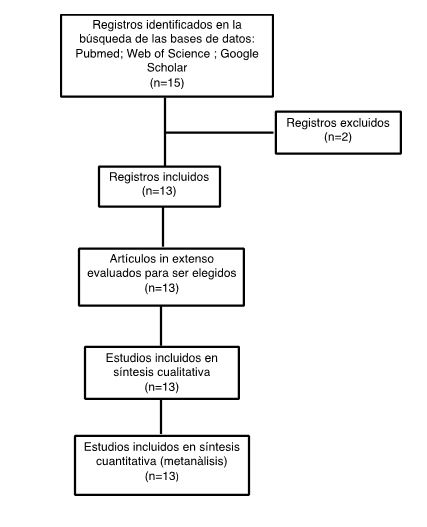
Tabla 1. Registro de los resultados de cada trabajo incluido en el análisis final.
| ESTUDIO/AÑO | Pacientes (n) | Masas (n) | Malignos (n) | Benignos (n) | V(+) | F(+) | F(-) | V(-) | Prevalencia malignidad
% |
| Amor/2009 | 171 | 187 | 25 | 162 | 25 | 16 | 0 | 146 | 13.7 |
| Amor/2011 | 372 | 432 | 112 | 320 | 111 | 45 | 1 | 275 | 25.9 |
| Qiuye/2013 | 1149 | 1449 | 99 | 1350 | 98 | 38 | 1 | 1312 | 6.8 |
| Rams/2015 | 87 | 98 | 14 | 84 | 14 | 9 | 0 | 75 | 14.3 |
| Orozco/2015 | 387 | 387 | 66 | 321 | 56 | 12 | 10 | 309 | 17.1 |
| Diaz/2017 | 257 | 281 | 35 | 246 | 34 | 17 | 1 | 229 | 12.5 |
| Zhang/2017 | 242 | 263 | 110 | 153 | 106 | 24 | 4 | 129 | 41.8 |
| Migda/2018 | 215 | 215 | 53 | 162 | 50 | 45 | 3 | 117 | 24.7 |
| Zheng/2019 | 325 | 325 | 129 | 196 | 117 | 18 | 12 | 178 | 39.7 |
| Basha/2019 | 308 | 325 | 127 | 198 | 124 | 12 | 3 | 186 | 39.1 |
| Khalaf/2019 | 116 | 156 | 53 | 103 | 52 | 3 | 1 | 100 | 33.3 |
| Behnamfar/2019 | 197 | 158 | 12 | 146 | 11 | 28 | 1 | 118 | 7.6 |
| Sonnemann/2019 | 197 | 197 | 43 | 154 | 42 | 55 | 1 | 99 | 21.8 |
| TOTALES | 4023 | 4473 | 878 | 3595 | 840 | 322 | 38 | 3273 |
(N): numero; V(+): verdaderos positivos; V(-): verdadero negativo; F(+): falso positivo; F(-): falso negativo.
Tabla 1a. Registro de los resultados de sensibilidad, especificidad, valor predictivo positivo y negativo, Likelihood ratio (+) y (-) para cada trabajo incluido en el análisis final.
| ESTUDIO/AÑO | SENSIBILIDAD (IC:95%) | ESPECIFICIDAD (IC:95%) | VP (+) | VP (-) | LR (+) | LR (-) |
| Amor/2009 | 100.0 (86.3 – 100.0) | 90.1(84.5 – 94.2) | 61.0 | 100.0 | 10.13 | 0.000 |
| Amor/2011 | 99.1(95.1 – 100.0) | 85.9 (81.6 – 89.6) | 71.2 | 99.6 | 7.03 | 0.010 |
| Qiuye/2013 | 99.0 (93.0 – 99.8) | 97.2 (96.2 – 98.0) | 72.1 | 99.9 | 35.17 | 0.010 |
| Rams/2015 | 100.0 (76.8 – 100.0) | 89.3 (80.6 – 95.0) | 60.9 | 100.0 | 9.33 | 0.000 |
| Orozco/2015 | 84.8 (73.9 – 92.5) | 96.3 (93.6 – 98.1) | 82.4 | 96.9 | 22.70 | 0.157 |
| Diaz/2017 | 97.1(85.1 – 99.9) | 93.1(88.4 – 95.6) | 66.7 | 99.6 | 14.06 | 0.031 |
| Zhang/2017 | 96.4 (91.0 – 99.0) | 84.3 (77.6 – 89.7) | 81.5 | 97.0 | 6.14 | 0.043 |
| Migda/2018 | 94.3 (84.3 – 98.8) | 72.2 (64.7 – 79.0) | 52.6 | 97.5 | 3.40 | 0.078 |
| Zheng/2019 | 90.7 (84.3 – 95.1) | 90.8 (85.9 – 94.5) | 86.7 | 93.7 | 9.88 | 0.102 |
| Basha/2019 | 97.6 (93.3 – 99.5) | 93.9 (89.7 – 96.8) | 91.2 | 98.4 | 16.11 | 0.025 |
| Khalaf/2019 | 98.1(89.9 – 100.0) | 97.1(91.7 – 99.4) | 94.5 | 99.0 | 33.69 | 0.019 |
| Behnamfar/2019 | 91.7 (61.5 – 99.8) | 80.8 (73.5 – 86.9) | 28.2 | 99.2 | 4.78 | 0.103 |
| Sonnemann/2019 | 97.7 (87.7 – 99.9) | 64.3 (56.2 – 71.8) | 43.3 | 99.0 | 2.7 | 0.036 |
IC: Intervalo de confianza; VP: Valor predictivo; LR: Likelihood ratio
Tabla 2. Criterios de selección de cada trabajo incorporado en la selecion.
| Número | Edad | Test | ||||||||
| Estudio/
año |
País | Mujeres | Masas | CA | (Años Prom.) | Centros | Diseño | Indice | Ref. | Exam. |
| Amor / 2009 | Chile | 171 | 187 | 25 | 39 | U | P | USG – GIRADS | H + RE | M |
| Amor / 2011 | Chile /España | 372 | 432 | 112 | 44 | M | P | USG – GIRADS | H + RE | M |
| Qiuye / 2013 | China | 1149 | 1449 | 99 | 39.5 | U | P | USG – GIRADS | H + RE | M |
| Rams / 2015 | España | 87 | 98 | 14 | NA | U | R | USG – GIRADS | H | M |
| Orozco / 2015 | España | 387 | 387 | 66 | 43 | U | R | USG – GIRADS | H | M |
| Diaz / 2017 | Venezuela | 257 | 281 | 35 | 40.3 | U | P | USG – GIRADS | H + RE | U |
| Zhang / 2017 | China | 242 | 263 | 110 | 47.2 | U | R | USG – GIRADS | H + RE | M |
| Migda / 2018 | Polonia | 215 | 215 | 53 | 40 | U | P | USG – GIRADS | H | U |
| Zheng / 2019 | China | 325 | 325 | 129 | 47.2 | U | R | USG – GIRADS | H | M |
| Basha / 2019 | Egipto | 308 | 325 | 127 | 41 | M | P | USG – GIRADS | H + RE | M |
| Khalaf / 2019 | Egipto | 116 | 156 | 53 | 42 | U | P | USG – GIRADS | H + RE | M |
| Behnamfar / 2019 | Iran | 197 | 158 | 12 | 37.5 | U | P | USG – GIRADS | H | U |
| Sonnemann / 2019 | Mexico | 197 | 197 | 43 | 45.3 | U | R | USG – GIRADS | H | M |
| Totales | 4023 | 4473 | 878 | |||||||
CA: Cánceres; Prom: Promedio; U: único; M: múltiple; P: Prospectivo; R: Retrospectivo; USG: Ultrasonido ginecológico; Ref.: Referencia; H: Histología; R.E: Resolución Espontánea; Exam.: Examinador
Figura 2. Gráfico de histograma que muestra la evaluación de calidad (riesgo de sesgo y preocupaciones sobre la aplicabilidad) para todos los estudios incluidos en el metanálisis.
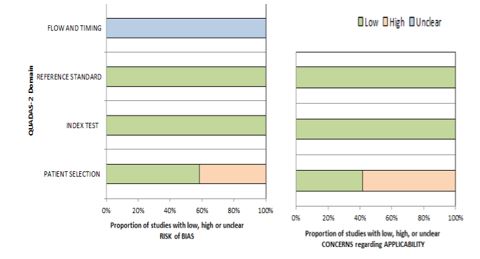
Tabla 3. Distribuciòn de tipos de lesiones en cada trabajo incorporado en el análisis final.
| G1 – G2 | G3 | G4 | G5 | TOTAL MAL.
(N) |
TOTAL MASAS
(N) |
PREV.
% |
|||||
| BEN.
(N) |
MAL.
(N) |
BEN.
(N) |
MAL.
(N) |
BEN.
(N) |
MAL.
(N) |
BEN.
(N) |
MAL.
(N) |
||||
| Amor/2009 | 56 | 0 | 90 | 0 | 11 | 2 | 5 | 23 | 25 | 187 | 13.4 |
| Amor/2011 | 92 | 0 | 183 | 1 | 32 | 8 | 13 | 103 | 112 | 432 | 25.9 |
| Qiuye/2013 | 731 | 0 | 581 | 1 | 32 | 28 | 6 | 70 | 99 | 1449 | 6.8 |
| Rams/2015 | 0 | 0 | 75 | 0 | 8 | 3 | 1 | 11 | 14 | 98 | 14.3 |
| Orozco/2015 | 3 | 0 | 306 | 10 | 8 | 12 | 4 | 44 | 66 | 387 | 17.1 |
| Diaz/2017 | 56 | 0 | 173 | 1 | 11 | 8 | 6 | 26 | 35 | 281 | 12.5 |
| Zhang/2017 | 65 | 0 | 64 | 4 | 24 | 77 | 0 | 29 | 110 | 263 | 41.8 |
| Migda/2018 | 2 | 0 | 114 | 4 | 45 | 41 | 0 | 9 | 54 | 215 | 25.1 |
| Zheng/2019 | 95 | 0 | 91 | 3 | 7 | 6 | 5 | 118 | 127 | 325 | 39.1 |
| Basha/2019 | 0 | 0 | 178 | 12 | 18 | 88 | 0 | 29 | 129 | 325 | 39.7 |
| Khalaf/2019 | 67 | 0 | 32 | 1 | 4 | 11 | 1 | 40 | 52 | 156 | 33.3 |
| Behnamfar/ 2019 | 59 | 0 | 59 | 1 | 24 | 6 | 4 | 5 | 12 | 158 | 7.6 |
| Sonnemann/2019 | 1 | 0 | 98 | 1 | 41 | 17 | 14 | 25 | 43 | 197 | 21.8 |
| TOTALES | 1227 | 0 | 2044 | 39 | 265 | 307 | 59 | 532 | 878 | 4473 | 19.63 |
| % CA por categoría | 1.9 | 53.7 | 90 | PREV. PROMEDIO | 23 | ||||||
| % CA por categoría en relación al total de cánceres | 4.4 | 35 | 60.6 | ||||||||
G1: GIRADS 1; G2: GIRADS 2; G3: GIRADS 3; G4: GIRADS 4; G5: GIRADS 5; BEN: Beningno;
MAL: Maligno; CA: Cáncer; PREV: Prevalencia
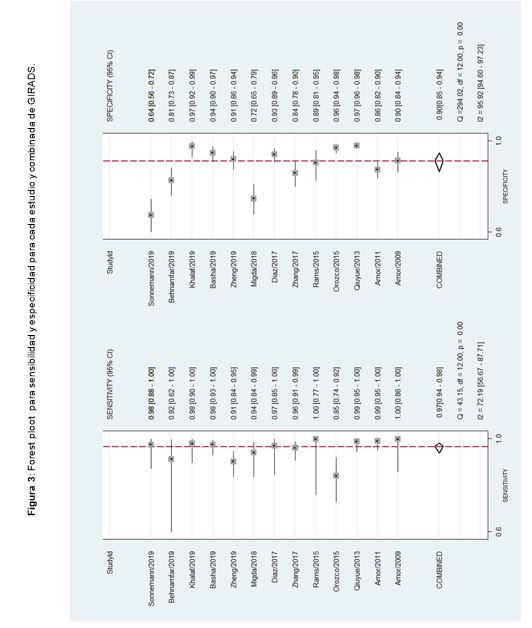
Figura 4: Curva ROC resumen para GIRADS.
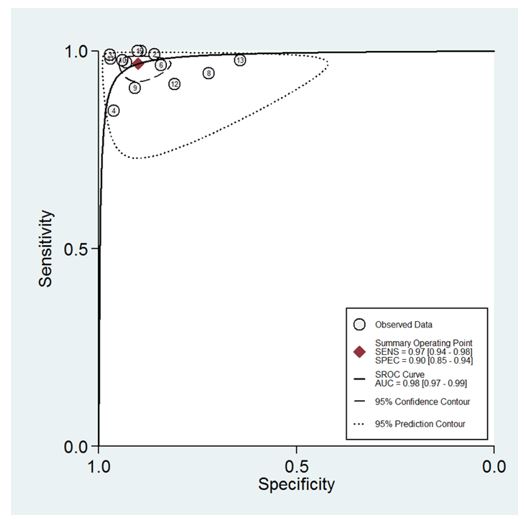
FIGURA 5. Nomograma de Fagan para detectar lesión maligna anexial utilizando la metodología GIRADS.
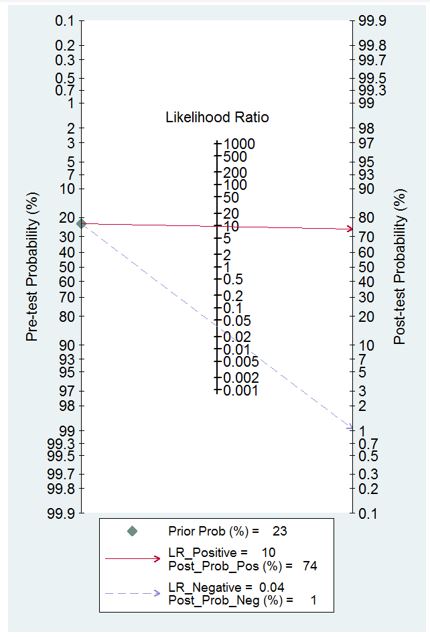
FIGURA 6. Gráfico utilizando método Deeks para evaluar el sesgo de publicación (p=0.27).