INTRODUCCIÓN
La Malformación Vascular Uterina (MVU) se define como un ovillo de vasos sanguíneos de diferente tamaño, con características de arteria y vena, sin red capilar intermedia. Es una causa poco común de metrorragia grave y se considera como posibilidad diagnóstica ante una hemorragia inesperada, excesiva o intermitente, después de un parto o de un procedimiento sobre el útero.
Su incidencia no es conocida con precisión porque hay comunicaciones aisladas o series de pocos casos, con menos de 100 pacientes informadas desde 1925 (1,2). Se ha planteado una incidencia probablemente mayor a la supuesta, a confirmar con el uso actual frecuente del examen con ultrasonido (US) y doppler color (3,4); otros advierten del sobrediagnóstico por interpretación inadecuada de las imágenes en casos de restos retenidos placentarios o de aborto (5).
Se clasifican en dos tipos: a) MVU primaria (congénita), por alteración de la angiogénesis, detención del desarrollo vascular y falla en su diferenciación a arteria o vena. Es un remanente embriológico con celularidad estable, sin regresión, que tiene múltiples conexiones vasculares pudiendo invadir tejido adyacente, especialmente durante el embarazo y que son muy poco frecuentes. b) MVU secundaria (adquirida), “traumática” o fístula arteriovenosa, que ocurre cuando un seno venoso queda incorporado en un proceso cicatricial del miometrio después de la necrosis del vello coriónico, en pacientes sometidas a cesárea o raspado uterino. También se presenta en pacientes con restos retenidos de aborto o placentarios, en enfermedad trofoblástica, en infección uterina, en embarazo múltiple, en cáncer uterino (endometrio o cuello), en endometriosis, en exposición a dietilestilbestrol. A diferencia de la congénita es una conexión arteriovenosa única, de mayor tamaño y más frecuente. Ocasionalmente puede regresar espontáneamente (6).
Las MVU pueden alcanzar tamaño y localización muy variables con expresión clínica amplia e impredecible desde asintomática e indetectable durante la vida, a expandirse por efecto hormonal sistémico (pubertad, embarazo, iatrogénico) con hemorragia uterina de tipo arterial y de riesgo vital (7). La metrorragia prolongada de bajo grado seguida de sangrado abrupto puede evolucionar con hipovolemia, disnea, hipotensión e insuficiencia cardíaca materna (8). Otros casos tienen pérdida reproductiva por alteraciones de la vascularización que comprometen el sitio de implantación y también debe considerarse en el estudio de infertilidad.
Actualmente, a los métodos diagnósticos imagenológicos (9), se han agregado nuevos procedimientos terapéuticos (embolización, ligadura vascular selectiva, coagulación bipolar laparoscópica, histerectomía) (7,10) y un enfoque multidisciplinario para manejo apropiado al caso individual (11,12).
Presentamos la experiencia de tres casos clínicos de hemorragia obstétrica en que se demostró MVU como factor etiológico y que fueron manejadas de acuerdo a los principios anteriores.
CASO CLINICO 1
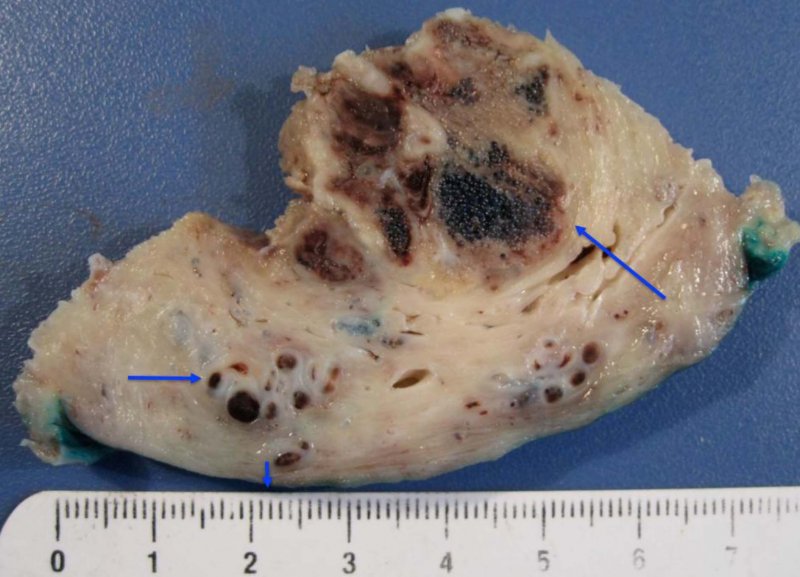
Mujer de 36 años, multípara, dos cesáreas anteriores. Primera cesárea (2002) por distocia de posición y fracaso por falta de descenso; recién nacido de 3650 g. La segunda cesárea (2011) fue por cesárea anterior y sospecha de macrosomia; recién nacido de 3750 g. Evoluciona con metrorragia intermitente durante 65 días, que no cede al tratamiento médico y con anemia progresiva (Hematocrito 25%, Hemoglobina 8,2 g/dL). El examen clínico confirma anemia, hipotensión, taquicardia, subinvolución uterina (18 cm de altura), con fondo a nivel umbilical, sensible, sangrado genital, en ausencia de signos de infección y gonadotropina coriónica <10 mU/L. Es hospitalizada con diagnósticos de metrorragia tardía del puerperio de cesárea y anemia secundaria. El examen con US revela lesión del fondo uterino, con estructuras anecoicas irregulares, que mide 45 x 35 x 48 mm, de localización intramural en todo el espesor (Figura 1), que al examen doppler reveló flujo de alta velocidad y baja resistencia. La angiorresonancia confirmó masa vascularizada, con extenso shunt arteriovenoso y paso rápido del contraste durante la fase arterial a la vena uterina contralateral (Figura 2). Dada la extensión de la lesión observada en la resonancia que alcanzó el límite externo miometrial con riesgo de rotura y hemoperitoneo pre o intraoperatorio, se decidió un tratamiento quirúrgico combinado con embolización previa y luego histerectomía con intervalo de 24 horas. Se efectúa cateterización bilateral de arterias ilíacas internas y luego supraselectiva de uterinas embolizando con partículas de PVA y Gelfoam, logrando la oclusión vascular y supresión de flujo arterial. Al día siguiente en la laparotomía se confirma subinvolución, congestión del fondo y consistencia normal del útero. Se efectuó histerectomía subtotal expedita, sin complicaciones y egreso a los cuatro días. En la Figura 3 se observa un corte sagital del útero con la imagen macrocópica de la malformación vascular, de crecimiento exofítico y que se extiende en todo el espesor miometrial, desde la cavidad hasta 2 mm de la serosa. Su representación microscópica se observa en la Figura 4 y se comenta en la discusión.
CASO CLINICO 2
Mujer de 39 años, sin hijos, que cursando semana 5 de gestación, presenta metrorragia. La ecografía es compatible con restos de aborto, subunidad beta de 234 mUI/ml, anemia moderada (Hematocrito 29%, Hemoglobina 10,1 g/dL). Al iniciar el legrado uterino presenta metrorragia copiosa que determina suspensión del procedimiento y se controla con la insuflación de un balón Foley intrauterino. Al US se observó lesión ístmica, heterogénea (Figura 5), de 61 x 37 x 41 mm, muy vascularizada, con flujos de alta velocidad y baja resistencia. La angiografía demostró lesión vascular característica con arteria uterina derecha muy gruesa (mayor que la ilíaca) (Figura 6). Es sometida a embolización obteniéndose reducción del 70% del flujo (Figura 7), evolucionando con cese del sangrado, sin requerir raspado uterino y alta a los dos días.
CASO CLINICO 3
Mujer de 37 años, gesta 4, para 2 (dos cesáreas anteriores) y dos abortos, con el último complicado por metrorragia intermitente durante 60 días. El examen clínico muestra una lesión palpable parauterina derecha, confirmada con RNM. Se efectuó laparotomía vaciándose un hematoma pelviano. Posteriormente continua con metrorragia durante 15 días (Hematocrito 27%, Hemoglobina 8,8 g/dL) y por un examen con US sospechoso de aneurisma es derivada a nuestro servicio. Al examen US doppler se observó lesión heterogénea, irregular, vascularizada con flujo de alta velocidad y baja resistencia (Figura 8) y la angiografía muestra lesión de arteria uterina derecha, con llene venoso rápido contralateral (Figura 9). Se efectuó cateterización selectiva bilateral de arterias ilíacas internas, cateterización supraselectiva de arterias uterinas y embolización, logrando adecuada estasia vascular, con buena tolerancia, cese del sangrado y alta a los tres días (Figura 10).
DISCUSIÓN
En el primer caso la sospecha se planteó por metrorragia persistente con imágenes sugerentes de MVU, sin otras causas como retención de restos placentarios, infección, tumor trofoblástico del sitio placentario, várices pelvianas ni otras lesiones uterinas (mioma, adenomiosis, hemangioma, sarcoma). El examen macroscópico confirmó una gran lesión vascular intramiometrial y la histopatología demostró neoformación de vasos sanguíneos con pared de diferente calibre y grosor, expandida en la pared miometrial hasta 2 mm de la serosa, con lumen ocupado por trombos ocasionales, gelita embolizante y endotelio normotípico. Su significado es el de una malformación congénita por angiogénesis aberrante, no adquirida, y objetivó retrospectivamente el riesgo de rotura vascular espontánea por su extensión hasta la serosa, indicando que la embolización preoperatoria fue una decisión de seguridad adecuada. En el endometrio adyacente se observaron vellosidades coriales fibrosas, con calcificación acentuada, de aspecto involutivo, sin signos de proliferación trofoblástica. El estroma fue fusoceluar, normotípico y sin signos inflamatorios. El diagnóstico diferencial más común es con la subinvolución del lecho placentario posparto o falla en el cierre de los vasos del lecho en ausencia de restos (13). Esta es una anormalidad adquirida transitoria que evoluciona con hemorragia tardía posparto, mayor riesgo de sangrado en el raspado uterino y con imágenes miometriales similares, pero de bajo flujo y se les ha denominado malformaciones no arterio-venosas, pero la biopsia excluyó esta lesión.
En el segundo caso la naturaleza de la lesión es similar y no adquirida ya que no había antecedentes obstétricos etiopatogénicos previos y en la última paciente la historia obstétrica con numerosos procedimientos sobre el útero es sugerente de malformación vascular adquirida; ambos casos no tuvieron biopsia porque no hubo histerectomía.
El manejo depende de la hemorragia, la estabilidad hemodinámica materna y la magnitud de la anemia, requiriendo evaluación inmediata e indicación apropiada. La latencia diagnóstica en los tres casos predispuso a una anemia progresiva, sin embargo se observaron diferencias individuales. En la primera paciente, con sangrado activo moderado, anemia secundaria y hemodinamia estable, se efectuó evaluación imagenológica rápida, y conocido el diagnóstico se privilegió el tratamiento quirúrgico con embolización protectora, previa a la histerectomía dada la extensión angiográfica de la malformación, objetivo logrado ya que no fue necesario transfundir (Hematocrito 29%, Hemoglobina 9,2 g/dL en postoperatorio inmediato) y la cirugía fue bien tolerada.
La segunda paciente, con diagnóstico de restos de aborto, al inicio del raspado uterino (primera entrada de la cucharilla) se produjo un sangrado hiperagudo pulsátil (origen arterial) que impidió el procedimiento por lo que se utilizó de inmediato un balón de taponamiento intrauterino con sonda Foley. Este método, de bajo costo y uso sencillo, se basa en que el taponamiento por distensión crea una presión intrauterina mayor que la del sistema arterial, estimula la contracción miometrial y tapona los vasos abiertos cesando el sangrado. Esto permite conservar el útero y prevenir una coagulopatía de consumo (14). Un inconveniente es que puede ocurrir sangrado sobre el balón si este no llena completamente la cavidad; el balón puede mantenerse 24 a 48 horas, con antibióticos asociados y luego deflación gradual. En el caso, la insuflación mantenida, favorecida por el menor tamaño uterino, permitió el control de la hemorragia, facilitó el estudio con angiografía las horas siguientes y luego la embolización definitiva evitando el raspado uterino. El uso exitoso del balón Foley está descrito en dos casos de malformación vascular uterina (4,15). Se han utilizado otros balones con el mismo propósito (de Sengstaken- Blakemore, de Bakri, de Rüsh) con resultado satisfactorio en el 87 y 88% de los casos (16,17). En el tercer caso, con diagnóstico tardío después de raspado y laparotomía, fue derivada a nuestro Centro y el diagnóstico se confirmó con angiografía procediéndose a la embolización que fue exitosa.
El otro factor determinante del manejo es la preservación de la fertilidad privilegiándose actualmente la embolización arterial por sobre la histerectomía.
En el primer caso la paciente consideró cumplida su paridad, lo que definió el tratamiento quirúrgico con embolización preoperatoria e histerectomía. En la segunda paciente, sin paridad y de 39 años y en la tercera paciente con un hijo y 37 años, se prefirió un manejo conservador con la embolización como tratamiento curativo. Por sus buenos resultados esta técnica ha sido propuesta de elección en la hemorragia posparto antes de una intervención quirúrgica y actualmente es un procedimiento común que permite conservar útero y anexos.
El éxito de la embolización se mide por la desaparición de los síntomas y la regresión en las imágenes, tiene la ventaja de evitar un raspado uterino desencadenante de hemorragia masiva y puede utilizarse en pacientes que no aceptan transfusión.
Se han comunicado los primeros casos de embarazo exitoso postembolización (10,18) sin embargo dado el número de casos efectuados aún no hay certeza de sus riesgos en gestaciones futuras, siendo probable la hipovascularidad con restricción fetal, la falla de placentación, la prematurez y la inercia uterina.
También se han informado fracasos y recidivas (19) que han requerido repetición del procedimiento o el uso de técnicas complementarias. Son explicables por falla en reconocer y embolizar la verdadera arteria alimentadora de la malformación vascular, por embolización unilateral con reperfusión posterior desde la arteria contralateral y por un error en la apreciación de la extensión y compromiso de órganos vecinos por la malformación. Aún con estas reservas se han comunicado cifras del 75 al 100% de éxito en el control de la hemorragia con el procedimiento (20-22).
En nuestras tres pacientes la embolización fue exitosa en suprimir el sangrado, tratar la lesión primaria y no hubo complicaciones. Con la mayor experiencia del operador, la cateterización vascular más selectiva, la renovación del material de embolización, la mejor interpretación previa de las imágenes y el trabajo multidisciplinario integrado con casos accediendo oportunamente a centros de referencia con radiología intervencional, los resultados han sido progresivamente mejores.
CONCLUSION
1. Se confirmó una malformación vascular uterina en tres casos clínicos como causa de hemorragia obstétrica. 2. La sospecha clínica asociada a los métodos de ultrasonido, resonancia y angiografía fueron indispensables para el diagnóstico. 3. La embolización selectiva fue una terapia exitosa en los tres casos. 4. El tratamiento adecuado se debe adaptar al caso individual. 5. El manejo eficaz debe ser multidisciplinario.
BIBLIOGRAFÍA
1. Ghai S, Rajan DK, Asch MR, Muradali D, Simons ME, TerBrugge KG. Eficaccy of embolization in traumatic uterine vascular malformation. J Vasc Interv Radiol 2003;14:1401-8.
2. Hickey M, Fraser IS. Clinical implications of disturbances of uterine vascular morphlogy and function. Ballieres Clin Obstet Gynaecol 2000;14:937-51.
3. Aziz N, Lenzi T, Brooke Jefrey Jr R, Lyell DJ. Postpartum uterine arteriovenous fistula. Obstet Gynecol 2004;103:1076-8.
4. Manolistas T, Hurley V, Gilford E. Uterine arteriovenous malformation- a rare cause of uterine hemorrhage. Aust New Zeland J Obstet Gynaecol 1994;34:197-9.
5. Müngen E. Vascular abnormalities of the uterus: have we recently over-diagnosed them? Ultrasound Obstet Gynecol 2003;21:529-31.
6. Itoh H, Keitoku M, Masatsune F, Sagawa N, Mori T, Togashi K. Spontaneous resolution of a postcesarean arteriovenous fistula of the uterine cervix: the usefulness of transvaginal color doppler scanning. J Obstet Gynecol 1997;23:439-44.
7. Grivell R, Reid KM, Mellor A. Uterine arteriovenous malformations: a review of the current literature. Obstet Gynecol Survey 2005;60:761-7.
8. Musa A, Hata T, Hata T, Hata K, Kitao M. Pelvic arteriovenous malformation diagnosed by color flow doppler imaging. AJR Am J Roent 1989;153:1311-2.
9. Timmerman D, Van den Bosch T, Peeraer K, Debrouwere E, Van Schubroeck D, Stockx L, et al. Vascular malformations in the uterus: ultrasonographic diagnosis and conservative management. Eur J Obstet Gynecol Reprod Biol 2000;92:171-8.
10. Maleux G, Timmerman D, Heye S, Wilms G. Acquired uterine vascular malformations: radiological and clinical outcome after transcatheter embolotherapy. Eur Radiol 2006;16:299-306.
11. Lee BB, Do YS, Yakes W, Kim DI, Mattassi R, Hyon WS. Management of arteriovenous malformations: a multidisciplinary approach. J Vasc Surg 2004;39:590-600.
12. Kim JY, Kim DI, Do YS, Lee BB, Kim YW, Shin SW, et al. Surgical treatment for congenital arteriovenous malformation: 10 years’ experience. Eur J Vasc Endovasc Surg 2006;32:101-6.
13. Khong TY, Chin MS. Subinvolution of the placental bed after molar pregnancy. J Reprod Med 1996;41 :352-4.
14. De Loor JA, van Dam PA. Foley catheters for uncontrolable obstetric or gynecologic hemorrhage. Obstet Gynecol 1996;88:737.
15. Ghosh TK. Arteriovenous malformation of the uterus. Obstet Gynecol 1986;68:40S-43S.
16. Condous GS, Arulkurmaran S, Symonds I, Chapman R, Sinha A, Razvi K. The “tamponade test” in the management of massive postpartum hemorrhage. Obstet Gynecol 2003;101:767-72.
17. Seror J, AlloucheC, Elhaik S. Use of Sengstaken–Blakemore tube in massive postpartum hemorrhage: a series of 17 cases. Acta Obstet Gynecol Scand 2005:84:660-4.
18. Goldberg J, Pereira L, Berghella V. Pregnancy after uterine artery embolization. Obstet Gynecol 2002;100:869-72.
19. Takeuchi K, Yamada T, Iwasa M, Maruo T. Successful medical treatment with danazol after failed embolization of uterine arteriovenous malformation. Obstet Gynecol 2003;102:843-4.
20. Ojala K, Perala J, Kariniemi J, Ranta P, Raudaskoski T, Tekay A. Arterial embolization and prophylactic catheterization for the treatment for severe obstetric hemorrhage. Acta Obstet Gynecol Scand 2005;84:1075-80.
21. Vedantham S, Goodwin SC, McLucas B, Mohr G. Uterine embolization: an underused method of controlling pelvic hemorrhage. Am J Obstet Gynecol 1997;176:938-48.
22. Pelage J, Sorer P, Repiquet D, Herbreteau D, LeDref O, Houdart E, et al. Secondary postpartum haemorrhage: treatment with selective arterial embolization. Radiology 1999;212:385-9.