2006
3
Autores:
Ernesto Perucca P.1, Eduardo Cuellar J.1, Paolo Ricci A.1, Roberto Altamirano A.1, Carlos Cuadra C.1, David Sáez M.2, Rodrigo Carvajal G.1, Isabel Galleguillos F.a, Muschi Szigethi Q.a, Sergio Álvarez V.a, Norman Agurto R.a, Jessica Zamora F.a
Instituciones:
1Servicio de Obstetricia y Ginecología y Neonatología, Hospital Barros Luco-Trudeau, Universidad de Chile, 2Servicio de Neurología, Hospital Barros Luco-Trudeau, Universidad de Chile.
aInterno(a), Facultad de Medicina, Universidad de Chile.
Tipo de documento:
Casos ClínicosMiastenia gravis. Embarazo e impacto perinatal
Contenido del documento:
INTRODUCCIÓN
Miastenia gravis (MG) es una enfermedad de la placa motora del músculo estriado, caracterizada por fatigabilidad fluctuante de algunos grupos musculares. Es causada por autoanticuerpos que están dirigidos contra el receptor colinérgico de los músculos esqueléticos (1), los que pueden ser detectados en 85% de los casos (2,3).
La prevalencia de la enfermedad es de 2-10 por 100.000 habitantes, sin embargo hay que considerar que 65 a 70% de los casos ocurre en mujeres, siendo particularmente frecuente en mujeres jóvenes en edad fértil (1,2).
En embarazadas con MG, se puede presentar miastenia neonatal transitoria en 12 a 20% de los recién nacidos (4,5). Recientemente se ha comunicado que la MG está asociada con un incremento de las complicaciones durante el nacimiento, existiendo mayor riesgo de parto prematuro, rotura prematura de membranas, mayor posibilidad de intervenciones y de morbimortalidad perinatal (5).
Por otra parte, la influencia del embarazo sobre la miastenia es impredecible, Osserman y observaron que en un tercio de los casos se producía una exacerbación, en otro tercio no se producen cambios, y en el tercio restante se produce mejoría, situación que ha sido confirmada por otros autores (7). Los efectos de cada embarazo en una misma mujer con miastenia pueden ser diferentes de uno a otro, y la interrupción del embarazo no altera el curso de la recaída.
Nuestro grupo publicó en 1985 los tres primeros casos (8), posteriormente en 1989 se amplió la experiencia (9). El objetivo de esta comunicación es analizar los resultados maternos y perinatales de 19 partos ocurridos en 9 pacientes portadoras de MG.
PACIENTES Y MÉTODOS
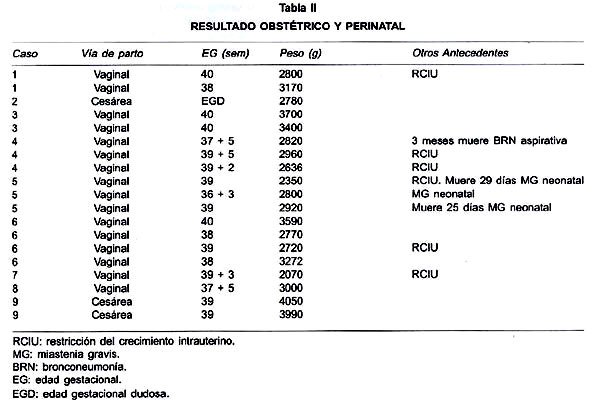
Se revisaron el total de embarazos ocurridos en pacientes con MG atendidas en el Servicio de Obstetricia y Ginecología del Hospital Barros Luco-Trudeau, desde enero de 1983 a marzo de 2004, sin considerar los embarazos previos al diagnóstico de la enfermedad. En este período hubo 9 pacientes portadoras de MG que tuvieron un total de 19 partos. Se describen a continuación todos los casos clínicos en forma resumida y se comenta nuestra casuística con dos tablas que resumen nuestra experiencia (Tablas I y II).
CASOS CLÍNICOS
Caso 1: Paciente a los 13 años de edad inicia en forma progresiva una MG tipo IIb. Timectomizada a los 15 años por hiperplasia tímica. Se obtiene importante remisión, con reducción de los requerimientos de neostigmina para desarrollar sus actividades diarias. A los 19 años, se embaraza por primera vez, cursa normalmente el primer y segundo trimestre de gestación, presentándose en el tercer trimestre una severa descompensación, coincidente al uso de gentamicina por un cuadro infeccioso urinario. Completa su gestación de 40 semanas e inicia trabajo de parto vaginal espontáneo sin complicaciones. No presentó deterioro de su condición durante el puerperio. Recién nacido, femenino, 2.800 g, Apgar 9-10. Desarrolló ictericia disenzimática tratada con fototerapia, sin manifestaciones de MG neonatal. La paciente mantiene terapia con neostigmina oral 15mg cada 8 horas.
En su segundo embarazo a las 21 semanas se hospitaliza por cuadro de pielonefritis aguda tratada con cefradina, sin descompensación miasténica. Inicia parto espontáneo a las 38 semanas, con estudio de unidad feto-placentaria normal. El período de dilatación duró 9 horas 25 minutos. Se aplicó anestesia local para realizar perineotomía. Puerperio sin incidentes. Recién nacido de 3.170 g, Apgar 9-9, evolucionó con ictericia disenzimática, sin MG neonatal.
Caso 2: Paciente que a los 26 años de edad inicia cuadro de MG tipo IIb. Sometida a radioterapia tímica y manejada con neostigmina en dosis habituales. De sus antecedentes obstétricos destacan un primer parto a los 24 años con aplicación de fórceps. Recién nacido vivo, femenino, de 1.800 g. Segundo parto vaginal a los 25 años con polihidroamnios y mortineonato de 2.000 g. A los 33 años portando ya MG, presenta su tercera gestación, evolucionando sin descompensación durante el proceso grávido puerperal. Presenta embarazo de edad gestacional dudosa, pero por parámetros de laboratorio de madurez fetal y condiciones obstétricas desfavorables, se decide operación cesárea y esterilización tubaria. Recién nacido femenino, 2.780 g, Apgar 8-9, sin evidencias de MG neonatal.
Caso 3: Paciente que inicia a los 18 años de edad cuadro de MG tipo IIb, manejada con dosis habituales de neostigmina. Tiene 2 embarazos a los 25 y 27 años respectivamente, sin presentar agravaciones de su enfermedad. La evolución de ambos procesos gestacionales fue normal y culminaron con 2 partos vaginales espontáneos. El primer recién nacido tuvo un peso de 3.700 g y Apgar 9-9. El segundo pesó 3400 g y Apgar 9-9. Ambos de sexo femenino y ninguno presentó MG neonatal.
Caso 4: Paciente de 29 años, con antecedentes de MG diagnosticada a los 17 años. En tratamiento con neostigmina oral desde entonces, sin timectomía. El primer embarazo cursó en forma fisiológica, con recién nacido vivo, de término, 2.820 g, Apgar 9-9, que fallece a los 3 meses por bronconeumonía aspirativa. El segundo embarazo evoluciona fisiológicamente, sin exacerbación de su patología de base, con parto vaginal a las 39 semanas; recién nacido vivo, sano, de 2960 g. Último embarazo en 2002, que cursa sin descompensación de su enfermedad basal, aún en tratamiento con neostigmina oral; el estudio ecográfico mostró restricción del crecimiento intrauterino, con doppler y líquido amniótico normal; a las 39 semanas inicia parto vaginal espontáneo, con recién nacido de sexo femenino de 2.636 g, Apgar 9-9, sin evidencias de MG neonatal.
Caso 5: Paciente de 27 años, con antecedentes de MG grado IV. Desde los 16 años, en tratamiento con neostigmina en dosis máxima y prednisona 30 mg/día. Con antecedentes de plasmaféresis y neumonía que requirió ventilación mecánica. Además, portadora de trastorno depresivo mayor que motivó el abandono de los controles médicos. Dentro de sus antecedentes obstétricos destaca a los 24 años de edad un embarazo fisiológico con parto vaginal de recién nacido de término, con peso de 2.350 g, que fallece a los 29 días de vida con el diagnóstico de miastenia gravis neonatal.
A los 25 años cursando su segundo embarazo, presentó fatigabilidad facial de predominio vespertino, que se interpretó como exacerbación de la enfermedad, por lo que se administró prednisona 25 mg/día. Evolucionó favorablemente, terminando el embarazo a las 36 semanas con parto vaginal espontáneo. Recién nacido adecuado a edad gestacional, 2.800 g, Apgar 8-9. El recién nacido evolucionó en atención inmediata con crisis de cianosis, hipotonía e hipoactividad. Se conectó a ventilación mecánica y se inició terapia con neostigmina endovenosa. Evoluciona satisfactoriamente interpretándose el cuadro como MG neonatal transitoria.
A los 27 años cursa su último embarazo, con mal control prenatal (último a las 30 semanas). A las 39 semanas por parto vaginal espontáneo nace niño de 2.920 g, Apgar 8-9. Evoluciona a las pocas horas con hipotonía, sin actividad, con débiles movimientos respiratorios. Se administró neostigmina, a pesar de lo cual presentó paro cardiorrespiratorio que revirtió con drogas vasoactivas y ventilación mecánica. Fallece a los 25 días de vida con encefalopatía hipóxica isquémica grado 3 y sepsis intrahospitalaria.
Caso 6: Paciente de 25 años, con antecedentes de MG desde los 19 años. Timectomía a los 20 años, manejada con neostigmina oral. Con antecedentes obstétricos de salpingostomía izquierda por embarazo tubario a los 19 años y cuatro embarazos fisiológicos, sin exacerbación de la enfermedad. Éstos finalizaron en 4 partos vaginales espontáneos y dieron como producto recién nacidos de término, adecuados para la edad gestacional, Apgar 9-9. Todos los partos vaginales a las 40 semanas (3.590 g), 38 semanas (2.770 g), 39 semanas (2.720 g) y 38 semanas (3.272 g), todos sin miastenia neonatal. El último embarazo fue a los 25 años.
Caso 7: Primigesta de 20 años, MG iniciada a los 15 años, tratada con neostigmina oral. En remisión dos años previo al embarazo. Gestación de evolución fisiológica hasta las 36 semanas comenzando entonces cuadro hipertensivo moderado, sin alteraciones de los exámenes de laboratorio. Desde el punto de vista de su MG refiere presentar fatigabilidad vespertina, sin otra manifestación. El neurólogo indica manejo sin medicación y vigilar posible descompensación, pero la enferma permanece en remisión espontánea. Desde el punto de vista obstétrico el estudio seriado ultrasonográfico demostró restricción del crecimiento intrauterino. A las 39 semanas inició trabajo de parto espontáneo con período de dilatación de 9 horas, anestesia peridural con bupivacaína, sin incidentes. Parto vaginal espontáneo de recién nacido de 2.070 g, Apgar 9-9, 39 semanas, pequeño para la edad gestacional; cursó con hipoglicemia e ictericia disenzimática tratado con fototerapia y no presentó MG neonatal.
Caso 8: Paciente de 33 años con anexectomía en 1983 por embarazo tubario. En estudio de fertilidad se concluyó factor tubario. En espera de cirugía tubárica, se embaraza espontáneamente. A las 24 semanas de gestación presenta cuadro caracterizado por impotencia funcional transitoria de las extremidades inferiores, no consultando en esa ocasión. Estando hospitalizada por cuadro hipertensivo moderado, a las 36 semanas comienza con paraparesia proximal severa que le impide deambular, debilidad de ambas manos, marcada paresia del cuello, sin disfagia pero con diplopía transitoria. Se postula diagnóstico de MG comprobándose luego en la electromiografía un patrón miopático. Se inició tratamiento con neostigmina inyectable con respuesta favorable. Estudio de la unidad feto placentario concluye probable restricción del crecimiento intrauterino. Se induce el parto a las 37 semanas. El trabajo de parto duró 10 horas y el expulsivo 1 hora, aplicándose fórceps, con anestesia raquídea baja, sin incidentes. Puerperio normal. Recién nacido de 3.000 g, Apgar 8 -9, sin MG neonatal. Remisión espontánea en el posparto.
Caso 9: Paciente que en marzo de 1991 a los 18 años de edad, debuta con un cuadro de MG tratada con neostigmina 75 mg/día respondiendo parcialmente, presentando cuadros respiratorios con deterioro de la espirometría, por lo que se decide elevar la dosis de neostigmina a 90 mg/día. Se realizan 10 sesiones de plasmaféresis con buena respuesta bajando la dosis de neostigmina a 75 mg, se catalogó como MG tipo IIB. Mantiene tratamiento con neostigmina, presentando algunas exacerbaciones manejadas con adecuación de la dosis y plasmaféresis. En 1992 se realizó timectomía, describiéndose el timo con 2 formaciones nodulares. En 1994 en su primer parto se practica cesárea por macrosomía fetal, con anestesia raquídea. El recién nacido pesó 4.050 g, Apgar 9-9, durante la evolución de su embarazo se mantuvo con neostigmina, no recibió inmunosupresores ni corticoides, no hubo exacerbación de la enfermedad y el RN no presentó MG neonatal. Posparto se mantuvo con neostigmina 70 mg/día y en 2 ocasiones se utilizó plasmaféresis. En su segundo embarazo evolucionó sin exacerbación, con neostigmina oral. Parto en febrero de 1997 por cesárea, con recién nacido de 3.990 g, Apgar 9-9, sin MG neonatal. Actualmente cursa su tercer embarazo en el segundo trimestre de la gestación, con manejo multidisciplinario.
DISCUSIÓN
En esta serie no hubo muertes maternas, sin embargo hubo 2 muertes neonatales atribuibles a complicaciones de miastenia gravis neonatal (11%). En el grupo de pacientes miasténicas analizadas, se produjo exacerbación de la miastenia en dos casos y en un caso la enfermedad debutó durante el embarazo, lo que comparativamente es inferior a las series comentadas previamente (6,7). Una de las exacerbaciones se produjo por el uso de un aminoglucósido, antibióticos conocidamente contraindicados en esta enfermedad por su efecto bloqueador neuromuscular.
La timectomía utilizada como tratamiento de la MG, tiene un efecto positivo sobre las exacerbaciones durante el embarazo, las que son menos frecuentes en pacientes timectomizadas (2,10); con respecto a esto nuestra serie no permite conclusiones, debido a que sólo 3 pacientes estaban timectomizadas, todas fuera del periodo gestacional, si bien no existen contraindicaciones para este procedimiento durante el embarazo (11), se recomienda el uso previo de plasmaféresis.
El manejo médico de la MG no debiera tener cambios durante el embarazo. El tratamiento dependerá de la severidad del cuadro. Los inhibidores de la acetilcolinoesterasa, piridostigmina, neostigmina y edrofonio no cruzan la barrera placentaria, o es mínimo, por lo que tiene pocos efectos sobre el feto. La situación del edrofonio, que es usado como prueba diagnóstica, no es el pasaje placentario sino, su acción potente sobre la musculatura incluyendo la estimulación sobre el músculo uterino. Ajustes de dosis durante la gestación deben ser hechos más bien como consecuencia de la presencia de efectos secundarios como náuseas, vómitos, expansión del volumen plasmático, alteración de la absorción gastrointestinal e incremento en el clearence renal (2).
Los corticoesteroides, una de las primeras líneas de tratamiento inmunosupresor, pueden durante el embarazo inducir ganancia excesiva de peso, alteraciones psiquiátricas desde leves cambios de humor hasta psicosis y alteraciones de la glicemia que incluyen la diabetes esteroidal. Salvo la existencia de un incremento leve en la incidencia de labio leporino y paladar hendido, las tasas de otras anomalías en el feto son similares a la población general (2,12). Debiera tenerse en cuenta el uso de una dosis extra de corticoides durante el trabajo de parto en pacientes sometidas a terapia esteroidal crónica, debido a la supresión del eje hipotálamo-hipófisis-suprarrenal, con el fin de evitar el riesgo de una crisis addisoniana. Otros inmunosupresores como la azatioprina, tiene un claro efecto teratogénico, además de inhibir el desarrollo de la placenta y del embrión, efecto relacionado a dosis (13), por lo que sólo debieran reservarse para pacientes en que la gravedad de su condición y falla en respuesta a otras terapias ameriten su uso. En nuestra serie en ningún caso se usó azatioprina, sólo se trataron con anticolinesterásicos y corticoides.
Otra opción terapéutica es la plasmaféresis, que se utiliza en pacientes en crisis miasténica o como preparación a procedimientos quirúrgicos; como procedimiento transitorio, debe acompañarse de agentes inmunosupresores para mantener los efectos del procedimiento. Durante el embarazo su realización es segura, no se uso plasmaféresis en ninguna de nuestras pacientes.
En la serie no hubo anomalías congénitas, pero se han descrito en madres que reciben corticoides u otros inmunosupresores, estas incluyen hipognatia, polidactilia e hipogammaglobulinemia (2). La posible inmovilización fetal prolongada incluye dimorfismo craneofacial, múltiples anquilosis, hipoplasia pulmonar y retardo de crecimiento intrauterino (2,14,15). En nuestros casos, hubo 6 neonatos con retardo de crecimiento intrauterino (35%).
La MG afecta al 10-20% de los recién nacidos. Los síntomas se producen desde pocas horas a varios días después del nacimiento y pueden persistir hasta por tres meses, sin embargo el 80% presenta el cuadro en los primeros días (2,5), Si bien el recién nacido que a la semana no ha presentado signos de MG, puede ser dado de alta, pero hay que mantenerlo en observación más allá del periodo neonatal. En nuestra serie hubo tres MG neonatal que ocurrieron en una misma paciente, dos de estos RN fallecieron. No existe correlación entre la severidad de la MG materna, los niveles de anticuerpos antirreceptor y la ocurrencia de MG neonatal, pero es evidente que las pacientes que han tenido hijos con MG neonatal transitoria, incrementan el riesgo de reaparición del mismo síndrome. Parece razonable el evitar la lactancia en presencia de exacerbación post parto de la MG materna, o presencia de altos títulos de anticuerpos ya que estos pasan al niño a través de la leche materna, mientras que los anticolinesterásicos no lo hacen (16).
Con respecto a la vía de resolución del parto, hubo tres cesáreas cuyas indicaciones fueron obstétricas, éstas deben reservarse solo por problemas obstétricos, ya que el trabajo de parto no se ve alterado por la enfermedad. Algunos autores recomiendan el uso de fórceps en la etapa final, con el fin de reducir la fatiga materna.
Entre otras consideraciones en pacientes con MG, no existe contraindicación para el uso de anestesia regional, la que es segura para el parto vaginal y cesárea. Desde el punto de vista clínico es de utilidad aconsejar a la gestante en el control de los movimientos fetales, además consideramos que los estudios ultrasonográficos deben ser más frecuentes, como elemento para evaluar signos de akinesia fetal, como ser la disminución de movimientos respiratorios y la presencia de hidroamnios, secundario a hipoplasia pulmonar atribuida a la acción de anticuerpos antirreceptor sobre el diafragma fetal causando así su debilidad (14,15).
Hay que tener presente que deben evitarse algunos medicamentos como los ya mencionados aminoglucósidos, pero además hay que consignar a los bloqueadores neuromusculares, el sulfato de magnesio, quinina y quinidina, grandes cantidades de procainamida y benzodiacepinas.
Para nuestro grupo resulta importante presentar esta casuística retrospectiva en un largo periodo de tiempo, ya que permitirá tener la suficiente cautela en estos pacientes y así aminorar los riesgos perinatales. El manejo del embarazo y parto en la MG debe hacerse en forma multidisciplinaria, con el concurso de un neurólogo que evalúe a la paciente y vaya definiendo en cada momento la terapia más apropiada.
BIBLIOGRAFÍA
- Bender AN, Ringel SP, Engel WK, Daniels MP, Vogel Z. Myasthenia gravis. A serum factor blocking acetylcholine receptors of human neuromuscular junction. Lancet 1975;1(7907):607-9.
- Daskalakis GJ, Papageorgiou IS, Petrogiannis N, Anatsaklis AJ, Michalas SK. Myasthenia gravis and pregnancy. Eur J Obstet Gynecol Reprod Biol 2000; 89(2):201-4.
- Battochi AP, Majolini L, Evoli A, Lino MM, Minisci C, Tonali P. Course and treatment of myasthenia gravis during pregnancy. Neurology 1999;52(3):447-52.
- Vincent A, McConville J, Farrugia ME, Bowen J, Plested P, Tang T, et al. Antibodies in myasthenia gravis and related disorders. Ann NY Acad Sci 2003; 998:324-35.
- Djelmis J, Sotorko M, Moyer D, Ivanisevic M. Myasthenia gravis in pregnancy: report on 69 cases. Eur J Obstet Gynecol Reprod Biol 2002;104:21-5.
- Osserman KE, Genkins G. Studies in myasthenia gravis: reduction in mortality rate after crisis. JAMA 1963;183:97-101.
- Plauche WC: Myasthenia gravis in pregnancy: An update. Am J Obstet Gynecol 1979;135:691-3
- Caballero L. Mistenia gravis y embarazo. Consideraciones neurológicas, obstétricas y neonatales. Presentación de 3 casos clínicos. Bol Hosp SJ Dios 1985;32:3-5.
- Perucca E, Cazenave H, Yurac C, Aguirre R, Olivares M. Manejo obstétrico y perinatal en miastenia gravis. Rev Chil Obstet Ginecol 1989;54:348-51.
- Edén RD, Gall SA. Myasthenia gravis and pregnancy: a reappraisal of thimectomy. Obstet Ginecol 1983;62:328-33
- Ip MS, So SY, Lam WK, Tang LC, Mok CK. Thimectomy in myastenia gravis during pregnancy. Post Med J 1986;62(728):473-4.
- Sidhu RK, Hawkins DF. Corticosteroids. Clin Obstet Gynecol 1981;8:383-404
- Williamson RA, Karp LE. Azathioprine teratogenicity: review of the literature and case report. Obstet Gynecol 1981;58:247-50.
- Rowland JM, Henrickx AG. Corticosteroids teratogenicity. Adv Vet Sci Comp Med 1983;27:99-128.
- Pena SDJ, Shokeir MHK. Syndrome of camptodactylity, multiple ankylosis, facial anomalies and pulmonary hypoplasia: a lethal condition. J Pediatr 1974; 85:373-4.
- Brueton L, Huson S, Cox PM, Shirley I, Thompson EM, et al. Asymptomatic maternal myasthenia as a cause of the Pena-Shokeir phenotype. Am J Med Genetics 2000;92(1):1-6.