2006
6
Autores:
Paolo Ricci A.1, Adolfo Cruz C.2, Mario Rodríguez P.2, Héctor Sepúlveda M.3, Isabel Galleguillos F.2, Francisco Rojas Z.2, Verónica Peña M.2, Rodrigo Carvajal G.2, María Bravo M.2, Rodrigo Castillo I.2, Claudia Núñez P.a
Instituciones:
1Servicio de Ginecología, Hospital Barros Luco-Trudeau, 2Servicio de Cirugía, Hospital Barros Luco-Trudeau, 3Servicio de Ginecología y Servicio de Cirugía, Hospital Barros Luco-Trudeau.
aAlumno(a) de Medicina, Universidad de Chile.
Tipo de documento:
Trabajos OriginalesMicrocalcificaciones Birads 4
Contenido del documento:
INTRODUCCIÓN
El cáncer de mama es la patología oncológica más frecuente en la mujer occidental y la principal causa de muerte por cáncer femenino en Europa, Estados Unidos, Australia y ciertos países de América Latina. Su incidencia anual se estima en 700.000 nuevos casos, de los cuales fallecen alrededor de 300.000 (1).
En Chile el cáncer de mama es la primera causa de muerte oncológica en la mujer, con una tasa de mortalidad de 13,4/100.000 mujeres (2), seguido por el cáncer de estómago (13,3/100.000) y el de vesícula biliar (13/100.000). En este contexto, adquiere especial importancia el estudio de las lesiones no palpables de mama y su probable asociación con cáncer (3-5), destacando las microcalcificaciones (depósitos de calcio menores de 1 milímetro de diámetro mayor), donde la mamografía constituye la principal herramienta diagnóstica. Éstas, a diferencia de las lesiones palpables, tienen un comportamiento menos agresivo, existiendo un mayor porcentaje de carcinomas in situ y una menor invasión a ganglios linfáticos, con una mayor tasa de sobrevida (6). El mayor porcentaje de las microcalcificaciones clasificadas como BIRADS 4, corresponde a lesiones benignas (7,8).
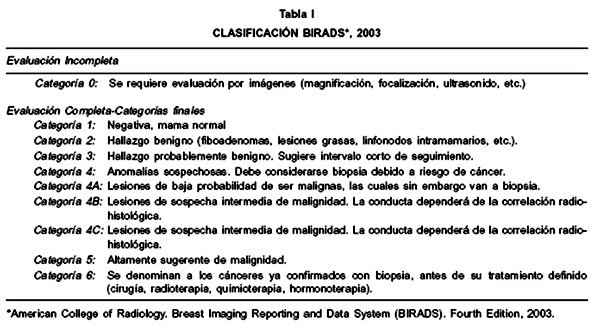
El sistema BIRADS (Breast Imaging Reporting and Data System) fue publicado por el American College of Radiology en un esfuerzo por estandarizar los informes de las mamografías (9). Se trata de un sistema que se ha actualizado en 4 ediciones (1993, 1996, 1998 y 2003). La última edición agrega la categoría BIRADS 6, y subdivide al grupo 4 en tres subgrupos (4A, 4B y 4C), lo que deberá tenerse presente en futuras revisiones (Tabla I) (10).
Los avances de la técnica de imágenes, especialmente en mamografía y ultrasonografía mamaria, han mejorado la pesquisa de lesiones en etapa subclínica, favoreciendo el diagnóstico precoz del cáncer de mama (9).
Con el objetivo de conocer la asociación y significado, tanto clínico como histológico de la presencia de microcalcificaciones BIRADS 4, se realizó un estudio retrospectivo recopilando la experiencia de 12 años la Unidad de Patología Mamaria del Hospital Barros Luco-Trudeau.
MATERIAL Y MÉTODO
Se analizó retrospectivamente un universo de 204 pacientes, con edad mediana de 52 años, portadoras de microcalcificaciones clasificadas como BIRADS 4, estudiadas por el Comité de Patología Mamaria y sometidas a cirugía, en la Unidad de Patología Mamaria (UPM), Servicio de Cirugía, Hospital Barros Luco Trudeau, entre enero de 1993 y diciembre de 2004.
Con el fin de asegurar la unificación de criterios y su estricto apego a la clasificación BIRADS, entre 1993 y 1997 las placas mamográficas se realizaron sólo en dos servicios externos y fueron revisadas por el comité de la UPM.
Entre los años 1993 y 1997 ingresaron 67 pacientes, gran parte de ellos se concentró en los 2 últimos años de este período. Adquirido el mamógrafo de la UPM, hubo un aumento progresivo del ingreso de pacientes por año.
La localización de las microcalcificaciones se demostró por mamografía en todos los casos. En 73 de ellos (36%) en que la presencia de un tumor en la mamografía no era claro, se consideró necesario efectuar además ultrasonografía. De éstos, 22 estaban dentro de límites normales, 34 tenían quistes de aspecto benigno uni o bilaterales y 17 presentaban tumores sólidos, definidos todos como patología benigna, por citología efectuada por payec.
Todas las pacientes ingresaron a pabellón marcadas radioquirúrgicamente con arpón metálico localizado en la zona de las microcalcificaciones y se les realizó mastectomía parcial. A todas las muestras quirúrgicas se les realizó un control radiológico para comprobar la presencia de microcalcificaciones.
RESULTADOS
La localización más frecuente de las microcalcificaciones BIRADS 4 fue la mama izquierda con el 52% (106 casos), la mama derecha 42% (85 casos), y ambas 6% (13 casos).
En 5 casos hubo dos cuadrantes afectados al mismo tiempo de mama izquierda, y en 3 casos dos cuadrantes de mama derecha.
En la mama izquierda el cuadrante superior externo presentó el 53% de las microcalcificaciones, seguido por 14% unión de cuadrantes superiores, 9% unión de cuadrantes inferiores, 7% cuadrante superior interno, 6% retroareolar, 6% unión de cuadrantes externos, 3% cuadrante inferior externo, y 2% cuadrante inferior interno.
En la mama derecha el cuadrante superior externo presentó el 53% de las microcalcificaciones, 10% unión de cuadrantes superiores, 10% retroareolar, 8% cuadrante inferior interno, 7% cuadrante superior interno, 4% unión de cuadrantes externos, 4% unión de cuadrantes internos, y 4% cuadrante inferior externo.
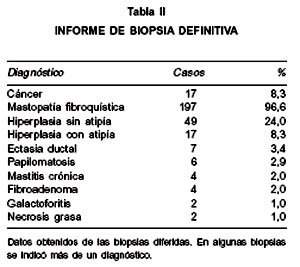
Se realizó biopsia rápida en 189 casos (92,6%). Se informaron 8 (4,2%) como positivas para cáncer mamario, lo que fue corroborado por la biopsia lenta. Al analizar la biopsia diferida lenta, realizada en todos los casos, destacan 17 casos con cáncer mamario (8,3%), condición fibroquística 197 casos (96,6%), hiperplasia sin atipía 49 casos (24%), hiperplasia con atipía 17 (8,3%), ectasia ductal 7 (3,4%), papilomatosis 6 (2,9%), mastitis crónica 4 (2%), fibroadenoma 4 (2%), galactoforitis 2 (1%) y necrosis grasa 2 (1%) (Tabla II).
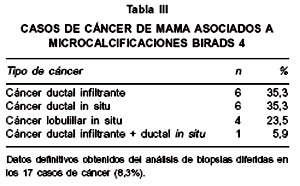
Al analizar las biopsias de los 17 casos de cáncer, 6 (35,3%) correspondían a ductal infiltrante, 6 (35,3%) a ductal in situ, 4 (23,5%) a lobulillar in situ, y 1 (5,9%) a ductal infiltrante asociado a ductal in situ (Tabla III).
Noventa (44%) pacientes permanecen en control actualmente en la unidad, incluidos los 17 casos a los que se detectó cáncer. El promedio de controles ambulatorios postoperatorios para las pacientes dadas de alta fue de 4, con una mediana de 2. Doce casos presentaron nuevas microcalcificaciones BIRADS 4.
DISCUSIÓN
En 1984, Le Gals divide las microcalcificaciones en 5 tipos, determinando porcentajes de malignidad para cada caso (11-13) (Tabla IV). Se asocian con mayor frecuencia a cáncer las microcalcificaciones descritas de forma vermicular, distribución lineal o en ramas de árbol sin hojas, y las de tamaño irregulares (13) (Tabla V). Según de Lafontan (14) las características que son estadísticamente significativas para sospecha de cáncer son ocho: 1) Número de microcalcificaciones por cm2; 2) Diámetro medio de las microcalcificaciones; 3) Número total de microcalcificaciones; 4) Irregularidad en la densidad de las microcalcificaciones; 5) Irregularidad en los tamaños; 6) Formas lineales o ramificadas; 7) Alta densidad; 8) Calcificaciones vermiculares.
Otro dato que debemos conocer es el publicado por Nishimura y cols en 2004. En pacientes con cáncer asociado a microcalcificaciones, el riesgo de invasión es sólo del 10% en las puntiformes regulares que ocupan una superficie menor o igual a 10 milímetros. En cambio las pleomórficas que ocupan más de 10 milímetros, presentan invasión en el 37% de los casos (15). El estudio mamográfico de las calcificaciones según Stomper y cols, puede predecir la presencia de invasión en más del 45%, y ausencia de invasión en más del 90% de los casos.
El estudio de las microcalcificaciones en nuestro hospital se realiza principalmente por medio de la mamografía, asociando placas focalizadas y magnificadas, constituyendo el método diagnóstico principal, y su informe se enmarca en la clasificación de BIRADS. Sin embargo, se describen otros métodos como el ultrasonido, que requiere transductores de 10 a 13 mhZ, pero que tienen la desventaja de no permitir realizar una correcta evaluación en la profundidad del parénquima mamario; recurso que se utiliza más bien para realizar biopsias core bajo visión ultrasonográfica (17-21). Otros estudios se pueden realizar con resonancia nuclear magnética, sin embargo una limitante es el alto costo (22).
La mamografía digital constituye una técnica computarizada que es capaz de retirar los artefactos de la mamografía convencional, constituyendo un buen método para aislar las microcalcificaciones y así analizarlas con mayor facilidad (23-27).
La mamografía convencional es el examen de imageneología más usado en el estudio de mamas. En nuestra casuística, la mamografía de rutina fue un hallazgo en la mayoría de las pacientes ingresadas con microcalcificaciones BIRADS 4. Por estas razones los centros que realizan estos exámenes, deben entregar informes que contengan la clasificación de BIRADS, además de señalar la urgencia que dicha paciente sea evaluada por un especialista.
La importancia de buscar y diagnosticar las microcalcificaciones BIRADS 4, queda expresada en su asociación a procesos neoplásicos. En nuestra experiencia, se presentó malignidad en el 8,3% de las pacientes con microcalcificaciones BIRADS 4, resultado inferior a otras publicaciones nacionales e internacionales, que señalan cifras entre el 12 y 30% (8,28-30). Sin embargo, no debemos olvidar que también registramos asociación a lesiones de alto grado, que requieren a los menos seguimientos especiales.
Las microcalcificaciones motivan el 50% de las biopsias, debido a la existencia de lesiones no palpables (31). En nuestro hospital, el estudio histológico de las microcalcificaciones, se realiza por biopsia radioquirúrgica a través de mastectomías parciales. Para ello se realiza una marcación preoperatoria con agujas como las de Kopans, Homer o Bard, lo que permite señalar la zona donde se encuentran las microcalcificaciones, evitando grandes resecciones de tejido sano (4,5,32-34). En la literatura internacional se describen también la realización de biopsias estereotáxicas con mamotome, con agujas de 11 gauge (35-37). Experiencia publicada también en nuestro medio (35,38).
No es de extrañar la mayor concentración de microcalcificaciones en el cuadrante superior externo, ya que es el cuadrante con mayor cantidad de tejido glandular (34).
La biopsia rápida de las microcalcificaciones no se recomienda en la literatura internacional, dado su bajo rendimiento y la posibilidad de perder material importante para la biopsia definitiva. Sin embargo, se realizó en 189 casos, sólo con un fin académico, para comparar con los resultados de la biopsia definitiva. Además, la biopsia rápida pocas veces modifica la conducta operatoria, ya que no entrega información precisa de todos los márgenes, y tampoco especifica si se trata de una infiltración que sobrepasa la membrana basal o es un carcinoma in situ. En nuestra experiencia, se corroboró este bajo rendimiento.
El mayor número de casos de la serie corresponde al período de incorporación de un mamógrafo a nuestro hospital, sin embargo, ya se veía un incremento en los dos años previos. Durante el período anterior a esta adquisición, todas las mamografías se realizaban exclusivamente en dos centros asistenciales, y todas las placas e informes fueron analizados antes de planificar la cirugía por un Comité, para así asegurar la uniformidad de criterios. Por ello, es importante destacar la labor en equipo para diagnosticar y tratar a las pacientes con microcalcificaciones BIRADS 4, con la colaboración de ginecólogos y cirujanos de la unidad, en conjunto con radiólogos y anatomopatólogos.
Finalmente, podemos concluir que las microcalcificaciones BIRADS 4 constituyen un hallazgo importante en la mamografía, encontrándose asociadas en un porcentaje importante a cáncer y lesiones de alto riesgo. Destacando entre los cánceres: el ductal infiltrante, ductal in situ y el lobulillar in situ.
BIBLIOGRAFÍA
- Peralta MO. Cáncer de mama en Chile. Datos epidemiológicos Rev Chil Obstet Ginecol 2002; 67(6): 439-45.
- Donoso E, Cuello M. Mortalidad por cáncer en la mujer chilena. Análisis comparativo entre los años 1997 y 2003. Rev Chil Obstet Ginecol 2006;71(1): 10-6.
- Salvi M, Canova I, Battaglia T, Caputo S. Microcalcification and breast pathology: differential diagnosis and oncogenic risk assessment. Clin Ter 2003; 154(4):255-7.
- Aguirre B, Gutierrez L, Ortega D. Técnicas de la localización prequirúrgica de lesiones mamarias no palpables. Rev Chil Radiol 1997;3(1):18-20.
- Pizarro J, De Rurange MJ, Lastra M, Monsalva R, Villagrán H, Zamorano S, et al. Marcación preoperatoria de lesiones mamarias no palpables. Rev Chil Radiol 1998; 4(1):19-22.
- Silverstein MJ, Gamagami P, Masetti R, Legmann MD, Craig PH, Gierson ED. Results from a multidisciplinary breast center. Analysis of disease discovered. Surg Oncol Clin N Am 1997;6(2):301-14.
- Parker SH, Burbank F, Jackman RJ, Aucreman CJ, Cardenosa G, Cink TM, et al. Percutaneous large-core breast biopsy: a multi-institutional study. Radiology 1994;193(2):359-64.
- Charpin C, Allasia C, Davies JD, Devictor B, Boulat J, Ansaldi JL, et al. Digitization of microcalcifications in breast radiographs. Correlation with pathologic data. Anal Quant Cytol Histol 1995;17(4):230-40.
- American College of Radiology (ACR) Breast Imaging Reporting and Data System (Bi-RadsTM). Third Edition. Reston (VA):American College of Radiology;1998.
- American College of Radiology (ACR) Breast Imaging Reporting and Data System (Bi-RadsTM). Fourth Edition. Reston (VA):American College of Radiology; 2003.
- Le Gal M, Chavanne G, Pellier D. Diagnostic value of clustered microcalcifications discovered by mammography (apropos of 227 cases with histological verification and without a palpable breast tumor). Bull Cancer 1984;71(1):57-64.
- Yunus M, Ahmed N, Masroor I, Yaqoob J. Mammographic criteria for determining the diagnostic value of microcalcifications in the detection of early breast cancer. J Pak Med Assoc 2004;54(1):24-9.
- Gulsun M, Demirkazik FB, Ariyurek M. Evaluation of breast microcalcifications according to Breast Imaging Reporting and Data System criteria and Le Gal’s classification. Eur J Radiol 2003;47(3):227-31.
- De Lafontan B, Daures JP, Salicru B, Eynius F, Mihura J, Rouanet P, et al. Isolated clustered microcalcifications: diagnostic value of mammography-series of 400 cases with surgical verification. Radiology 1994;190(2):479-83.
- Nishimura S, Takahashi K, Gomi N, Tada K, Makita M, Tada T, et al. What is the predictor for invasion in non-palpable breast cancer with microcalcifications? Breast Cancer 2004;11(1):49-54.
- Stomper PC, Geradts J, Edge SB, Levine EG. Mammographic predictors of the presence and size of invasive carcinomas associated with malignant microcalcification lesions without a mass. AJR Am J Roentgenol 2003;181(6):1679-84.
- Soo MS, Baker JA, Rosen EL. Sonographic detection and sonographically guided biopsy of breast microcalcifications. AJR Am J Roentgenol 2003; 180(4):941-8.
- Marini C, Traino C, Cilotti A, Roncella M, Campori G, Bartolozzi C. Differentiation of benign and malignant breast microcalcifications: mammography versus mammography-sonography combination. Radiol Med (Torino) 2003;105(1-2):17-26.
- Ariche-Maman S, Maruani A, Michenet P, Bonneau C, Degand P, Lebas P. Value of ultrasound detection of post-mammotome scar for preoperative localization of breast microcalcifications J Radiol 2003;84(11 Pt 1):1747-51.
- Cleverley JR, Jackson AR, Bateman AC. Pre-operative localization of breast microcalcification using high-frequency ultrasound. Clin Radiol 1997; 52(12): 924-6.
- Anderson ME, Soo MS, Bentley RC, Trahey GE. The detection of breast microcalcifications with medical ultrasound. J Acoust Soc Am 1997;101(1):29-39.
- Whitehouse GH, Moore NR. MR imaging of the breast after surgery for breast cancer. Magn Reson Imaging Clin N Am 1994;2(4):591-603.
- Leichter I, Lederman R, Buchbinder SS, Bamberger P, Novak B, Fields S. Computerized evaluation of mammographic lesions: what diagnostic role does the shape of the individual microcalcifications play compared with the geometry of the cluster? AJR Am J Roentgenol 2004;182(3):705-12.
- Leichter I, Lederman R, Buchbinder S, Bamberger P, Novak B, Fields S. Optimizing parameters for computer-aided diagnosis of microcalcifications at mammography. Acad Radiol 2000;7(6):406-12.
- Di Nubila B, Cassano E, Origgi D, Treviganti R, Bozzini A, Cernigliaro F, et al. Analogic versus digital mammographic examination a radiological study of mammary microcalcifications on 52 surgical samples. Radiol Med (Torino) 2003;106(4):297-304.
- Gazmuri P, Espinoza N. Mamografia «Full Digital» directa o en campo completo: experiencia preliminar. Rev Chil Obstet Ginecol 2002;67(5):343-8.
- Gazmuri P. Biopsia estereotáxica con mamografía digital. Rev Chil Radiol 1997;3(4):177-8.
- Ciatto S, Catarzi S, Morrone D, Rosselli Del Turco M. The differential diagnostic criteria of breast microcalcifications. Radiol Med (Torino) 1992;83(4): 390-4.
- León A, Camacho J, Baeza R, Claure R, Goñi I, Razmilic D, et al. Microcalcificaciones mamarias. Estudio retrospectivo de trece años. Rev Chil Cir 1998;50:290-3.
- Pierart J, Burmeister R, Steinberg J, Martinez C, Hinrichs E. Significación de las microcalcificaciones mamarias de acuerdo a sus características de presentación. Rev Chil Cir 1993;45:363-5.
- Solé C, Fernández C, Acevedo JC. Programa de screening y tratamiento de cáncer de mama. Rev Chil Cancerol Hematol 1996;6:149-55.
- Pardo M, Sepúlveda S, Cuevas C, Díaz C. Biopsia quirúrgica con marcación preoperatoria en lesiones no palpables de la mama: Experiencia de 10 años. Rev Chil Obstet Ginecol 2003;68(5):387-91.
- Gazmuri P, Espinoza A. Biopsia estereotáxica mamaria – 826 casos. Primera experiencia chilena. Rev Chil Obstet Ginecol 2000; 65(3):163-9.
- Vélez R, Gazmuri P, Gómez L, Schwartz R, Iglesias R. Microcalcificaciones mamarias: significado y conducta. Rev Chil Cir 1990;42:47-50.
- Fischmann A, Pietsch-Breitfeld B, Muller-Schimpfle M, Siegmann K, Wersebe A, Rothenberger-Janzen K, et al. Radiologic-histopathologic correlation of microcalcifications from 11g vacuum biopsy: analysis of 3196 core biopsias. Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr 2004;176(4):538-43.
- Becette V, Cherel P, Menet E, Yacoub S, Brain E, Hagay C, et al. Biopsy of breast microcalcifications using an 11-Gauge vacuum-assisted device: roles and challenges for the pathologist. Ann Pathol 2003;23(6):496-507.
- Gallegos Hernandez JF, Tanis PJ, Deurloo EE, Nieweg OE, Rutgers EJ, Kroon BB, et al. Radio-guided surgery improves outcome of therapeutic excision in non-palpable invasive breast cancer. Nucl Med Commun 2004;25(3):227-32.
- Pinochet MA, Horvath E, González P, Uchida M, Wenzel H. Biopsia estereotáxica con mammotone: resultados preliminares. Rev Chil Radiol 2001;7:86-9.