2020
6
Autores:
Sochog
Instituciones:
Marta Arnáez de la Cruz1, Alba Rodríguez Pérez1, Juan Pérez Bretones2, Antonio Jiménez Caraballo1, Manuel Pantoja Garrido1, Álvaro Gutiérrez Domingo3.
1 Unidad de Gestión Clínica de Obstetricia y Ginecología del Hospital Universitario Virgen Macarena de Sevilla, España.
2 Unidad de Gestión Clínica de Obstetricia y Ginecología del Hospital Universitario Torrecárdenas de Almería, España.
3 Unidad de Gestión Clínica de Anatomía Patológica del Hospital Universitario Virgen Macarena de Sevilla, España.
Correspondencia: Manuel Pantoja Garrido, pantoja_manuel@hotmail.com
Tipo de documento:
Casos ClínicosMioma en remanente cervical tras histerectomía supracervical laparoscópica, presentación de un caso y revisión de la literatura
Contenido del documento:
INTRODUCCIÓN
Los miomas uterinos son los tumores pélvicos más frecuentes en la mujer1. Pueden presentarse como tumoraciones asintomáticas que se diagnostican de forma casual en una revisión ginecológica de control, aunque en otras ocasiones pueden ser causa de hipermenorrea, metrorragia orgánica y clínica por compresión de órganos vecinos como dolor, dificultad miccional o fecal1. Su diagnóstico se realiza básicamente mediante la combinación de la clínica y las pruebas de imagen como la ecografía, aunque en ocasiones puede ampliarse el estudio con otras técnicas como la resonancia magnética (RM)2. La palpación abdominal y el tacto bimanual ayudan a la categorización y delimitación de estos. Actualmente, disponemos de diversos tratamientos efectivos para los miomas, tanto médicos como quirúrgicos. Dentro del tratamiento quirúrgico hay varias opciones, desde la más conservadora mediante una miomectomía, hasta una histerectomía que puede ser tanto total como subtotal (no extirpando el cérvix uterino). Se puede optar por una vía mínimamente invasiva siempre que sea posible, lo cual abre un nuevo debate respecto a las complicaciones secundarias a la morcelación uterina no estanca3,4. Si no se realiza dicha morcelación en bolsa5, puede aparecer una miomatosis parasitaria secundaria a la dispersión de fragmentos en la cavidad abdominal6. En caso de optar por realizar una histerectomía subtotal, se debe tener en cuenta la posibilidad de recidiva miomatosa en la porción remanente cervical7, implicando, además, un seguimiento mediante citología y/o test del virus del papiloma humano (VPH) para la prevención del cáncer de cérvix7.
Presentamos el caso clínico de una paciente que se sometió a una histerectomía subtotal laparoscópica por un útero con múltiples miomas, debutando a los 11 años de la cirugía con una incontinencia urinaria secundaria a la comprensión producida por un mioma en el remanente cervical, que requirió de una segunda intervención quirúrgica. El objetivo principal de este trabajo es valorar las ventajas e inconvenientes de la conservación cervical en las histerectomías por patología benigna. Además, realizaremos una revisión de la literatura publicada respecto a las complicaciones asociadas a la morcelación uterina intracavitaria, la patología recidivante en el cérvix uterino y los efectos adversos relacionados con la exéresis de este; ya que ante la aparición de un mioma uterino sobre remanente cervical (como en el caso presentado), la asociación a la morcelación no estanca previa siempre es una etiología que considerar.
CASO CLÍNICO
Presentamos el caso de una mujer de 52 años, en seguimiento en las consultas de Ginecología General por clínica de incontinencia urinaria de esfuerzo. Entre sus antecedentes personales destacaban un hipotiroidismo en tratamiento con levotiroxina y una intervención quirúrgica hace 11 años por útero con múltiples miomas sintomático mediante una histerectomía subtotal con salpinguectomía bilateral laparoscópica con morcelación intracavitaria no estanca, se mantuvieron ambos ovarios puesto que eran morfológicamente normales y la paciente era premenopáusica, por lo que no precisó terapia hormonal sustitutiva posteriormente. La paciente no se había realizado seguimientos posteriores a la intervención, excepto las citologías correspondientes al programa de detección precoz de cáncer de cérvix, que habían resultado negativas. Durante la exploración se objetivó un prolapso de compartimento anterior grado I-II. A la palpación abdominal, se observó una tumoración móvil que parecía depender de la cara posterior de cérvix, llegando a nivel infraumbilical y lateralizada hacia la fosa ilíaca derecha. La especuloscopia no mostraba alteraciones, con cérvix formado, cerrado y bien epitelizado. Mediante la ecografía transvaginal se observó la pelvis ocupada por una formación ovoidea de 9x6cm, bien definida, de contornos regulares, con una ecogenicidad homogénea y disminuida respecto al resto del parénquima cervical, escasa vascularización tras aplicación de Doppler color, que parecía depender del remanente cervical. No se objetivó patología anexial ni líquido libre en Douglas (Figura 1). Como parte del estudio de filiación del tumor pélvico se solicitó una RM pélvica sin contraste, que informó de una lesión de morfología ligeramente ovoidea, de 79×82 mm, de contornos bien delimitados, baja intensidad de señal en T1 e intermedia en T2, sugestiva de leiomioma en aparente continuidad con cérvix uterino. No parecía depender del ovario derecho, que se observaba sin alteraciones, mientras que en el ovario izquierdo se describía un quiste folicular de 23mm (Figura 2). Tras valorar el caso de forma individualizada, así como los riesgos y beneficios de las diversas opciones terapéuticas, se decidió proponer a la paciente una intervención quirúrgica mediante traquelectomía vía vaginal, informándose, además, de las posibles complicaciones derivadas de realizar una morcelación de la pieza vía vaginal no estanca en caso de ser necesaria. La paciente tenía una citología de cérvix negativa del año previo, como no refirió relaciones sexuales de riesgo no precisaba nueva citología antes de la cirugía (cribado trienal). Durante la intervención vía vaginal se confirmó el origen cervical del mioma, llevándose a cabo la amputación del remanente cervical junto a la tumoración descrita, con gran dificultad dado el tamaño de esta. Para la extracción de la pieza se realizó en un primer tiempo una morcelación vía vaginal mediante la hemisección del cérvix con bisturí frío a través de vagina, y en un segundo tiempo la fragmentación de la tumoración en múltiples piezas que permitió su extracción completa (Figura 3). La paciente no presentó ninguna alteración durante su ingreso y postoperatorio inmediato, recibiendo el alta hospitalaria precoz tras una rápida recuperación. En la consulta postquirúrgica se objetivó un buen estado general, exploración sin hallazgos patológicos y sutura de colpotomía en buen estado, no dehiscente. El resultado definitivo anatomopatológico de la pieza fue: metaplasia cervical asociada a leiomioma sin áreas de necrosis ni hemorragia con células fusiformes con bordes indistinguibles, citoplasma eosinófilo fibrilar y núcleo en “forma de cigarro” (Figura 4).
DISCUSIÓN
La miomatosis uterina es una patología frecuente en la mujer premenopáusica, su patogenia se explica por dos procesos, por un lado, la transformación de miocitos normales en células anormales y por otro el crecimiento de miocitos anormales mediante expansión clonal, influenciados por factores hormonales1. Presentan un fenotipo común con genotipos diferentes, ya que parecen coexistir múltiples vías genéticas implicadas en el crecimiento de los miomas, entre las que destacan las mutaciones somáticas en el grupo MED12, seguido del HMGA1-2 y del colágeno tipo IV1. Los miomas pueden presentarse clínicamente de forma asintomática y ser diagnosticados mediante una ecografía de forma casual; aunque, dependiendo de su localización y tamaño, pueden también producir síntomas como metrorragia, dolor o dificultad miccional o fecal por compresión de órganos vecinos, entre otros2. El diagnóstico mediante ecografía ginecológica (transvaginal o en su defecto transrectal) es el método de elección por su disponibilidad, bajo coste y buena tolerancia, permitiendo una descripción óptima y específica de la localización anatómica y características del mioma, como su vascularización, presencia de degeneración, calcificaciones o sombras acústicas8. En los casos más complicados, donde no sea posible delimitar la tumoración, su localización o no se pueda realizar una ecografía, la prueba complementaria de elección es la RM9. Es en estos miomas sintomáticos, como en el caso que presentamos, donde cobra gran importancia el tratamiento, que actualmente puede ser médico mediante anticonceptivos hormonales para el control del ciclo o análogos de la GnRH, principalmente; o quirúrgico mediante miomectomía o histerectomía total/subtotal10. En esta revisión abordaremos principalmente esta última opción, ya que fue la intervención realizada en nuestro caso. Actualmente, la vía endoscópica permite realizar intervenciones mínimamente invasivas, que disminuyen el dolor postoperatorio, la tasa de infecciones y la estancia hospitalaria, entre otros muchos beneficios11.
Durante mucho tiempo se han defendido los beneficios de la histerectomía subtotal laparoscópica (HSTL) respecto a la función sexual femenina o el fortalecimiento del suelo pélvico (secundario a la conservación cervical), en comparación con la histerectomía total laparoscópica (HTL). Sin embargo, aunque algunos estudios revelaron ventajas a corto plazo tras una HSTL, su efecto beneficioso desaparece con el tiempo, igualándose a la HTL. Además, se ha visto que las expectativas preoperatorias altas en relación con la sexualidad postoperatoria se correlacionan con un cambio en el funcionamiento y una mejora de la calidad sexual en este grupo de pacientes, presente incluso 12 meses tras la cirugía12. Uno de los problemas fundamentales de la HSTL es la dificultad de extraer la pieza quirúrgica, por lo que se han desarrollado dispositivos como los morceladores, que permiten la fragmentación de esta, facilitando así, dichas maniobras13. La morcelación de piezas quirúrgicas tiene una tasa de complicaciones de un 4-5%, pudiendo aumentar en casos de escasa experiencia del cirujano, mal funcionamiento del dispositivo o falta de visualización. Los efectos adversos descritos más frecuentemente derivados del uso de este dispositivo son las lesiones intestinales, de vasos sanguíneos, riñones, vejiga y diafragma. Otra complicación rara, pero de bastante importancia es la diseminación del tejido miomatoso en la cavidad abdominal como consecuencia de realizar las maniobras de forma no estanca, pudiendo causar una miomatosis parasitaria14, así como la creación de múltiples implantes endometriósicos en pacientes con adenomiosis15. Este punto resulta interesante para el caso presentado, puesto que no podemos descartar la posibilidad de que se tratara de un mioma parásito implantado tras la morcelación no estanca vs aparición de nuevo mioma uterino. Aunque el uso de sistemas de contención en bolsa aumenta el tiempo quirúrgico, el coste del procedimiento y el dolor postoperatorio16. Por otra parte, debemos tener en cuenta que en el remanente cervical postquirúrgico puede recidivar la patología causante de la indicación, como los miomas uterinos17,18, al igual que en el caso clínico presentado, dificultando su exéresis en un segundo tiempo, secundaria a la pérdida de la anatomía normal del aparato genital y la presencia de cuadros adherenciales. Una de las complicaciones más graves a tener en cuenta es la posibilidad de diseminación sarcomatosa en aquellas pacientes con neoplasias no diagnosticados previamente, objetivadas en el análisis histológico posterior de la pieza quirúrgica (1 de cada 350-500 mujeres histerectomizadas por patologías benignas pueden presentar un sarcoma oculto19, aunque las incidencias varían desde los 2 casos por cada 1000 pacientes hasta el 1,4%, dependiendo de los trabajos revisados20,21), lo que empeora drásticamente el pronóstico y supervivencia de estas pacientes5. El mantenimiento del cérvix residual puede ser causante también de metrorragia cíclica cuando contiene parte de tejido endometrial, sin poder descartar a la larga la aparición de un carcinoma de endometrio, y obliga, además, a continuar los controles citológicos periódicos de los programas de cribado de neoplasias cervicales, por la posibilidad de aparición de un carcinoma de cérvix.
Actualmente, la técnica más aceptada para la extracción de piezas de HSTL es la morcelación estanca mediante bolsas que no permitan la diseminación de fragmentos por la cavidad abdominal. Aunque el nivel de evidencia disponible no es suficiente para dar recomendaciones definitivas protocolizadas, la Sociedad Europea de Endoscopia Ginecológica ha publicado unas recomendaciones prácticas para la morcelación, basadas en la literatura disponible al respecto, contraindicándola cuando existan signos de necrosis tisular o importante vascularización5. Por otro lado, debemos tener en cuenta que algunos trabajos publicados en los que se ha utilizado colorantes en bolsas de morcelación tras el procedimiento, han objetivado derrame de este a cavidad hasta en un 9,2% de los casos (aunque macroscópicamente la bolsa impresionaba intacta)22. La HTL es una técnica quirúrgica de mayor complejidad y que requiere una curva de aprendizaje más extensa por parte del cirujano, sin embargo, dado el porcentaje de beneficios para las pacientes es la opción que los estudios plantean como de elección. Sin olvidar, además, que las maniobras de morcelación puede incrementar notablemente la duración de la cirugía y, por tanto, el tiempo anestésico y sus complicaciones derivadas. No se han observado diferencias significativas en las tasas de complicaciones en la HTL con respecto a las HSTL, cuando ambos procedimientos son realizados por ginecólogos expertos23.
El diagnóstico de los miomas uterinos de nueva aparición en el remanente cervical, tal como ocurrió en el caso expuesto, pueden orientarse mediante ecografía vaginal, pero deben ser confirmados mediante RM, para descartar así, el origen anexial de la misma, principalmente en pacientes menopáusicas con ovarios atróficos de difícil visualización ecográfica24. Las manifestaciones clínicas como la metrorragia o los síntomas compresivos (dificultad para la micción o la defecación), también nos pueden hacer sospechar de la presencia de lesiones residuales, en aquellas pacientes con antecedentes de HSTL y morcelación no estanca. El tratamiento de esta infrecuente entidad clínica es fundamentalmente quirúrgico, mediante la amputación cervical vía vaginal o laparoscópica, pudiendo requerir de la morcelación de la pieza en aquellas masas de gran tamaño2, como ocurre en el caso descrito, en el cual se realizó una morcelación vaginal con bisturí.
CONCLUSIONES
La histerectomía total laparoscópica es una técnica quirúrgica más compleja que la histerectomía subtotal, sin embargo, debe realizarse en los casos en los que sea posible, ya que no aumenta los riesgos de la cirugía en manos expertas; sobre todo cuando la indicación quirúrgica es por un útero miomatoso, debido a la posibilidad de recidiva de dicha patología en el muñón cervical. Además, es posible que la porción remanente de cérvix contenga endometrio y sea causante de metrorragias cíclicas e incluso origen de un carcinoma endometrial, obligando, por tanto, a continuar con las revisiones ginecológicas periódicas y el cribado de cáncer de cérvix. La técnica de HSTL implica el uso de morceladores, con el consiguiente riesgo de diseminación de fragmentos miomatosos, uterinos o endometriales a la cavidad abdominal. Actualmente se acepta la morcelación en bolsa estanca para evitar dicha complicación, teniendo en cuenta que existe un pequeño porcentaje de sarcomas ocultos no diagnosticados previamente a la cirugía. Esta técnica aumenta el coste y el tiempo quirúrgico de forma importante. Tras diversos estudios y publicaciones, se ha puesto de manifiesto que la extirpación del cérvix en la histerectomía total no aumenta la dificultad para las relaciones sexuales si se hace de forma correcta, ya que no debe conllevar un acortamiento significativo de la vagina.
REFERENCIAS
- Stewart EA, Laughlin-Tommaso SK. Uterine fibroids (leiomyomas): Histology and pathogenesis. UpToDate. Mar 22, 2019.
- Stewart EA, Laughlin-Tommaso SK. Uterine fibroids (leiomyomas): Epidemiology, clinical features, diagnosis and natural history. UpToDate. Mar 22, 2019.
- Rabischong B, Beguinot M, Compan C, Bourdel N, Kaemmerlen AG, Pouly JL, et al. Complication à long terme du morcellement utérin par voie cœlioscopique: Les myomes parasitiques iatrogènes. J Gynecol Obstet Biol la Reprod. 2013;42(6):577–84. doi: 10.1016 / j.jgyn.2013.07.006.
- Holloran-Schwartz MB, Fierro M, Tritto A. Delayed presentation of a paracytic myoma fragment after laparoscopic supracervical hysterectomy requiring small bowel resection. A case report. J Reprod Med. 2015 Jan-Feb;60(1-2):75-7.
- Rechberger T, Miotła P, Futyma K, Ziętek A, Filipczak A, Rechberger E, et al. Power morcellation for women undergoing laparoscopic supracervical hysterectomy — safety of procedure and clinical experience from 426 cases. Ginekol Pol. 2016;87(8):546–51. doi: 10.5603/GP.2016.0042.
- Verberg MFG, Boomsma CM, Pijnenborg JMA. A parasitic myoma: unexpected finding after laparoscopic hysterectomy. Ned Tijdschr Geneeskd. Ned Tijdschr Geneeskd. 2013;157(52):A6683.
- Bojahr B, Lober R, Römer T, Schwesinger G. Large cervix myoma after supra-cervical hysterectomy. Zentralbl Gynakol. Zentralbl Gynakol. 1996;118(8):468-70.
- Fascilla FD, Cramarossa P, Cannone R, Olivieri C, Vimercati A, Exacoustos C. Ultrasound diagnosis of uterine myomas. Minerva Ginecol. 2016 Jun;68(3):297-312.
- Olalla S, Monleon J, Cristóbal I, Cañete ML. Diagnostic evaluation of uterine myomas. Eur J Obstet Gynecol Reprod Biol. 2020 Feb 14. pii: S0301-2115(20)30091-9. doi: 10.1016/j.ejogrb.2020.02.023.
- Stewart EA, Barbieri RL, Chakrabarti A. Overview of treatment of uterine leiomyomas (fibroids). UpToDate. Feb 14, 2020.
- Cohen SL, Tommaso Falcone T, Eckler K. Overview of treatment of uterine leiomyomas (fibroids). UpToDate. Jan 14, 2019.
- Berlit S, Tuschy B, Wuhrer A, Jürgens S, Buchweitz O, Kircher AT, et al. Sexual functioning after total versus subtotal laparoscopic hysterectomy. Arch Gynecol Obstet. 2018 Aug;298(2):337-344. doi: 10.1007/s00404-018-4812-7.
- Smits RM, Kruif JH De, Heteren CF Van. European Journal of Obstetrics & Gynecology and Reproductive Biology Complication rate of uterine morcellation in laparoscopic supracervical hysterectomy: a retrospective cohort study. Eur J Obstet Gynecol Reprod Biol. 2016 Apr;199:179-82. doi: 10.1016/j.ejogrb.2016.02.022.
- Alcalá-Alcalde M del M, Pantoja-Garrido M, Frías-Sánchez Z. Mioma parasitario intestinal primario como hallazgo durante la cirugía laparoscópica ginecológica. Ginecol Obstet Mex. 2016;84(9):593–600.
- Zamboni T M, Valenzuela M P, Pomés C C, Cuello F M, Mayerson B D. Hallazgo de fragmentos uterinos intrabdominales poshisterectomía. Rev Chil Obstet Ginecol. 2010;75(1):42–6.
- Boza A, Misirlioglu S, Taskiran C, Urman B. Contained Power Morcellation Versus Transvaginal Extraction for Retrieval of Laparoscopically Removed Myomas: A Comparison of Perioperative Outcomes. Surg Innov. 2019 Feb;26(1):72-76. doi: 10.1177/1553350618790710.
- Germán E, Peña F, Milena A, Africano A, Medina BC, Medina M, et al. Caso clínico Miomatosis uterina en cérvix residual. Ginecol Obstet Mex 2012;80(10):659-662.
- Chu CM, Acholonu UC, Chang-Jackson S-CR, Nezhat FR. Leiomyoma recurrent at the cervical stump: report of two cases. J Minim Invasive Gynecol. 2012 Jan-Feb;19(1):131-3. doi: 10.1016/j.jmig.2011.10.006.
- Murji A, Scott S, Singh SS, Bougie O, Leyland N, Laberge PY, et al. No. 371-Morcellation During Gynaecologic Surgery: Its Uses, Complications, and Risks of Unsuspected Malignancy. J Obstet Gynaecol Can. 2019 Jan;41(1):116-126. doi: 10.1016/j.jogc.2018.07.016.
- Desai VB, Wright JD, Schwartz PE, Jorgensen EM, Fan L, Litkouhi B, et al. Occult Gynecologic Cancer in Women Undergoing Hysterectomy or Myomectomy for Benign Indications. Obstet Gynecol. 2018 Apr;131(4):642-651. doi: 10.1097/AOG.0000000000002521.
- Zivanovic O, Leitao MM, Iasonos A, Jacks LM, Zhou Q, Abu-Rustum NR, et al. Stage-specific outcomes of patients with uterine leiomyosarcoma: a comparison of the International Federation Gynecology and Obstetrics and American Joint Committee on Cancer Staging Systems. J Clin Oncol 2009;27:2066-72. doi: 10.1200/JCO.2008.19.8366.
- Cohen SL, Morris SN, Brown DN, Greenberg JA, Walsh BW, Gargiulo AR, et al. Contained tissue extraction using power morcellation: prospective evaluation of leakage parameters. Am J Obstet Gynecol. 2016 Feb;214(2):257.e1-257.e6. doi: 10.1016/j.ajog.2015.08.076.
- Lonky NM, Mohan Y, Chiu VY, Park J, Kivnick S, Hong C, et al. Hysterectomy for benign conditions: Complications relative to surgical approach and other variables that lead to post-operative readmission within 90 days of surgery. Womens Health (Lond). 2017 Aug;13(2):17-26. doi: 10.1177/1745505717714657.
- Yi C, Li L, Wang X, Liu X. Recurrence of uterine tissue residues after laparoscopic hysterectomy or myomectomy. Pak J Med Sci. 2014 Sep;30(5):1134-6. doi: 10.12669/pjms.305.4509.
FIGURAS
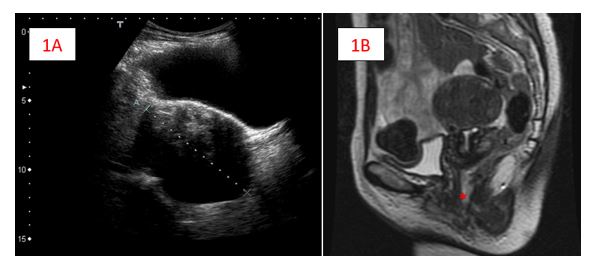
Figura 1: 1A: corte transversal de mioma uterino con medición diámetro máximo de 90,5mm en ecografía transvaginal; 1B: corte sagital de mioma en RM secuencia T2, donde se observa continuidad con la vagina (*).
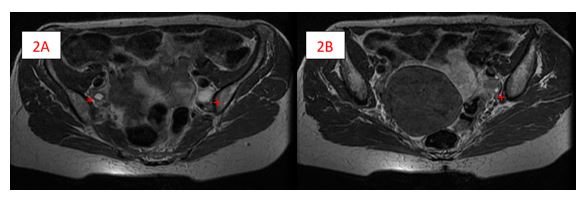
Figura 2: Imagen de RM secuencia T2 donde se observan ovarios en un corte axial. 2A: ovario izquierdo con un único folículo dominante (*), ovario derecho (+); 2B: Ovario derecho (+), sin relación con mioma uterino.
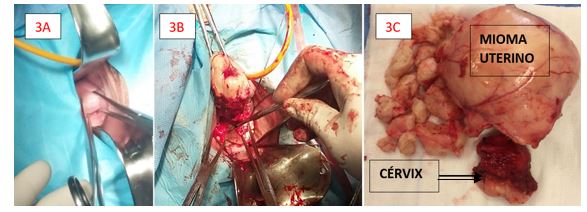
Figura 3: Imágenes de la traquelectomía cervical vía vaginal y la pieza postquirúrgica. 3A: cérvix uterino al comienzo de la cirugía; 3B: Apertura de fórnices vaginales; 3C: Pieza quirúrgica tras extirpación completa que incluye cérvix, mioma uterino y pequeñas porciones de mioma morcelado.
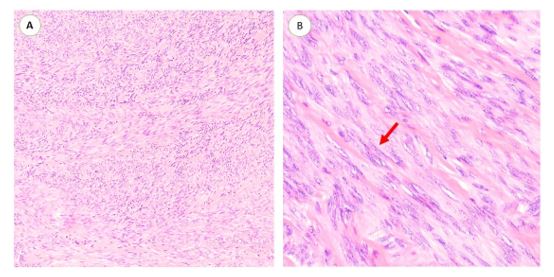
Figura 4: Leiomioma. A) En esta imagen, a poco aumento, podemos ver que se trata de un tumor dispuesto en fascículos que interseccionan entre sí. Además, no se observan áreas de necrosis ni hemorragia (HE,4x). B) A mayor aumento, vemos que el tumor se compone de células fusiformes con bordes indistinguibles, citoplasma eosinófilo fibrilar y núcleo en “forma de cigarro” con nucleólo poco evidente (flecha). No se observan figuras de mitosis (HE,40x).



