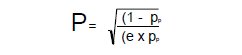2010
2
Autores:
Ricardo Cornejo U.
Tipo de documento:
Trabajos OriginalesMORFOMETRÍA DEL NUCLEOLO EN LA DIFERENCIACIÓN CELULAR DEL EPITELIO MAMARIO
Contenido del documento:
RESUMEN
Antecedentes: El proceso biológico de diferenciación celular es la traducción de múltiples procesos nucleares y citoplasmáticos que determinan cambios complejos y fundamentales en la ultraestructura, bioquímica y fisiología celular, los cuales pueden ser cuantificados mediante técnicas morfométricas. Objetivo: Evidenciar en términos cuantitativos y morfológicos las variaciones experimentadas por los nucleolos pertenecientes a células mamarias de la línea HC11 tanto normales como en mecanismo de diferenciación. Método: Se estudió a nivel de la microscopía electrónica de transmisión los tipos celulares en etapa de proliferación (HC11 GM) en comparación con células en estadio de diferenciación (HC11 IM), cuantificando las variaciones de los nucleolos y su relación con estructuras involucradas en síntesis proteica.
Resultados: Se evidencian diferencias estadísticamente significativas referentes al área, volumen y longitud entre los nucleolos pertenecientes al tipo celular normal-proliferante y el que se encuentra en proceso de diferenciación. Conclusión: Las células mamarias en proceso de diferenciación presentan una notable disminución de sus nucleolos, y sus ribonucleoproteínas constitutivas generarán básicamente ribosomas adheridos al retículo endoplasmático rugoso, sintetizando proteínas de exportación.
PALABRAS CLAVE: Diferenciación celular, morfometría, nucleolos, glándula mamaria
SUMMARY
Background: The biological process of cell differentiation is the traslation of multiple nuclear and cytoplasmic processes that determine complex and fundamental changes in ultrastructure, biochemistry and cell physiology, which can be quantified using morphometric techniques. Objective: To show in quantitative and morphological terms changes experienced by the nucleolus belonging to HC11 line mammary cells both, in proliferating and differentiation process. Methods: A study at the level of transmission electron microscopy of cell types in stage of cell proliferation in comparison with stage of differentiation was designed to quantify variations of nucleolus and their relation to structures involved in protein synthesis. Results: Marked differences in the area, volume and length of the nucleolus were found between normal-proliferating cell types and those in mechanism of differentiation. Conclusion: The mammary cells in differentiation process show a dramatic decline in its nucleoli and their ribonucleoproteins generate basically ribosomes attached at endoplasmic reticulum, synthesizing export proteins.
KEY WORDS: Cellular diffentiation, morphometry, nucleolus, mammary glands
INTRODUCCIÓN
Las células HC11 constituyen una línea de epitelio mamario normal derivada del linaje COMMA 1D obtenidas de glándula mamaria de ratas BALB/c en mitad de preñez, las cuales retienen características de la diferenciación normal de la glándula y producen ß caseína, la principal proteína de la leche (1). Las células mamarias normales en períodos de proliferación son estimuladas mediante el factor de crecimiento epidérmico (EGF), agente mitogénico, el cual unido a un receptor tirosina quinasa de membrana plasmática fosforilando proteínas citosólicas, origina una cascada de señales generando el mecanismo de la división celular y originando de este modo el tipo celular HC11 GM (2).
Estas células descritas son inducidas al proceso de diferenciación por estimulaciones de prolactina, hormona que modula la transcripción de genes para ß caseína y promueve acúmulo de este RNA mensajero en el citoplasma (3). Del mismo modo, insulina y su funcionalidad anabólica, estimula la síntesis proteica de estas células epiteliales (4); de igual manera dexametasona, glicocorticoide que induce la diferenciación terminal de estas células mamarias, actúa sinergicamente con prolactina en la expresión del gen de ß caseína (5). Producto de dichas estimulaciones se genera el tipo celular HC11 IM.
A este respecto Taverna y cols (6), describieron que en las células HC11 GM, la activación de los receptores para EGF, es un paso esencial tanto para el crecimiento celular, como para adquirir competencia en la respuesta a los estímulos de hormonas lactogénicas. De igual modo Hynes y cols (7), demostraron que las células HC11 IM sintetizan y secretan proteínas como las glicoproteínas laminina y tenascina tanto en ausencia como en presencia del EGF.
En este contexto, pareció interesante describir cuantitativamente las eventuales diferencias que pudiese experimentar el nucleolo, componente que, en base a su constitución ribonucleoproteica, genera una determinada tasa de biogénesis ribosomal y por ende, en directa relación con una mayor o menor actividad en la síntesis proteica citosólica (8).
MATERIAL Y MÉTODO
Microscopía Electrónica de Transmisión: Al pellet que contenía las células HC11 GM (célula de glándula mamaria normal-proliferante) y HC11 IM (célula de glándula mamaria diferenciada) se le adicionó solución de glutaraldehído 2%, en tampón fosfato 0,15 M, pH 7,2 y se mantuvo a temperatura ambiente, por 2 horas. Posteriormente, fue sometido a un lavado en solución de 6 g de NaCl y 73 g de sacarosa, disueltos en 1 litro de agua destilada.
La post-fijación se realizó en solución de tetróxido de osmio 1%, disuelto en la solución de lavado antes descrita, durante una hora, a 40º C, y acetato de uranilo 0,5% por 18 horas. Luego de lavado el material fue deshidratado en concentraciones crecientes de acetona (30 a 100%) e incluido en Araldita 6005. Se obtuvieron cortes ultrafinos de aproximadamente 70 nm de grosor, los que fueron tratados durante 40 minutos con acetato de uranilo 2% y citrato de plomo 0,5% por 10 minutos.
Las muestras fueron estudiadas y fotografiadas en un microscopio electrónico Phillips EM 400. Método Estereológico: A partir de los bloques para microscopía electrónica, fueron obtenidos cortes ultrafinos, en los cuales se micrografiaron cada uno de los tipos celulares con un aumento de 10.500 X. Para la evaluación de las fracciones volumétricas de los diferentes componentes celulares, fue sobrepuesto un retículo de puntos en las micrografías electrónicas y se procedió al conteo diferencial de los puntos que incidían sobre los perfiles de los componentes celulares, calculándose la fracción volumétrica que un determinado componente ocupa, mediante la siguiente ecuación:
Donde:
P = número total de puntos incidentes sobre la unidad de volumen Pp = estimativa previa de la fracción volumétrica del componente en estudio e = error patrón relativo que se desea tener asociado a la fracción volumétrica
Con el objetivo de determinar diferencias estadísticamente significativas, los datos morfométricos obtenidos fueron sometidos a la prueba de Wilcoxon para muestras no paramétricas. Para el cálculo del área nucleolar fue utilizado el software Sigma Pro 5.0
RESULTADOS
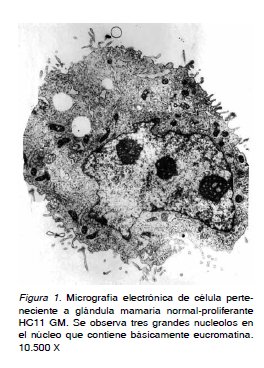
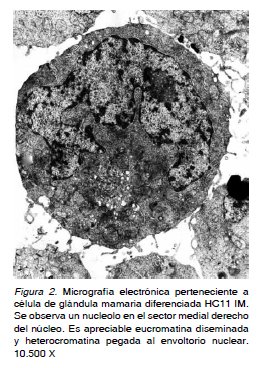
En las micrografías electrónicas obtenidas de los tipos celulares tanto normales-proliferantes (HC11 GM) como diferenciadas (HC11 IM) (Figura 1 y 2), se realizaron los análisis morfométricos correspondientes. Los valores obtenidos determinaron diferencias estadísticamente significativas (p=0,043; Wilcoxon) con un 95% de confianza y un error de 5%. Teniendo en cuenta que la prueba establece diferencias significativas con un valor de Z= 2,023 tanto para las longitudes como para las áreas que poseen los nucleolos (elegidos al azar) de ambos tipos celulares, indican que efectivamente existen diferencias estadísticamente significativas, situación que permite constatar
la variación de los nucleolos en medida que transcurre el mecanismo de diferenciación producto de las estimulaciones lactogénicas (Tablas I y II). En este sentido, en la Figura 3 se describe este resultado evidenciándose las marcadas diferencias cuantitativas entre ellos, tanto que el volumen cuantificado en la célula proliferante es equivalente, al doble de la encontrada en la célula en diferenciación. En este mismo contexto, la Tabla I describe la diferencia expresada en micrones cuadrados de las áreas de nucleolos perteneciente a 5 células HC11 GM elegidas al azar, pudiéndose precisar nuevamente que el organelo es mayor que los encontrados en las 5 células en proceso de diferenciación. Finalmente, en la Tabla II se evidencia la diferencia expresada en micrones correspondiente a la longitud de los nucleolos, en células normales y diferenciadas.
DISCUSIÓN
La presencia de nucleolos en las células eucarióticas argumenta en el sentido que estas son poseedoras de las materias primas para la realización de biogénesis ribosomal, es decir, la construcción de nuevos ribosomas, organelos en los cuales se producirá la “lectura” del RNAm, generado como producto de la transcripción realizada a expensa del molde de secuencias nucleotídicas del DNA. Por tanto, en términos genéricos es posible argumentar que: “grandes nucleolos o mas de uno, indica que aquel tipo celular tendrá probabilidad de formar nuevos ribosomas y por ello, la célula se especializará en efectuar síntesis proteica” (9).
De acuerdo al dogma fundamental de la biología molecular descrito, y considerando que la célula diferenciada sintetiza y secreta activamente tanto ß caseína como proteínas, para la matriz extracelular, podría pensarse “a priori” que esta célula debiera presentar abultados o varios nucleolos.
Sin embargo, observando los resultados obtenidos, derivados de la cuantificación morfométrica de
los valores pertenecientes a los nucleolos presentes en los tipos celulares HC11 GM y IM, se puede concluir que el tipo celular ya diferenciado presenta una notable disminución, tanto en las fracciones volumétricas y en las áreas, como en la longitud de estos organelos con respecto a los valores encontrados en la célula normal-proliferante.
En este contexto, en las células HC11 GM, la presencia de grandes nucleolos les imprimen características generadora de una elevada biogénesis ribosomal y se reafirma en el hecho que esta célula posee multitud de ribosomas libres encargados de sintetizar proteínas para el consumo interno representadas por aquellas que participarán en el transcurso de las diferentes etapas de las sucesivas mitosis estimuladas por el factor de crecimiento epidérmico. Concomitante con este hecho, ha sido ya demostrado que estas células presentan fracciones volumétricas de eucromatina en porcentajes muy elevados evidenciando, por ende, que la expresión génica para codificar ARNribosómicos y proteínas para la progresión del proceso mitótico de este tipo celular es también constante y elevada (10).
De igual manera, la notable disminución de la constitución nucleolar evaluada en células ya diferenciada, se interpreta como que la correspondiente biogénesis ribosomal genera ribosomas que serán mayoritariamente adheridos a las membranas del retículo endoplasmático rugoso (presente en volumen y porcentaje importante en HC11 IM), lugar en donde se sintetizarán, como ya fue expresado, especifica y exclusivamente proteínas de exportación como ß caseína y otras que constituirán parte de la matriz extra-celular (7,11).
En este sentido, podría argumentarse que en este tipo celular diferenciado, las estimulaciones hormonales lactogénicas pudiesen actuar como moléculas activadoras tanto en la expresión de los genes involucrados en codificar ARNribosómicos como en los de ß caseína solamente en medida que la célula precisara su síntesis y posterior secreción.
BIBLIOGRAFÍA
1. Ball R, Friis R, Schoenenberger C, doppler W, Groner B. Prolactin regulation of beta-casein gene expresion and of a cytosolic 120 KD protein in a cloned mouse mammary epithelial cell line. EMBO J 1988;7:2089-95.
2. Carpenter G, Cohen S. Epidermal growth factor. Biol Chem 1990;265:7709-12.
3. Guyette W, Matusik R, Rosen J. Prolactinmediated transcriptional and post-transcriptional control of casein gene expression. Cell 1979;17:1013-23.
4. Fawcett D. Tratado de Histología. Editorial Interamericana- Mc Graw-Hill, 1987. p1025.
5. Doppler W, Groner B, Ball R. Prolactin and glucocorticoid hormones synergistically induce expression of transfected rat beta-casein gene promoter constructs in a mammary epithelial cell line. Proc Natl Acad Sci USA 1989;86:1048.
6. Taverna D, Groner B, Hynes N. Epidermal growth factor receptor, platelet-derived growth factor receptor, and c-erbB-2 receptor activation all promote growth but have distinctive effects upon mouse mammary epithelial cell differentiation. Cell Growth & Differentiation 1991;2:14554.
7. Hynes N, Taverna D, Cella N, Chammas R. The effect of the extraccellular matrix upon HC11 mammary epithelial cell differentiation. Ciencia e Cultura 1992;44:253-6.
8. Paniagua R, Nistal M, Sesma P, Alvarez M, Fraile B, Anadon R, Sáez F. Biología Celular Editorial Interamericana-McGraw-Hill, 2007. p387.
9. Lodish H, Berk A, Zipursky S, Matsudaira P, Baltimore D, Darnell J. Biología Celular y Molecular. Editorial Médica Panamericana 2003. p622.
10. Cornejo R. Las células mamarias en proceso de diferenciación disminuyen su volumen citoplasmático y nuclear. Rev Chil Obstet Ginecol 2005;70:156-9.
11. Cornejo R. Morfometría de la diferenciación de células epiteliales mamarias en cultivo. Rev Chil Anat 1995;13:33-41.