2020
5
Autores:
Sochog
Instituciones:
Andrea Sumba Chávez1, Silvina Malvasio del Valle1, Dardo Centurión Arballo1, Cecilia Castillo Leska1.
Servicio de Oncología Clínica y Anatomía Patológica. Hospital de clínicas, Dr. Manuel Quíntela. Universidad de la República. Montevideo, Uruguay..
Correspondencia
Dra. Andrea Sumba Chávez.
Email: andysum1991@gmail.com
Tipo de documento:
Casos ClínicosSarcoma sinovial pleuropulmonar primario: Desafío del tratamiento durante el embarazo
Contenido del documento:
INTRODUCCIÓN
El sarcoma sinovial (SS) monofásico representa el 8% de los sarcomas de partes blandas;1 habitualmente diagnosticado en los miembros inferiores, la localización pleuropulmonar es poco frecuente y agresiva (correspondiendo a 0,1-0,5% de las neoplasias pulmonares primarias).2,3 Por su baja incidencia no hay guías terapéuticas específicas y sólo existen tres reportes de casos publicados en la literatura de este tumor en esta localización diagnosticado durante el embarazo. Reportamos el caso de una primigesta de 11 semanas de gestación al momento del diagnóstico de un SS pulmonar primario, a la cual se le realizó la resección quirúrgica del tumor y posteriormente recibe quimioterapia adyuvante durante el tercer trimestre del embarazo. Participaron en el manejo terapéutico los equipos de cirugía de tórax, ginecología, neonatología, medicina interna, psicología médica, oncología médica, oncología radioterápica y la cátedra de farmacología del Hospital de Clínicas Dr. Manuel Quíntela.
El estudio de este caso clínico cuenta con el aval de la Catedra de Oncología Clínica y así mismo fue solicitado y aprobado por el Comité de Ética del Hospital de Clínicas Dr. Manuel Quíntela.
CASO CLÍNICO
Mujer, de 21 años de edad, primigesta, cursando un embarazo de 11 semanas de gestación, ingresa al hospital de clínicas para la evaluación de una masa pulmonar derecha de 9 cm de diámetro, hallazgo radiológico que fue realizado en el contexto de una consulta en emergencia por intento de autoeliminación. (Figua1) (Figura 2). Posteriormente se realizó una biopsia guiada por tomografía de la masa pulmonar que demostró la presencia de una neoplasia fusocelular con morfología y perfil de inmunohistoquímica compatible con sarcoma sinovial monofásico (Citoqueratina -, Vimentina +, CD99+, FL1+, BCL2+, TLE1 +). Los estudios de estadificación no evidenciaron la presencia de metástasis por lo que el tumor fue catalogado según la clasificación TNM (8va Edición, 2017) como T2N0M0 grado histológico 3, estadio IIIA. Evaluado el caso en conjunto con colegas de cirugía de tórax, se decide dado que era posible su resección con márgenes negativos, la realización de una lobectomía superior derecha. El estudio anatomopatológico confirma el diagnóstico de SS monofásico de 72x71x46mm que infiltra estructuras bronquiales y la pleura visceral con márgenes negativos. Se observa un alto número de mitosis: 66 mitosis en 50 campos de gran aumento. 0/2 ganglios. (Figura 3-4-5-6).
Este caso fue presentado en el comité de oncología ginecológica y perinatal donde se integraron diversas especialidades para el manejo terapéutico integral de la madre y el feto. Se decidió que dada la presencia de algunos factores de mal pronóstico para la recaída sistémica como el tamaño tumoral y número de mitosis (ver Tabla 2) se realice un tratamiento de quimioterapia adyuvante por 2-3 ciclos durante el tercer trimestre del embarazo seguida al finalizar la gestación, de radioterapia en el tórax y quimioterapia hasta completar 5 ciclos, balanceando los potenciales riesgos y beneficios para la madre y el feto; también, discutiendo los mismos con la paciente, la cual aceptó la realización de quimioterapia adyuvante, que inicia cursando la semana 24 de gestación (Adriamicina 80 mg el Día 1 e Ifosfamida 2.5 gr Días 1, 2 y 3 asociado a Mesna los días 1,2,3) cumpliendo un total de 2 ciclos cada 21 días, durante su embarazo. En el seguimiento obstétrico ecográfico a las 32 semanas se le diagnosticó oligohidramnios y restricción de crecimiento intrauterino que se atribuyó a la quimioterapia, también se le realizó una ecografía Doppler feto-útero-placentario que indicó la presencia de un aceptable estado hemodinámico fetal. Se decidió dado estos hallazgos, interrumpir el embarazo y realizar una cesárea a las 33 semanas de gestación obteniéndose un recién nacido sano, de 1400 gramos, Apgar 8/9 que ingresa a neonatología teniendo una evolución favorable durante la internación. La paciente recibió luego de la cesárea 2 ciclos de quimioterapia adicionales a la dosis estándar y luego por decisión de la paciente se interrumpe el tratamiento, no aceptando continuar con quimioterapia ni la realización de radioterapia en el tórax.. Actualmente, a 15 meses del diagnóstico, se encuentra libre de recidiva.
DISCUSIÓN
El sarcoma sinovial pleuropulmonar primario, es un tumor mesenquimatoso de pulmón y/o pleura, aparece con mayor frecuencia en niños, representa el 8% de los sarcomas.1 El lugar de presentación habitual son las extremidades, sin embargo, puede localizarse en cabeza y cuello, pared abdominal, tracto gastrointestinal, corazón, riñón, peritoneo, pulmón y pleura.4–6 El debut como tumor primario de pulmón y/o pleura, es raro y altamente agresivo.7–10 Se presenta entre las edades de 15 y 40 años11,12con una media de edad de 38 años; no tiene diferencias en cuanto al sexo y no se relaciona con el tabaquismo.7 .
Cuando se localiza en hemitórax se presentan síntomas como dolor torácico, disnea, tos seca, febrícula; hemo, hidro o neumotórax9,13 pero algunos pacientes pueden ser asintomáticos como el caso de nuestra paciente, que fue un hallazgo incidental durante la valoración imagenológica en el contexto de un intento de autoeliminación. El diagnóstico de sarcoma sinovial se basa en datos clínicos, morfológicos, inmunohistoquímicos y citogenéticos. Se distinguen cuatro tipos básicos de sarcoma sinovial: monofásico, que está compuesto completamente por células fusiformes; bifásico: con forma de huso y células epiteliales, monofásico fibroso y el pobremente diferenciado.11,14 En la inmunohistoquímica, es positivo para citoqueratina, antígeno epitelial de membrana (EMA), B cell Lymphoma 2 (Bcl-2) y vimentina; ynegativo para S-100, desmina, actina de músculo liso y marcadores tumorales vasculares. En la Tabla 1, se compara al SS con otros tumores frecuentes en esa localización (Mesotelioma, fibrosarcoma, hemangiopericitomas, leiomiosarcoma, tumor fibroso solitario) con los que se debe hacer un diagnóstico diferencial.15
SS18-SSX es una translocación equilibrada característica entre los cromosomas X y 18, t(X; 18) (p11.2; q11.2) que se encuentra en el 80-90% de los casos de sarcoma sinovial, y se confirma mediante la detección de la translocación SS18-SSX por FISH o de la proteína producto de esa fusión por RT-PCR.15–17 Esta fusión del gen SS18 en el cromosoma 18 y uno de los 3 genes SSX del cromosoma X (SSX1, SSX2 y SSX4) se cree que está en la base de la patogénesis del sarcoma por la desregulación de la expresión del gen.17 En nuestro caso clínico el informe de anatomía patológica reporta una neoplasia fusocelular de alto grado con inmunohistoquímica concordante, aunque por limitaciones de disponibilidad del estudio molecular en nuestro medio, no pudo realizarse el análisis genético utilizando FISH o RT-PCR con el fin de determinar la translocación característica.
La detección molecular sería de preferencia en este y todos los casos, ya que son alteraciones propias de la patología y confirmatorias del diagnóstico.18 En el caso presentado, dado que en nuestro medio no es posible realizar el estudio molecular, porque requiere de métodos de testeo complejos y patólogos especializados en estas técnicas, se planteó por el equipo multidisciplinario que dado se cumplieron los demás requisitos para el diagnóstico (clínicos, histológicos, inmunohistoquímicos) y no existen otros planteos diferenciales, considerar el diagnostico de sarcoma sinovial y proseguir con el tratamiento. Las guías europeas para el manejo de los sarcomas plantean que el estudio molecular es un estudio esencial cuando: el diagnóstico patológico específico es dudoso, la presentación clínica- patológica es inusual, y puede tener valor pronóstico y / o predictivo para seleccionar el tratamiento.19,20
En la mayoría de los sarcomas de localización torácica, las imágenes de tomografía computarizada muestran una lesión bien definida de densidad heterogénea sin afectación ósea adyacente y sin calcificaciones, a menudo acompañada de un derrame pleural ipsilateral, lo que tiene correlación con la tomografía de tórax de la paciente.
Los factores de mal pronóstico son edad avanzada, tamaño del tumor >5 cm, sexo femenino, resección incompleta, alto número de mitosis (> 10 por 10 campos de gran aumento), estado de los márgenes positivos, invasión neurovascular y, recientemente la variante SYT-SSX1.1,16(Tabla 2). Tomando en consideración estos factores, la paciente del caso clínico pertenece al grupo de alto riesgo de metástasis a distancia con mal pronóstico.
La asociación sarcomas y embarazo es excepcional, la influencia del embarazo en la iniciación, promoción, desarrollo de sarcomas no está establecido. Adameşteanu et al. En sus publicaciones refiere que durante la gestación el desbalance hormonal podría contribuir al crecimiento del tumor, pero la fisiopatología no es del todo clara.14
La recaída es principalmente local involucrando pared torácica, pericardio, diafragma. La extensión directa a la cavidad abdominal y las metástasis a ganglios linfáticos son infrecuentes. Su diseminación vía hemática es principalmente a hueso, hígado y cerebro.21
El tratamiento actual para el sarcoma pleuropulmonar primario es controvertido, al no existir una terapéutica estándar, la evidencia surge de reporte de casos y extrapolaciones de tratamientos de sarcoma sinovial primario de extremidades, donde principalmente se opta por la resección quirúrgica.. De la publicación de Bacha et al. surge que la resección completa de los sarcomas pulmonares primarios puede producir una tasa de supervivencia a 5 años del 69%.22 Aquellos con resección incompleta, bulky, ganglios comprometidos o factores de mal pronóstico pueden someterse a tratamientos multimodales.23 Destacamos que en las gestantes la cirugía es posible en todos los trimestres, pero es preferible durante el segundo trimestre cuando el riesgo de aborto espontáneo disminuye. El uso de radioterapia debe ser considerada una vez finalizado el embarazo dado el alto riesgo de complicaciones fetales que parecen cuando el feto recibe dosis superiores a 0.2 Gy.24 Los efectos dependerán de la dosis administrada y la etapa del embarazo. Durante el periodo preimplantacional conlleva riesgo de muerte del embrión y luego durante el primer trimestre en etapa de la organogénesis, produce riesgo de anencefalia o microcefalia, alteraciones oculares, espina bífida, retraso mental, etc. También en etapas posteriores puede producir alteraciones del desarrollo fetal, retraso mental, alteraciones esqueléticas, retardo de crecimiento intrauterino, riesgo de infertilidad y cáncer.25 +).
La rareza de este tumor no permitió hasta la fecha estudios fase II o III de quimioterapia o radioterapia adyuvante /neoadyuvante en esta patología, por lo que sus beneficios no son del todo claros, sin embargo, dada la evidencia disponible sabemos que el tratamiento combinado podría reducir el riesgo de metástasis a distancia.11,26
Pruebas más convincentes de la eficacia de la quimioterapia adyuvante en el tratamiento de sarcomas de tejidos blandos en adultos, pudo ser reportada en un estudio del Grupo Cooperativo Pediátrico Italiano y Alemán de Sarcomas de Tejidos Blandos, donde se evidencia que los tumores con tamaño menor de 5 cm, por lo general no se benefician de tratamiento adyuvante si tuvieron una resección completa. Los de alto riesgo: con más de 5 cm y con factores de mal pronóstico se podría considerar tratamiento con quimioterapia.26,27 Por lo expuesto se optó por realizar quimioterapia con criterio adyuvante usando el plan de quimioterapia estándar (Adriamicina 50 mg/m2 más Ifosfamida 1,5mg/m2 con mesna) para sarcomas, de forma intravenosa en bolo28 con dosis de Ifosfamida distribuida en 3 días.29
Cabe destacar los problemas terapéuticos vinculados a la quimioterapia en el embarazo, la gran mayoría de antineoplásicos se pueden administrar después de la semana 14 de gestación24 considerando el peso actual de la paciente en cada ciclo y con las mismas dosis que pacientes no embarazadas.
Hasta la fecha no se ha demostrado un incremento de la mortalidad materna o de los efectos secundarios propios de los medicamentos, pero si hay que considerar los potenciales efectos teratogénicos cuando se administran en el primer trimestre.30
Después del segundo trimestre la quimioterapia no está asociada con una tasa de defectos de nacimiento por encima del 3% encontrada en la población general.31
En un estudio reportado en la literatura internacional por Cardonick et al. analizaron 376 fetos expuestos a quimioterapia en el útero y mostraron las siguientes complicaciones: restricción de crecimiento intrauterino (7%), rotura espontánea de membranas o trabajo de parto prematuro (5%), muerte fetal (5%) y muerte neonatal (1%), pero el perfil de toxicidad fetal varia con la droga y el tiempo de exposición a la misma.32
La doxorrubicina es categoría D en el embarazo y se han documentado casos de atresia intestinal, fístula traqueoesofágica, hipoplasia de vejiga junto con anomalías cardiovasculares,33 presenta una toxicidad aceptable y las guías internacionales indican un riesgo bajo de afectar el desarrollo del feto si se usan en el 2 y 3 trimestre de gestación.34,35 La ifosfamida también es categoría D, hay pocos casos reportados de su uso en embarazadas con cáncer,23,28,36 se ha relacionado a malformaciones fetales, oligoamnios, hemorragia intraventricular y restricción de crecimiento intrauterino,35
Los resultados a largo plazo de los niños expuestos a quimioterapia intrauterina no son del todo claros, no existe evidencia de buena calidad y se necesitan análisis prospectivos para sacar conclusiones y realizar recomendaciones. Sin embargo, muchos de los niños presenta un desarrollo normal sin problemas de salud, con habilidades cognitivas, rendimiento académico y conductual similar a la población general,37,38 pero se ha reportado alteraciones cardiacas, perdida de la audición, disfunción gonadal, infertilidad, retraso en el crecimiento, presencia de cáncer y alteraciones neurológicas;24,39 por lo que todos los recién nacidos deben ser examinados por un neonatólogo para evaluar y detectar posibles anormalidades congénitas y enfermedades actuales o potenciales.
El tercer consenso internacional de canceres en el embarazo recomienda mediciones antropométricas (peso, longitud, circunferencia cefálica) que debe obtenerse para evaluar el crecimiento en cada visita y se debe tener un alto índice de sospecha a largo plazo para detectar posibles trastornos hematológicos (especialmente si se administró quimioterapia 4 semanas antes del parto), inmunológicos, auditivos (en los expuestos a platinos), cardiacos (electrocardiograma y ecocardiograma principalmente en quienes se expusieron a antraciclinas) y neurológicos al primer mes, posteriormente a los 6, 12, 18 meses pasando a una vez al año hasta los 17 años.24 También se recomienda una consulta genética y durante el desarrollo del niño realizar tamizaje de cáncer (si corresponde) y alteraciones reproductivas.31
Al inicio del tratamiento se obtuvo el consentimiento de la paciente ampliamente informada de los riesgos, eventuales complicaciones y expectativas con el plan de quimioterapia a usar, se la vigiló estrechamente durante todo el término del embarazo, destacando la importancia del manejo de un equipo interdisciplinario para la captación de complicaciones de forma temprana y su resolución precoz. La paciente se encuentra viva hasta la actualidad. Sigue en controles estrictos con el fin de evaluar tempranamente sitios de recurrencia, su hijo se encuentra sano y sin patologías documentadas.
CONCLUSIONES
Si bien el tratamiento adyuvante en sarcomas sinoviales es controvertido, dado el pobre pronóstico, la naturaleza agresiva de este tumor y alto riesgo de recaída, la terapéutica escogida fue la exéresis tumoral durante el embarazo con la adición de quimioterapia adyuvante y posterior radioterapia para optimizar los resultados maternos. A pesar de no existir una terapéutica estándar, la quimioterapia adyuvante en pacientes de alto riesgo, aún en el curso de un embarazo (luego del primer trimestre) debe ser considerada.
Declaración de consentimiento del paciente.
Los autores certifican que se obtuvieron todos los formularios de consentimiento necesarios en las acciones médicas realizadas al paciente y para que sus imágenes y otra información clínica sean reportadas en la revista.
REFERENCIAS
- Weiss S, Goldblum J. Enzinger and Weiss’s Soft Tissue Tumors. 6th Edition. (Elsevier by Saunders, ed.). 8th November 2013; 2008.
- Estors M, Rinaldi P, Gaspar C. Neumotórax de repetición como presentación de sarcoma sinovial pleuropulmonar. Rev Patol Respir. 2012;15(2):61-63.
- Rajeev L, Patidar R, Babu G. A rare case of primary synovial sarcoma of lung. Lung India. 2017;34(6):545-547. doi:10.4103/lungindia.lungindia_7_17
- Kanade U, Gadgil P. Abdominal Wall Synovial Sarcoma During Pregnancy-a Case Report. Indian J Surg. 2013;75(Suppl 1:463-464. doi:10.1007/s12262-012-0794-z
- Schreiber-Facklam H, Bode-Lesniewska B. Primary monophasic synovial sarcoma of the duodenum with SYT/SSX2 type of translocation. Hum Pathol. 2007;38(6):946-949. doi:10.1016/j.humpath.2007.01.018
- Saif A. Primary synovial sarcoma of the abdominal wall: a case report and review of the literature. J Fam Community Med. 2008;15(3):123–125. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3377125/
- Esaka E, Celebrezze J. Pulmonary synovial sarcoma presenting as a pneumothorax during pregnancy. Obs Gynecol. 2008;111(2 Pt 2:555-558. doi:10.1097/01.AOG.0000286769.70432.de
- Dennison S, Weppler E. Primary Pulmonary Synovial Sarcoma: A Case Report and Review of Current Diagnostic and Therapeutic Standards. Oncologist. 2004;9:339-342. doi:10.1634/theoncologist.9-3-339
- Bunch K, Deering S. Primary Pulmonary Synovial Sarcoma in Pregnancy. Case Rep Obs Gynecol. 2012;2012:32603:1-3. doi:10.1155/2012/326031
- Altekruse S. SEER Cancer Statistics Review, 1975–2007. National Cancer Institute. Published 2009. http://seer.cancer.gov/csr/1975_2007/ (table 15.28)
- Silva R, Gross J. Primary monophasic synovial sarcoma of the pleura: Neoadjuvant chemotherapy followed by complete resection. Thorac Cancer. 2010;1(3):95-101. doi:10.1111/j.1759-7714.2010.00019.x
- Mrabet F, El Ouazzani H. Primary Pleuropulmonary Synovial Sarcoma: A Case. Case Rep Pulmonol. Case Rep Pulmonol. 2018;2018:51902. doi:10.1155/2018/5190271
- Colwell A, D’Cunha J. Synovial sarcoma of the pleura: a clinical and pathologic study of three cases. J Thorac Cardiovasc Surg. 2002;124(4):828-832. doi:10.1067/mtc.2002.124242
- Adameşteanu M, Scurtu R, Lascăr I. Biphasic synovial sarcoma in a 19-year-old pregnant woman: a case report. Rom J Morphol Embryol. 2015;56(1):289-294.
- Lang T, Chen H, Xiong B. Primary pleuropulmonary and mediastinal synovial sarcoma: a clinicopathologic and molecular study of 26 genetically confirmed cases in the largest institution of southwest China. Diagn Pathol. 2016;11(1):62. doi:10.1186 / s13000-016-0513-3
- Bergh P, Meis-Kindblom J. Synovial sarcoma: identification of low and high risk groups. Cáncer. 1999;12:2596–2607. doi:doi.org/10.1002/(SICI)1097-0142(19990615)85:12<2596::AID-CNCR16>3.0.CO;2-K
- Klebe S, Prabhakaran S, Hocking A. Pleural malignant mesothelioma versus pleuropulmonary synovial sarcoma: a clinicopathological study of 22 cases with molecular analysis and survival data. Pathology. 2018;50(6):629-634. doi:10.1016/j.pathol.2018.06.001
- org. Soft Tissue Sarcoma NCCN Clinical Practice Guidelines in Oncology. Evidence Block. NCCN. 2020;Version 6.:67-68. https://www.nccn.org/professionals/physician_gls/pdf/sarcoma_blocks.pdf
- Casali P, Abecassis N, Bauer S. Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018;29 (Suppl:iv51-iv67.
- Coindre J, Pelmus M. Should molecular testing be required for diagnosing synovial sarcoma? A prospective study of 204 cases. Cancer. 2003;98(12):2700-2707. doi:10.1002/cncr.11840
- Mirzoyan M, Muslimani A, Setrakian S. Primary pleuropulmonary synovial sarcoma. Clin Lung Cancer. 2008;9:257-261.
- Bacha E, Wright C, Grillo H. Surgical treatment of primary pulmonary sarcomas. Eur J Cardiothorac Surg. 1999;15(4):456-460. doi:10.1016/s1010-7940(99)00045-7
- Olivier M, Narjiss B, Domont J. Doxorubicin and ifosfamide for high-grade sarcoma during pregnancy. Cancer Chemother Pharmacol. 2012;69:357–367.
- Amant F, Berveiller P, Boere I. Gynecologic cancers in pregnancy: guidelines based on a third international consensus meeting. Ann Oncol. 2019;30:1601–1612. doi:10.1093/annonc/mdz228
- Mazeron R, Barillot I, Mornex F. Radiothérapie et grossesse [Radiotherapy during pregnancy]. Cancer Radiother. 2016;20 Suppl:S264-S268.
- Ferrari A, Brench I. The role of adjuvant chemotherapy in children and adolescents with surgically resected, high‐risk adult‐type soft tissue sarcomas. Pediatr blood Cancer. 2005;Volume 45(2):128-134. https://onlinelibrary.wiley.com/doi/pdf/10.1002/pbc.20376
- Deshmukh R, Mankin H. S. Synovial sarcoma: the importance of size and location for survival. Clin Orthop Relat Res. 2004;419:155-161. https://pubmed.ncbi.nlm.nih.gov/15021147/
- Boddy A, Yule S, Wyllie R. Comparison of Continuous Infusion and Bolus Administration of Ifosfamide in Children. European Journal of Cancer. Eur J Cancer. 1995;31:785-790.
- Germann N, Goffinet F, Goldwasser F. Anthracyclines during pregnancy: embryo-foetal outcome in 160 patients. Ann Oncol. 2004;15:146–150. doi:10.1093 / annonc / mdh009
- Gziri M, Amant F, Debiève F. Effects of chemotherapy during pregnancy on the maternal and fetal heart. Prenat Diagn. 2012;32(7):614-619. doi:10.1002/pd.3847.
- Amant F, Halaska M, Fumagalli M. Gynecologic cancers in pregnancy: guidelines of a second international consensus meeting. Int J Gynecol Cancer. 2014;24(3):394–403. doi:10.1097/IGC.000000000000006
- Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. Lancet Oncol. 2004;5(5):283–291. doi:10.1016/S1470-2045(04)01466-4
- ADRIAMYCIN (DOXOrubicin HCl) for Injection. AF 34171.
- Amant F, Deckers S, Van Calsteren K. Breast cancer in pregnancy: recommendations of an international consensus meeting. Eur J Cancer. 2010;46:3158–3168. doi:10.1016/j.ejca.2010.09.010
- Fernandez H, Diallo A, Baume D. Anhydramnios and cessation of foetal growth in a pregnant mother with polychemotherapy during the second trimester. Prenat Diagn. 1989;9(9):681–682. doi:10.1002/pd.1970090913
- Lergier J, Jimenez E, Maldonado N. Normal pregnancy in multiple myeloma treated with cyclophosphamide. Cancer. 1974;34(4):1018-1022. doi:10.1002/1097-0142(197410)34:4<1018::aid-cncr2820340409>3.0.co;2-4
- Cardonick E, Gringlas M, Hunter K. Development of children born to mothers with cancer during pregnancy: comparing in utero chemotherapy-exposed children with nonexposed controls. Am J Obs Gynecol. 2015;212(5):658.e1-8.
- Murthy R, Theriault R, Barnett C. Outcomes of children exposed in utero to chemotherapy for breast cancer. Breast Cancer Res. 2014;16(6):500. doi:10.1186/s13058-014-0500-0.
- Partridge A, Garber J. Long-term outcomes of children exposed to antineoplastic agents in utero. Semin Oncol. 2000;27(6):712-726. https://pubmed.ncbi.nlm.nih.gov/11130479/
TABLAS Y FIGURAS
Tabla 1. Diferencias por IHQ de las neoplasias primarias de pulmón.
| Caso clínico | Sarcoma Sinovial | Leiomiosarcoma | Mesotelioma | |
| SYT-SSX | no se realizó | + | – | – |
| IHQ | ||||
| Citoqueratina | no evaluable | + | + | |
| Vimentina | + | + | + | |
| Antígeno epitelial de membrana (EMA) | + | + | ||
| Proteína S-100 | +/- | |||
| B cell Lymphoma tipo 2 (Bcl-2) | + | + | ||
| Clúster of differentiation 99 (CD 99) | + | + | ||
| Friend leukemia integration 1 transcription factor (FLI 1) | + | |||
| Desmina | – | + | ||
| Calretinina | – | + | ||
Tabla 2. Grupos de riesgo para el desarrollo de metástasis.
| Grupos de alto y bajo riesgo de metástasis en los Sarcomas Sinoviales. | |
| Bajo riesgo de metástasis | Alto riesgo de metástasis |
| Edad <25 años | Edad >25 años |
| Tamaño <5cm | Tamaño >5cm |
| Ausencia de áreas de pobre diferenciación | Presencia de áreas de pobre diferenciación |
| Resección completa | Márgenes positivos de resección |
| Bajo número de mitosis | Alto número de mitosis |
Elaborado por el autor. Adaptado de libro Enzinger and Weiss’s Soft Tissue Tumors. 6th Edition. 1
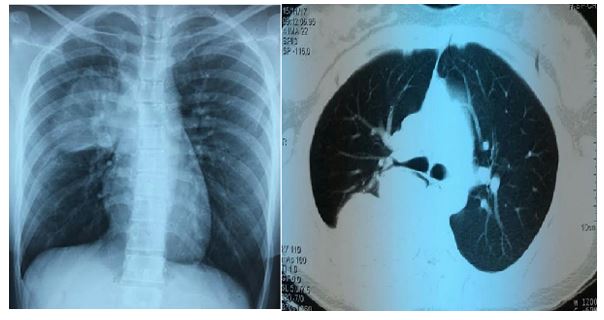
Figura 1. A. Radiografía de Tórax: Tumor en el tercio medio de lóbulo superior derecho. B. Tomografía de tórax: Tumoración de tercio medio de hemitórax derecho de 95mmx75x80mm de diámetro, de densidad heterogénea con el medio de contraste, que por su sector posterior presenta amplio contacto parietal, sin evidencia de erosiones óseas adyacentes. Por su sector anterior contacta con el bronquio intermediario, al que desplaza anteriormente y comprime.
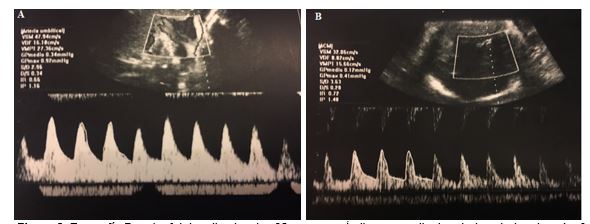
Figura 2. Ecografía Doppler fetal realizado a las 32 semanas: Índice promedio de arterias uterina derecha 0.73, izquierda 0.69. Figura A. Índice promedio de la Arteria umbilical 1.16 (Percentil 50-75). Figura B. Índice promedio de la arteria cerebral media 1.48. Índice promedio relación cerebro placentaria 1,27.
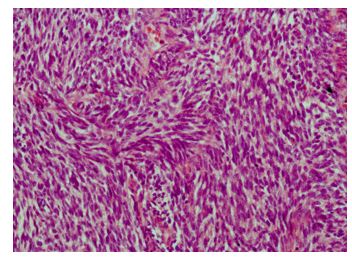
Figura 3. Técnica Hematoxilina y eosina: Proliferación fusocelular atípica, fasciculada y arremolinada, con células de talla media fusiformes, pobremente diferenciada con escaso citoplasma y núcleo ovoideo hipercromático. HE 10 x
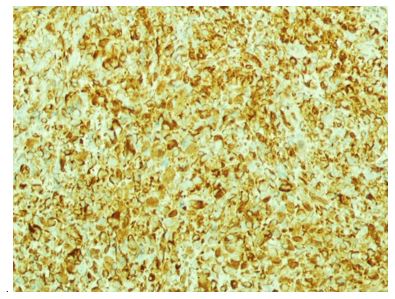
Figura 4. Inmunohistoquímica vimentina; Intensa marcación de membrana en 100 % de las células neoplásicas. 40 x
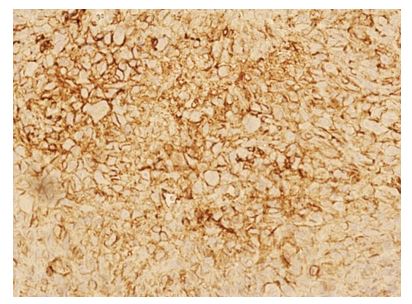
Figura 5. Inmunohistoquímica CD 99: Intensa marcación de membrana en más del 90 % de las células neoplásicas. 40 x
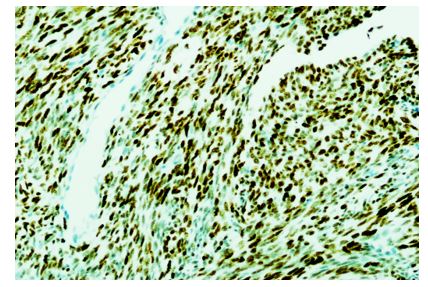
Figura 6. Inmunohistoquímica TLE 1: Intensa marcación nuclear más del 95 % de las células neoplásicas. 10x.



