2017
2
Autores:
Fernanda Cofré, Luis Delpiano, Yenis Labraña, Alejandra Reyes, Alejandra Sandoval, Giannina Izquierdo
Tipo de documento:
Guía ClínicaSÍNDROME DE TORCH: ENFOQUE RACIONAL DEL DIAGNÓSTICO Y TRATAMIENTO PRE Y POST NATAL.
Contenido del documento:
RESUMEN
Recomendaciones del Comité Consultivo de Infecciones Neonatales
Sociedad Chilena de Infectología, 2016.
TORCH Syndrome: Rational approach of pre and post natal diagnosis.
Recommendations of the Advisory Committee on Neonatal Infections. Sociedad Chilena de Infectología, 2016
Existen numerosas infecciones bacterianas, virales y parasitarias que pueden transmitirse desde la madre al feto o recién nacido (RN) y que significan un riesgo para él. El acrónimo TORCH se utiliza en forma universal para caracterizar a aquel feto o RN que presenta un cuadro clínico compatible con una infección congénita y que permite un enfrentamiento racional, tanto diagnóstico como terapéutico. El concepto tradicional de realizar un “test de TORCH” sin consideraciones específicas a cada paciente, hoy en día se considera no adecuado y ha sido reemplazado por exámenes específicos para patógenos específicos bajo circunstancias bien definidas. El presente documento revisa las características generales, epidemiológicas, patogénicas, diagnósticas y terapéuticas de los patógenos más frecuentemente involucrados en el estudio de pacientes con sospecha de TORCH.
PALABRAS CLAVE: TORCH, infección congénita, toxoplasmosis, tripanosomiasis americana, enfermedad de Chagas, síndrome de rubéola congénita, citomegalovirus, herpes simplex
SUMMARY
There is a lot of bacterial, viral or parasite infections who are able to be transmitted vertically from the mother to the fetus or newborn which implicates an enormous risk for it. The TORCH acronym is used universally to refer to a fetus or newborn which presents clinical features compatible with a vertically acquired infection and allows a rational diagnostic and therapeutic approach. The traditional “TORCH test” is nowadays considered not appropriate and it has been replaced for specific test for specific pathogens under well defined circumstances. The present document reviews the general characteristics, epidemiology, pathogenesis, diagnostic and therapeutic options for the most frequently involved pathogens in the fetus or newborn with TORCH suspicion.
KEY WORDS: TORCH, congenital infection, toxoplasmosis, American trypanosomiasis, Chagas disease, congenital rubella syndrome, cytomegalovirus, herpes simplex.
Existen numerosas infecciones bacterianas, virales y parasitarias que pueden transmitirse desde la madre al feto o recién nacido (RN) y que representan un riesgo para él. La infección puede ser adquirida en diferentes periodos durante la vida intrauterina y neonatal: in utero, al momento del parto o en periodo post natal (1,2). El resultado final de este proceso infeccioso se puede traducir en reabsorción del embrión, aborto, mortinato, malformaciones congénitas, RN prematuros, retardo del crecimiento intrauterino (RCIU), enfermedad aguda in utero en el RN o post parto, infección asintomática pero persistente en el periodo neonatal con secuelas neurológicas crónicas o un niño sano sin secuelas (1,3).
El acrónimo TORCH se utiliza en forma universal para caracterizar aquel feto o RN que presenta un cuadro clínico compatible con una infección congénita y permite un enfrentamiento racional, tanto diagnóstico como terapéutico (4,5) Los microorganismos clásicamente incluidos son Toxoplasma gondii, virus de la rubéola, citomegalovirus (CMV), virus herpes simplex (VHS) y otros agentes (en orden alfabético: enterovirus, Listeria monocytogenes, Mycobacterium tuberculosis, parvovirus B-19, Treponema pallidum, Trypanozoma cruzi, virus de hepatitis B, virus de inmunodeficiencia humana, virus varicela-zoster)
Las manifestaciones clínicas de las infecciones congénitas están influenciadas por múltiples factores independientes entre sí, como el efecto del patógeno sobre la organogénesis, el momento en que ocurre la infección respecto a la edad gestacional, la presencia o ausencia de inmunidad materna y el modo de adquisición de la infección (1,5). Los abortos o mortinatos generalmente se dan cuando la madre se infecta tempranamente en el embarazo o cuando la enfermedad sistémica de la madre es grave. La razón por la cual se producen partos prematuros no es bien comprendida pero está descrito que aquellos niños con infecciones virales congénitas y pequeño para la edad gestacional (PEG), son el resultado de un RCIU producto de la disminución.
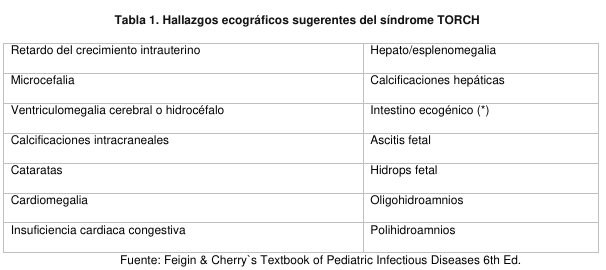
Las infecciones fetales virales pueden sospecharse si la madre se ve expuesta o experimenta una infección por un virus conocido que se puede transmitir en forma vertical o frente a anomalías detectadas en los controles ecográficos de rutina. (Tabla 1). El diagnóstico serológico definitivo de infección aguda en la mujer embarazada requiere la demostración de seroconversión. (1).
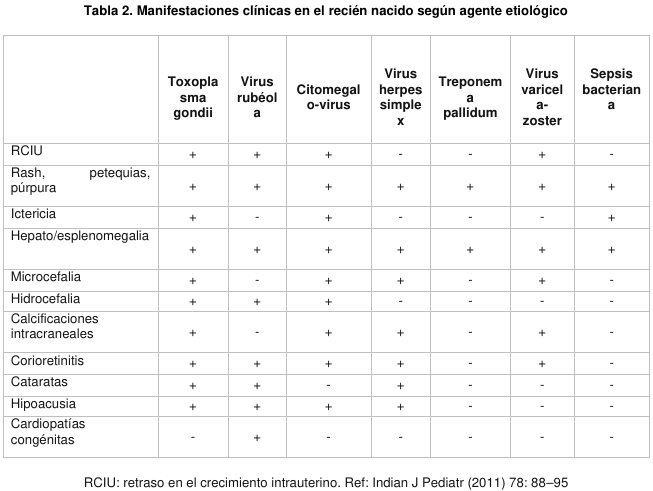
En el RN, los hallazgos clínicos habituales que sugieren una infección congénita aguda son: ictericia, petequias o hepato/esplenomegalia al momento de nacer o inmediatamente posterior al parto, en un neonato habitualmente PEG. Por otro lado, frente a un RN con sospecha de sepsis neonatal en que los cultivos son sistemáticamente negativos para bacterias y hongos, también debe plantearse la posibilidad de una infección congénita aguda. (Tabla 2).
Frente a la sospecha de una infección congénita debe evaluarse a la madre en búsqueda de antecedentes que apoyen esta posibilidad. Sin embargo, la ausencia de historia de infección no descarta la posibilidad de infección en el RN dado que la mayoría de ellas son asintomáticas.
La larga lista de patógenos capaces de producir infecciones congénitas debe ser considerada a la luz de los síntomas clínicos del RN, epidemiología en torno a la gestación, el estado materno de vacunación, el tamizaje serológico efectuado durante el embarazo y factores de riesgo como viajes a zonas endémicas o conductas sexuales. Para que el apoyo con pruebas de laboratorio tenga un buen rendimiento, debe solicitarse muestras adecuadas en el momento correcto y utilizarse exámenes precisos con buena sensibilidad y especificidad (4). El concepto tradicional de realizar un “test de TORCH” sin consideraciones específicas a cada paciente, hoy en día se considera no adecuado y ha sido reemplazado por exámenes específicos para ciertos patógenos bajo circunstancias bien definidas.
El ser un RN PEG -presente en 3 a 7% de los RN- no corresponde a una entidad específica en sí, sino que es una manifestación de múltiples patologías maternas, fetales o placentarias. Dado que una de las posibles causas es tener una infección congénita, algunos autores sugieren realizar un “test de TORCH” como parte de la evaluación rutinaria en estos RN; sin embargo, esta asociación está basada en datos limitados. Datos actuales sugieren de poca utilidad un tamizaje TORCH completo a aquellos RN cuya única manifestación clínica es ser PEG, ya que, la incidencia de CMV estudiada mediante prueba de cultivo acelerado (shell vial) en orina en este grupo específico es tan sólo de 2%. (6,7).
A continuación revisaremos las características generales, epidemiológicas, patogénicas y principalmente del diagnóstico de los patógenos más frecuentes involucrados en el estudio de pacientes con sospecha del síndrome TORCH.
Toxoplasmosis
Toxoplasma gondii es un protozoo tisular de distribución cosmopolita, intracelular obligado, del Phylum Apicomplexa.
Epidemiología
La toxoplasmosis es la zoonosis más frecuente en el mundo, con prevalencia de infección que alcanza hasta 80-90% en algunos países. Es universal y afecta a todos los animales de sangre caliente incluyendo al hombre. El hombre se infecta al ingerir carne cruda o insuficientemente cocida que tenga quistes del parásito o por el consumo de frutas y hortalizas que estén contaminadas con ooquistes de T. gondii eliminados por las heces de gatos jóvenes infectados. En Chile, la infección adquirida comienza al año o año y medio de vida y va aumentando con la edad, de modo tal que 40% de la población mayor de 21 años presenta la parasitosis. (8). La toxoplasmosis congénita (TC) es una enfermedad poco frecuente. Sin embargo, sus graves consecuencias en algunos niños hacen que sea motivo de interés y preocupación por parte de obstetras y pediatras. De acuerdo a la experiencia mundial se produce un caso congénito por cada 1.000 partos (8).
Enfermedad congénita.
El riesgo de la transmisión al hijo
La transmisión del parásito de la madre al hijo puede ocurrir únicamente cuando la infección se adquiere por primera vez durante el embarazo y aumenta gradualmente con el progreso de la gestación. En términos generales, un tercio de las madres con infección aguda darán a luz un hijo con toxoplasmosis, en su mayoría con un desarrollo normal; sin embargo, el 4% tiene posibilidades de morir, tener un daño neurológico permanente o compromiso visual desde los primeros años de vida. (9)
La infección materna es sub-clínica en la mayoría de los casos; por lo tanto, el diagnóstico se basa en pruebas serológicas. La mujer gestante debe conocer su estado inmunológico con respecto a la enfermedad y las mujeres susceptibles deben tomar las precauciones específicas.
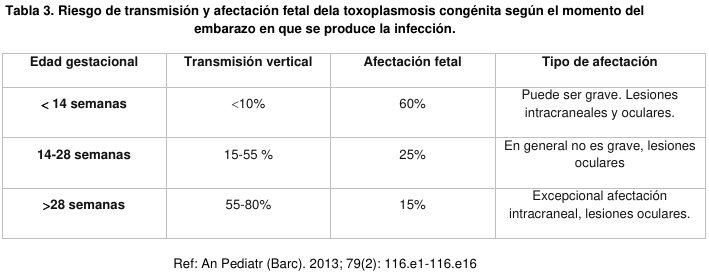
Luego de la primo-infección ocurrida durante el embarazo, puede sobrevenir la transmisión vertical del parásito al producto de la concepción y causar una amplia gama de secuelas que van desde el aborto espontáneo hasta el nacimiento de un niño con diferentes manifestaciones clínicas o asintomático. Sin embargo, la mayoría de los RN infectados es aparentemente sano y puede presentar las manifestaciones de la infección años después del nacimiento. La transmisión placentaria ocurre en relación lineal con el tiempo de gestación: es baja la frecuencia en el primer trimestre y aumenta hacia el final del embarazo. (Tabla 3).
La enfermedad en el hijo se manifiesta en la vida intrauterina o después del nacimiento. El compromiso de quienes presentan la infección varía de acuerdo al grado de lesión: corio-retinitis, ceguera, hidrocefalia, calcificaciones intracerebrales, epilepsia, retraso mental (RM) o retraso del desarrollo psicomotor (RDSM). El riesgo de generar lesiones es mayor en las primeras semanas y poco frecuente después de la semana 26. (9)
El riesgo global de transmisión vertical del parásito en la infección materna es alrededor de 40%, pero se reduce significativamente con la administración de espiramicina. En las dos a tres últimas semanas degestación, el riesgo alcanza a 90% y no debiera dejar de tratarse.
Manifestaciones clínicas. Existen cuatro formas de presentación (10):
• Enfermedad neonatal: RN gravemente afectado con expresión clínica de una enfermedad generalizada, compromiso del sistema nervioso central (SNC) y con secuelas que no siempre serán modificables con el tratamiento.
• Enfermedad que se manifiesta en los primeros meses de vida: Se incluyen los niños nacidos con enfermedad, aquellos con reconocimiento tardío de la enfermedad independientemente de la gravedad de los síntomas y niños que nacieron asintomáticos y se manifestaron tardíamente. El diagnóstico del niño se efectúa meses después del nacimiento. Los signos y síntomas pueden desaparecer con el tratamiento.
• Enfermedad que se manifiesta tarde en la vida: Se diagnostica por la presencia de una secuela o la reactivación de una infección no diagnosticada durante la infancia. Se presenta con frecuencia como corio-retinitis y es menos frecuente con síntomas neurológicos como convulsiones o hidrocefalia por estenosis de un acueducto.
• Infección asintomática: El 90% de los niños infectados son clínicamente sanos y muestran IgG persistentes o crecientes como única expresión de su infección. Pueden padecer secuelas o desarrollar corio-retinitis, sordera, hidrocefalia, RM o RDSM años más tarde, por lo que requieren tratamiento.
Sintomatología en el recién nacido
Los signos y síntomas de la TC son muchos y muy variados, pero no específicos. (Tabla 4). También hay que considerar que la TC mantiene una clínica semejante con otras infecciones congénitas, especialmente con la infección causada por CMV.
Por su frecuencia y sus características clínicas, las lesiones corio-retinianas y las encefálicas son las más típicas y también, las más graves y deben buscarse en forma dirigida.
Diagnóstico etiológico (Tablas 5 y 6).
El diagnostico de la infección por T. gondii esta basada primariamente en el estudio serológico.
IgM es lo primero en aparecer, generalmente 1 semana después de la infección, siendo los niveles crescientes hasta 1-3 meses y luego decrecientes a partir de los 9 meses, llegando a la negativización. Un 9-27% de la población puede tener títulos persistentes de IgM por 2 o mas años (Villard).
IgG aparece a partir de las 2 semanas de la infección llegando a un peak a los 3 meses, mantiene un plateau por 6 meses y luego de 1 año inicia un lento descenso hasta llegar a su nivel mas bajo que se mantiene de por vida debido a la persistencia de los quistes latentes en el individuo infectado. La avidez de estos anticuerpos IgG aumenta progresivamente durante los primeros 4 meses post infección (Villard).
IgA tiene una cinética de producción similar a IgM, con un peak mas tardío y persistencia de los anticuerpos por 3-4 meses post infección (Villard).
Lo ideal sería realizar el tamizaje sistemático de IgG anti-Toxoplasma en toda mujer embarazada en el primer trimestre de gestación. Ante un resultado negativo la mujer embarazada se considera en riesgo de contraer la infección aconsejándose realizar medidas preventivas primarias.
Un resultado positivo puede tener dos interpretaciones:
• considerar que la IgG específica (+) es debida a una infección previa al embarazo y no realizar otros exámenes o
• buscar infección reciente mediante detección de IgM; un resultado de IgM negativo indica que la infección fue antes del embarazo y, por tanto, sin riesgo para el feto.
Diagnóstico prenatal
La detección de IgM materna en la mujer embarazada no significa necesariamente infección aguda, ya que la IgM puede persistir más de un año. Ante esta situación se puede realizar exámenes adicionales como determinación del test de avidez y detección de IgA u obtener una segunda muestra de IgG, una vez transcurridas tres semanas, con objeto de ver si se producen diferencias significativas en el título de anticuerpos. (Figura 2). La demostración de seroconversión entre dos muestras separadas por dos a cuatro semanas y obtenidas durante el embarazo confirma una infección aguda durante la gestación.
Los anticuerpos IgG de alta avidez tardan en aparecer 12 a 16 semanas desde la infección y, por tanto, un resultado de alta avidez en el primer trimestre del embarazo indica que la infección se produjo antes de 16 semanas, por lo que no hay riesgo para el feto. Por el contrario, una baja avidez (o un resultado indeterminado) puede persistir por meses a años después de la infección primaria y, por tanto, no debe ser utilizada como única prueba para confirmar una infección reciente.
Los anticuerpos de clase IgA aparecen poco después de los de clase IgM y persisten 6 a 7 meses desde la primo-infección. Sin embargo, se han detectado en algunos casos durante más de un año y su ausencia en un pequeño porcentaje de infecciones agudas, por lo que han de interpretarse junto con los resultados de avidez. Los ensayos de avidez y de IgA son útiles cuando sólo se dispone de una muestra de suero.
Cuando el diagnóstico se plantea en el segundo o tercer trimestre de gestación y no se dispone de una muestra del inicio del embarazo, la serología no nos permite descartar que se haya producido una infección al inicio del embarazo.
El diagnostico prenatal de infección fetal es necesario cuando los resultados serológicos en la mujer embarazada son indicativos de infección durante la gestación o poco antes de ésta o cuando existe evidencia ecográfica de daño fetal. El diagnóstico de infección fetal se basa en la detección del parásito y/o en la respuesta inmune específica en el feto. La detección del parásito por reacción de polimerasa en cadena (RPC) en muestras de líquido amniótico por amniocentesis es más rápida, sensible y segura que los métodos tradicionales (serología, cultivo e inoculación en ratón) siendo el método de elección. La RPC en líquido amniótico obtenido por amniocentesis a partir de la semana 18 de gestación, tiene una buena sensibilidad y una especificidad de 100%, con un valor predictor positivo de 100%; sin embargo, un resultado negativo no descarta totalmente la infección. La amniocentesis debe realizarse cuando haya trascurrido cuatro semanas desde la infección aguda en la mujer gestante.
La detección del parásito por cultivo en líneas celulares o inoculación en ratón, a partir de muestras de líquido amniótico, también permite establecer el diagnóstico, aunque la menor sensibilidad respecto a la RPC y la mayor complejidad de la técnica hacen que no sea de empleo rutinario.
Diagnóstico en el RN
En el RN la detección de IgM y/o IgA en sangre se considera diagnóstico de infección fetal. La IgM o IgA pueden no ser detectadas hasta en 70% de los niños infectados en el primer trimestre de gestación, por lo que en estos casos se debe hacer el seguimiento serológico durante el primer año de vida. La desaparición de la IgG en el primer año de vida descarta la infección.
En el momento del parto se puede realizar estudio con RPC de la placenta lo que traduce la infección de la placenta pero no necesariamente del RN, examen que tiene una especificidad de 97%. El estudio anátomopatológico de la placenta es de baja sensibilidad y se desaconseja (11).
La RPC en sangre, orina y LCR en el RN se puede realizar como complemento diagnóstico al estudio serológico cuando no se detecta IgA o IgM específicas. Esto último tiene una buena especificidad pero baja sensibilidad por lo que un resultado positivo confirma la infección pero un resultado negativo no la descarta y requiere de seguimiento serológico (11).
Estudio complementario del RN
Al RN con TC confirmada o probable deben realizarse estudios analíticos, de imagen y de microbiología.
• Hemograma y evaluación bioquímica completa con función hepática. Carecen de especificidad y sólo son necesarias para determinar el grado y la extensión de la enfermedad.
• Fondoscopia realizada idealmente por un oftalmólogo pediátrico.
• Neuroimágenes: ecografía cerebral o resonancia magnética (RM) cerebral. Una ecografía cerebral realizada por una persona experta puede obviar la RM. Los hallazgos más característicos son las calcificaciones y la hidrocefalia.
• Estudio citoquímico del LCR. • Estudio microbiológico.
• Obligado: IgM e IgG en la primera semana de vida. Si está disponible, realizar también IgA.
• Recomendado: RPC en sangre, LCR y orina.
• Opcional: estudio de RPC en placenta. (11)
Tratamiento
Todos los pacientes con TC, independientemente de su condición clínica al nacimiento, deben recibir tratamiento. (9) (Tabla 7).
El seguimiento de cualquier niño con TC debe hacerse hasta pasada la pubertad. Una vez finalizado un año de tratamiento se debe realizar una fondoscopia, una serología completa y una ecografía cerebral o tomografía computarizada según la historia al nacimiento.
Si existen signos de curación se hace una fondoscopia cada uno a dos años hasta la pubertad, momento en que el estudio oftalmológico se realiza cada seis meses por el mayor riesgo de recaída a pesar de un tratamiento correcto. Si en ese momento se produce una elevación significativa de IgG, lo que no es habitual, o signos de reactivación de corioretinitis, se aconseja nuevo tratamiento con pirimetamina más ácido folínico más sulfadiazina durante dos a tres meses. (14).
Prevención primaria; en la mujer embarazada no inmune
Se deben indicar consejos profilácticos a toda mujer embarazada que presente una serología IgG negativa en la primera visita del embarazo:
• Lavado de manos antes de ingerir alimentos.
• Ingestión de carnes rojas bien cocidas, no consumir carnes ahumadas o en salmuera.
• Lavado minucioso de las manos luego de manipular carne cruda o vegetales frescos.
• Limpieza de las superficies y utensilios de cocina que tuvieron contacto con carne cruda.
• No ingerir vegetales crudos cuando no se pueda asegurar que fueron bien lavados.
• Si realiza trabajos de jardinería, debe usar guantes y luego lavarse las manos.
• Evitar contacto con excretas de gato. En el caso de poseer mascota felina se recomienda remover las excretas diariamente, con guantes y lavado de manos posterior, ya que los ooquistes son infectantes a partir de las 36 horas de su eliminación y sobreviven a temperaturas entre 4º y 37ºC. (9).
Sífilis
La sífilis congénita corresponde a la infección transplacentaria producida por Treponema pallidum, desde una madre con sífilis no tratada o inadecuadamente tratada, al producto de la gestación. Esta infección puede afectar al feto en cualquier etapa del embarazo y el riesgo de infección varía según la etapa evolutiva de la enfermedad en la gestante. El daño producido en el feto se relaciona con su capacidad de montar una respuesta inmune, lo que ocurre especialmente después de las 16-20 semanas de gestación.
La infección produce un compromiso multisistémico y es así como, las manifestaciones clínicas en el RN infectado son variadas y pueden estar presentes al nacer o desarrollarse en los primeros dos años de vida. Por lo tanto, el diagnóstico de esta patología es complejo y se basa en el análisis de los antecedentes epidemiológicos, serológicos y la clínica del binomio madre-hijo.
Agente causal
Treponema pallidum es el agente causal, pertenece a la familia Spirochaetaceae, está compuesto por ocho a veinte espiras enrolladas, lo que le permite un movimiento rotatorio. Es una bacteria filiforme que no tiñe con los métodos convencionales (Gram, naranja de acridina, otros). Cuenta con proteínas en su membrana externa que le facilitan la adherencia, atraviesa las membranas y la piel intacta. Es muy lábil a las condiciones ambientales, no se trasmite por la contaminación de objetos, sólo por contacto directo y su reservorio es exclusivamente humano. Es muy sensible a penicilina con una concentración inhibitoria m 33 horas.
Epidemiología
La Organización Mundial de la Salud (OMS) estima que anualmente hay 12 millones de personas infectadas con sífilis en el mundo, de las cuales 2 millones corresponden a mujeres embarazadas y 270.000 a RN con sífilis congénita.
En Chile (15), la tasa de incidencia de sífilis en la población general fue de 22,3 por 100.000 habitantes en el año 2014; 23% de los casos notificados de sífilis correspondieron a mujeres embarazadas, de las cuales 35 y 34% cursaron con una sífilis latente precoz y latente tardía, respectivamente, 9% con sífilis primaria y 5% sífilis secundaria. La tasa de sífilis congénita confirmada, de acuerdo a criterios epidemiológicos, fue de 0,24-0,25 por 1.000 RN vivos.
Los factores de riesgo materno (16) relacionados con la infección durante el embarazo son:
• falta de control del embarazo
• abuso de sustancias
• antecedentes de otras infecciones de transmisión sexual
• comercio sexual
• haber recibido tratamiento para la sífilis con antimicrobianos distintos a penicilina benzatina o haberse efectuado este tratamiento antimicrobiano menos de un mes antes del parto
• sospecha de re-infección
• historia de tratamiento no documentado o verificable
• gestantes portadoras de VIH
• adolescentes • parejas no tratadas y
• sífilis diagnosticada en etapa secundaria durante el embarazo.
La principal vía de transmisión es trans-placentaria, si bien se describen casos que la han adquirido por contacto directo con secreciones o lesiones activas ricas en T. pallidum, presentes al momento del paso del RN por el canal del parto. No se transmite por leche materna.
El riesgo de transmisión al producto de la gestación varía según la etapa de la enfermedad en la mujer embarazada; es de 75-95% en sífilis con menos de un año de evolución (sífilis primaria, secundaria y latente precoz) y de 35-10% en sífilis con más de un año de evolución (sífilis latente tardía y sífilis terciaria); la situación de mayor riesgo para el feto se produce cuando la mujer embarazada cursa una sífilis secundaria.
La infección no tratada en la mujer embarazada da origen a 25% de abortos, 25% de mortinatos y del 50% restante, 40% de los RN nacen con sífilis congénita sintomática y 60% nacen asintomáticos, pero desarrollaran la enfermedad en los primeros dos años de vida.
Si la mujer gestante recibe un tratamiento adecuado, antes de las 16-20 semanas de gestación, 100% de los RN nacen sanos. Si el tratamiento fue posterior a ello se han observado secuelas en 1 a 3%.
La gravedad de la infección se relaciona con el momento en que la mujer embarazada adquiere la infección, la edad gestacional, la carga infectante que afecta al feto y la oportunidad con que la madre establece una respuesta immune.
Sífilis y embarazo
La detección de la sífilis a través del tamizaje con serología no treponémica en la mujer embarazada ha demostrado ser una buena estrategia (17,18), tanto en prevención de la sífilis congénita, como disminuyendo la incidencia de parto prematuro y de muerte fetal y perinatal, por esta causa.
El tamizaje durante el embarazo debe realizarse siempre con técnicas no treponémicas cuantitativas; entre las recomendadas están el RPR y el VDRL. Es recomendable utilizar la misma técnica durante toda la gestación, dado que esto permite evaluar la evolución de la curva serológica, su respuesta al tratamiento y detectar posibles re-infecciones. La confirmación del diagnóstico de la primo-infección en la mujer embarazada se realiza con pruebas serológicas treponémicas (MHATpmicrohemaglutinación de T. pallidum y FTA Absfluorescent T. pallidum antibodies). Estas pruebas no son útiles para realizar seguimiento, dado que en la gran mayoría de los casos permanecen reactivas durante toda la vida, con posterioridad a la infección. (Nota: Actualmente el Laboratorio de Referencia Nacional del Instituto de Salud Pública-ISP- trabaja con MHAp). Tanto las pruebas serológicas no treponémicas como las treponémicas detectan IgG, esto es, se produce paso de anticuerpos al feto, a través de la barrera placentaria.
En nuestro país, la normativa del MINSAL establece el tamizaje en la mujer embarazada con pruebas no treponémicas (VDRL o RPR cuantitativo) al momento de la primera consulta, a las 24 semanas, entre las 32- 34 semanas de gestación y al parto.
Se ha observado que entre 65 y 85% de las madres de RN con sífilis congénitas probables y confirmadas, adquieren la infección en el tercer trimestre del embarazo, detectada por seroconversión durante este periodo o en el parto, o bien, por aumento en la dilución al compararla con las anteriores. Por lo anterior, la situación serológica de la madre siempre debe ser conocida antes de darla de alta desde la maternidad porque esto define en gran medida la conducta a seguir con el RN.
La evolución de la curva serológica de pruebas no treponémicas posteriormente a un tratamiento bien llevado en la mujer embarazada, debe evaluarse cuidadosamente, en especial en las mujeres gestantes que han presentado sífilis primaria y secundaria. En un estudio donde se evaluaron 166 mujeres gestantes con sífilis (19), con un promedio de edad gestacional de 29 + 5 semanas, de las cuales 56% presentó sífilis precoz, se observó que sólo en 38% de ellas disminuyó en dos diluciones la serología no treponémica al parto, y esto se relacionó especialmente con aquellas mujeres que presentaron cuadros de sífilis primaria o secundaria. Si se considera los cuadros de sífilis latente en etapa precoz y tardía, en general, 16 a 28% de las mujeres embarazadas adecuadamente tratadas no muestran un descenso en dos diluciones de la serología no treponémica, al parto.
Entre los antecedentes epidemiológicos se recomienda verificar la situación serológica y el antecedente de tratamiento de la pareja de la mujer gestante, especialmente cuando hay sospechas de re-infección.
Se han comunicado fracasos de tratamiento en la mujer gestante con sífilis secundaria, a pesar de haber recibido tratamiento adecuado con penicilina benzatina, lo cual guardaría relación con una alta carga infectante; se recomienda en estos casos la evaluación de la unidad feto-placentaria y la búsqueda de indicios de infección fetal. Se considera tratamiento adecuado de la mujer embarazada, el haber recibido dos dosis de penicilina benzatina de 2.400.000 UI c/u, con un intervalo de una semana, un mes antes del parto, y al parto contar con seguimiento serológico de pruebas no treponémicas que evidencien una disminución de la dilución, en comparación a la dilución al momento del diagnóstico.
Al comparar el uso de una versus dos dosis de penicilina benzatina, en el tratamiento de la mujer gestante (20), hay estudios que han mostrado una menor eficacia del esquema de una dosis en sífilis secundarias, en sífilis con diluciones de RPR por sobre 1:16 o VDRL de 1:32 o más. Por otra parte, debido a las alteraciones en el volumen de distribución que se producen en la gestación, especialmente en el tercer trimestre, se ha observado que una dosis de penicilina benzatina de 2.400.000 UI no alcanza concentraciones en el suero materno que aseguren la erradicación de T. pallidum a la semana de su administración (21).
Ceftriaxona se encuentra entre las opciones de tratamiento de la sífilis en la población general y en la mujer embarazada pero no hay estudios que avalen su eficacia en prevenir la sífilis congénita. En cuanto a los macrólidos/azálidas como eritromicina y azitromicina, la transferencia placentaria estos los fármacos es baja y las concentraciones alcanzadas en el suero fetal también lo son (22). Por lo tanto, cualquier tratamiento antimicrobiano recibido por la mujer gestante, diferente a penicilina benzatina, se considera inadecuado y obliga a tratar y estudiar al RN.
Cuadro clínico
Se describen dos formas de presentación de la sífilis congénita, la forma precoz, que se manifiesta en los dos primeros años de vida y la forma tardía que se presenta después de esa edad (23,24).
Las manifestaciones clínicas de la sífilis congénita precoz, va desde la forma multisistémica, oligosintomática a la asintomática, siendo esta última la forma más frecuente.
Forma multisistémica: generalmente corresponde a un RN gravemente enfermo, de aspecto séptico, con RCIU, hepato-esplenomegalia, anemia, trombocitopenia, compromiso del SNC, hepatitis, pancreatitis, neumonía alba, glomerulonefritis, osteocondritis, corio-retinitis en “sal y pimienta”, uveítis, lesiones en la piel, e incluso, puede cursar con un shock séptico. En esta forma clínica, la manifestación más frecuente es la hepatoesplenomegalia, asociada a la presencia de anemia, trombocitopenia, con leucocitosis o leucopenia. La anemia hemolítica se presenta con test de Coombs negativo, se resuelve en forma lenta y puede persistir por semanas; se asocia a formación de complejos inmunes, a crioglobulinemia y macroglobulinemia. La hepatitis puede ser de tipo colestásica y se resuelven lentamente (25), al igual que la anemia hemolítica, luego de una terapia adecuada; inicialmente puede apreciarse una exacerbación del cuadro posterior a la administración de penicilina G sódica. Del punto de vista gastrointestinal también se describen manifestaciones como ileitis y enterocolitis necrosante.
Diez por ciento de los RN que presentan neumonía alba quedan con daño pulmonar crónico, especialmente prematuros y RN que requieren ventilación mecánica invasora. Además se asocia a fibrosis obliterante focal.
El diagnóstico se confirma con relativa facilidad ya que, habitualmente cursan con elevadas diluciones de serología no treponémica en el suero.
Forma oligosintomática: se presenta generalmente en los primeros seis meses de vida y las manifestaciones clínicas más frecuentes son las lesiones de piel, mucosas y las alteraciones óseas. También pueden presentar, poliadenopatías, síndrome nefrótico, hepatitis y hemoglobinuria paroxística nocturna, entre otras manifestaciones.
Las lesiones cutáneas y mucosas se manifiestan con mayor frecuencia desde la segunda a la décima semana de vida, y pueden ser: exantema máculopapular simétrico, lesiones descamativas y lesiones ampollares palmo-plantares que corresponden al pénfigo sifilítico. Las manifestaciones de mucosas se presentan con mayor frecuencia entre los 7-10 días de vida y pueden corresponder a: rinitis mucosas, mucopurulenta o sanguinolenta, parches mucosos o placas blanquecinas en la lengua y faringe e incluso laríngeas; estas lesiones son ricas en espiroquetas y, por tanto, infectantes.
Dentro de las manifestaciones óseas se describe la osteocondritis, que origina la pseudoparálisis de Parrot, epifisitis, periostitis, que generalmente se manifiestan después del mes de vida.
Forma asintomática: es la más frecuente. Los RN no presentan síntomas ni signos clínicos al nacer, la serología no treponémica es reactiva en similar o menor dilución a la observada en la madre, e incluso puede ser no reactiva, si la infección materna ocurrió muy cercana al parto; por lo tanto, en esta situación el diagnóstico de sospecha se debe establecer con los antecedentes epidemiológicos y serológicos de la madre. El 60% de los RN infectados nace asintomático y, de no ser tratados, desarrollará la enfermedad en las siguientes tres a ocho semanas de vida.
Neurolúes. La neurosífilis puede estar presenta en cualquiera de estas formas, habitualmente es asintomática, y en pocos casos se pueden observar alteraciones del citoquímico del líquido cefalorraquídeo. En la era pre-tratamiento con penicilina, 15% de los RN con sífilis congénita desarrollaban formas meningo-vasculares, con manifestaciones como: meningitis, compromiso de pares craneales, hidrocefalia, infarto cerebral y diabetes insípida. Si bien, las alteraciones en el citoquímico del LCR son infrecuentes, en el RN la presencia de más de 25 leucocitos por ml y/o proteínas sobre 150 mg/dl (> a 170 mg/dl en prematuros) son sugerentes de una neurosífilis (17). Cabe señalar que 40-50% de los RN con sífilis sintomática presentan neurosífilis.
El VDRL reactivo en LCR se considera muy específico de neurosífilis aunque cabe la posibilidad de difusión de Ac maternos tipo IgG al suero y LCR del RN (26). La detección de material genético, a través de técnicas de RPC en LCR, confirma el diagnóstico de neurosífilis. Las pruebas serológicas treponémicas en el LCR dan falsos positivos, por lo que no se recomiendan para confirmar el diagnóstico de neurosífilis, pero sí tienen un valor predictor negativo.
La sífilis congénita en su forma tardía, es muy poco frecuente y se presenta en los casos de sífilis no tratada. Generalmente se manifiesta en la pubertad y el cuadro clínico es similar a las manifestaciones de la sífilis terciaria del adulto: queratitis intersticial, granulomas necrosantes (gomas), neurosífilis, y la forma cardiovascular. En algunos casos, se pueden evidenciar las secuelas o estigmas, como son: los dientes de Hutchinson, molares de mora, perforación del paladar duro, nariz en silla de montar, tibias en “sable”, opacidades corneales, atrofia óptica, sordera por compromiso del VIII par craneal e hidrartrosis (articulación de Clutton).
Diagnóstico
En Chile se ha adoptado, para efectos diagnósticos, la siguiente clasificación epidemiológica (10):
Sífilis congénita confirmada:
• Caso en el que se confirma la presencia de T. pallidum en secreciones o tejidos
• Caso sintomático o asintomático en el que la serología no treponémica (VDRL o RPR) en el suero de sangre periférica del RN se encuentra > dos diluciones (ó 4 veces los títulos) por sobre la materna, al momento del parto.
• Caso sintomático o asintomático con VDRL reactivo en LCR del RN.
• Caso sintomático o asintomático que después del año de vida presenta pruebas serológicas treponémicas reactivas
Sífilis congénita probable. Caso en el que se plantea la sospecha clínica de sífilis congénita en base a la evaluación de los antecedentes epidemiológicos, serológicos del binomio madre e hijo y del tratamiento de la madre, y que no cumple con los criterios mencionados previamente, por lo cual no se puede descartar ni confirmar la infección.
Estos criterios difieren de lo establecido por el CDC de Atlanta, E.U.A., (27) quienes definen como caso confirmado, sólo aquel en quien se logra la identificación del agente causal, en secreciones o tejidos. En el resto de las situaciones mencionadas no sería posible descartar ni confirmar la infección, por lo tanto se mantendrían en una condición de probable.
Para establecer la sospecha diagnóstica de sífilis congénita siempre hay que evaluar:
• Los antecedentes epidemiológicos, serológicos y de tratamiento de la sífilis en la mujer embarazada.
• La situación clínica y la serología en el RN.
La serología no treponémica reactiva al parto, no siempre es sinónimo de sífilis en la mujer gestante, lo ideal es evaluar la curva serológica. Si en la mujer gestante las pruebas no treponémicas se encuentran reactivas, al momento del parto:
• Hay que verificar si la dilución encontrada corresponde a una seroconversión o se encuentra estable o es más baja o más alta, en comparación a las diluciones previas.
• Preguntar si fue tratada y verificar que el tratamiento haya sido adecuado.
La seroconversión de las pruebas no treponémicas (VDRL-RPR) o un aumento en dos diluciones (ó 4 títulos) de la serología en comparación a las diluciones previas al parto, debe llevar a plantear el diagnóstico de sífilis en la mujer embarazada y el de sífilis congénita probable en el RN, independiente de la situación serológica o clínica de éste. La indicación en esta situación es tratar, estudiar y realizar seguimiento al RN, lo que permitirá confirmar el diagnóstico o quedar en condición de probable.
Los VDRL falsamente positivos del embarazo, que habitualmente se presentan con diluciones menores a 1:4, se descartan con pruebas treponémicas no reactivas (MHTp). También se pueden observar falsos negativos; se describen en 1 a los 2% de los casos de sífilis secundarias y se explican por el fenómeno de prozona (Nota: Prozona = una concentración desproporcionadamente alta de anticuerpos en relación a la antígeno en la reacción, que inhibe la reacción antígeno-anticuerpo).
En el caso de la mujer gestante, con curva serológica no treponémica reactiva a diluciones estables o menores a las diluciones previas al parto, lo prioritario es establecer si recibió tratamiento adecuado. Si no recibió tratamiento adecuado estaríamos frente a una sífilis congénita probable, independiente de la situación serológica o clínica del RN, y se debe tratar, estudiar y realizar seguimiento.
Si al momento del parto, la curva serológica de las pruebas no treponémicas (VDRL o RPR) en la mujer gestante, se aprecia estable o reactiva a diluciones más bajas que las previas y con el antecedentes verificable de un tratamiento adecuado durante el embarazo, es necesario evaluar cuidadosamente la serología del RN y sus condiciones clínicas. Lo habitual, es que el RN se encuentre asintomático y que la serología no treponémica en sangre periférica resulte no reactiva o reactiva a diluciones similares o más bajas que la materna, lo que permite realizar seguimiento del RN y así, verificar la negativización del VDRL o RPR; esto ocurrirá, generalmente, antes de los tres meses de vida, dado que esta serología reactiva corresponde a un paso trans-placentario de anticuerpos tipo IgG maternos.
Todo RN hijo de madre con serología no treponémica reactiva al parto debe realizarse serología no treponémica en sangre periférica (nunca del cordón umbilical). Un VDRL o RPR reactivo en el RN, por sobre dos diluciones (ó 4 títulos) a la observada en la madre, confirma el diagnóstico, pero la ausencia de este criterio no descarta la infección. El VDRL reactivo en LCR es muy sugerente de neurosífilis en presencia o ausencia de manifestaciones clínicas en el RN, examen que tiene una sensibilidad y especificidad de 90 y 53%, respectivamente.
La forma clínica multisistémica, si bien es poco frecuente, habitualmente se asocia a diluciones de VDRL o RPR en suero o sangre más elevadas.
La detección en el RN asintomático o sintomático, hijo de madre no tratada o inadecuadamente tratada, con pruebas no treponémicas (VDRL-RPR) en diluciones dos veces menores en relación a la serología materna, no permite confirmar la infección congénita. Estos casos quedan catalogados como probables y es posible que el seguimiento permita confirmar el diagnóstico con pruebas treponémicas reactivas después del año de vida, y en caso contrario quedan en la condición de probables.
El hallazgo de test serológico treponémicos y no treponémicos (VDRL o RPR) reactivos en el RN puede corresponder al paso trans-placentario de IgG materna pero la determinación de IgM específica para T. pallidum en el RN es signo sugerente de infección congénita. Está presente en 80 y 35% de los RN sintomáticos y asintomáticos, respectivamente, con una sensibilidad de 66% y especificidad de 100%. Tiene valor diagnóstico sólo cuando la madre ha sido inadecuadamente tratada o no ha recibido tratamiento para la sífilis; por otra parte, cuando no se detecta, ello no descarta la infección del RN.
La determinación de pruebas treponémicas en el RN no se recomienda, mide IgG (paso trasplacentario), y no aporta al diagnóstico de sífilis congénita.
La determinación de material genético a través de estudios de RPC se ha realizado en suero o sangre del RN con una sensibilidad y especificidad de 94 y 90 -97%, respectivamente y en LCR con una sensibilidad de 65% y especificidad de 97%.
Hasta el momento no se dispone de un método diagnóstico único con la suficiente sensibilidad y especificidad que permita descartar la infección en el RN.
Manejo
Se pueden presentar dos situaciones (10):
RN hijo de madre con sífilis sin tratamiento o inadecuadamente tratada o con reinfección: El RN se debe tratar y estudiar. El estudio básico recomendado, tanto en el RN sintomático como asintomático, incluye VDRL en sangre o suero periférico, punción lumbar para estudio citoquímico y VDRL del LCR, radiografía de huesos largos y cráneo, fondoscopia, hemograma con recuento de plaquetas, pruebas de función hepática. En pacientes sintomáticos se debe completar el estudio con radiografía de tórax, evaluación de la función renal y otros exámenes de acuerdo a la sintomatología y nivel de gravedad de cada caso.
RN hijo de madre con sífilis adecuadamente tratada: En estos RN no se recomienda realizar estudio ni hospitalizar, pero sí es necesario determinar el VDRL o RPR en sangre periférica para establecer su condición serológica basal. Si la prueba serológica no treponémica en el RN resulta no reactiva o reactiva a una dilución menor o igual a la observada en la madre al momento del parto, al paciente sólo se le realiza seguimiento del VDRL o RPR hasta verificar su negativización.
En un seguimiento de 121 RN hijos de madres con sífilis adecuadamente tratadas, 95% de los casos negativizaron el VDRL antes de los tres meses de vida y 100% a los cuatro meses (30); en todos ellos las pruebas treponémicas realizadas después del año de vida fueron no reactivas, lo que permitió descartar la infección en 100% de los casos. No hay evidencia científica, más allá de la opinión de algunos expertos, que avale el uso de penicilina benzatina en este grupo de RN en forma profiláctica; en este aspecto no hay consenso en las guías internacionales (28).
Entre las reacciones adversas no alérgicas (29) de penicilina benzatina, se describen las vasculares con una frecuencia de 42%. Cincuenta por ciento de ellas se presentaron en niños menores de 5 años, con 6% de gangrena o necrosis y en 3% de amputación de la extremidad afectada. En Chile no se recomienda el uso de penicilina benzatina bajo 2 años de edad, por el riesgo de lesiones vasculares (síndrome de Nicolau) que se presentan por la administración de este antimicrobiano en forma accidental endovascular, pero que también se describen secundariamente a un fenómeno inflamatorio desencadenado en los tejidos circundantes a los vasos sanguíneos, sin que necesariamente se haya administrado directamente en el torrente sanguíneo.
Si la prueba serológica no treponémica en el RN resulta reactiva a una o más diluciones por sobre la observada en la madre al momento del parto, el RN se debe tratar y estudiar. Esto se observa en madres que se reinfectan o cuando se produce un fracaso del adecuado tratamiento con penicilina benzatina, en la mujer embarazada, lo cual si bien, es muy infrecuente, se asocia con la co-existencia de infección por VIH y con sífilis secundaria.
Tratamiento
El tratamiento de elección para la sífilis congénita y la neurosífilis es penicilina G sódica. Actualmente se recomienda10 días de tratamiento con penicilina G sódica en los caso de sífilis congénita con y sin neurosífilis (10). (Tabla 8).
La penicilina procaína, de administración intramuscular no alcanza concentraciones adecuadas en el SNC, que aseguren la erradicación de T. pallidum. No hay evidencia que avale el uso de otros antimicrobianos ni tampoco de otros lactámicos para el tratamiento de la sífilis congénita.
Seguimiento
El seguimiento clínico y serológico permite verificar la negativización de las pruebas serológicas no treponémicas (VDRL, RPR) en suero y en los casos de neurosífilis en el LCR, lo que asociado a una buena evolución clínica da cuenta del éxito del tratamiento.
La determinación de pruebas treponémicas después del año de vida, permite confirmar algunos casos, pero no están recomendadas para realizar el seguimiento serológico.
El diagnóstico y seguimiento serológico debe realizarse siempre con la misma técnica no treponémica, dado que las diluciones obtenidas por las diferentes técnicas no son comparables entre ellas.
Se diferencian tres situaciones específicas:
RN hijos de madres con sífilis adecuadamente tratadas: en estos casos se realiza control médico y de la serología no treponémica mensualmente hasta su negativización, que habitualmente ocurre antes de los cuatro meses de vida.
RN con sífilis congénita probable y sífilis confirmada: se recomienda realizar control clínico y con serología no treponémica (VDRL, RPR) al mes, 2, 3, 6 y 12 meses de edad. Si el VDRL o RPR permanece reactivo a los seis meses de vida se debe estudiar al paciente y evaluar la necesidad de repetir el tratamiento. Después de los 12 meses se realizan pruebas treponémicas, que en los casos de sífilis probables permitirían confirmar la infección. En los casos sintomáticos las pruebas treponémicas pueden permanecer reactivas durante toda la vida.
RN con neurosífilis Además realizar el seguimiento correspondiente a una sífilis confirmada, se debe determinar el VDRL en LCR a los seis meses de vida, para verificar su negativización. La presencia de celularidad, aumento de las proteínas y/o VDRL reactivo en LCR a los seis meses de vida, es indicación de repetir el tratamiento. En estos pacientes se recomienda realizar seguimiento neurológico, oftalmológico y por otorrinolaringólogo.
Los pacientes con diagnostico de sífilis congénita sintomática confirmada negativizan el VDRL o RPR en suero o sangre más tardíamente que los casos asintomáticos, lo cual ocurre habitualmente alrededor de los seis meses de vida. Se describen casos en que la negativización ha sido más tardía pero se asocia a diluciones iniciales de VDRL o RPR muy elevadas y amerita un seguimiento cuidadoso; ante la duda de fracaso de tratamiento se recomienda evaluar y tratar nuevamente.
En general, los casos con persistencia del VDRL en LCR o en suero reactivo, después de los seis meses de vida, tienen indicación de evaluación y considerar repetir el tratamiento.
Enfermedad de Chagas (Tripanosomiasis Americana)
La enfermedad de Chagas es una zoonosis parasitaria causada por Trypanozoma cruzi, cuyo vector es Triatoma infestans (“vinchuca”) y es endémica en 21 países de Latinoamérica, incluido Chile, perteneciendo al grupo de las enfermedades olvidadas (“neglected diseases” en inglés), según conceptos acuñados por la OMS (31-33). El parásito se transmite a través de: deposiciones de un triatoma infectado (vectorial), transfusiones de sangre o de órganos sólidos (transfusional), trans-placentaria o ingestión oral de alimentos o líquidos contaminados (alimentaria) (31).
Epidemiología
En zonas no endémicas, la transmisión congénita o trans-placentaria es el principal modo de transmisión de T. cruzi (34). La tasa de transmisión congénita reportada en Latinoamérica varía de 0,7–18,2%, con un promedio de 5% en áreas endémicas (31, 34).
La enfermedad de Chagas congénita puede presentarse en las fases aguda y crónica de la infección materna, puede repetirse en cada embarazo y transmitirse desde una generación a otra (vertical) pero generalmente se da en el contexto de una madre seropositiva que se encuentra en la fase crónica indeterminada o asintomática de la enfermedad (34, 35).
Infección vertical
La infección crónica materna no tiene efecto en el destino del embarazo o del RN si no existe transmisión al feto. Cuando el feto resulta infectado hay un aumento del riesgo de parto prematuro, bajo peso de nacimiento y rotura prematura de membranas, producto de la inflamación placentaria (36). Durante el primer trimestre del embarazo la transmisión es probablemente inhabitual y ocurre con mayor frecuencia durante el segundo o tercer trimestre del embarazo, cuando el flujo sanguíneo placentario se hace continuo y difuso, facilitando el intercambio sanguíneo feto-placentario (36).
Sin embargo, como la mayoría de las mujeres se infectan antes de comenzar el embarazo es imposible determinar el momento exacto de la transmisión del parasito (36).
Los factores de riesgo para la transmisión congénita son:
• madres que viven o han migrado de zonas endémicas
• madres que viven o han migrados de áreas con altas tasas de transmisión
• antecedente de hermanos con infección congénita
• madre con parasitemias detectables (RPC en sangre positiva)
• madres con disminución de la respuesta inmune mediada por células T.
• co-infección materna con VIH o malaria (36).
Cuadro clínico
La mayoría de los RN son asintomáticos (40-100%) (35-37). Los signos y síntomas clínicos son inespecíficos y comunes a otras infecciones congénitas encontrándose frecuentemente prematurez, bajo peso de nacimiento y RCIU. Puede haber distress respiratorio por neumonitis parasitaria y son frecuentes la ictericia, hepatomegalia y esplenomegalia (36, 37).
Se considera sospechoso de enfermedad de Chagas congénita aquel RN hijo de madre infectada que presenta convulsiones, hepato-esplenomegalia, cardiomegalia, distress respiratorio, hidrops fetal, prematurez, o que es asintomático pero con antecedentes maternos de la enfermedad (32, 33, 35-37). (Tabla 9). La mortalidad de la infección congénita es de 5% y está dada principalmente por miocarditis y meningo-encefalitis lo que se asocia a altas parasitemias en el RN (34, 36).