2007
1
Autores:
Cristina Irribarra Á.1, Ramón Almuna V.1, Sócrates Aedo M.1, Arnaldo Porcile J.1
Instituciones:
1Departamento de Obstetricia y Ginecología, Facultad de Medicina, Universidad de Chile, Hospital Dr. Luis Tisné Brousse.
Tipo de documento:
Trabajos OriginalesTestosterona sérica en trastornos hipertensivos del embarazo
Contenido del documento:
INTRODUCCIÓN
Dentro de los trastornos hipertensivos del embarazo son relevantes la hipertensión arterial crónica esencial (HACE) y la preeclampsia.
La HACE, definida como la presencia de hipertensión arterial desde antes del embarazo o iniciada en las primeras 20 semanas de gestación, se ha observado en 1-3 % de las mujeres embarazadas (1). En cambio, se ha comunicado que un 6 a 7% de las primíparas desarrollarán preeclampsia, desorden multisistémico caracterizado por manifestaciones clínicas que van desde una hipertensión arterial leve al término del embarazo, hasta crisis hipertensiva severa con proteinuria, convulsiones (eclampsia) y síndrome de HELLP.
La etiopatogenia de la preeclampsia es aún poco clara; se presume que se trataría de un síndrome clínico que tendría en común el daño de la célula endotelial (2); con una hiperreactividad vascular y hemostática que involucraría al sistema renina angiotensina, eicosanoides y plaquetas (3).
Aunque no se ha demostrado una relación causa efecto, existen evidencias de que los andrógenos séricos, en especial la testosterona, se encuentran elevados en mujeres con preeclampsia (4).
El propósito de este estudio es dilucidar si existe tal aumento en embarazadas con HACE sin preeclampsia sobreagregada.
MATERIAL Y MÉTODO
Se invitó a participar en el estudio a mujeres concurrentes a control de gestación de tercer trimestre al Servicio de Obstetricia y Ginecología del Servicio de Salud Metropolitano Oriente, descartándose las que presentaban antecedentes de diabetes mellitus, diabetes gestacional, nefropatía, mesenquimopatías, patología tiroídea e hirsutismo.
A medida que ingresaban al estudio, se fueron asignando a 3 grupos. 1) Grupo de normotensas: las primeras 15 mujeres normotensas (presión arterial sistólica <140 mmHg y diastólica <90 mmHg) que aceptaron ingresar al estudio; conforman el grupo control. 2) Grupo preeclampsia: las primeras 16 mujeres en que se diagnosticó preeclampsia. Los criterios aplicados para el diagnóstico de preeclampsia fueron: registros de presión arterial normal en el primer trimestre (presión arterial sistólica <130 mmHg con presión arterial diastólica <80 mmHg), que aumenta después de la semana 20 de gestación a niveles de presión arterial sistólica 140 mmHg y/o presión arterial diastólica 90 mmHg (observadas con intervalo de 6 horas en dos o más ocasiones), y que teniendo controles previos sin proteinuria, el examen de orina del tercer trimestre muestra >1 g de proteinuria en 24 horas, y con presencia de edemas. 3) Grupo HACE: las primeras 14 mujeres con diagnóstico de HACE, con registros de presión arterial sistólicos de 140 mmHg y diastólicos de 90 mmHg previos al embarazo y durante toda la gestación; y que no habían recibido tratamiento antihipertensivo farmacológico durante el embarazo, salvo régimen hiposódico; no fueron incluídas las mujeres embarazadas con HACE que tuviesen manifestaciones de preeclampsia sobre agregada.
A todas las mujeres se les registró la edad, paridad, índice de masa corporal (IMC) [peso(kg)/talla(m2)], presión arterial sistólica y diastólica (mmHg), proteinuria en 24 h y la semana de gestación que cursaban al momento de la obtención de las muestras de sangre.
En el Instituto de Estudios Médicos Avanzados se procesaron las muestras de sangre obtenidas en ayunas (a las 8 horas AM) de todas las mujeres estudiadas; siendo rotuladas, centrifugadas e inmediatamente conservada la fracción sérica a 70°C hasta su análisis.
Se midió testosterona total sérica (Tt) y testosterona libre sérica (Tl) usando radio inmuno análisis (RIA), y proteína ligante sexual sérica (SHBG) con técnica IRMA (Diagnostic Products Corp, Los Angeles, California). La sensibilidad analítica y coeficientes de variación inter-ensayo e intra-ensayo de los reactivos utilizados son respectivamente: RIA de Tt= 0,14 nmol/L; 5-17,5% y 6,4-11%. RIA de Tl= 0,52 pmol/mL; 7,5-17,5% y 8,5-18,3%. IRMA de SHBG= 0,04 nmol/L; 5,3% y 8,5%.
El índice de andrógenos libres (IAL) se calculó aplicando la fórmula:
Tt (nmol/L)/SHBG (nmol/L) x 100.
El análisis estadístico se realizó con software SPSS 11.0. Se calculó promedios ± desviación estándar (DE) y se aplicó ANOVA de un factor y Kruskal-Wallis; aceptándose significancia estadística con p<0,05.
El estudio propuesto no presentaba riesgo para las pacientes involucradas ni se vulneraban las normas éticas de la Declaración de Helsinki, siendo previamente aprobado por el comité de ética del Departamento de Obstetricia y Ginecología de la Facultad de Medicina del Campus Oriente de la Universidad de Chile.
RESULTADOS
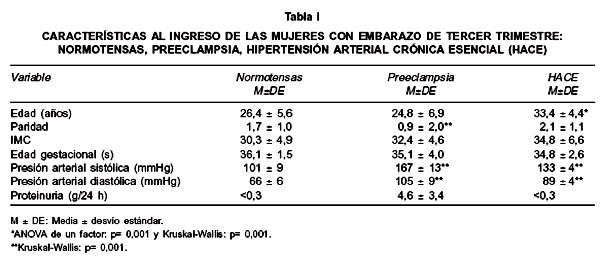
En la Tabla I se muestran las características de los grupos estudiados. El grupo de embarazadas con HACE presentó mayor edad (33,4±4,4 años), con significación estadística (ANOVA de un factor y Kruskal Wallis, p= 0,001) respecto al grupo control de embarazadas normotensas (26,4±5,6 años) y del grupo de embarazadas con preeclampsia (24,8±6,9 años). El grupo con preeclampsia informó una paridad significativamente menor que los otros 2 grupos (Kruskal Wallis, p=0,001). El IMC del grupo control (30,4±4,9), del grupo con preeclampsia (32,5±4,6) y del grupo de embarazadas con HACE (34,8±6,6) se encuentra en rangos de sobrepeso y obesidad, sin diferencias significativas entre ellos.
Las presiones arteriales sistólica y diastólica del grupo con preeclampsia (167±13/105±9 mmHg) y las presiones registradas en el embarazo, del grupo con HACE (133±4/89±4 mmHg) se encontraron significativamente más elevadas que en el grupo control (101±9/66±6 mmHg). Así mismo se observa que los valores de presiones arteriales sistólica y diastólica de las mujeres preeclámpticas eran más altos que los valores de las mujeres con HACE (Kruskal Wallis, p=0,001).
En el grupo con preeclampsia se encontró aumentada la proteinuria (4,6±3,4 g/24 h); en cambio, en los otros dos grupos todas las mujeres presentaron proteinuria dentro de límites normales (<0,3 g/24 h).
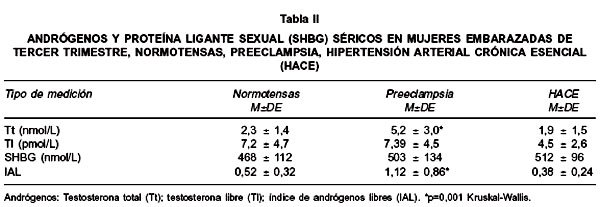
En la Tabla II se puede observar que el grupo de embarazadas con preeclampsia presentan valores séricos de Tt (5,2±3,0 nmol/L) e IAL (1,1±0,9) significativamente mayores (Kruskal-Wallis; p=0,001) en comparación con las embarazadas con HACE (1,9±1,5 nmol/L y 0,4±0,2) y con las embarazadas normotensas (2,3±1,4 nmol/L y 0,5±0,3).
Los valores séricos de SHBG (IRMA) y de Tl (RIA) no presentaron diferencias significativas en ninguno de los tres grupos en estudio.
DISCUSIÓN
En relación al aumento de testosterona sérica en la preeclampsia, hay investigadores que comunicaron que los andrógenos se incrementan en la preeclampsia (5-8); en cambio otros no encontraron dicho aumento (9,10). Respecto de este punto se debe aclarar que en algunos de aquellos trabajos en que no se demostró aumento de testosterona sérica utilizaron técnicas no validadas para la medición de ésta (11-13).
Por otro lado, a pesar de que en este estudio las mediciones séricas por RIA de la Tl no se encontraron elevadas en el grupo de mujeres con preeclampsia, no puede descartarse que de todas maneras exista un aumento real de la Tl sérica, desde que se ha comunicado que la metódica por RIA empleada para medir Tl no ha logrado resultados confiables ni reproducibles, dando valores inferiores a los que se obtienen midiendo la Tl sérica en cámaras de diálisis de equilibrio, usando T tritiada de alta pureza (14-18), que es considerado el patrón de referencia para la medición de Tl in vitro.
Las mujeres seleccionadas en este estudio presentaban un IMC elevado (>30), lo que es coincidente con otros estudios que han comunicado aumento de andrógenos séricos en mujeres con preeclampsia (4); lo cual debe ser considerado en el análisis de este tipo de estudios, dado que la obesidad habitualmente se acompaña de hiperinsulinismo, que ha sido reconocido como un factor importante en la fisiopatología del hiperandrogenismo (19,20). La insulinemia no fue estudiada en este trabajo y habría sido de interés hacerlo para evaluar si también se comporta similar en los tres grupos estudiados.
Las mujeres embarazadas con HACE presentaron en este etudio niveles séricos de Tt y de IAL símiles a los encontrados en las embarazadas normotensas; a diferencia de las mujeres con preeclampsia, en las que esos niveles séricos estaban significativamente elevados. Este hallazgo, que no había sido reportado en la literatura médica, permitiría descartar la posibilidad de que la asociación del aumento de testosterona sérica en la preeclampsia fuese dependiente del factor hipertensivo. Nuestros resultados demuestran que no habría tal relación.
Aunque la asociación entre preeclampsia y Tt sérica aumentada no condiciona una relación de causa efecto, es de interés recordar que existen reportes que permiten suponer alguna relación entre ellos. En ese sentido se ha observado que mujeres portadoras de hiperandrogenemia tendrían un mayor riesgo de desórdenes hipertensivos en el embarazo (21,22); también se ha asociado la deficiencia de aromatasa placentaria con la presencia de hipertensión en el embarazo (23). Y se ha demostrado que la insulina inhibiría la producción de aromatasa en el citotrofoblasto humano (24) reduciendo la aromatización de androstenediona a estrógeno, lo que también condiciona hiperandrogenemia.
Por otra parte, Muttukrishna y cols (25), comunicaron que la inhibina A, que es producida en la placenta, estaría aumentada en el suero de mujeres con preeclampsia y ha sido propuesta como marcador de preeclampsia. Pigny y cols (26), encontraron que en el síndrome de ovarios poliquísticos había un incremento de inhibina A y de los niveles séricos de andrógenos, lo que podría deberse a estimulación de la producción de andrógenos en la teca ovárica. Este mecanismo podría estar involucrado en el incremento de los niveles séricos de andrógenos en las mujeres embarazadas con ovarios hiperandrogénicos. Y el mismo mecanismo podría estar participando en el aumento de andrógenos en la preeclampsia.
Se puede concluir que este estudio es un aporte clínico que confirmaría una asociación entre preeclampsia y testosterona sérica aumentada; pero que no sería dependiente del factor hipertensivo.
AGRADECIMIENTOS: El procesamiento y el financiamiento de los exámenes de laboratorio en este estudio fueron aportados por el Instituto de Estudios Médicos Avanzados (IEMA).
BIBLIOGRAFÍA
- Sibai BM. Chronic hipertensión in pregnancy. Clin Perinatol 1991;18:833-44.
- Roberts JM, Taylor RN, Musci TJ, Rodgers GM, Hubel CA, Mclaughlin MK. Preeclampsia: an endothelial cell disorder. Am J Obstet Gynecol 1989;161: 1200-4.
- Gant NF, Daley GI, Chand S, Whalley PJ, Macdonald PC. A study of angiotensin II pressor response throughout primigravid pregnancy. J Clin Invest 1973;52:2682-9.
- De Vries MJ, Dekker GA, Schoemaker J. Higher risk of preeclampsia in the polycystic ovary syndrome. A case control study. Eur J Obstet Gynecol Reprod Biol 1998;76:91-5.
- Acromite MT, Mantzoros CS, Leach RE, Hurwitz J, Dorey LG. Androgens in preeclampsia. Am J Obstet Gynecol 1999;180:60-3.
- Serin IS, Kula M, Basbug M, Unluhizarci K, Gucer S, Tayyar M. Androgen levels of preeclamptic patients in the third trimester of pregnancy and six weeks after delivery. Acta Obstet Gynecol Scand 2001;80:1009-13.
- Jirecek S, Joura E, Tempfer C, Knöfler M, Husslein P, Zeisler H. Elevated serum concentrations of androgens in women with pregnancy-induced hypertension. Wien Klin Wochenschr 2003;115:162-6.
- Laivuori H, Kaaja R, Rutanen EM, Viinikka L, Ylikorkala O. Evidence of high circulating testosterone in women with prior preeclampsia. J Clin Endocrinol Metab 1998;83:344-7.
- Miller N, Garry D, Cohen H, Figueroa R. Serum androgen markers in preeclampsia. J Reprod Med 2003;48:225-9.
- Ficicioglu C, Kutlu T. The role of androgens in the etiology and pathology of preeclampsia. J Obstet Gynaecology 2003;23:134-7.
- Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 1999;84:3666-72.
- Stanczyk FZ, Cho MM, Endres DB, Morrison JL, Patel S, Paulson RJ. Limitations of direct stradiol and testosterone immunoassay kits. Steroids 2003; 68:1173-8.
- Holownia P, Conway GS, Shrivastava U, Round J, Honour JW. A clinical evaluation of a direct radioimmunoassay of testosterone. Clin Chim Acta 1993; 214:31-43.
- Akalaev AN, Pakhomov VP, Sokolov SD. Determination of testosterone esters in oil solutions by a gas-liquid chromatographic method. Farmatsiia 1974;23: 36-40.
- Winters SJ, Kelly DE, Goodpaster B. The analog free testosterone assay: are the results in men clinically useful? Clin Chem 1998;44:2178-82.
- Wilke TJ, Utley DJ. Total testosterone, free androgen index, calculated free testosterone and free testosterone by analog RIA compared in hirsute women and in otherwise normal women with altered binding of sex hormone binding globulin. Clin Chem 1987; 33:1372-5.
- Rosner W. Errors in the measurement of plasma free testosterone. J Clin Endocrinol Metab 1997;82: 2014-5.
- Boots LR, Potter S, Potter D, Azziz R. Measurement of total serum testosterone levels using commercially available kits: high degree of between-kit variability. Fertil Steril 1998;69:286-92.
- Nestler JE. Modulation of aromatase and p450 cholesterol side-chain cleavage enzyme activities of human placental cytotrophoblasts by insulin and insulin-like growth factor I. Endocrinology 1987;121: 1845-52.
- Nestler JE. Insulin and insulin-like growth factor-I stimulate the 3 beta-hydroxysteroid dehydrogenase activity of human placental cytotrophoblasts. Endocrinology 1989;125:2127-33.
- Fridström M, Nisell H, Sjöblom P, Hillensjö T. Are women with polycystic ovary syndrome at increased risk of pregnancy- induced hypertension and/or preeclampsia? Hypertens Pregn 1999;18:73-80.
- Radon PA, McMahan MJ, Meyer WR. Impaired glucose tolerance in pregnant women with polycystic ovary syndrome. Obstet Gynecol 1999;94:194-7.
- Hähnel ME, Martin LD, Michael CA, Hähnel R. Metabolism of androstenedione by placental microsomes in pregnancy hypertension. Clin Chim Acta 1989;181:103-8.
- Nestler JE. Insulin-like growth factor II is a potent inhibitor of the aromatase activity of human placental cytotrophoblasts. Endocrinology 1990;127:2064-70.
- Muttukrishna S, Knight PG, Groome NP, Redman CW, Ledger WL. Activin A and inhibin A as possible endocrine markers for preeclampsia. Lancet 1997; 349:1285-8.
- Pigny P, Cortet-Rudelli C, Duhamel A, Deroubaix-Allard D, Racadot A, Dewilly D. Serum alpha-inhibin levels in polycystic ovarian syndrome: relationship to the serum androstenedione level. J Clin Endocrinol Metab 1997;82:1939-43.