2021
1
Autores:
Sochog
Instituciones:
Tamara Pradillo A (1), José Sevilla R(1), María Luisa Valdés R(2), Esther Pérez C(3), Silvia Fraga C(1),Montserrat González R(1), María Laguna H1, María Bordés I(1), Lara Sobrino L(1), Juan Miguel Rodríguez C(1).
1_ Facultativo/a especialista en ginecología y obstetricia. Servicio de Ginecología y obstetricia. Hospital Universitario Infanta Elena. Valdemoro, Madrid.
2_ Facultativa especialista en ginecología y obstetricia. Ayuntamiento de Madrid, Madrid.
3_ Facultativa especialista en ginecología y obstetricia. Servicio de Ginecología y obstetricia. Hospital de Cabueñes. Gijón. Asturias.
Correspondencia: Tamara Pradillo Aramendi, tamara.pradillo@quironsalud.es.
Tipo de documento:
Artículo de RevisiónTratamiento del embarazo ectópico en cicatriz de cesárea. Revisión de la literatura a propósito de 3 casos.
Contenido del documento:
INTRODUCCIÓN
El embarazo en cicatriz de cesárea previa (ECC) es la implantación del blastocisto fuera del endometrio en la cicatriz de histerotomía previa, rodeado de miometrio y tejido conectivo. El ECC es infrecuente, 1/2000 embarazos, el 4-6% de los embarazos ectópicos en mujeres con cesárea previa, 1/531 mujeres con cesárea previa tendrá un embarazo en la cicatriz de histerotomía (1-5). Su incidencia aumenta por el incremento de las cesáreas y una mayor facilidad para su diagnóstico (5,6). La hipótesis más aceptada sobre su patogénesis es que la implantación se produce en un defecto del segmento uterino, istmocele, o en tractos microtubulares que se forman durante la agresión de la pared uterina tras una cesárea o cirugía uterina (como legrado, miomectomía, metroplastia, histeroscopia e incluso extracción manual de la placenta) (7-9), secundario a una pobre vascularización del segmento uterino, ocasionando fibrosis y adelgazamiento del miometrio(2). También se ha descrito que la adenomiosis o el antecedente de fecundación in vitro podría asociarse al embarazo intramural (10). No hay evidencia de que más de una cesárea aumente el riesgo (1). Se ha sugerido que el cierre continuo en una sola capa de la histerotomía puede aumentar el riesgo de ECC, no obstante, no hay estudios que lo confirmen (1,11).
Puede cursar con sangrado vaginal y/o dolor abdominal, un tercio son asintomáticos en el momento del diagnóstico (1). Su importancia reside en sus complicaciones, como rotura uterina, hemorragia grave y riesgo de pérdida de la fertilidad (12,13,14).
La mayoría se diagnostican en el primer trimestre, la técnica de elección es la ecografía transvaginal. La ecografía muestra que el saco gestacional se implanta en el segmento uterino inferior anterior, con evidencia de dehiscencia miometrial y cavidad uterina y canal endocervical vacíos. Otros hallazgos incluyen ausencia o adelgazamiento miometrio entre la vejiga y el saco gestacional, evidencia doppler color peritrofoblástico (8,13).
Se describen dos tipos de ECC: tipo 1 (endógeno), el saco gestacional crece hacia el interior de la cavidad, el tipo 2 (exógeno), crece hacia la vejiga y pared abdominal, en este tipo es importante determinar si existe de invasión de estructuras pélvicas adyacentes y su grado. La Resonancia Magnética y la histeroscopia se utilizan para evaluar la ubicación y grado de invasión, pero no son imprescindibles para el diagnóstico (2,3,15,16). La determinación del tipo puede ayudar a tomar una decisión terapéutica óptima. En la elección terapéutica se debe considerar la estabilidad hemodinámica y el deseo genésico (17).
Las opciones terapéuticas pueden ser médicas, quirúrgicas o combinación de ambas. Hasta la fecha no existen esquemas estandarizados de tratamiento. Su manejo óptimo sigue siendo controvertido debido a su baja prevalencia (18). Por este motivo, realizamos una revisión de la literatura y proponemos un algoritmo de manejo del ECC. También presentamos tres casos de ECC resueltos con diferentes tratamientos en el Hospital Universitario Infanta Elena de 2015 a 2017.
MÉTODO
Se realiza una revisión sistemática cualitativa. Se realizó una búsqueda bibliográfica en bases de datos con las palabras clave: cesarean scar pregnancy, cesarean scar ectopic gestation, treatment, management en PubMed, Embase, Ovid y Uptodate. De 654 resultados, excluimos los artículos duplicados y los que no contaban con información relevante sobre el manejo de ECC. Añadimos ciertos trabajos citados en la bibliografía por su pertinencia en la revisión del tema. Finalmente contamos con 51 artículos. De las revisiones sistemáticas encontradas sobre el manejo del ECC, seleccionamos cuatro(17,18,19,20), que contaban datos cualitativos, para elaborar tablas sobre el éxito y complicaciones de los distintos tratamientos. Las definiciones de éxito y complicaciones de estas se detallan a continuación:
(17) Éxito: no necesidad de tratamiento adicional. Complicaciones: hemorragia (sangrado > 500 ml), histerectomía
(18) Éxito: no necesidad de tratamiento adicional. Complicaciones severas: histerectomía, laparotomía, hemorragia (sangrado> 1.000 mL o transfusiones de sangre)
(19) Éxito: no necesidad de tratamiento adicional. Complicaciones: histerectomía. No se define qué se considera sangrado ni si éste se produce previo o posterior al tratamiento, por lo que no incluimos este dato en nuestra revisión.
(20) Éxito: no necesidad de tratamiento adicional. Complicaciones: necesidad inmediata o tardía de un tratamiento secundario.
RESULTADOS
Se describen 5 modalidades de manejo del ECC: observación, tratamiento médico con metotrexato (MTX), Embolización de Arterias Uterinas (EAU), Ultrasonido Focalizado de Alta Intensidad (UFAI) y tratamiento quirúrgico. También se informa de tratamientos combinados.
Observación
Alta morbilidad, con más 50% de complicaciones como parto prematuro, rotura uterina, anomalías de la placentación, invasión de órganos vecinos, histerectomía y hemorragia significativa. También se han descrito coagulopatía intravascular diseminada, shock hipovolémico y muerte, por ello, no se recomienda (18,21).
Algunos autores proponen requisitos para aquellas pacientes que deseen conducta expectante (estabilidad, gestación no viable, tipo 1, β-hCG en descenso y nulos o mínimos síntomas(22,23). Se observaron mejores resultados cuando la actividad cardíaca fetal era negativa(12).
Un meta-análisis(12) cuestiona que la interrupción del embarazo sea la única opción que se le ofrezca a las pacientes, dado que observa que un 76,9%(40/52) de las que tenía actividad cardiaca fetal positiva evolucionaron hasta el tercer trimestre. No obstante, 39,2% presentó hemorragia intensa durante el tercer trimestre, 10,2% rotura uterina, 74,8% acretismo placentario con dos tercios (17/29) de placentas pércretas y un 60,6%(23/40) de histerectomías en el momento de la cesárea.
Las pacientes deben conocer la estrecha vigilancia y morbilidad que supone esta opción.
Tratamiento médico
- MTX sistémico: Se observan diversas pautas de administración intramuscular (im): monodosis (50mg/m2) o dosis múltiples (1mg/kg) en días alternos con ácido folínico, con un máximo de 4 dosis hasta que la β-hCG disminuya un 15%), otros estudios contemplan un protocolo de dosis única con posibilidad de una segunda dosis a la semana(24,25,26,27). La literatura muestra una tasa de resolución entre el 8,7%-75% sin describirse protocolos de dosis de los casos y estudios incluidos. Se han descrito un 13% de complicaciones graves (Tabla 1).
- MTX intrasacular (de 25 a 50mg) vía transabdominal o transvaginal guiadas por ecográfía, con posibilidad de aspiración previa del contenido del saco. Algunos clínicos repiten la dosis en una semana si la β-hCG no ha disminuido un 15%, al igual que se describió en el tratamiento sistémico(27,28). Su éxito varía del 60 al 88%(18,28). La tasa de complicaciones descrita es similar o inferior a la del tratamiento sistémico (Tabla 1). Algunos autores lo consideran como tratamiento de primera línea(4,20). Un estudio compara la administración de MTX local con el régimen sistémico monodosis con posibilidad de segunda dosis a la semana, con una eficacia similar (69.2% vs 67.3% respectivamente)(27). Tratamientos combinados con MTX local y KCl inyectados en el saco gestacional más MTX sistémico aumentan la tasa de éxito(21,28,29). El KCl intrasacular suele utilizarse en presencia de actividad cardiaca fetal(6,25,30).
Maheux-Lacroix et al.(17) describe un éxito del 56%, 60% y 77% para la terapia sistémica, local y sistémica y combinada, respectivamente. Cuatro estudios informaron el uso de protocolos multidosis con una tasa de éxito del 54%.
Se han propuesto pautas de selección de las pacientes para un mayor éxito en el tratamiento: <8 semanas de gestación, ausencia de actividad cardíaca embrionaria, hemodinámicamente estable, β-hCG < 5000-12000 mIU/ml, y más de 2 mm de espesor entre el miometrio y vejiga(11,17,25,30). Otros estudios sugieren el éxito si masa trofoblástica < 2-3cm de diámetro(28,31) y niveles de β-hCG <20000-100000 mIU/ml(27,38,31).
Con el tratamiento médico la media de retorno de βhCG a la normalidad es 45 +/- 13 (6–188) días(17).
EAU
Bajo anestesia local, abordaje transfemoral, inyección de partículas de alcohol polivinílico o gelatina de trisacrilo. Más frecuente como tratamiento adyuvante para disminuir el sangrado, suele realizarse 24-48 h antes del procedimiento quirúrgico y en ocasiones combinado con tratamiento médico con MTX previo a la oclusión(17,32).
La EAU, como tratamiento de primera línea, tiene una tasa de éxito del 18 al 81% con un 5% de hemorragia y un 4% de histerectomías (Tabla 2). Cuando se asocia a otros tratamientos médicos o quirúrgicos, el éxito aumenta, llegando a alcanzar el 93% cuando combina con el legrado, de ahí que Birch Petersen et al.(18) considere esta asociación como un posible tratamiento de primera línea. Dado que la necesidad de tratamiento complementario cuando se utiliza sólo puede llegar a ser del 82%, algunos no lo recomiendan como tratamiento de inicio(18) , otros sugieren que la EAU como un enfoque de primera línea debe estar limitado a los casos con sangrado significativo y/o sospecha de malformación arteriovenosa(19). Además, la seguridad de EAU en mujeres con deseo genésico es controvertida (riesgo de insuficiencia ovárica e infertilidad, aborto, parto prematuro y hemorragia postparto)(33). Se propone asociar la EAU a otros tratamientos cuando el riesgo de sangrado es alto (niveles elevados de βhCG o alto flujo sanguíneo en ecografía) (32), mujeres con sangrado vaginal abundante o sospecha de malformación arteriovenosa(19). También se utiliza como terapia de rescate cuando el tratamiento se complica con sangrado excesivo(17,20).
La media de retorno de βhCG a la normalidad con EAU solo es 60 (49–73) y asociado a otros tratamientos 27 ± 13 (7–134) (17).
UFAI
Puede realizarse con ablación sola o en combinación con legrado por aspiración bajo guía histeroscópica. El ultrasonido en tiempo real se utiliza para orientar el área del saco gestacional y monitorizar la respuesta(18). La tasa de éxito es del 91 al 100%, hemorragia entre 0-4% e histerectomía 0% (Tabla 3). La media de retorno de βhCG a la normalidad es 29 +/- 8 (7–70) días(17).
La Tabla 4 describe los efectos adversos del tratamiento no quirúrgico del ECC.
Tratamiento quirúrgico
Resección del ECC
- Legrado: habitualmente guiado por ecografía. Como tratamiento único se describe un éxito del 37,1 al 76% con 21% complicaciones severas (Tabla 5). Algunas revisiones no lo recomiendan como tratamiento de primera línea debido al riesgo de hemorragia grave(18,30,19,20). En publicaciones de series de casos que describen la técnica como legrado por aspiración no se observaron complicaciones mayores, aunque el 22% requirió tratamiento adicional. Se recomienda un grosor miometrial de más de 3,5 mm(25). Un estudio retrospectivo de 232 mujeres tratadas con legrado observó una tasa de éxito del 91% con 7 semanas o menos, en comparación con el 56% cuando es mayor de 7 semanas. Los ECC tipo 2, alta vascularización o actividad cardiaca, se asocian a mayor fracaso del tratamiento y complicaciones(34,35). Cuando el legrado se realiza en combinación con EAU o asociado a EAU y tratamiento médico disminuye notablemente la necesidad de procedimientos y las complicaciones (Tabla2). La media de retorno de βhCG a la normalidad es 27 ± 10 (6–140), sin gran variación cuando se asocia a otros tratamientos (17).
- Histeroscopia quirúrgica: una alternativa mínimamente invasiva que permite realizar la resección de la gestación ectópica. Puede realizarse junto con ecografía abdominal permitiendo mejorar el control de la profundidad de resección. Fue descrita en 2005 por Wang(36). Su éxito es del 39-83% con 3,2% complicaciones severas (Tabla 6). Yang et al.(37) describe una cohorte de 39 casos tratados mediante resección histeroscópica, previamente a la cirugía 36 pacientes recibieron mifepristona y 3 pacientes MTX + EAU; sólo 2 pacientes requirieron una intervención adicional. No hubo diferencias en la pérdida de sangre durante la cirugía y la normalización de β-hCG entre los ECC tipo 1 y 2 (17.6 vs 20.7 días); sin embargo, el tiempo de absorción de la masa restante fue significativamente mayor en el tipo 2 (media 72.2 vs 29.9 días). Con el objetivo de minimizar el sangrado se ha descrito la inyección de vasopresina en el estroma cervical (10ml de una dilución de 20 unidades en 50ml de suero fisiológico) previa a la histeroscopia(38), así como la administración intraoperatoria de 10 UI de oxitocina o carboprost 0.5mg vía rectal(39) y la colación temporal de balón intrauterino tras la resección(32,39). En 2014 Wang(39) observó que en la resección histeroscópica de EEC tipo 2 se asociaba con sangrado intraoperatorio y postoperatorio excesivo, descenso lento en los niveles de β-hCG, tiempo más prolongado de absorción de la masa residual, con una mayor proporción de casos que requirieron retratamiento y mayor riesgo de infección intrauterina y hemorragia masiva a largo plazo. Recomiendan un espesor miometrial >3mm para aplicar esta técnica(40). Se podría utilizar como tratamiento primario, especialmente para las EEC tipo 1, asociándose un seguimiento corto, una rápida disminución de β-hCG(19,20,25), con una media de resolución de 25 ± 7 (3–34) (17).
Resección y reparación del ECC
- Laparoscopia: permite resecar el embarazo ectópico y reparar el defecto uterino. Descrita por Lee en 1999(2). Publicaciones posteriores confirman que puede ser un método seguro y eficaz(39,41-43). Tiene una tasa de éxito del 64,4-97% sin complicaciones graves (Tabla 7), con media de retorno de β-hCG de 19 +/- 5 (17–36) días(17). Los artículos publicados describen su uso mayoritariamente en ECC tipo 2(41,43). Wang et al.(39) trató con este método a 32 pacientes sin describirse complicaciones. Utiliza inyección de hipofisina (0,1 unidades/ml, 10–20ml) perilesional para disminuir el sangrado, posteriormente aspiración transvaginal del contenido uterino, colocación globo intrauterino, y por último la resección del embarazo ectópico. Fuchs 2015(43) utiliza vasopresina (20 unidades en 400 ml de solución salina), suturas de torniquete o clips vasculares para la oclusión temporal de las arterias uterinas. Papillon-Smith et al.(44) utiliza vasopresina local (20 UI/100 ml de solución salina) y ligadura bilateral de la división anterior de la arteria ilíaca interna. Con estos procedimientos los autores describen mínimas pérdidas hemáticas. Para el cierre del defecto se realiza sutura de 1 a 3 capas(39,43,44). Li et al.(47) sugiere realizar histeroscopia tras cierre del defecto para verificar la normalidad de la cavidad y diagnosticar y tratar posibles problemas como adherencias.
- Vía vaginal: se realiza colpotomía anterior para acceder al ECC con la posterior extracción y reparación de la cicatriz anterior. Presenta una tasa de éxito del 97-99%, 0,9% complicaciones severas (Tabla 7) y con media de retorno β-hCG de 24+/-6 (6–32) días(17). Una preocupación que se ha planteado es la visualización incompleta del ECC y la cicatriz de histerotomía con el potencial de tejido embrionario persistente(29).
- Vía laparotómica: Resección y reparación con una tasa de éxito del 71,4-96%, un 4% de hemorragia (Tabla 7) y media de retorno de β-hCG de 21+/-1 (14–44) días(17).
Histerectomía
Los datos encontrados en la literatura se describen habitualmente en mujeres con inestabilidad hemodinámica, sangrado agudo, rotura uterina o implantación placentaria anormal; mayormente realizada por vía laparotómica (Tabla 8).
Se han propuesto algunos algoritmos de manejo (Tabla 9).
CASOS CLÍNICOS
CASO 1: 37 años. G2C1. Consulta por sangrado vaginal escaso, 6 semanas de amenorrea y test de gestación positivo. β-hCG 3050 UI/L. Ecografía transvaginal: en área de histerotomía previa imagen econegativa de 7×3,7 mm, con cavidad uterina y canal endocervical vacíos. A las 72h β-hCG 6250 mUI/ml, confirmándose ECC endógeno con saco gestacional de 9×6 mm a nivel de istmocele que abomba hacia cavidad uterina, con vesícula vitelina de 3.6×2.8 mm sin polo embrionario y reacción decidual con doppler positivo escaso. Se administra MTX im (50 mg/m2), a las 72h se administra 25 mg de MTX intrasacular diluido en 1 cc vía histeroscópica confirmándose un saco gestacional en bóveda del istmocele previa aspiración del contenido del saco. Presentó sangrado posterior autolimitado y dolor abdominal leve. La evolución fue favorable, con descenso progresivo de la β-hCG (5721, 2435, 699, 10, 0 UI/ml en días 4,7,10,18 y 22 tras la administración de MTX im) y resolución de la imagen descrita en ecografía al mes del último control. Se realiza una histeroscopia diagnóstica a los 4 meses sin observarse tejido residual. (Figura 1).
CASO 2: 41 años. G2C1. Acude por amenorrea 5+4 semanas con dolor abdominal autolimitado y test de gestación negativo. Se realizan β-hCG seriadas cada 4 días, con valores de: 399, 596, 961, 657, 447 UI/l, la ecografía transvaginal presenta imagen de 8×7 mm, sin vesícula vitelina ni polo embrionario, que cumple criterios ecográficos de ECC endógeno. Se administra MTX im (50mg/m2). Se produce descenso de β-hCG desde el primer control, 4º día β-hCG de 242 UI/l, se decide observación y control β-hCG en días 7,15 y 27 con valores de 120, 29 y 5 U/l respectivamente. Presentó sangrado autolimitado y molestias abdominales. La imagen ecográfica se resolvió a los 5 meses.
CASO 3: 40 años. G3C1A1, portadora BRCA1. En ecografía control del primer trimestre (amenorrea 11+6 semanas) se diagnosticó gestación en istmocele, visualizando ECC exógeno con masa trofoblástica de 27×19 en contacto con la serosa con saco gestacional que crece hacia cavidad abdominal y embrión de 2mm sin latido cardiaco, amplia reacción decidual y vascularización periférica. β-hCG 315 UI/l. RMN: masa trofoblástica de 25x31x35 mm en istmocele en contacto con serosa uterina sin infiltración vesical. Debido a la elevada vascularización, contacto con la serosa uterina, portadora BRCA1, y deseo genésico cumplido, se plantea tratamiento quirúrgico (histerectomía + doble anexectomía laparoscópica) que cursó sin complicaciones. (Figura 2).
DISCUSIÓN
A pesar de la amplia bibliografía publicada hasta la fecha no hay una actitud de consenso ni pautas de actuación claras respecto al tratamiento. Las revisiones bibliográficas están limitadas por la calidad y heterogeneidad de los estudios y casos incluidos, con gran variedad de tratamientos asociados o no, en su mayoría retrospectivos y sin asignación al azar, lo que los hace difícilmente comparables.
El tratamiento médico con MTX resulta atractivo por ser menos invasivo, sin embargo, el tiempo de vigilancia y resolución suele ser prolongado. Algunos autores no lo recomiendan como tratamiento de primera línea debido a que observaron alta necesidad de tratamiento secundario y complicaciones(10,20). No obstante, al igual que sucede con la gestación ectópica tubárica, en pacientes que cumplen ciertos criterios, se observan mejores resultados y en este subgrupo podría considerarse como terapia de primera línea(11,17,25,28,30).
Presentamos 1 caso de ECC tipo 1 resuelto con éxito mediante tratamiento combinado con MTX sistémico e intrasacular guiado por histeroscopia. Las publicaciones sobre esta técnica son escasas. La administración local mediante histeroscopia, ha sido utilizada para el tratamiento de gestaciones intersticiales(46) y también en un caso de ECC(47), aunque a diferencia de nuestro primer caso, a pesar de una progresiva disminución en la β-hCG decidieron realizar resección histeroscópica a las 2 semanas por spotting. La revisión de MineKanat-Pektas et al. (19) incluye 14 casos, pero no informa de sus resultados como grupo independiente. No obstante, podríamos pensar que las tasas de éxito deben ser similares a las de la terapia con MTX local guiadas por ecografía, ya que la técnica únicamente difiere en el método de guía de la misma. La histeroscopia tiene la ventaja de que nos permite una visualización directa del saco gestacional y un mayor control del procedimiento. Nos decantamos por el tratamiento combinado en vez de sistémico, porque se ha observado que la tasa de resolución es mayor con el primero(17), probablemente por la limitación de la exposición de MTX al trofoblasto por la presencia de tejido fibroso que rodea el saco gestacional. Nuestro segundo caso de ECC tipo 1, presentaba valores bajos de β-hCG de inicio con buena respuesta al tratamiento con dosis única de MTX por lo que no requirió terapia local.
Los tratamientos quirúrgicos, tienen altas tasas de éxito, sin embargo, son más invasivos, se requiere mayor habilidad quirúrgica y no están exentos de riesgo. Los resultados del legrado pueden optimizarse realizándolo por aspiración y seleccionado a pacientes con menor edad gestacional. La resección histeroscópica y la resección y reparación laparoscópica han sido propuestos como tratamientos primarios(19).
Nuestro tercer caso, ECC tipo 2 en paciente de 40 años con BRCA mutado y deseo genésico cumplido, es un ejemplo de que en determinadas situaciones, la histerectomía, puede considerarse como tratamiento de primera línea en ausencia de síntomas graves o inestabilidad hemodinámica.
Para las pacientes con futuro deseo genésico resulta importante abordar el riesgo de recurrencia y fertilidad posterior al tratamiento del ECC. El riesgo de recurrencia se desconoce debido a la poca frecuencia del ECC, pérdida de seguimiento y a una pequeña proporción intentan un embarazo(48). Algunos estudios sitúan la recurrencia entorno al 4-15,6%(48,49), otro trabajo lo sitúa en el 40%(50). Respecto al riesgo de recurrencia en función del tratamiento, en general los estudios y revisiones alegan un pequeño tamaño muestral para extraer conclusiones firmes(17,50), no obstante Maheux-Lacroix et al.(17) reportaron casos de recurrencia en todas las modalidades de tratamiento excepto en la reparación quirúrgica. La revisión de MineKanat-Pektas et al.(19) encontró que la capacidad de lograr un embarazo a término posterior está relacionada con el éxito del tratamiento sistémico con MTX o reparación quirúrgica. El embarazo a término fue significativamente más frecuente en el grupo de reparación quirúrgica.
La combinación de tratamientos parece aumentar la tasa de éxito, no obstante, podría implicar un mayor riesgo de efectos secundarios y costes. Al igual que otros autores(17,19,20,32), proponemos la EAU asociada a otros tratamientos cuando el riesgo de sangrado es alto, mujeres con sangrado vaginal abundante o sospecha de malformación arteriovenosa. Se recomienda evitarla en la medida de lo posible en pacientes con deseo genésico por el potencial impacto perjudicial en la fertilidad(33).
Proponemos el siguiente esquema de manejo para las pacientes con ECC en primer trimestre (Figura 3).
CONCLUSIÓN
El manejo de los ECC debe de ser individualizado y estar basado en la evidencia publicada hasta la fecha, además de los medios disponibles y la experiencia de los profesionales en los distintos procedimientos, guiándonos por el tipo de ECC y su grado de vascularización e invasión, grosor del miometrio, niveles de β-hCG, presencia de actividad cardiaca, clínica y estabilidad hemodinámica de la paciente. Deben tenerse en cuenta las circunstancias y patología intercurrente de la mujer, así como su deseo genésico o de preservación del útero.
REFERENCIAS
- Rotas MA, Haberman S, Levgur M. Cesarean scar ectopic pregnancies: etiology, diagnosis, and management. Obstet Gynecol 2006; 107:1373.
- Lee CL, Wang CJ, Chao A, Yen CF, Soong YK. Laparoscopic management of an ectopic pregnancy in a previous Caesarean section scar. Hum Reprod 1999; 14(5):1234-6.
- Valley MT, Pierce JG, Daniel TB, Kaunitz AM. Cesarean scar pregnancy: imaging and treatment with conservative surgery. Obstet Gynecol 1998; 91(5 Pt 2):838-40.
- Lee CL, Wang CJ, Chao A, Yen CF, Soong YK. Laparoscopic management of an ectopic pregnancy in a previous Caesarean section scar. Hum Reprod 1999; 14(5):1234-6.
- Timor-Tritsch IE, Monteagudo A, Santos A, Tsymbal T, Pineda G, Arslan AA. The diagnosis, treatment, and follow-up of cesarean scar pregnancy. AJOG 2012; 207(1): 44.e1-13.
- Jurkovic D, Hillaby K, Woelfer B, Lawrence A, Salim R, Elson CJ. First-trimester diagnosis and management of pregnancies implanted in the lower uterine segment scar in the first trimester. Ultrasound Obstet Gynecol 2003; 47(4):511-7.
- Ash A, Smith A, Maxwell D. Caesarean scar pregnancy. BJOG 2007; 114(3):253-63.
- Fylstra DL, Pound-Chang T, Miller MG, Cooper A, Miller KM. Ectopic pregnancy within a cesarean scar: a review. Am J Obstet Gynecol 2002, 187(2):302-4.
- Godin PA, Bassil S, Donnez J. An ectopic pregnancy developing in a previous cesarean section scar. Fertil Steril 1997; 67(2):398-400.
- Marchiolé P, Gorlero F, de Caro G, Podestà M, Valenzano M. Intramural pregnancy embedded in a previous Cesarean section scar treated conservatively. Ultrasound Obstet Gynecol 2004; 23(3):307-9.
- Maymon R, Halperin R, Mendlovic S, Schneider D, Herman A. Ectopics pregnancy in a cesarean scar: review of the medical approach to an iatrogenic complication. Hum Reprod Uptodate 2004; 10(6):515-23.
- Calì G et al. Outcome of Cesarean scar pregnancy managed expectantly: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2018 Feb;51(2):169-175.
- Vial Y, Petignat P, Hohlfeld P. Pregnancy in a cesarean scar. Ultrasound Obstet Gynecol 2000; 16(6):592-3.
- Graesslin O, Dedecker F Jr, Quereux C, Gabriel R. Conservative treatment of ectopic pregnancy in a cesarean scar. Obstet Gynecol 2005; 105(4):869-71.
- Shih JC. Cesarean scar pregnancy: diagnosis with three-dimensional (3D) ultrasound and 3D power Doppler. Ultrasound Obstet Gynecol 2004; 23(3):306-7.
- Shufaro Y, Nadjari M. Implantation of a gestational sac in a cesarean section scar. Fertil Steril 2001; 75(6):1217.
- Maheux-Lacroix S, Li F, Bujold E, Nesbitt-Hawes E, Deans R, Abbott J. Cesarean scar pregnancies: a systematic review of treatment options. J Minim Invasive Gynecol 2017; 24(6):915-925.
- Birch Petersen K, Hoffmann E, Rifbjerg Larsen C, et al. Cesarean scar pregnancy: a systematic review of treatment studies. Fertil Steril 2016; 105(4):958-67.
- Kanat-Pektas M, Bodur S, Dundar O, Bakır VL. Systematic review: What is the best first-line approach for cesarean section ectopic pregnancy? Taiwan J Obstet Gynecol 2016;55(2):263-9.
- TimorTritsch IE, Monteagudo A. Unforeseen consequences of the increasing rate of cesarean deliveries: early placenta accretand cesarean scar pregnancy. A review. Am J Obstet Gynecol 2012; 2007 (1):14-29.
- Sadeghi H et al. Cesarean scar ectopic pregnancy: case series and review of the literature. Am J Perinatol 2010; 27(2):111-20.
- Mollo A, Conforti A, Alviggi C, De Placido G. Successful direct bipolar resection of 6th week cesarean scar pregnancy: Case report and literature review. Eur J Obstet Gynecol Reprod Biol 2014;179 229–231.
- Liu H, Leng J, Shi H, Lang J. Expectant treatment of cesarean scar pregnancy: two case reports and a glimpse at the natural courses. Arco Gynecol Obstet 2010; 282(4):455-8.
- Kutuk MS, Uysal G, Dolanbay M, Ozgun MT. Successful medical treatment of cesarean scar ectopic pregnancies with systemic multidose methotrexate: single-center experience. J Obstet Gynaecol Res 2014; 40: pp. 1700-1706.
- Gonzalez N, Tulandi T. Cesarean scar pregnancy: a systematic review. J Minim Invasive Gynecol 2017; 24(5):731-738.
- Barnhart KT, Gosman G, Ashby R, Sammel M. The medical management of ectopic pregnancy: a meta-analysis comparing ‘‘single dose’’ and ‘‘multidose’’ regimens. Obstet Gynecol 2003; 101(4):778-84.
- Peng P, Gui T, Liu X, Chen W, Liu Z. Comparative efficacy and safety of local and systemic methotrexate injection in cesarean scar pregnancy. Ther Clin Risk Manag 2015; 11:137–142.
- Cheung VY. Local Methotrexate Injection as the First-lineTreatment for Cesarean Scar Pregnancy: Review of the Literature. J Minim Invasive Gynecol 2015; 22 (5): 753-8.
- Glenn TL et al. Cesarean Scar Ectopic Pregnancy: Current Management Strategies. Obstet Gynecol Surv. 2018;73(5):293-302.
- Parker VL, Srinivas M. Non-tubal ectopic pregnancy. Arch Gynecol Obstet 2016;294(1):19-27.
- Dior UP, Palma-Dias R, Reidy KL, Cheng C, Healey M. Cearean Scar Pregnancies: incidence and factors associated with conversion to surgery from medical management. J Minim Invasive Gynecol 2019; 26(5):919-927.
- Li H, Guo HY, Han JS, et al. Endoscopic treatment of ectopic pregnancy in a cesarean scar. J Minim Invasive Gynecol 2011; 18(1):31-5.
- Walker WJ, McDowell SJ. Pregnancy after uterine artery embolization for leiomyomata: a series of 56 completed pregnancies. Am J Obstet Gynecol 2006; 195(5):1266-71.
- Wu XQ, Zhang HW, Fang XL, Ding H, Piao L, Joseph Huang S. Factors associated with successful transabdominal sonography-guided dilation and curettage for early cesarean scar pregnancy. Int J Gynecol Obstet 2014; 131(3):281-4.
- Wang CB, Tseng CJ. Primary evacuation therapy for cesarean scar pregnancy: three new cases and review. Ultrasound Obstet Gynecol 2006;27(2):222-6.
- Wang CJ, Yuen LT, Chao AS, Lee CL, Yen CF, Soong YK. Caesarean scar pregnancy successfully treated by operative hysteroscopy and suction curettage. BJOG 2005 ;112(6):839-40.
- Yang Q, Piao S, Wang G, Wang Y, Liu C. Hysteroscopic Surgery of Ectopic Pregnancy in the Cesarean Section Scar. J Minim Invasive Gynecol 2010; 16(4):432-6.
- Chang Y, Kay N, Chen YH, Chen HS, Tsai EM. Resectoscopic treatment of ectopic pregnancy in previous cesarean delivery scar defect with vasopressin injection. Fertil Steril 2011; 96(2): e80-e82.
- Wang G, Liu X, Bi F, Yin L, Sa R, Wang D. Evaluation of the efficacy of laparoscopic resection for the management of exogenous cesarean scar pregnancy. Fertil Steril 2014; 101(5):1501-7.
- Marrón K , Weaver Z . Hysteroscopic and laparoscopic management of caesarean scar (niche) defects in symptomatic patients. J Obstet Gynaecol 2018; 38 (5): 730.
- Wang YL, Su TH, Chen HS. Laparoscopic management of an ectopic pregnancy in a lower segment cesarean section scar: a review and case report. J Minim Invasive Gynecol 2005;12(1):73-9.
- Wang YL, Su TH, Chen HS. Operative laparoscopy for unruptured ectopic pregnancy in a caesarean scar. BJOG 2006; 113(9):1035-8.
- Fuchs N, Manoucheri E, Verbaan M, Einarsson JI. Laparoscopic management of extrauterine pregnancy in caesarean section scar: description of a surgical technique and review of the literature. BJOG 2015;122(1):137-40.
- Papillon-Smith J, Sobel ML, Niles KM, Solnik MJ, Murji A. Surgical management algorithm for caesarean scar pregnancy. J Obstet Gynaecol Can 2017. 39(8):619-626.
- Li J, Li X, Yu, Zhang X, Xu W, Yang J. Combined laparoscopic and hysteroscopic management of cesarean scar pregnancy with temporary occlusion of bilateral internal iliac arteries: A case report and literature review. Medicine (Baltimore) 2018;97(32): e11811.
- Leggieri C, Guasina F, Casadio P, Arena A, Pilu G, Seracchioli R. Hysteroscopic Methotrexate Injection Under Ultrasonographic Guidance for Interstitial Pregnancy. J Minim Invasive Gynecol 2016; 23(7): 1195-1199.
- Korkontzelos I, Tsirkas P, Antoniou N, Souliotis D, Kosmas I. Successful term pregnancy after treatment of a cesarean scar ectopic gestation by endoscopic technique and conservative therapy. Fertil Steril 2008; 90(5):2010.e13-5.
- Wang Q, Peng HL, He L, Zhao X. Reproductive outcomes after previous cesarean scar pregnancy: follow up of 189 women. Taiwan J Obstet Gynecol 2015; 54(5):551-3.
- Maymon R et al. Fertility performance and obstetric outcomes among women with previous cesarean scar pregnancy. J Ultrasound Med 2011;30(9):1179-84.
- Grechukhina O, Deshmukh U, Fan L, Kohari K, Abdel-Razeq S, Bahtiyar MO, Sfakianaki AK. Cesarean Scar Pregnancy, Incidence, and Recurrence: Five-Year Experience at a Single Tertiary Care Referral Center. Obstet Gyneco 2018;132(5):1285-1295.
- Tahaoglu AE et al. A single centre’s experience of caesarean scar pregnancy and proposal of a management algorithm. J Obstet Gynaecol 2019;39(2):259-264.
TABLAS
Tabla 1. Metotrexato (MTX)
| Tratamiento | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17) | MTX sistémico (n 202)
MTX local (n137) MTX sistémico + local (n106) |
56%
60% 77% |
6% hemorragia, 3% histerectomía
4% hemorragia, 2,2% histerectomía 11% hemorragia, 2,2% histerectomía |
| Birch Petersen 2016(18)
|
MTX sistémico (n339)
Aspiración + MTX/KCl local (n148) |
75,2%
84,5%
|
13% complicaciones severas
(n10) histerectomía (n25) hemorragia 13,5% complicaciones severas (n9) histerectomía, (n9) hemorragia |
| Mine Kanat-Pektas 2016(19) | MTX sistémico (n 549) | 8,7% | 3,7% histerectomía |
| TimorTritsch 2012(20) | MTX sistémico (n87)
MTX local transabdominal (n9) MTX local transabdominal + sistémico (n14) MTX local transvaginal (n32) |
37,9%
88,9% 84,6%
87,5% |
62,1%
11,1% 15,4%
12,5% |
Tabla 2. Embolización de Arterias Uterinas (EAU)
| Tratamiento | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17) | EAU (n113)
EAU + legrado (n595) EAU + MTX + legrado (n346) EAU + otra cirugía (n189) |
81%
93% 98% 97% |
5% hemorragia, 4,4% histerectomía
4% hemorragia,1,2% histerectomía 4% hemorragia, 0,3% histerectomía 3% hemorragia, 1,1% histerectomía |
| Birch Petersen 2016(18)
|
EAU + legrado (n295)
EAU + legrado + MTX (n427)
EAU + legrado + histeroscopia (n85) |
93,6 %
68,6%
95,4% |
3,4% complicaciones severas
(n6) histerectomía, (n4) hemorragia 2,8% complicaciones severas (n2) histerectomía, (n8) hemorragia 1,2% complicaciones severas (n1) histerectomías |
| Mine Kanat-Pektas 2016(19) | EAU (n361) | 18,3% | 1,1% histerectomía |
| TimorTritsch 2012(20)
|
EAU (n5)
EAU + MTX sistémico (n54) EAU + MTX local (n3) EAU + legrado (n78) |
20%
55,4% 100% 70,5 |
80%
44,6% 0% 29,5% |
Tabla 3. Ultrasonido focalizado de alta intensidad (UFAI)
| Tratamiento | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17)
|
UFAI (n93)
|
91%
|
4% hemorragia, 0% histerectomía
|
| Birch Petersen 2016(18)
|
UFAI (n16)
UFAI + histeroscopia/legrado (n53) |
100%
100%
|
0% complicaciones severas
0% complicaciones severas
|
Tabla 4. Tratamientos no quirúrgicos del EEC. Efectos secundarios o adversos
| MTX | Náuseas, vómitos, malestar gastrointestinal, alopecia, neumonitis, aumento de enzimas hepáticas supresión de la médula ósea y estomatitis (6-36%). Cirrosis y fibrosis hepática, poco frecuentes y más graves(18,31)
Más frecuentes en régimen multidosis(18,31) |
| EAU | Dolor pélvico (25%), fiebre o infección (18%), náuseas y / o vómitos (8%) y dolor en las extremidades (4%)(18) |
| UFAI | Reingresos (11%), dolor (18%) e induración subcutánea (1%)(18) |
Tabla 5. Legrado (L)
| Tratamiento | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17) | L (n645)
L + MTX (n243) |
76%
80% |
28% hemorragia, 2,5% histerectomía
17% hemorragia, 6,2% histerectomía |
| Birch Petersen 2016(18) | L (n243) | 48,1% | 21% complicaciones severas
(n11) histerectomía, (n37) hemorragia |
| Mine Kanat-Pektas 2016(19) | L (n232) | 61,6% | 7,3% histerectomía |
| TimorTritsch 2012(20) | L (n97)
L + MTX (n54) |
37,1%
14% |
62,9%
86% |
Tabla 6. Resección histeroscópica (HSC)
| Tratamiento | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17) | HSC (n117) | 88% | 3% hemorragia, 1,7% histerectomía |
| Birch Petersen 2016(18 ) | HSC (n95) | 83% | 3,2% complicaciones severas
(n1) histerectomía |
| Mine Kanat-Pektas 2016(19) | HSC (n110)* | 39% | 0% histerectomía |
| TimorTritsch 2012(20) | HSC (n61)
HSC + MTX (n5) |
85,3%
100% |
14,7%
0% |
*En 14 casos el tratamiento fue inyección intrasaccular de metotrexato/etanol
Tabla 7. Resección y reparación laparotómica (LT), laparoscópica(LS) y vaginal(V)
| Vía de abordaje | Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17)
|
LT (n23)
LS (n62) V (n151) |
96%
97% 99% |
4% hemorragia, 0% histerectomía
0% hemorragia, 0% histerectomía 1% hemorragia, 0,7% histerectomía |
| Birch Petersen 2016(18) | LS (n69)
V (n118) |
97,1%
99,2% |
0% complicaciones severas
0,9% complicaciones severas (n1) histerectomía |
| Mine Kanat-Pektas 2016(19) | (n174) LT 44.8%, LS 48,3%, V 6,9% | 92,1% | 1,7% histerectomía |
| TimorTritsch 2012(20)
|
LT (14)
LS (n49) LS + histeroscopia (n5) V (n1) |
71,4%
69,4% 80% 100% |
28,6%
30,6% 20% 0% |
Tabla 8. Histerectomía
| Tasa éxito | Complicaciones | |
| Maheux-Lacroix 2017(17) (n4) | 100% | 25% hemorragia |
| TimorTritsch 2012(20) (n3) | 100% | 0% |
Tabla 9. Algoritmos y esquemas de manejo del ECC propuestos en la literatura
| Tahaoglu 2019(51)
|
ECC tipo 1 con (β-hCG <5000UI o latido cardiaco negativo o gestación >6 semanas) | Metotrexato |
| ECC tipo 1 con (β-hCG > 5000UI o latido cardiaco positiva o gestación <6 semanas) | Legrado/histeroscopia | |
| Los ECC tipo 2 con (β-hCG <10000UI o actividad cardiaca negativa o gestación >6 semanas) | Legrado/metotrexato
|
|
| Los ECC tipo 2 con (β-hCG > 10000UI o actividad cardiaca positiva o gestación <6 semanas)
|
Resección laparoscópica/laparotómica | |
| González 2016(25)
|
Terapia metotrexato multidosis con inyección intraamniótica y/o intrafetal de ClK cuando hay actividad cardíaca fetal | La dosis de metotrexato de 1 mg/kg de peso vía intramuscular.
Cuando los niveles de β-hCG no disminuyen adecuadamente o comienzo de sintomatología, se realiza resección histeroscópica de la gestación para ECC tipo 1 o laparoscópica para ECC tipo 2. |
| Papillon-Smith et al 2017(44)
|
Tratamiento quirúrgico primario.
Si existe actividad cardiaca se administra ClK local intramniótico, 48h-7 días después se realiza laparoscopia con ligadura bilateral de la rama anterior de la arteria iliaca interna y disección de la plica vesicouterina a nivel del istmo para confirmar el tipo de ECC |
En tipo 1 realizan abordaje transcervical: con inyección de vasopresina intracervical, dilatación cervical, diagnóstico histeroscópico, legrado por aspiración bajo visión laparoscópica y nueva histeroscopia para resecar tejido coriónico residual y realizar hemostasia. |
| En tipo 2 realizan resección y reparación del defecto por vía laparoscópica previa inyección de vasopresina en el miometrio que rodea al ectópico. |
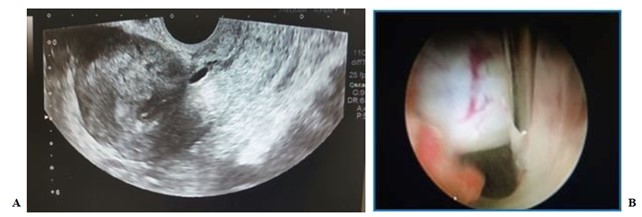
Figura 1. ECC tipo 1. (A) Ecografía transvaginal, corte sagital. (B) Visión por histeroscopia.
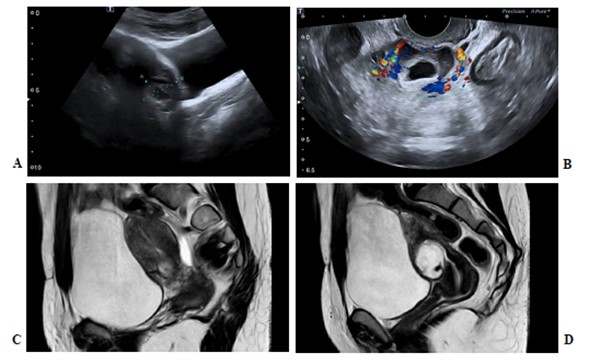
Figura2. ECC tipo2. (A) Ecografía transvaginal, corte sagital. (B) Ecografía transvaginal, corte transversal con Doppler color. C) Resonancia Magnética, corte parasagital, istmocele. (D) Resonancia Magnética, corte sagital, ECC.
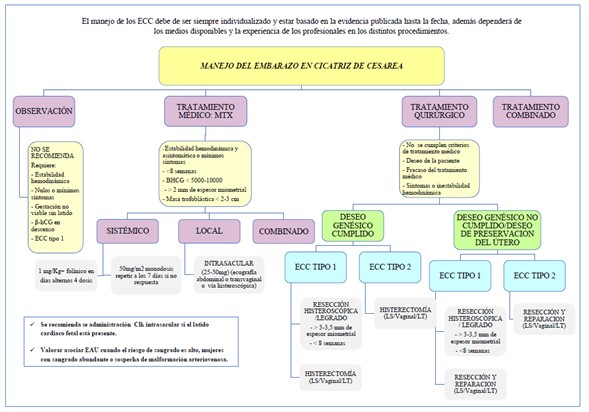
Figura 3. Algoritmo de manejo del ECC



