2006
5
Autores:
René Rivera Z.1, Raúl Barrero P.1, Gladys García M.2, David Barrero V.a, Angélica Larraín H.b
Instituciones:
1Servicio de Obstetricia y Ginecología, Hospital Félix Bulnes C., 2Servicio de Anatomía Patológica, Hospital Félix Bulnes C..
aAlumno(a) de Medicina, Universidad de Chile, bMatrona, Escuela de Obstetricia, Universidad de Santiago de Chile.
Tipo de documento:
Casos ClínicosTumor borderline mucinoso ovárico gigante con microinvasión
Contenido del documento:
INTRODUCCIÓN
Los tumores de ovario borderline, también llamados tumores de bajo potencial maligno (1), inicialmente descritos por Taylor en 1929 como tumores «semimalignos» o como variantes hiperplásticas del cistoadenoma (2), han sido objeto de estudio para precisar su etiopatogenia, así como los factores que representan mal pronóstico en términos de recurrencia y mortalidad. La clasificación histológica en este tipo de tumores ha presentado modificaciones, fundamentalmente respecto de la atipía celular, variante micropapilar serosa y en relación al concepto de microinvasión (3). Se presenta un caso clínico de un tumor borderline mucinoso ovárico gigante, con focos de microinvasión operado, incluyendo una revisión de la literatura.
CASO CLÍNICO
Paciente de 41 años, consulta el 27/11/05 por dolor y aumento de volumen abdominal de dos meses de evolución. Entre sus antecedentes mórbidos destaca hipertensión arterial crónica y obesidad mórbida (IMC: 51,7). Al examen ginecológico se aprecia cuello uterino de aspecto sano, no se logra delimitar útero ni ovarios. Se palpa gran tumor que ocupa la cavidad abdominopélvica, que rechaza diafragma y bases pulmonares. Ecografía y TAC abdominal confirman la presencia de tumoración sólido-quística compleja, de probable origen ovárico de 35 x 26 cm, sin ascitis ni adenopatías. CA-125: 67,6 U/ml.
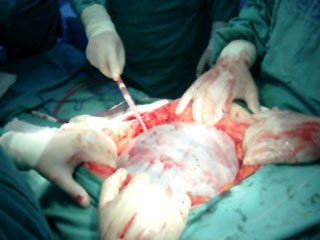
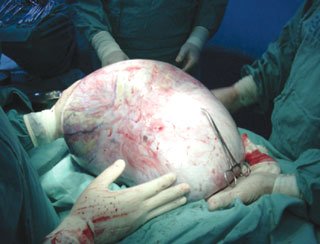
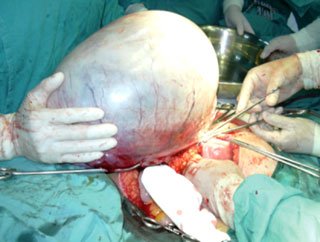
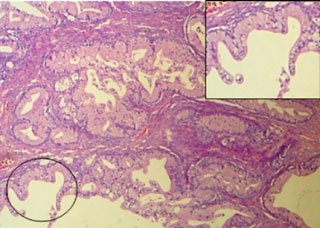
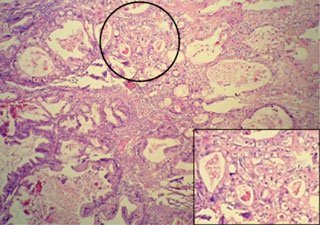
El 05/12/05 se practica laparotomía exploradora, realizándose tumorectomía de gran lesión ovárica derecha (Figuras 1, 2 y 3). Biopsia intraoperatoria informa tumor borderline mucinoso sólido-quístico de 13,8 kg con sospecha de invasión. Se toma muestra para estudio citológico, efectuándose histerectomía total más anexectomía izquierda, omentectomía infracólica y apendicectomía. Exploración de superficie subdiafragmática, hígado, correderas parietocólicas y trayecto aorto-cava sin evidencias de tumor. Biopsia diferida concluye: tumor borderline mucinoso mülleriano ovárico, con focos de microinvasión menores de 3 mm, sin compromiso de cápsula ni infiltración vascular (Figuras 4 y 5). Omento, apéndice y citológico sin evidencia de neoplasia. La paciente evoluciona satisfactoriamente y es dada de alta el 10/12/05.
DISCUSIÓN
Los tumores de ovario borderline, representan el 15% de los tumores epiteliales de ovario (4), pudiendo corresponder a la estirpe serosa, mucinosa, endometrioide, células claras o células transicionales (tumor de Brenner) (1). Las estirpes serosa y mucinosa corresponden a las más frecuentes con un 63 y 37%, respectivamente (5).
Histológicamente, presentan estructura quístico -papilar, estratificación celular y grados variables de atipía celular (6). La microinvasión, definida como la infiltración estromal de células neoplásicas aisladas o en grupos, con una extensión máxima en profundidad de 3 a 5 mm o una superficie de grupo con implantes invasivos se describen hasta en un 83%, comparado a un 33% en el grupo con implantes no invasivos (15). Los mecanismos descritos para el desarrollo de este tipo de lesión son (16):
- La transformación maligna en un tumor borderline, que origina metástasis a sitios extraováricos.
- Desprendimiento de células del tumor borderline y por vía intracavitaria peritoneal o por vía linfática se alcanzarían sitios a distancia.
- Desarrollo de un implante extraovárico invasivo, independiente del tumor borderline ovárico primario, con la participación de clones celulares separados.
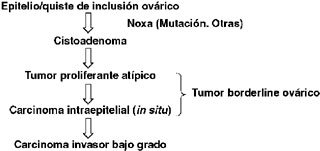
Se ha propuesto un nuevo concepto en la patogenia de este tipo de neoplasias, que contrasta con el desarrollo de los carcinomas de ovario de alto grado. En este modelo, aplicable para los tipos serosos, mucinosos, endometrioides, células claras y transicionales, los tumores borderline se desarrollarían a partir de alteraciones producidas en el epitelio ovárico, en quistes de inclusión o en focos endometriósicos (17). Estas alteraciones han sido estudiadas principalmente en tumores borderline serosos y mucinosos, los cuales concentran una alta frecuencia de mutaciones en ciertos genes como KRAS y BRAF (18). También se describe en ellos aumento en la expresión de la kinasa dependiente de ciclina CDKN1A (P21/WAF1), así como desbalance alélico progresivo en regiones cromosómicas discretas como 1q, 5q, 8p, 18q, 22q, Xp (19,20). El cistoadenoma sería la lesión morfológica inicial, progresando un grupo de éstos a tumor proliferante atípico, carcinoma intraepitelial in situ (micropapilar en los tumores serosos), pudiendo finalizar un subgrupo en un carcinoma invasor de bajo grado (G1) (Figura 6) (7,8,9) ha sido encontrada en el 10 a 15% de los tumores borderline serosos y entre el 9 a 19% de los de estirpe mucinosa (6,10,11). Actualmente no se ha precisado si el número de focos microinvasivos, así como el grado de atipía celular presente en ellos cambian el pronóstico. Otro elemento en discusión es el número de secciones histológicas que se deberían realizar, dado que al existir duda de invasión el número de éstas aumenta más allá del número promedio actualmente indicado (1 sección por cm de diámetro máximo tumoral), según criterio del patólogo (8).
La variante micropapilar, presente en el 12% de los tumores borderline serosos (12), ha sido definida por la presencia de un centro o eje fibrovascular del cual emergen micropapilas delgadas de gran longitud («aspecto de medusa») que deben ocupar un área mayor de 5 mm de dimensión máxima, con o sin microinvasión (13). La importancia de esta variante sería la asociación con un mayor compromiso ovárico bilateral, mayor presentación en estadíos avanzados, así como de una mayor frecuencia de implantes invasivos. Ésta última característica ha sido vinculada al peor pronóstico presente en este tipo de tumores (12).
Respecto de los implantes peritoneales, actualmente se clasifican como no invasivos e invasivos (10,13). En el primer grupo se describen los epiteliales y los desmoplásticos. En el segundo, aparece infiltración tumoral del estroma subyacente, a una profundidad variable (14). El pronóstico, en términos de sobrevida a 5 años, se reduce significativamente en el grupo con implantes invasivos (66% versus 95,3% para implantes no invasivos) (10). Respecto de recurrencias, en el (21,22). El tumor borderline seroso y mucinoso puede ser dividido en 2 tipos (23): Tumor proliferante atípico y carcinoma intraepitelial (in situ). Como puede verse, el tumor borderline ovárico, representaría una etapa en la progresión a un carcinoma invasor de bajo grado. Del mismo modo, la atipía puede ser severa, representada en el carcinoma in situ.
La etapa más frecuente es la I con un 71 a 90% (24). Respecto de los exámenes de apoyo habitualmente utilizados, el CA-125 se encuentra elevado en el 30 a 83% de los casos (25). La ultrasonografía transvaginal informa características quísticas, sólidas o complejas (25,26), sin embargo, al igual que el CA-125, representan formas de estudios inespecíficos (27).
Respecto de los factores pronósticos, solo los implantes peritoneales y probablemente la arquitectura micropapilar, representan un pronóstico adverso, en términos de recurrencia y sobrevida (1). El compromiso ganglionar linfático pélvico y lumboaórtico, presente en el 7 a 18% de los casos, no cambia el pronóstico (1,28).
El tratamiento recomendado en pacientes jóvenes que desean mantener fertilidad es la cirugía conservadora (quistectomía, ooforectomía o salpingo-ooforectomía unilateral según extensión tumoral), con recurrencias del 18,5%, las cuales se tratan quirúrgicamente, sin afectar la sobrevida (28). En pacientes mayores, con paridad cumplida la histerectomía total más salpingo-ooforectomía bilateral logra recurrencias de 4,7%; la linfadenectomía pélvica o lumboaórtica no ha demostrado ser de utilidad en el manejo de tumores borderline ováricos (28). La sobrevida a 10 años alcanza un 99% para la etapa I, reduciéndose a un 77% en la etapa IV (1).
BIBLIOGRAFÍA
- Ayhan A, Guven Guvendag ES, Guven S, Kucukali T. Recurrence and prognostic factors in borderline ovarian tumors. Gynecol Oncol 2005;98:439-45.
- Taylor HC. Malignant and semimalignant tumors of the ovary. Surg Gynecol Obstet 1929;48:204-30.
- Rabban JT, Bell DA. Current issues in the pathology of ovarian cancer. J Reprod Med 2005;50:467-74.
- DiSaia PJ, Creasman WT, Burger RA, Monk BJ, Match DG. La masa anexial y el cáncer ovárico precoz. DiSaia PJ, Creasman WT. Oncología Ginecológica Clínica. 6ª ed. Madrid: Harcourt, SA. 2002; 259-288.
- Boger-Megiddo I, Weiss NS. Histologic subtypes and laterality of primary epithelial ovarian tumors. Gynecol Oncol 2005;97:80-3.
- Hart WR. Mucinous tumors of the ovary: a review. Int J Gynecol Pathol 2005;24(1):4-25.
- Shappell HW, Riopel MA, Smith Sehdev AE, Ronnett BM, Kurman RJ. Diagnostic criteria and behavor of ovarian seromucinous (endocervical-type mucinous and mixed cell-type) tumors. Am J Surg Pathol 2002;26(12):1529-41.
- Nomura K, Aizawa S. Noninvasive, microinvasive, and invasive mucinous carcinomas of the ovary. Cancer 2000;89:1541-6.
- Dubé V, Roy M, Plante M, Renaud MC, Tetu B. Mucinous ovarian tumors of Mullerian-type: an analysis of 17 cases including borderline tumors and intraepithelial, microinvasive, and invasive carcinomas. Int J GynecolPathol 2005;24(2):138-46.
- Bell DA, Longacre TA, Prat J, Kohn EC, Soslow RA, Ellenson LH, et al. Serous borderline (low malignant potential atipical proliferative) ovarian tumors: Workshop Perspectives. Hum Pathol 2004;35:934-48.
- Fauvet R, Boccara J, Dufournet C, David-Montefiore E, Poncelet C, Darai E. Restaging surgery for women with borderline ovarian tumors. Cancer 2004;100:1145-51.
- Eichhorn JH, Bell DA, Young RH, Scully RE. Ovarian serous borderline tumors with micropapillary and cribiform patterns: a study of 40 cases and comparison with 44 cases without these patterns. Am J Surg Pathol 1999;23(4):397-409.
- Seidman JD, Soslow RA, Vang R, Berman JJ, Stoler MH, Sherman ME, et al. Borderline ovarian tumors: diverse contemporary viewpoint on terminology and diagnostic criteria with illustrative images. Hum Pathol 2004;35:918-33.
- Gershenson DM, Silva EG, Levy L, Burke TW, Wolf JK, Tornos C. Ovarian serous borderline tumors with invasive peritoneal implants. Cancer 1998;82:1096-103.
- Boran N, Cil AP, Tulunay G, Ozturkoglu E, Koc S, Bulbul D, et al. Fertility and recurrence results of conservative surgery for borderline ovarian tumors. Gynecol Oncol 2005;97:845-51.
- Sherman ME, Birrer MJ, Cho KR, Ellenson LH, Gorstein F, Seidman JD. Current challenges and opportunities for research on borderline ovarian tumors. Hum Pathol 2004;35:961-70.
- Körner M, Burckhardt E, Mazzucchelli L. Different proportions of aneusomic cells in ovarian inclusion cysts associated with serous borderline tumours and serous high-grade carcinomas support different pathogenetic pathways. J Pathol 2005;207:20-6.
- Singer G, Oldt III R, Cohen Y, Wang BG, Sidransky D, Kurman RJ, et al. Mutations in BRAF and KRAS characterize the development of low-grade ovarian serous carcinoma. J Natl Cancer Inst 2003;95:484-86.
- Crispens MA. Borderline ovarian tumours: a review of the recent literature. Curr Opin Obstet Gynecol 2003;15:39-43.
- Meinhold-Heerlein I, Bauerschlag D, Hilpert F, Dimitrov P, Sapinoso LM, Orlowska-Volk M, et al. Molecular and prognostic distinction between serous ovarian carcinomas of varying grade and malignant potential. Oncogene 2005;24:1053-65.
- Shih IeM, Kurman RJ. Ovarian tumorigenesis. A proposed model based on morphological and molecular genetic analysis. Am J Pathol 2004;164(5): 1511-8.
- Bell DA. Origins and molecular pathology of ovarian cancer. Modern Pathol 2005;18:S19-S32.
- Singer G, Stöhr R, Cope L, Dehari R, Hartmann A, Cao D-F, et al. Patterns of p53 mutations separate ovarian serous borderline tumors and low- and high-grade carcinomas and provide support for a new model of ovarian carcinogenesis. Am J Surg Pathol 2005;29(2):218-24.
- Sherman ME, Mink PJ, Curtis R, Cote TR, Brooks S, Hartge P, et al. Survival among women with borderline ovarian tumors and ovarian carcinoma a population-based analysis. Cancer 2004;100(5): 1045-52.
- Behtash N, Modares M, Abolhasani M, Ghaemmaghami F, Mousavi M, Yarandi F, et al. Borderline ovarian tumours: clinical analysis of 38 cases. J Obstet Gynaecol 2004;24(2):157-60.
- Horiuchi A, Itoh K, Shimizu M, Nakai I, Yamazaki T, Kimura K, et al. Toward understanding the natural history of ovarian carcinoma development: a clinicopathological approach. Gynecol Oncol 2003;88:309-17.
- Exacoustos C, Romanini ME, Rinaldo D, Amoroso C, Szabolcs B, Zupi E, et al. Preoperative sonographic features of borderline ovarian tumors. Ultrasound Obstet Gynecol 2005;25:50-9.
- Tinelli R, Tinelli A, Tinelli F, Cicinelli E, Malvasi A. Conservative surgery for borderlie ovarian tumors: A review. Gynecol Oncol 2006;100:185-91.