2020
5
Autores:
Sochog
Instituciones:
Andrés Carvajal 1, María José Soto 2 , Marcela Calonge 1, Carlos Troncoso 1, Rose Meier 1, Eliseo Sánchez 1, Rodrigo Carvajal 1.
1 Clínica Instituto Valenciano de Infertilidad (IVIRMA), Santiago, Chile
2 Departamento Medicina Reproduciva, Red de Salud UC Christus.
Correspondencia
Contacto: Dr. Andrés Carvajal Abumohor
E-mail: andres.carvajal@ivirma.com
Tipo de documento:
Trabajos OriginalesVitrificación de ovocitos en pacientes oncológicas: experiencia en clínica ivi chile y revisión de la literatura
Contenido del documento:
INTRODUCCIÓN
Hoy en día los avances en tecnología y medicina han permitido cambiar de forma importante el pronóstico de pacientes oncológicos, tanto en quimioterapia, radioterapia, como técnicas quirúrgicas. La sobrevida de pacientes con cáncer de mama y cáncer infantil ha ido mejorando en el tiempo1. Esto, sumado al retraso de la maternidad a nivel mundial dado el aumento del desarrollo profesional y la postergación del embarazo por fines personales, ha resultado en un incremento del número de mujeres con diagnóstico oncológico en edad fértil que aún no han tenido descendencia y que mantienen el deseo de embarazo1 . A partir de lo anterior surge la intención y necesidad de la preservación de la fertilidad al momento del diagnóstico oncológico y la educación de los profesionales de salud sobre los tipos de tratamientos existentes. Tanto la Sociedad Europea de Medicina Oncológica como la Sociedad Americana de Oncología Clínica (ASCO) sugieren consejería precoz al momento del diagnóstico de cáncer en mujeres jóvenes. Solo el 68% de las pacientes oncológicas discute con su médico tratante el tema de fertilidad previo al inicio del tratamiento y, de ellas, sólo el 10% decide someterse a un tratamiento de preservación2. Las estrategias de preservación de fertilidad incluyen la criopreservación de tejido ovárico, supresión de la función ovárica con análogos de GnRh previo al tratamiento, criopreservación de ovocitos inmaduros y la criopreservación de embriones u ovocitos a través de estimulación ovárica controlada (EOC), siendo la última la de mayor uso y efectividad2.
El objetivo de este estudio es hacer un análisis descriptivo, retrospectivo, de la experiencia en criopreservación de ovocitos en pacientes oncológicas en Clínica IVI Chile entre los años 2008 a 2017 y revisión de la literatura.
MATERIALES Y MÉTODOS
Se analizaron los datos obtenidos de pacientes oncológicas que acudieron a Clínica IVI Chile entre Enero de 2008 a Mayo del 2017 en búsqueda de preservación de fertilidad. Se obtuvieron datos demográficos, tales como: edad, diagnóstico de ingreso, tipo de protocolo de estimulación utilizado y datos clínicos como: número de ovocitos obtenidos y duración de la estimulación. Además, se realizó un seguimiento telefónico posterior a la preservación de ovocitos para evaluar el deseo de fertilidad, uso de ovocitos vitrificados y pronóstico de su enfermedad de base. Los datos son anonimizados. Todas las pacientes firmaron un consentimiento informado y el estudio cuenta con la aprobación del comité de ética científico del servicio de salud metropolitano oriente.
RESULTADOS
En total, cuarenta pacientes con diagnóstico oncológico se realizaron tratamiento en Clínica IVI Chile entre Enero del 2008 y Mayo del 2017.
Los diagnósticos oncológicos específicos por orden de frecuencia se presentan en el Gráfico1.
Los datos demográficos de la serie se describen en la Tabla 1. En todas las pacientes se optó por la vitrificación de ovocitos.
El protocolo de estimulación más utilizado fue con un antagonista de GnRH asociado a gonadotropinas más Letrozole N: 24(59%). El segundo protocolo fue con un esquema de antagonistas de GnRH y Gonadotropinas sin letrozole N:16(41%). Las gonadotropinas utilizadas fueron una combinación de FSH asociado a LH o HMG.
En relación a los protocolos de EOC, el antagonista de GnRH fue iniciado con un tamaño folicular de 14 mm. Adicionalmente, en pacientes con cáncer hormono-sensibles, se utilizó Letrozole en forma continua, de inicio a término del tratamiento, en dosis de 5 mg al día. En la mayoría de los casos, el inicio del tratamiento se realizó en etapa folicular temprana, lo que se conoce como técina convencional10.
A las 40 pacientes se les tomó niveles de estradiol. Los niveles promedio de estradiol en los protocolos con uso de Letrozole (N=24) fueron de 593 pg/ml (DS ± 259) y, sin uso de Letrozole (N=16), 2786 pg/ml (DS ±1977) (Gráfico 2), con rangos de estradiol entre 69 pg/ml y 1880 pg/ml utilizando Letrozole y entre 927 pg/ml y 7080 pg/ml sin uso de Letrozole.
Respecto al número de ovocitos totales y maduros obtenidos en protocolos con Letrozole (N=24) fue, en promedio 13 (DS± 7,4) y 9 (DS± 5,7), respectivamente. En protocolos sin Letrozole (N=16), el número fue de 11(DS± 7) y 8 (DS±6,5), respectivamente. (Gráfico 3, Tabla 2).
En cuanto al gatillante de ovulación, de las 40 pacientes, 24 utilizaron Lupron, 13 HCG y 3 Doble gatillante. El número de ovocitos totales y maduros promedio obtenidos según gatillante de ovulación fue: 11 (DS± 6,6)y 9(DS±6,4), respectivamente, utilizando Hormona Coriónica Humana (HCG); 13(DS± 8,1) y 9(DS± 6,2) con Agonista de GnRH ; 17 (DS± 3,5) ovocitos totales y 12 (DS± 6,3) maduros al usar doble gatillante (HCG+GnRH). (Gráfico 4 y Tabla 3)
Por último, en cuanto al seguimiento de las pacientes que se contactaron, hay una paciente fallecida por un cáncer no hormono-sensible.
En cuanto a la utilización de los ovocitos vitrificados aún no se cuenta con resultados. Hasta la fecha cinco mujeres han regresado por deseos de fertilidad, de las cuales dos están en espera de la autorización del equipo oncológico tratante para realizar fecundación in vitro. En las demás pacientes no se ha podido realizar tratamiento; la razón en una de ellas es por infertilidad explicada por factor masculino severo y en el caso de las otras dos pacientes, fueron sometidas a histerectomía total como parte del tratamiento oncológico.
DISCUSIÓN
Dentro de las técnicas disponibles para preservación de fertilidad, las más utilizadas y aceptadas son la criopreservación de ovocitos y embriones2. Otros métodos incluyen:
- Criopreservación de tejido ovárico: consiste en la extracción laparoscópica de corteza ovárica para criopreservar, la cual contiene folículos primordiales. Posteriormente, este tejido puede auto-transplantarse en peritoneo o a nivel subcutáneo. Esta técnica es utilizada principalmente en pacientes pre-menárquicas o en aquellas que no tengan la opción de espera previo al tratamiento oncólogico. Sin embargo, su efectividad en tasa de embarazo no supera el 29%3.
- Supresión ovárica con análogos de GnRH previo al ciclo de quimioterapia: esta técnica ha permitido disminuir la probabilidad de fallo ovárico prematuro, mediante la inducción de un estado post menopáusico transitorio que permite proteger al ovocito del efecto nocivo de la quimioterapia4. Sí es importante mencionar que no es totalmente efectiva para impedir el daño ovárico asociado a los tratamiento oncológicos.
- Maduración in vitro de ovocitos inmaduros: se han logrado avances significativos en esta técnica. Sin embargo, aún persiste en línea de investigación sin ser todavía de aplicación clínica.5
Actualmente la estimulación ovárica controlada (EOC) para crioperservación de ovocitos o embriones es la técnica más establecida y utilizada para preservación de fertilidad en pacientes oncológicas. Es posible utilizarla en cualquier paciente en la que su quimioterapia pueda diferirse dos semanas6. De los protocolos disponibles para EOC, el más utilizado y recomendado es el uso de gonadotropinas asociadas a antagonistas de GnRH para estimulación ovárica y, posteriormente, el uso de un análogo de GnRH para gatillar la ovulación. Esto permite disminuir la probabilidad de un síndrome de hiperestimulación ovárica7.
Existe evidencia de que niveles altos de estradiol en forma mantenida podrían afectar la sobrevida en pacientes con cánceres hormono-sensibles8,9. Por otro lado, en el meta análisis de Rorgers10 , con un seguimiento a 6,9 años en pacientes con cáncer de mama, no se observa diferencia significativa en sobrevida de pacientes que realizaron EOC con letrozole vs paciente que no realizaron EOC. Sin embargo, en este último meta análisis, sólo se comparan dos grupos con niveles bajos de estradiol (grupo con letrozole vs grupo sin EOC), pero no se comparan grupos con niveles altos de estrogenos (EOC sin inhibidores de aromatasa) vs un grupo con medidas bajas estrogenos. Por lo tanto, por el momento, se recomienda añadir en la EOC el uso de inhibidores de aromatasa, como Letrozole, con el objetivo de mantener niveles de estradiol bajos8. En este estudio, se obtuvieron niveles más bajos de estradiol con el uso de inhibidores de aromatasa, siendo en promedio 593 pg/ml y el valor máximo 1880 pg/ml, medida que es protectora en cánceres hormono sensibles. Se utilizó Letrozole durante todo el tratamiento (desde el inicio de la estimulación ovárica hasta posterior a la extracción de óvulos) permitiendo, de esta manera, mantener bajos los niveles hormonas en todo momento.
El número de ovocitos maduros obtenidos es similar con el uso de Letrozole asociado a gonadotropinas versus gonadropinas en monoterapia. Este hecho se cumple en nuestras pacientes también. No se obtuvo diferencias significativas en el número de ovocitos maduros en los protocolos de estimulación con Letrozole versus el uso de gonadotropinas solas. Esta diferencia no fue significativa dado el número (n) reducido de pacientes.
El inicio randomizado de la estimulaión ovárica representa una nueva estrategia en la EOC en pacientes oncológicos, que se sugiere utilizar cuando no es posible esperar un próximo período menstrual para iniciar la inducción ovulatoria, dada la premura de iniciar el tratamiento oncológico.
En el inicio randomizado se decide el protocolo a utilizar en función de la fase del ciclo mentrual en la que se encuentre la paciente. Se ha propuesto iniciar la estimulación de dos posibles maneras: en fase folicular tardía o en fase lútea, ya sea posterior al peak de hormona luteinizante (LH) o bien, después de la inducción ovulatoria con HCG o agonista GnRH2. En una fase folicular precoz es posible utilizar un antagonista de GnRH para luego iniciar la EOC. Por otro lado, en pacientes en fase folicular tardía se utiliza la inducción de ovulación (con agonista GnRH), aspiración folicular y, posteriormente, se reinicia la EOC con el resto de folículos más pequeños. Finalmente, está la alternativa de inicio de EOC en fase lútea12.
En nuestro centro, hemos comenzado la EOC en distintos momentos del ciclo menstrual, dependiendo del momento en que la paciente oncólogica consulta, obteniendo buenos resultados.
El inicio randomizado presenta una ventaja significativa respecto a otras modalidades, ya que disminuye el tiempo total del tratamiento de fertilidad sin comprometer el número de ovocitos totales o madurez ovocitaria antes del tratamiento oncológico. Tanto el inicio randomizado según fase del ciclo menstrual, como la técnica convencional (inicio en fase folicula precoz), tienen la misma efectividad en el resultado final de preservación de fertilidad2.
En cuanto a las dosis de gonadotropinas, en IVI Chile utilizamos una dosis promedio de 225 UI con buenos resultados. Las dosis recomendadas de gonadotropinas para EOC varían entre 150 y 300 UI . Dosis menores pueden disminuir la cantidad de ovocitos extraídos.
Con el objetivo de optimizar la cantidad de ovocitos maduros, es ideal desencadenar ovulación con folículos de tamaño sobre los 18 mm y utilizar agonistas de GnRH como gatillante14. En este estudio, se observan tasas similares de ovocitos obtenidos entre los distintos tipos de desencadenante de ovulación, siendo mayor en el grupo de pacientes que recibieron doble gatillante (Gráfico 4).
Respecto a la tasa de embarazo posterior con FIV, ésta es inversamente proporcional a la edad de la paciente y directamente proporcional a la cantidad de óvulos vitrificados. A menor edad y mayor cantidad de ovocitos vitrificados, mayor es la tasa de embarazo13 . Cobo 201615 demostró que la tasa de embarazo bajo los 36 años con ocho ovocitos maduros es de un 40% versus sólo un 15% con 5 ovocitos maduros. Desde los 36 años en adelante, la tasa de embarazo con 8 óvulos maduros es 19,9% y con 5 óvulos maduros sólo un 5%.
Las complicaciones asociadas al procedimiento son bajas (menos de 1%), siendo hemorragia, síndrome hiperestimulación ovárica, infección y torsión ovárica las más frecuentes. En esta serie no se presentaron complicaciones asociadas.
En cuanto al acceso al tratamiento, en nuestro centro, los primeros casos fueron pacientes que consultaron por cuenta propia. Sin embargo, posteriormente la mayoría de los casos fueron derivados por instituciones con servicio de oncología. En nuestra experiencia, no todos los oncólogos u oncoginecólogos derivan sus pacientes oncólogicas jóvenes para preservación de fertilidad previo tratamiento oncológico. Adicionalmente, no todos realizan consejería respecto al impacto del tratamiento oncológico en la reserva ovárica y, por ende, ésta la realizamos recién en clinica IVI cuando la paciente consulta. Esto provoca que aún existan pacientes jóvenes con cáncer que inician su tratamiento oncológico desconociendo la posibilidad que tenían de preservar su fertilidad, lo que hace de extrema importancia el trabajo en conjunto del equipo oncológico y de medicina reproductiva para darles la opción de mantener su fertilidad a futuro.
Cabe destacar que las aseguradoras no cubren el financiamiento total del tratamiento para preservación de fertilidad en pacientes oncológicas, a diferencia del cáncer testicular, donde la preservación de semen si está cubierta. Esperamos que esto pueda mejorar en el futuro para que un mayor número de pacientes con cáncer puedan preservar su fertilidad.
CONCLUSIÓN
En nuestro centro, las pacientes oncológicas con deseo de preservar fertilidad lograron realizar vitrificación de ovocitos en la gran mayoría de los casos. El número de días necesarios para realizar el tratamiento es breve, lo cual permite diferir lo menos posible el inicio del tratamiento oncológico. El pronóstico reproductivo posterior de estas pacientes es bueno dado que son pacientes jóvenes en su mayoría. Nuestros datos confirman que es posible personalizar el inicio de la estimulación, acortando con ello los días para el inicio del tratamiento oncológico, sin poner en riesgo el éxito del tratamiento de preservación de la fertilidad. Recomendamos una consejería a todas las pacientes con diagnóstico reciente de cáncer y edad fértil sobre el impacto del tratamiento oncólogico en su reserva ovárica para evaluar la posibilidad de preservar su fertilidad. Lo más importante es que el equipo oncólogico y de medicina reproductiva trabajen en conjunto para poder dar la posibilidad de fertilidad futura a estas pacientes.
REFERENCIAS
- Fuentes A., Jesam C, Devoto L., Angarita B., Galleguillos A., Torres A., Mackenna A. Postergación de la maternidad en Chile: Una realidad oculta rev Med chile 2010; 138: 1240-1245
- Kasum M, von Wolff M, Franulić D, Čehić E, Klepac-Pulanić T, Orešković S, Juras J.Fertility preservation options in breast cancer patients.GynecolEndocrinol. 2015;31(11):846-51
- Liebenthron J, Dittrich R, Toth B, et al. Orthotopic ovarian transplantation – results in relation to experience of the transplant- ation centers, overnight tissue transportation and transplantation into the peritoneum. Hum Reprod 2015;30:i97–8
- Masters GA, Krilov L, Bailey HH, et al. Clinical cancer advances 2015: annual report on progress against cancer from the american society of clinical oncology. J Clin Oncol 2015;33:786–809
- Telfer EE, McLaughlin M. In vitro development of ovarian follicles. Semin Reprod Med 2011;29:15–23.
- B. Courbiere, C. Decanter , Aspects cliniques pratiques de la vitrification ovocytaire en oncofertilite ́. Gynécologie Obstétrique & septembre 2014. Fertilité Volume 42, n° 9 pages 653-656
- Bedoschi G, Oktay K. Current approach to fertility preservation by embryo cryopreservation. Fertil Steril 2013;99:496–502
- Kasum M, Beketic ́-Oresˇkovic ́ L, Peddi PF, et al. Fertility after breast cancer treatment. Eur J Obstet Gynecol Reprod Biol 2014;173:13–18
- Pereira N, Hancock K, Cordeiro CN, Lekovich JP, Schattman GL, Rosenwaks Z. Comparison of ovarian stimulation response in patients with breast cancer undergoing ovarian stimulation with letrozole and gonadotropins to patients undergoing ovarian stimulation with gonadotropins alone for elective cryopreservation of oocytes. Gynecol Endocrinol. 2016 Oct;32(10):823-826.
- Rachael J. Rodgers, Geoffrey D. Reid, Juliette Koch, Rebecca Deans, William L. Ledger,
Michael Friedlander, Robert B. Gilchrist, Kirsty A. Walters, and Jason A. Abbott. The safety and efficacy of controlled ovarian hyperstimulation for fertility preservation in women with early breast cancer: a systematic review. Human Reproduction, Vol.32, No.5 pp. 1033–1045, 2017.
- Nurudeen SK1, Douglas NC, Mahany EL, Sauer MV, Choi JM. Fertility Preservation Decisions Among Newly Diagnosed Oncology Patients: A Single-Center Experience. Am J Clin Oncol. 2016 Apr;39(2):154-9
- Cakmak H, Rosen MP. Ovarian stimulation in cancer patients. Fertil Steril 2013;99:1476–84.
- Simi G, Obino ME, Casarosa E, Litta P, Artini PG, Cela V. Different stimulation protocols for oocyte cryropreservation in oncological patients: a retrospective analysis of single university centre. Gynecol Endocrinol. 2015;31(12):966-70.
- Friedler S, Koc O, Gidoni Y, Raziel A, Ron-El R. Ovarian response to stimulation for fertility preservation in women with malignant disease: a systematic review and meta-analysis. Fertil Steril 2012;97:125–33
- Ana Cobo, Ph.D., Juan A. García-Velasco, M.D , Aila Coello, Ph.D , Javier Domingo, M.D, Antonio Pellicer, M.D., Jose_ Remohí, M.D. Oocytes vitrification as an efficient option for elective fertility preservation. Fertil Steril. 2016 Mar;105(3):755-764
GRÁFICOS Y TABLAS
Gráfico 1. Frecuencia por tipo de cáncer.
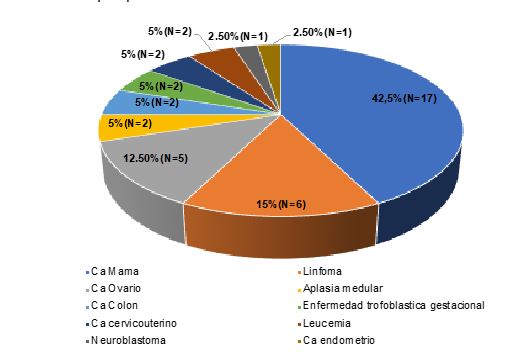
Gráfico 2. Valores de Estradiol promedio prepunción según tipo de protocolo.
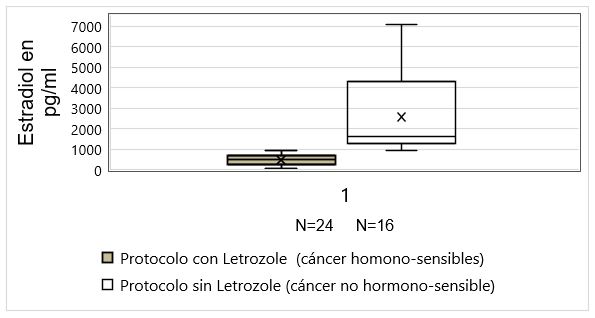
Gráfico 3. Número de ovocitos obtenidos según protocolo de estimulación.
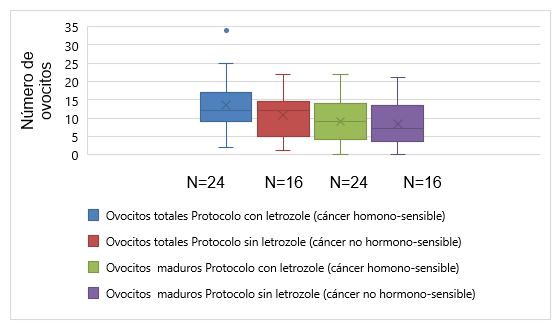
Gráfico 4. Número de ovocitos obtenidos según gatillante de ovulación.
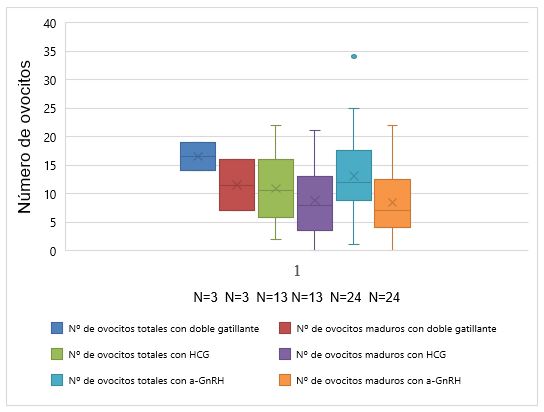
Tabla 1. Datos demográficos de pacientes (total 40).
| Variable | Promedio (Rango) – N |
| Edad (años) | 28 (13 – 40) |
| Tiempo desde primera consulta hasta inicio del tratamiento (días) | 3 (0 – 7) |
| Tipo de tratamiento oncológico | |
| Quimioterapia | 38 |
| Radioterapia | 5 |
| Histerectomía | 2 |
Tabla 2. Número de ovocitos según protocolo de estimulación ovárica.
| Número de Ovocitos | ||||
| Tipo de Protocolo | Totales (Promedio) | Máximos | Mínimos | Maduros (Promedio) |
| Protocolo con letrozole
(cáncer homono-sensible) N = 24 |
13 | 34 | 2 | 9 |
| Protocolo sin letrozole
(cáncer no hormono-sensible) N =16 |
9 | 22 | 2 | 8 |
Tabla 3. Número de ovocitos según gatillante de ovulación.
| Número de ovocitos | ||||||
| Gatiilante de ovulación | Totales (Promedio) | Maduros (Promedio) | Máximos | Mínimos | Maduros (Máximo) | Maduros (Mínimo) |
| Doble Triggering N = 3 | 17 | 12 | 19 | 14 | 16 | 7 |
| HCG N = 13 | 11 | 9 | 22 | 7 | 21 | 0 |
| GnRH N = 24 | 13 | 8 | 34 | 1 | 22 | 0 |



