2010
2
Autores:
Instituciones:
Eduardo Reyna V., Jorly Mejia M., Nadia Reyna V., Duly Torres C., Joel Santos B., Juan Perozo R.
Tipo de documento:
Trabajos OriginalesCONCENTRACIONES DE INTERLEUCINA-2 EN PACIENTES CON PREECLAMPSIA A TÉRMINO Y PRETÉRMINO
Contenido del documento:
RESUMEN
Antecedentes: Existen resultados contradictorios sobre las concentraciones de interleucina-2 (IL-2) en preeclámpticas y se desconoce si existen diferencias en las concentraciones al momento del diagnóstico. Objetivo: Comparar las concentraciones de IL-2 en pacientes preeclámpticas de término y de pretérmino. Método: Se seleccionaron 50 pacientes: 20 preeclámpticas de pretérmino (grupo A) y 30 de término (grupo B). Las muestras de sangre para la determinación de IL-2 se recolectaron antes del parto e inmediatamente después del diagnóstico de preeclampsia. Resultados: No hubo diferencias significativas con relación a edad materna, índice de masa corporal, valores promedio de presión arterial sistólica y diastólica al momento de la toma de la muestra. Las concentraciones de IL-2 fueron similares en el grupo de preeclámpticas pretérmino (67,5 ± 31,8 pg/ml) y el grupo de preeclámpticas de término (69,6 ± 28,5 pg/ml). No hubo correlación significativa entre las concentraciones de IL-2 con los valores promedio de presión arterial sistólica y diastólica. Conclusiones: Las pacientes preeclámpticas con embarazos pretérmino presentaron concentraciones similares de interleucina-2 al compararlo con preeclampticas a término al momento del diagnóstico. Los hallazgos de la investigación sugerirían una falta de activación de los linfocitos T en preeclámpticas.
PALABRAS CLAVE: Interleucina-2, preeclampsia, citokinas
SUMMARY
Background: There are contradictory results about interleukin-2 (IL-2) concentrations in preeclamptic patients and is unknown if there are differences in concentrations at the time of diagnosis. Objective: To compare concentrations of IL-2 in term and preterm preeclamptic patients. Method: Fifty patients were selected. Twenty preterm preeclamptic patients (group A) and thirty term preeclamptic patients (group B) were selected. Blood samples for IL-2 were collected in all patients before labor and immediately after diagnosis of preeclampsia. Results: There were not significant differences related to a maternal age, body mass index and mean values of systolic and diastolic blood pressure at the moment of collecting samples. There were
significant differences between groups in gestational age. There also was not significant difference in IL-2 concentrations in the study group (67.5 ± 31.8 pg/ml) and patients in control group (69.6 ± 28.5 pg/ml). There was not significant correlation between interlukin-2 and mean values of systolic and diastolic blood pressure.
Conclusion: Preeclamptic patients with preterm pregnancies presented similar interleukin-2 concentrations when compared to term preeclamptic patients at the time of diagnosis. The finding of this research suggests a lack of activation of T-lymphocytes in preeclamptic patients.
KEY WORDS: Interleukin 2, preclampsia, cytokines
INTRODUCCIÓN
La preeclampsia es un desorden multisistémico del embarazo con manifestaciones clínicas como hipertensión y proteinuria. Aunque la causa del desorden aún desconocida, los conceptos actuales sugieren una disfunción generalizada del endotelio vascular materno como hallazgo patogénico central (1).
La hipótesis de mala adaptación sugiere que la preeclampsia se debe a una inapropiada regulación de la respuesta materna inmune Th2, llevando a una desviación hacia la perjudicial inmunidad Th1 (2,3). El inicio de la disfunción endotelial en la preeclampsia es desconocido, pero se ha demostrado que las citokinas producen activación de los neutrófilos y de la adhesión celular al endotelio produciendo daño vascular (4).
Se conoce que las citokinas juegan un papel principal no solo en la señalización del sistema inmune, sino también en la ovulación, implantación, placentación y parto (5). Ciertas citokinas (como el factor estimulante de colonias de granulocitos y macrófagos, factor I estimulante de colonias interleucina 3 e interleucina 10) parecen ser favorables para el éxito del embarazo (6,7), mientras otras (como interleucina-2, factor de necrosis tumoral alfa e interferón gamma) tiene efectos deletéreos (8,9).
La interleucina-2 llamada también factor de crecimiento de las células T, es una de las citokinas inmunorreguladoras más importantes. Sus fuentes principales son los linfocitos CD4 Th1, los CD8 y las células natural killer. Es una molécula con un peso de 15.400 D, codificada por un gen ubicado en el cromosoma 4. Puesto que tiene una semidesintegración muy rápida, sus funciones son principalmente locales, auto y paracrinas. El receptor de membrana de la interleucina-2 no se expresa en las células T en reposo, pero alcanza sus valores pico al activarlas por dos o tres días, mientras que a los seis o diez disminuye considerablemente. Está formado por tres cadenas: alfa, beta y gamma que se relacionan en forma no covalente (10). Aunque se conoce que las citokinas, incluyendo, IL-6 e IL-10, están alteradas en la preeclampsia (11,12), existen resultados contradictorios sobre las concentraciones de interleucina-2 en las preeclámpticas y se desconoce si existen diferencias en las concentraciones dependientes del momento de aparición de la preeclampsia.
El objetivo de la investigación fue comparar las concentraciones de interleucina-2 en pacientes con preeclampsia a término y pre-término.
MATERIAL Y MÉTODO
Estudio prospectivo que analiza la concentración de interleucina-2 (IL-2), en un total de 50 pacientes preeclámpticas con diferentes edades gestacionales; 20 pacientes preeclámpticas de pretérmino (grupo A) y 30 pacientes preeclámpticas de término (grupo B).Todas las pacientes eran primigestas. Se definió preeclampsia a la presencia de presión arterial mayor o igual a 140/90 mmHg, en dos tomas separadas por 6 o más horas, y proteinuria de 24 horas =300 mg, o 1-2 cruces de proteinuria en un examen cualitativo, en gestaciones =20 semanas.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente (antes de las 20 semanas), hábito tabáquico, enfermedad cardiaca o renal, diabetes mellitus, embarazo múltiple y tratamiento con medicamentos que puedan alterar el metabolismo de la IL-2.
Las muestras de sangre (10 ml), obtenidas de la vena antecubital, se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico, y se las dejó coagular a temperatura ambiente. Posteriormente, a los 30 minutos de tomada la muestra, fueron centrifugadas a 4500 g por 10 minutos y almacenadas a -80º C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de la IL-2 en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las dos mediciones fue el resultado final. La sensibilidad del método fue de 4 pg/ml. El coeficiente de variación intra e interensayo fue menor del 9%.
Los valores obtenidos se presentaron como promedio +/- desviación estándar. Se utilizó la prueba t de Student para muestras no relacionadas para el análisis de los grupos y la comparación de las variables continuas. Los coeficientes de correlación entre la IL-2 y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. Se consideró un valor p< 0,05 como estadísticamente significativo. La investigación fue aprobada por el Comité de Ética de la institución.
RESULTADOS
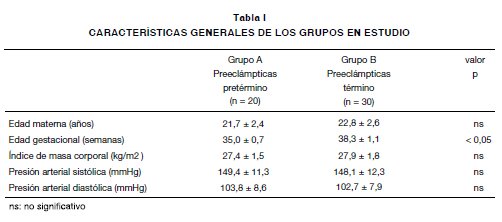
Las características generales de los dos grupos de pacientes se muestran en la Tabla I. No hubo diferencias significativas entre los grupos con relación a edad materna, índice de masa corporal y valores promedio de presión arterial sistólica y diastólica al momento de la toma de la muestra.
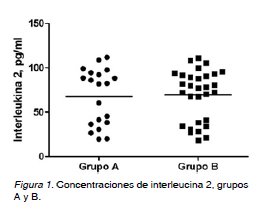
No hubo diferencias estadísticamente significativa entre las pacientes en el grupo de preeclámpticas de pretérmino (grupo A: 67,5 ± 31,8 pg/ml) y las preeclámpticas de término (grupo B: 69,6 ± 28,5 pg/ml (Figura 1). Al realizar la correlación entre las concentraciones de IL-2 y los valores de presión arterial, no se observaron correlaciones significativa con los valores de presión arterial sistólica (r = 0,170; p>0,05), ni con los valores de presión arterial diastólica (r = 0,076; p>0,05).
DISCUSIÓN
En el presente estudio, no se encontraron diferencias significativas en las concentraciones de IL-2
en las pacientes con preeclampsia de término comparado con las pacientes con preeclampsia de pretérmino; de igual forma no encontramos correlación entre los niveles de IL-2 y valores de presión arterial. Uno de los cambios importantes en la preeclampsia es la activación generalizada o la lesión de las células vasculares endoteliales maternas. Se han descrito cambios físicos y funcionales en el endotelio vascular como alteraciones de la permeabilidad y resistencia vascular (13,14), por lo que la enfermedad parece ser en forma primaria un desorden de las células endoteliales (15). Hasta la fecha no se conoce ningun otro trabajo que compare las concentraciones de IL-2 en preeclámpticas antes y durante el término del embarazo.
Dados los efectos dramáticos de las citokinas, se ha propuesto que el trofoblasto y las células endoteliales maternas son los blancos para la agresión inmune en la preeclampsia, ya que son las sustancias efectoras de esta agresión (15). Redman y cols (14) sugieren que los hallazgos clínicos de la preeclampsia son bien descritos por una respuesta inflamatoria materna excesiva, mientras que Massé y cols (15) sugieren que la acción de las citokinas es una de las hipótesis más atractivas de la disfunción inmune en este síndrome.
Las citokinas, incluyendo las interleucinas, representan un diverso grupo de moléculas que ejercen una amplia acción, son diferentes células en el sistema inmune, hematopoyético, endocrino, cardiovascular y nervioso central. Pueden ser producidas por casi cualquier célula nucleada, y generalmente están asociadas con inflamación, activación del sistema inmune, diferenciación y muerte celular (16). Las citokinas han sido clasificadas por ser pro-inflamatorias (IL-1, factor de necrosis tumoral alfa, e IL-6) o antiinflamatorias (IL-10 y factor de crecimiento y transformación beta) dependiendo del balance final de sus efectos sobre el sistema inmune. La expresión tanto de las citokinas proinflamatorias como antiinflamatorias induce ciertas patologías que pueden ser observadas en las preeclámpticas (por ejemplo, isquemia, hemorragia y convulsiones) (17).
La literatura médica que estudia la relación de IL-2 y preeclampsia es escasa. Eneroth y cols (18) consiguieron desde el primer trimestre, mayores concentraciones séricas del receptor de IL-2 en la preeclampsia que en las gestantes sin complicaciones. Este hallazgo significativo apoya la hipótesis sobre factores inmunológicos en esta patología de la gestación, puesto que los niveles del receptor de IL-2, también han sido encontrados en cantidades elevadas, durante episodios de rechazo de trasplantes (19-21). Hamai y cols (22), reportaron valores séricos significativamente elevados de IL-2 y factor de necrosis tumoral alfa durante el primer trimestre, en mujeres que tuvieron preeclampsia después de 28 semanas de gestación. Estos mismos autores afirman que la expresión de IL-2 en los tejidos deciduales, pudiera reducir las sustancias angiogénicas procedentes del trofoblasto.
La IL-2 se detecta en células estromales endometriales decidualizadas y linfocitos en la decidua de preeclámpticas, pero no en la decidua de mujeres sanas (23). El posible papel de la IL-2 en la fisiopatología de la preeclampsia es sugerido por los hallazgos de disminución de la angiogénesis en la placenta de las preeclámpticas inducido por las células natural killer activadas por linfocitos (24). En las células activadas, la porción extracelular de la cadena alfa se desprende a la circulación, convirtiéndose en el receptor soluble. La IL-2, junto al interferón gamma y el factor de necrosis tumoral alfa, es considerada una sustancia nociva para el embarazo, y su administración puede provocar el aborto (25-27). En estudios experimentales, se ha encontrado que la IL-2 esta relacionada con la presencia de convulsiones (28).
Los hallazgos de la investigación sugieren que existe una respuesta inflamatoria universal y marcada en la preeclampsia, aunque la respuesta misma no puede ser explicada por las faltas de signos de la alteración del balance Th1 / Th2. Los hallazgos de la presente investigación sugerirían una falta de activación de los linfocitos T en las preeclámpticas. Estos hallazgos, junto con otras investigaciones previas, reflejarían la verdadera condición in vivo, pero también puede explicar la conocida acción paracrina de las citokinas de las células T, ya que las citokinas secretadas se unen rápidamente a los receptores de las células vecinas (29).
CONCLUSIÓN
Las pacientes preeclámpticas con embarazos pretérmino presentaron concentraciones similares de interleucina-2 al compararlo con preeclampticas a término. Los hallazgos de la presente investigación sugerirían una falta de activación de los linfocitos T en preeclámpticas.
BIBLIOGRAFÍA
1. Olusi S, Diejomaoh M, Omu A, Abdulaziz A, Prabha K, George S. Interleukins in preeclampsia. Ann Saudi Med 2000;20:4-7.
2. Challis J, Lockwood C, Myatt L, Norman J, Strauss J, Petraglia F. Inflammation and pregnancy. Reprod Sci 2009;16:206-15.
3. Saito S, Sakai M. Th1/Th2 balance in preeclampsia. J Reprod Immunol 2003;59:161-73.
4. Nadar S, Al Yemeni E, Blann A, Lip G. Thrombomodulin, von Willebrand factor and E-selectin as plasma markers of endothelial damage/dysfunction and activation in pregnancy induced hypertension. Thromb Res 2004;113:123-8.
5. Bowen J, Chamley L, Mitchell M, Keelan J. Cytokines of the placenta and extra-placental membranes: biosynthesis, secretion and roles in establishment of pregnancy in women. Placenta 2002;23:239-56.
6. Dealtry G, O’Farrell M, Fernandez N. The Th2 cytokine environment of the placenta. Int Arch Allergy Immunol 2000;123:107-19.
7. Chaouat G, Assal Meliani A, Martal J, Raghupathy R, Elliott J, Mosmann T, et al. IL-10 prevents naturally occurring fetal loss in the CBA x DBA/2 mating combination, and local defect in IL-10 production in this abortion-prone combination is corrected by in vivo injection of IFN-tau. J Immunol 1995;154:4261-8.
8. Miranda S, Malán Borel I, Margni R. Altered modulation of the in vitro antibody synthesis by placental factors from the CBA/J x DBA/2 abortion-prone mating combination. Am J Reprod Immunol 1998;39:341-9.
9. Robertson S, Sjöblom C, Jasper M, Norman R, Seamark R. Granulocyte-macrophage colony-stimulating factor promotes glucose transport and blastomere viability in murine preimplantation embryos. Biol Reprod 2001;64:1206-15.
10. Holthe M, Staff A, Berge L, Lyberg T. Different levels of platelet activation in preeclamptic, normotensive pregnant, and nonpregnant women. Am J Obstet Gynecol 2004;190:1128-34.
11. Hennessy A, Painter D, Orange S, Horvath J. Placen-tal tissue interleukin-10 receptor distribution in preeclampsia. Am J Reprod Immunol 2003;49:377-81.
12. Al-Othman S, Omu A, Diejomaoh F, Al-Yatama M, Al-Qattan F. Differential levels of interleukin 6 in maternal and cord sera and placenta in women with preeclampsia. Gynecol Obstet Invest 2001;52:60-5.
13. Sanguansermsri D, Pongcharoen S. Pregnancy immunology: decidual immune cells. Asian Pac J Allergy Immunol 2008;26:171-81.
14. Redman C, Sargent I. Pre-eclampsia, the placenta and the maternal systemic inflammatory response-a review. Placenta 2003;24 Suppl A:S21-7.
15. Massé J, Giguère Y, Kharfi A, Girouard J, Forest J. Pathophysiology and maternal biologic markers of preeclampsia. Endocrine 2002;19:113-25.
16. Ozaki K, Leonard W. Cytokine and cytokine receptor pleiotropy and redundancy. J Biol Chem 2002;277:29355-8.
17. Buttram S, Wisniewski S, Jackson E, Adelson P, Feldman K, Bayir H, et al. Multiplex assessment of cytokine and chemokine levels in cerebrospinal fluid following severe pediatric traumatic brain injury: effects of moderate hypothermia. J Neurotrauma 2007;24:1707-17.
18. Eneroth E, Remberger M, Vahlne A, Ringden O. Increased serum concentrations of interleukin-2 receptor in the first trimester in women who later developed severe preeclampsia. Acta Obstet Gynecol Scand 1998;77:591-3.
19. Mehta R, Shah G, Adler W, Kittur D. Soluble interleukin 2 receptor (sIL-2R) levels in renal transplant recipients. Clin Transplant 2004;18:67-71.
20. Gorin N, Piantadosi S, Stull M, Bonte H, Wingard J, Civin C. Increased risk of lethal graft-versus-host disease-like syndrome after transplantation into NOD/ SCID mice of human mobilized peripheral blood stem cells, as compared to bone marrow or cord blood. J Hematother Stem Cell Res 2002;11:277-92.
21. Shaiegan M, Iravani M, Babaee G, Ghavamzadeh A. Effect of IL-18 and sIL2R on aGVHD occurrence after hematopoietic stem cell transplantation in some Iranian patients. Transpl Immunol 2006;15:223-7.
22. Hamai Y, Fujii T, Yamashita T, Nishina H, Kozuma S, Mikami Y, et al. Evidence for an elevation in serum interleukin-2 and tumor necrosis factor-alpha levels before the clinical manifestations of preeclampsia. Am J Reprod Immunol 1997;38:89-93.
23. Hara N, Fujii T, Okai T, Taketani Y. Histochemical demonstration of interleukin-2 in decidua cells of patients with preeclampsia. Am J Reprod Immunol 1995;34:4451.
24. Hamai Y, Fujii T, Yamashita T, Kozuma S, Okai T, Taketani Y. Pathogenetic implication of interleukin-2 expressed in preeclamptic decidual tissues: a possible mechanism of deranged vasculature of the placenta associated with preeclampsia. Am J Reprod Immunol 1997;38:83-8.
25. Tezabwala B, Johnson P, Rees R. Inhibition of pregnancy viability in mice following IL-2 administration. Immunology 1989;67:115-9.
26. Bates M, Quenby S, Takakuwa K, Johnson P, Vince G. Aberrant cytokine production by peripheral blood mononuclear cells in recurrent pregnancy loss? Hum Reprod 2002;17:2439-44.
27. Romero T, Ruiz A, Molina R, González E, Taborda J, Estévez J. Concentraciones séricas de interleucina-2 en el embarazo normal. Rev Obstet Ginecol Venez 1999;59:3-6.
28. Jonsson Y, Rubèr M, Matthiesen L, Berg G, Nieminen K, Sharma S, et al. Cytokine mapping of sera from women with preeclampsia and normal pregnancies. J Reprod Immunol 2006;70:83-91.
29. De Sarro G, Rotiroti D, Audino M, Gratteri S, Nisticó G. Effects of interleukin-2 on various models of experimental epilepsy in DBA/2 mice. Neuroimmunomodulation 1994;1:361-9.