2007
4
Autores:
Patricio Cisterna C.1, Ricardo Orellana H.1, Andrés Freiré H.1
Instituciones:
1Unidad de Oncología Ginecológica, Servicio de Obstetricia y Ginecología, Complejo Asistencial Dr. Sótero del Río.
Tipo de documento:
Casos ClínicosTumor ovárico de bajo potencial maligno (borderline). Patrón seroso micropapilar.
Contenido del documento:
INTRODUCCIÓN
Los tumores ováricos de bajo potencial maligno o borderline (BPM), son tumores epiteliales de este órgano que tienen comportamiento biológico intermedio entre las lesiones benignas y el carcinoma invasor del ovario. Son neoplasias que presentan una mayor proliferación epitelial que los tumores benignos, pero sin invasión destructiva del estroma. La mayoría se diagnostica en etapas precoces (Etapa I), y representan aproximadamente el 15% de los tumores ováricos. Las variedades serosos y mucinosos son los más frecuentes, se presentan en promedio 10 años antes que los carcinomas y la sobrevida es del 95% a 10 años (1-4). En los tumores BPM se han observado los mismos factores epidemiológicos que en el carcinoma invasor y también los mismos factores de protección, su frecuencia es mayor en mujeres alrededor de los 40 años de edad.
Fueron descritos por Taylor en 1929, e incluidos en la clasificación FIGO en 1971 y OMS en 1973 para todas las clases de tumores epiteliales, sin embargo, la mayor experiencia se dispone casi exclusivamente de las categorías seroso y muci-noso. El diagnóstico histopatológico se basa en las características de la lesión primaria por la presencia de proliferación epitelial, con formación de papilas, atipias nucleares, actividad mitótica de grado variable y por la ausencia de invasión estro-mal, hecho que caracteriza a los carcinomas (5,6).
Los tumores de BPM son básicamente una enfermedad intraperitoneal, más que retroperito-neal. Pueden ser localizados o extensos, tampoco debe influir en el diagnóstico la presencia de implantes e inclusiones en linfonodos (metástasis), ya que tanto los tumores de bajo potencial maligno como los carcinomas pueden dar metástasis. Se pueden acompañar de implantes peritoneales, los que son más frecuentes en la variedad serosa. En los mucinosos este adquiere la forma de pseudomixoma, el cual puede coincidir con un tumor primario del apéndice cecal. Las posibilidades de transformación maligna de estos tumores es menor al 1%.
Los criterios empleados para el diagnóstico de un tumor epitelial de bajo potencial maligno se han restringido exclusivamente a dos puntos esenciales:
- Presencia de dos o más de los siguientes hallazgos:
– Estratificación celular
– Atipias nucleares
– Aumento del número de mitosis
– Crecimiento yemante: Desprendimiento de grupos celulares a espacios quísticos - Ausencia de invasión del estroma en el tumor primario.
TUMOR SEROSO DE BPM
La mayoría de las neoplasias serosas de BPM, se caracterizan por la presencia de lesiones quísticas que contienen pequeñas proyecciones papilares que crecen en la superficie interna del quiste y pueden desprenderse (7,8,9). Sin embargo, no es raro ver tumores serosos de BPM en los cuales las papilas crecen también en la superficie externa (variedades exofíticas). Microscópicamente el epitelio es estratificado, de dos o más capas celulares con atipias nucleares, formación de papilas y pequeños acúmulos celulares que se desprenden del epitelio, aumento de la actividad mitótica, pleomorfismo celular, con ausencia de invasión. En ocasiones descartar invasión puede ser difícil.
Los tumores serosos de BPM, se pueden acompañar de enfermedad extraovárica, denominados implantes peritoneales, presentes en 20-40% de los casos. Estos se han clasificado en implantes no invasivos (epiteliales y desmoplási-cos) e implantes invasivos. La importancia radica en que la existencia de enfermedad extraovárica invasiva determina mayor riesgo de progresión de la enfermedad y de recurrencia aun décadas después del diagnóstico inicial. Por eso es importante determinar la presencia o no de implantes que pueden ser focales, por lo tanto, es necesario realizar un buen muestreo del peritoneo (10-13).
Se ha descrito también la presencia de inclusiones epiteliales en linfonodos en pacientes con tumores serosos de BPM, muy difícil de diferenciar de una metástasis. Otra lesión hallada con frecuencia es la presencia de endosalpingiosis en los linfonodos, algunas veces, las áreas de endosalpingiosis pueden mostrar abundante proliferación celular, que puede tener la apariencia de un implante invasivo dentro de los senos de los ganglios linfáticos. La mayoría de los patólogos no están familiarizados con la presencia de metástasis en linfonodos en caso de tumores serosos de BPM debido a que generalmente no se realiza linfadenectomía en esta patología (8,10).
Existen aun muchas preguntas sin respuesta con respecto al estado de los linfonodos en los tumores serosos de BPM.
Implantes peritoneales y linfonodos. Uno de los aspectos más controvertidos de los tumores serosos de BPM, es su asociación con implantes peritoneales en una proporción variable estimada entre un 15 y 40% de los casos. Aunque pueden presentarse en todas las formas neoplásicas, se observan con mayor frecuencia en las pacientes portadoras de tumores con comportamientos exo-fíticos. El aspecto histológico de los implantes peritoneales suele reproducir, aunque no de forma absolutamente constante el propio del tumor primario, destacando la ausencia de signos de invasión destructiva.
Los implantes peritoneales se han clasificado en función de su comportamiento con respecto al estroma en no invasivos e invasivos. El primer tipo, caracterizado por la presencia de proliferaciones glandulares análogas al del tumor primario, pueden subdividirse a su vez en epitelial y desmo-plásicos. En los implantes de tipo invasivo el estroma parece infiltrado por células tumorales que penetran en su interior, formando pequeños agregados o clusters, desorganizando su arquitectura normal. En tales casos el aspecto global de los focos tumorales remeda vagamente el propio del adenocarcinoma seroso de bajo grado. Aunque el significado biológico de los implantes invasivos no se conoce todavía con exactitud, parece que existe un impacto en la sobreviva en pacientes con implantes invasivos, en función de la atipía nuclear y de la actividad mitótica. Además de la superficie peritoneal, se pueden encontrar lesiones serosas tipo BPM en linfonodos pélvicos y paraórticos .
En la generalidad de los casos resulta imposible determinar con precisión si los focos ganglionares representan verdaderas metástasis u obedecen al desarrollo sincrónico de una neoplasia serosa de BPM, a partir de inclusiones müllerianas benignas preexistentes. Lo que si parece poder aceptarse, de acuerdo con el estudio de las escasas series publicadas, es que este hallazgo, independientemente de su histogénesis, no afecta negativamente a la evolución de la enfermedad (14,15,16).
Microinvasión. Los tumores serosos de BPM pueden ser focalmente microinvasivos. Si bien estos tumores no se diferencian microscópicamente de los BPM típicos, desde el punto de vista histológico se caracterizan por presentar pequeños focos de elementos celulares con abundante citoplasma eosinófilo a modo de nidos, en el interior del estroma. Dicha forma de presentación no parece, al menos con los datos disponibles, modificar el pronóstico global de la enfermedad (19,20). La evolución de los casos publicados indica que los tumores microinvasivos poseen un comportamiento similar al de las variedades BPM típicas y que en consecuencia la conservación del útero y del ovario contralateral constituye una medida razonable en mujeres jóvenes deseosas de preservar la fertilidad.
TUMORES SEROSOS DE BPM CON PATRON MICROPAPILAR
Dentro de los tumores ováricos de BPM de tipo seroso, hay lesiones que son muy prolifera-tivas, que muestran un patrón micropapilar, implantes invasivos, áreas de microinvasión y metástasis en linfonodos. Debido a esto se ha llegado a hablar de variantes benignas y malignas, dentro de estas últimas se encuentra una nueva forma descrita por Kurman en 1996, el Carcinoma Seroso Micropapilar (CSMP), que no presenta invasión pero tiene una estructura papilar muy fina que puede acompañarse de implantes invasivos que se comporta en forma agresiva y debiera considerarse como un carcinoma seroso en su tratamiento.
El CSMP carece de crecimiento infiltrativo destructivo pero desarrolla mayor riesgo de bilaterali-dad, comportamiento exofítico, implantes invasivos estadios clínicos más avanzados, recurrencia y mortalidad por lo tanto se plantea el diagnóstico diferencial con un carcinoma seroso de bajo grado. Esto explicaría la mayoría de los casos previamente clasificados como de BPM que progresan a una neoplasia maligna y que corresponde aproximadamente al 5 a 10 % (17,18). Otros patólogos opinan que los tumores serosos de BPM con áreas micropapilares están asociados a implantes invasivos más frecuentemente que los tumores borderline serosos que no presentan áreas micropapilares. También se observan en pacientes con estadios avanzados de la enfermedad, por lo tanto el índice de recurrencia es más alto, pero la sobrevida global es similar al resto de estos tumores. Ellos concluyen que la presencia de áreas micropapilares es una característica muy importante debido a que se asocia con un estadio más avanzado de la enfermedad y con implantes invasivos. Sin embargo, estos casos debieran ser designados como «tumores serosos de BPM con áreas micropapilares» en lugar de carcinomas serosos micropapilares.
TUMORES MUCINOSOS DE BPM
Los tumores mucinosos de BPM son microscópicamente indistinguibles de sus contrapartidas benignas y malignas. Son quísticos y multilocula-res, pueden tener áreas sólidas sin que esto lo cambie de categoría.
El diagnóstico es exclusivamente microscópico, más difícil que en el caso de los tumores serosos y se requieren de múltiples cortes histológicos de buena calidad técnica para poder asegurar la ausencia de invasión. Los principales criterios para diferenciar un tumor mucinoso de bajo potencial maligno de un adenocarcinoma mucinoso, especialmente para reconocer la invasión del estroma son los siguientes:
– Encontrar brotes sólidos en la periferia del tumor.
– Aún en ausencia de invasión claramente ¡dentificable, los tumores mucinosos con atipias, y que presentan una estratificación superior a 4 capas celulares, deben ser clasificados como carcinomas mucinosos, pues tienen un comportamiento más agresivo.
– La presencia de mucina extraglandular no es criterio de invasión pues en el pseudomixoma y en tumores benignos también se observa.
Hay proliferación epitelial con estratificación, atipia celular y actividad mitótica variable, con ausencia de invasión capsular o estromal. El 15% se asocia con pseudomixoma peritoneal y mucocele apendicular. Sólo el 2 a 4% de estos tumores presenta recurrencia o enfermedad metastásica. La ascitis mucinosa difusa o localizada que tiene su origen en adenocarcinomas mucinosos del tubo digestivo, páncreas y ovario se define como pseudomixoma peritoneal
Etapificación y tratamiento. La etapificación es necesaria porque entre un 25 a 30% de los casos aparentemente limitados al ovario, presentan diseminación extraovárica subclínica intraperitoneal y retroperitoneal. En las variedades mucinosas sería necesario etapificar debido a su heterocigocidad genética y su potencialidad maligna. En los tumores mucinosos es conveniente hacer apendicec-tomía dado el riesgo de un tumor primario sincrónico en ese órgano. Además existe un 20% de posibilidad que se trate de un cáncer invasor y no de un tumor de BPM (21,22,23).
El tratamiento quirúrgico puede ser:
– Ultraconservador: quistectomía con márgenes quirúrgicos negativos. Existe mayor riesgo de recidiva (15%).
– Conservador: ooforectomía unilateral, si desea conservar fertilidad.
– Radical: ooforectomía bilateral con histerectomía total, linfadenectomía y citorreducción en los casos de diseminación tumoral macroscópica.
La cirugía es el tratamiento de elección, adquiere importancia fundamental la resección tumo-ral máxima, en especial en los pocos casos de etapas avanzadas y recidivas.
Ante un hallazgo intraoperatorio y biopsia por congelación no conduyente, es preferible esperar el informe diferido y un segundo tiempo operatorio con equipo quirúrgico adecuado, debido a un subdiagnóstico de focos de invasión hasta en un 27%. El patrón de tratamiento es etapificación quirúrgica primaria y citorreducción (24,25).
Si el ovario residual es macroscópicamente sano y se pretende conservar la fertilidad, no es recomendable la biopsia de ovario. No se han demostrado metástasis si no hay tumor en la superficie del ovario. La sobreviva de la etapa IA a 10, 15 y 20 años es superior a 95% (26,27).
El 74% de las recidivas de tumores de BPM son como cáncer invasor. La cirugía de citorreducción secundaria parece ser el único tratamiento efectivo para pacientes con enfermedad recurrente pero puede aumentar el riesgo de complicaciones intra y postoperatorias, incluyendo la necesidad de resecciones extensas de intestino, infecciones y fístulas. En pacientes con enfermedad avanzada o enfermedad residual después de cirugía inicial, el pseudomixoma peritoneal o los implantes invasivos son considerados de alto riesgo de enfermedad recurrente (28).
La terapia adyuvante (quimioterapia en base a platino) es poco eficaz, por lo que no está indicada.
Casi todas las pacientes con tumor ovárico de BPM recurrente tienen enfermedad localizada dentro de la cavidad abdomino-pelviana, siendo inusual las metástasis a distancia y su manejo es la resección quirúrgica. La cirugía de citorrreducción secundaria es recomendada para pacientes con enfermedad recurrente aún cuando laparotomías repetidas son indicadas en el pseudomixoma peritoneal.
CASOS CLÍNICOS
Caso 1: Paciente de 54 años, G2P2A0. Antecedentes de salpingectomía bilateral en marzo de 1980 por salpingitis aguda bilateral. Extracción de DIU ectópico por laparotomía en noviembre de 1980, absceso de tabique rectovaginal tratado en forma conservadora en agosto de 1983. En junio de 1998 se realiza histerectomía más ooforectomía bilateral por enfermedad inflamatoria pelviana y proceso adherencial severo de la pelvis.
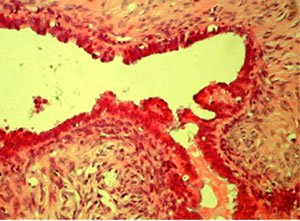
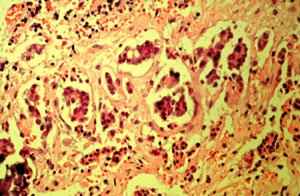
La biopsia diferida demostró en anexo derecho un cistoadenocarcinoma seroso de BPM (Figura 1). La paciente permanece en control sin evidencias de enfermedad hasta enero de 2004, en que es intervenida de urgencia por sospecha de hernia crural izquierda complicada, que correspondió a linfonodo inguinal necrosado; la biopsia demostró ganglio linfático infiltrado por proliferación neoplásica de estirpe epitelial, metástasis de carcinoma seroso papilar con formación de papilas y abundantes cuerpos de psamoma (Figura 2). El escáner demostró tumor pelviano y carcinomatosis peritoneal extensa, sin ascitis. Por lo que se etapificó como cáncer epitelial del ovario etapa III C, seroso papilar, indicándose quimioterapia con platino, la que no presentó respuesta por lo que se indica cambio de esquema a taxol más platino. Paciente rechaza cirugía citoreductora. A diciembre de 2006 la paciente sobrevive con enfermedad.
Caso 2: Paciente de 44 años, G5P5A0. Se presenta en noviembre de 2003 en urgencia ginecológica por dolor abdominal. Por clínica y ecografía se detecta tumor quístico anexial derecho complejo de 11 x 7 cm. Ingresa con el diagnóstico de tumor ovárico complicado. La laparotomía exploradora detecta tumor ovárico quístico bilateral de 13 x 11 cm a izquierda, torcido y necrosado y a derecha de 8 x 8 cm. Se procede a realizar tumorectomía ovárica bilateral e histerectomía total. No se detectó enfermedad extra ovárica.
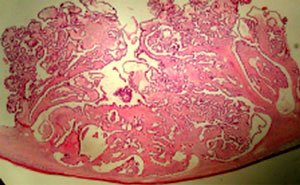
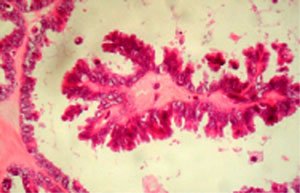
El informe histológico confirmó la presencia de cistoadenoma complicado con necrosis isquémica a izquierda, y tumor seroso de BPM con 40% de patrón micropapilar a derecha (Figuras 3 y 4). Marcador tumoral Ca 125 y estudio de diseminación negativos al cuarto mes post operatorio. A la fecha la paciente sobrevive sin evidencia de enfermedad.
CONCLUSIONES
Los tumores borderline o de BPM son un amplio grupo de neoplasias ováricas que van desde variantes benignas de evolución muy lenta y de buena respuesta al tratamiento conservador, hasta variedades agresivas, recientemente descritas, que se caracterizan por presentarse en estadios más avanzados, habitualmente con enfermedad extra-ovárica (implantes invasivos), y con menor respuesta a la cirugía, mayor riesgo de recidiva y por lo tanto menor sobrevida.
En este último grupo se describe el carcinoma seroso de BPM con patrón micropapilar, que según algunos autores es una forma de presentación más agresiva de los tumores de BPM y preconizan el diagnóstico diferencial con carcinoma infiltrante seroso de bajo grado. Otros autores opinan que los tumores serosos de BPM, con presencia de áreas micropapilares, constituyen una característica importante debido a esta asociación con estados más avanzados de la enfermedad y con implantes invasivos, sin embargo, según ellos, estos casos deberían ser designados como tumores serosos de BPM con áreas micro-papilares y no carcinomas serosos micropapilares. Pensamos que frente a la existencia de tumor de BPM con patrón micropapilar y enfermedad extraovárica la citoreducción puede no ser un tratamiento suficiente dado el alto riesgo de recidiva, por lo tanto, debe plantearse alguna terapia adyuvante homologando su manejo al del carcinoma seroso infiltrante de bajo grado. A pesar que se carece de una clara evidencia de la eficacia de la quimioterapia en este tipo de tumores, existen reportes de respuestas completas que han sido quirúrgicamente documentadas. En algunos centros oncológicos se recomienda como tratamiento post operatorio la quimioterapia en base a carbo-platino y paclitaxel, en pacientes con implantes peritoneales invasivos y no invasivos con enfermedad residual macroscópica.
BIBLIOGRAFÍA
- Cabero-Roura L Patología tumoral del ovario. Tratado de Ginecología y Obstetricia. Tomo II. Sociedad Española de Ginecología y Obstetricia 2003; 1603-21.
- Ozols RF, Rubin SC, Thomas G. Epitelial Ovarian Cancer. Principles and Practice in Gynecologic Oncology. 2a ed, 1997; 919-86.
- Nicosia SV. Ovarian and peritoneal borderline neoplasm: histopathology, diagnostic pitfalls and prognostication. Cancer Control 1996; 3(1): 58-65.
- Benedet JL, Hacker NF, Ngan HYS. Staging classifications and clinical practice guidelines of gynecologic cancer. FIGO: Committe on Gynecologic Oncology 2003; 105-6.
- Seidman JD, Soslow RA, Vang R, et al Borderline ovarian tumors: diverse contemporary viewpoints on terminology and diagnostic criteria with illustrative images. Hum Pathol 2004;35(8):918-33.
- Seidman JD, Kurman RJ. Subclassification of serous borderline tumors of the ovary into benign and malignant types. A clinicopathologic study of 65 advanced stage cases. Am J Surg Pathol 1996;20(11): 1331-45.
- Gershenson DM, Silva EG. Serous ovarian tumors of low malignant potential with peritoneal implants. Cancer 1990;65(3):578-85.
- Shiraki M, Otis N, Donovan JT, Powell JL. Ovarian serous borderline epithelial tumors with multiple retroperitoneal nodal involvement: metastasis or malignant transformation of epithelial glandular inclusions? Gynecol Oncol 1992;46(2):255-8.
- Bell DA, Longacre TA, Prat J, et al Serous borderline (low malignant potential, atypical proliferative) ovarian tumors: workshop perspectives. Hum Pathol 2004;35(8):934-48.
- Tan LK, Flynn SD, Carcangiu ML. Ovarian serous borderline tumors with lymph node involvement. Clinicopathologic and DNA content study of seven cases and review of the literature. Am J Surg Pathol 1994;18(9):904-12.
- Tavassoli FA. Serous tumor of low malignant potential with early stromal invasion (serous LMP with microinvasion). Mod Pathol 1988;1:407-14.
- Bell DA, Scully RE. Ovarian serous borderline tumors with stromal microinvasion: a report of 21 cases. Hum Pathol 1990;21(4):397-403.
- Gershenson DM, Silva EG, Levy L, et al Ovarian serous borderline tumors with invasive peritoneal implants. Cancer 1998;82(6):1096-103.
- Deavers MT, Gershenson DM, Tortolero-Luna G, et al Micropapillary and cribriform patterns in ovarian serous tumors of low malignant potential: a study of 99 advanced stage cases. Am J Surg Pathol 2002;26(9):1129-41.
- Eichhorn JH, Bell DA, Young RH, Scully RE. Ovarian serous borderline tumors with micropapillary and cribriform patterns: a study of 40 cases and comparison with 44 cases without these patterns. Am J Surg Pathol 1999;23(4):397-409.
- Burks RT, Sherman ME, Kurman RJ. Micropapillary serous carcinoma of the ovary. A distinctive low-grade carcinoma related to serous borderline tumors. Am J Surg Pathol 1996;20(11):1319-30.
- Deavers M, Malpica A, Gershenson D, Silva EG. Microinvasion in ovarian serous tumors of low malignant potential. A study of 100 high stage cases. Mod Pathol 2000;13:124A.
- Kadar N, Krumerman M. Barakat RR, et al. Platinum-based chemotherapy for advanced-stage serous ovarian carcinoma of low malignant potential. Gynecol Oncol 1995;59(3):390-3.
- Kadar N, Krumerman M. Possible metaplastic origin of lymph node «metastases» in serous ovarian tumor of low malignant potential (borderline serous tumor). Gynecol Oncol 1995;59(3):394-7.
- Barakat RR, Benjamin I, Lewis Jl Jr, et al. Platinum based chemotherapy for advanced-stage serous ovarian carcinoma of low malignant potential. Gynecologic Oncology 1995;59(3):390-393.
- Lin PS, Gershenson DM, Bevers MW, Lucas KR, Burke TW, Silva EG. The current status of surgical staging of ovarian serous borderline tumors. Cancer 1999;85(4):905-11.
- Gotlieb WH, Flikker S, Davidson B, et al. Borderline tumors of the ovary: fertility treatment, conservative management, and pregnancy outcome. Cancer 1998;82(1):141-6.
- Lu KH, Gershenson DM. Clinical management of borderline ovarian tumors. Contemporary Obstet Gynecol 2000;89-100.
- Silverberg SG, Bell DA, Kurman RJ, et al. Borderline ovarian tumors: key points and workshop summary. Hum Pathol 2004;35(8):910-7.
- Trope C, Kaern J, Vergote IB, et al. Are borderline tumors of the ovary overtreated both surgically and systemically? A review of four prospective randomized trials including 253 patients with borderline tumors. Gynecol Oncol 1993;51(2):236-43.
- Barakat RR, Benjamin I, Lewis JL Jr, et al. Platinum-based chemotherapy for advanced-stage serous ovarian carcinoma of low malignant potential. Gynecol Oncol 1995;59(3):390-3.
- Deavers MT, Gershenson DM, Tortolero-Luna G, et al. Micropapillary and cribriform patterns in ovarian serous tumors of low malignant potential: a study of 99 advanced stage cases. Am J Surg Pathol 2002;26(9): 1129-41.
- David M, Gershenson DM. Clinical management potential tumours of low malignancy. Best Pract Res Clin Obstet Gynaecol 2002;16(4):513-27.